- meta-syntes
- Om
- Våra webbplatser
- Webbbokskapitel
 |
 |
 |
Ralph Pearson introducerade sin Hard Soft Acid Base-princip (HSAB) i början av sextiotalet, och försökte på så sätt förena oorganisk och organisk reaktionskemi. Effekten av den nya idén var omedelbar, men under årens lopp har HSAB-principen snarare fallit i glömska medan andra tillvägagångssätt som utvecklades vid samma tidpunkt, såsom frontier molecular orbital (FMO)-teorin och molekylär mekanik, har blomstrat.
Denna sida diskuterar de djupgående begränsningarna i Pearsons tillvägagångssätt och jämför & kontrasterar HSAB-principen med kemogenesianalysen som den presenteras i den här webboken.
Notera, i denna webbbok:
| Lewis syror är RÖDA | Lewis baser är BLÅ |
- Irving-Williams stabilitetsserie
- Ahrland’s Type A, Type B Analysis
- Railsbacks geokemiska analys
- Pearsons HSAB-princip (The Hard Soft Acid Base Principle)
- Pearsons HSAB-klassificeringssystem, härifrån:
- Jensen’s Review of the HSAB Principle
- Klopmans FMO-analys
- Kombination av Pearsons och Klopmans idéer
- The Ho Paper
- HSAB-principen för organiska ämnen. & Huvudgruppskemister
- Problem, problem, problem, problem…
- Fajans regler
- Så, vad är det som händer?
- Varför jämför man HSAB-analysen ”uppifrån och ner” med kemogenesianalysen ”nedifrån och upp”
- The HSAB Papers:
- Other Post-Pearson Analysis
Irving-Williams stabilitetsserie
Irving-Williams stabilitetsserie (1953) pekade på att för en given ligand ökar stabiliteten hos dipositiva metalljonkomplex:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Det var också känt att vissa ligander bildade de mest stabila komplexen med metalljoner som Al3+, Ti4+ & Co3+ medan andra bildade stabila komplex med Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
In 1958 Ahrland et al. klassificerade metallkatjoner som typ A och typ B, där:
Typ A metallkatjoner inkluderar:
- Alkalimetallkatjoner: Li+ till Cs+
- Alkaliska jordartsmetallkatjoner: Be2+ till Ba2+
- Lättare övergångsmetallkatjoner i högre oxidationstillstånd: Ti4+, Cr3+, Fe3+, Co3+
- Protonerna, H+
Typ B metallkatjoner inkluderar:
- Tyngre övergångsmetallkatjoner i lägre oxidationstillstånd: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
- Vissa metaller finns i naturen som typ A-metall + typ A-ligandmineraler, till exempel karbonater: MgCO3 och CaCO3 och oxider: Fe2O3 och TiO2
- Medan andra återfinns som typ B-metaller + typ B-ligandmineraler, till exempel sulfidmalmer: PbS, CdS, NiS, etc.
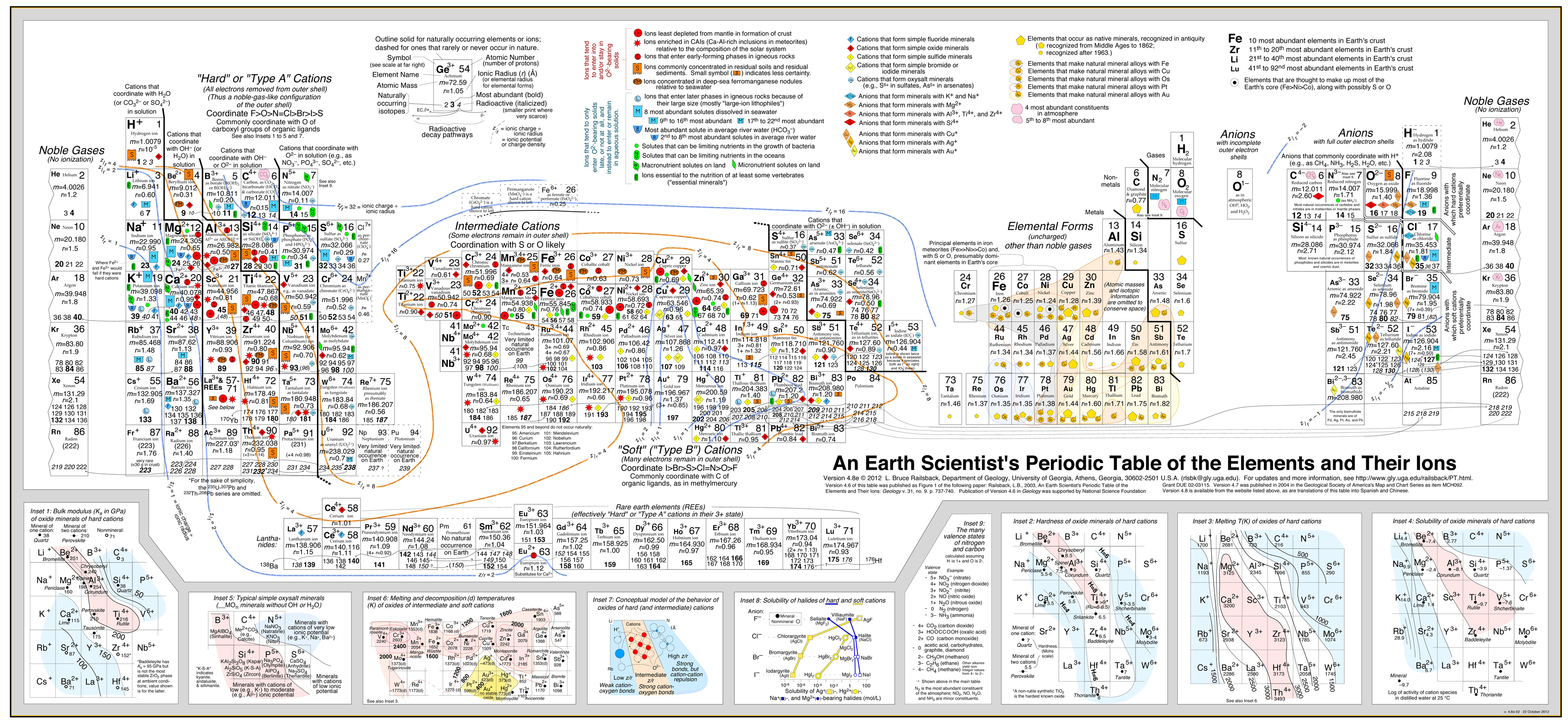
- Railsback-analysen använder sig av konturer av beteende som överlagras på det periodiska systemet. .
- Se artikeln: A Synthesis of Systematic Mineralogy av Bruce Railsback som utvecklar denna analys.
- Natriumjonen, Na+, är hårdare Lewis-syra än silverjonen, Ag+
- Alkoxidjoner, RO, är hårdare Lewisbaser än tioanjoner, RS
- Koppar(II)-jonen, Cu2+, är hårdare Lewis-syra än koppar(I)-jonen, Cu+
- Kväveanjonslutet på den ambidenterade cyanidjonen, CN, är hårdare Lewisbas än den mjukare kolanjonändan, NC
- Ambidentat-enolatjonen har ett hårt oxyanjon-Lewisbascentrum medan karbanjoncentrumet är mjukare Lewisbas och är mer nukleofilt
- Hårdare nukleofiler som alkoxidjonen, R-O, attackerar acyl(karbonyl)kolet.
- Mjukare nukleofiler som cyanidjonen, NC, och thioanjonen, R-S, attackerar β-alkylkolet.
- Eliminering vs substitution med 1,2-dikloretan
- Eliminering vs substitution med 2-brompropan
- β-Propiolakton
- Cyanidjoner
- Enolatjoner
- Nitritjoner
- Sulfitjoner
- Thiocyanatjoner
- Kongeneriska matriser återfinns alltid inom cellerna i Lewis syra/bas-interaktionsmatrisen, och inte överskridande celler.
- Hårda till mjuka trender förekommer inom kongeneriska matriser, men de korsar aldrig mellan matriserna.
- En liten positiv jon är starkt polariserande, gynnar kovalens, och för en given katjon ökar den kovalenta karaktären när anjonen blir större.
- Stora negativa joner är starkt polariserande, gynnar kovalens, och för en given anjon ökar den kovalenta karaktären när katjonen blir mindre.
- Kovalent karaktär ökar med ökande jonladdning på båda jonerna.
- Polarisering, och därmed kovalens, gynnas om den positiva jonen inte har en ädelgaskonfiguration. Detta är viktigt för katjoner som t.ex: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
- Fajans regler förklarar tydligt denna kemi genom att säga att den mycket lilla, högt laddade Be2+-jonen kan polarisera (förvränga) elektronmolnen hos de jämförelsevis stora kloridjonerna till kovalenta bindningar och därmed ge en molekylär struktur.
- Pearson-Klopman HSAB-analysen säger att berylliumjonen, som är den minsta av metallkatjonerna i grupp II, också är den hårdaste. Berylliumjonsalter borde därför uppvisa extrema laddningskontrollerade bindningar och ge upphov till joniska material, men det gör de inte.
- Chemogenesianalysen, här, säger att grupp II-kationer: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, utgör en kongenererad serie av laddade s-LUMO Lewis-syror, och att linjära beteendetrender finns över denna serie.
Dessa linjära beteendetrender kan om så önskas tillskrivas ett ”hårt-mjukt” beteende, men termerna ”hårt” och ”mjukt” kan endast användas med avseende på den kongeneriska serien i fråga och ”hårt-mjukt”-jämförelser kan inte göras med avseende på andra Lewis-syror. - Med utgångspunkt i alla arter i reaktionskemirummet identifieras ett antal viktiga arter som Lewis-syror och Lewis-baser.
- Lewissyror och Lewisbaser klassificeras sedan som hårda, gränslösa eller mjuka med hjälp av empiriska observationer och principen att: hårda Lewis-syror föredrar komplex med hårda Lewisbaser och mjuka Lewis-syror föredrar komplex med mjuka Lewisbaser:
- Huvudgruppens elementära hydrider utsätts för de 5 vätesondförsöken.
- Kongeneriska arrayer och arrayinteraktioner studeras.
- Linjära hårda till mjuka struktur- och reaktivitetstrender identifieras inom arrayer, och det erkänns att ett linjärt beteende inte kan förväntas mellan arrayer.
- Lewissyror och Lewisbaser klassificeras efter deras elektroniska Lewisstrukturer och FMO-topologier och ordnas i en matrix för växelverkan mellan Lewis-syror och Lewisbaser, här.
Ligander, kemiska enheter som bildar komplex med metallkatjoner, klassificerades som typ A eller typ B beroende på om de bildar stabilare komplex med metallkatjoner av typ A eller typ B, härifrån:
|
Ligandens tendens till komplex
med metaller av typ A |
Ligandens tendens till komplex
med metaller av typ A |
|
| komplex
med typ B-metaller |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Från denna analys, kan en empirisk regel härledas:
Metaller av typ A föredrar att binda (komplexa) till ligander av typ A
och
Metaller av typ B föredrar att binda (komplexa) till ligander av typ B
Dessa empiriska – experimentellt härledda – regler talar om att metaller av typ A är mer benägna att bilda oxider, karbonater, nitrider och fluorider, medan typ B-metaller är mer benägna att bilda fosfider, sulfider och selinider.
Railsbacks geokemiska analys
Analysen ”typ A, typ B” är av stor ekonomisk betydelse eftersom:
Detta tillvägagångssätt har med stor framgång utvecklats av Bruce Railsback med sin utmärkta och starkt rekommenderade ”Earth Scientist’s Periodic Table website”.
Klicka på bilden för att förstora den:
Pearsons HSAB-princip (The Hard Soft Acid Base Principle)
På sextiotalet utvidgade Ralph Pearson kraftigt typ A-typ B-logiken genom att förklara det differentiella komplexeringsbeteendet hos katjoner och ligander i termer av elektronpar accepterande Lewis-syror och elektronpar donerande Lewisbaser:
Lewissyra + Lewisbas → Lewis syra/baskomplex
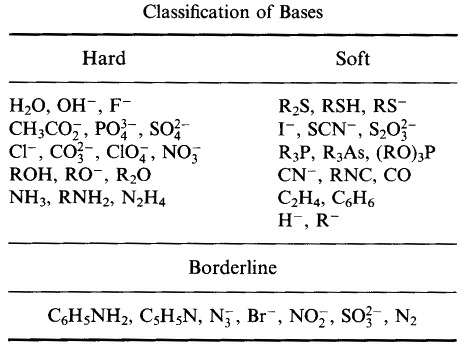
Pearson klassificerade Lewis-syror och Lewisbaser som hårda, gränslösa eller mjuka.
Enligt Pearsons princip hard soft acid base (HSAB):
Hårda syror föredrar att binda till hårda baser
och
mjuka syror föredrar att binda till mjuka baser
Omedelbart verkar HSAB-analysen ganska likartad med typ A- och typ B-systemet.
Pearson klassificerade emellertid ett mycket brett spektrum av atomer, joner, molekyler och molekylära joner som hårda, gränslösa eller mjuka, vilket flyttade analysen från den traditionella oorganiska metall/ligand-kemin till – och kombinerade med – den organiska kemins område.
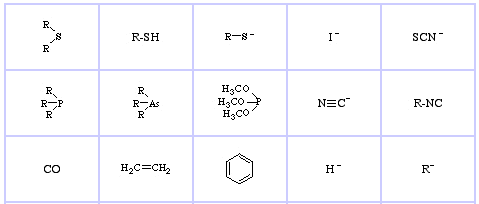
Pearsons HSAB-klassificeringssystem, härifrån:
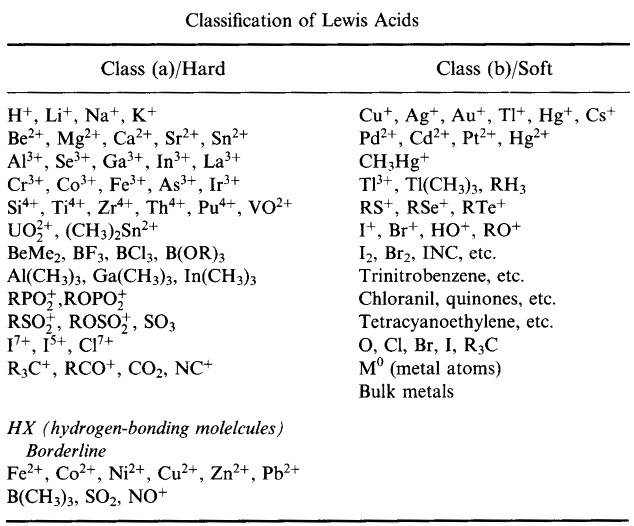
Pearson’s Hard Lewis Acids (från Chemical Thesaurus), här, och från congeneric array database, här:
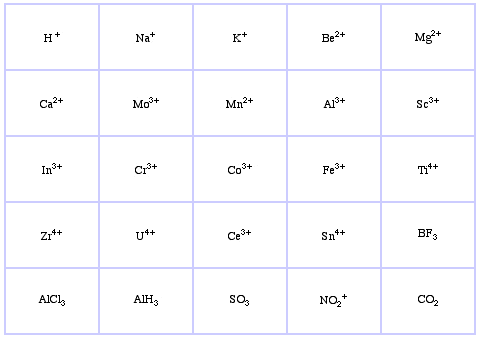
Pearson’s Borderline Lewis Acids, här och här:
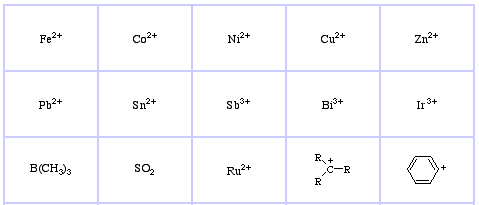
Pearson’s Soft Lewis Acids, här och här:
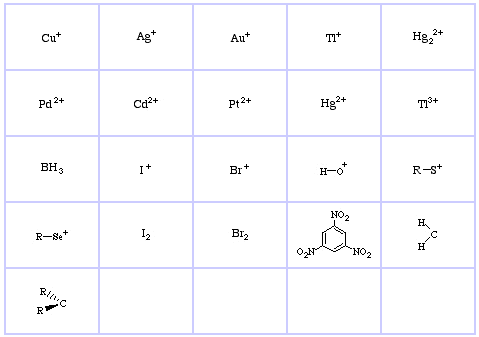
Pearson’s Hard Lewis Bases (från The Chemical Thesaurus), här, och från congeneric array database, här:
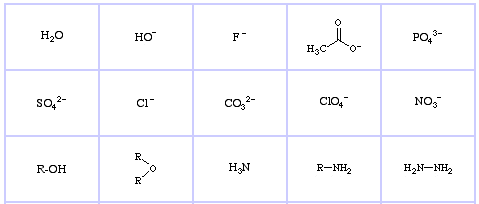
Pearson’s Borderline Lewis Bases, här och här:

Pearson’s Soft Lewis Bases, här och här:
Jensen’s Review of the HSAB Principle
William (Bill) Jensen presenterade tre artiklar i ACS-tidskriften Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Del I mars s. 11-14, del II april s. 13-18, del III maj s. 14-18. Del III handlar om Pearsons HSAB-analys.
Den kombinerade artikeln – som är både utmärkt och detaljerad – finns tillgänglig på Bills webbutrymme (och en klon av filen kan laddas ner från denna webbplats).
Klopmans FMO-analys
I 1968 försökte G. Klopman kvantifiera Pearsons HSAB-princip med hjälp av frontier molecular orbital (FMO)-teorin, som diskuteras på andra ställen i den här web-boken, här, med den här ekvationen:
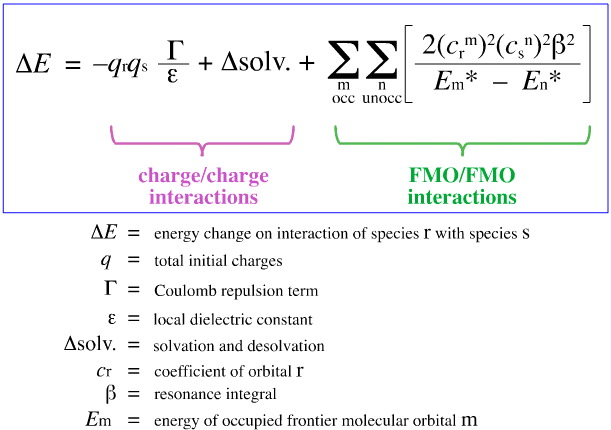
Klopman föreslog att:
Hårda syror binder till hårda baser för att ge laddningskontrollerade (joniska) komplex. Sådana interaktioner domineras av +/-laddningarna på de interagerande arterna.
och
Mjuka syror binder till mjuka baser för att ge FMO-kontrollerade komplex. Dessa interaktioner domineras av energierna hos de deltagande gränsmolekylära orbitalerna (FMO), den högsta ockuperade molekylära orbitalet (HOMO) och den lägsta oockuperade molekylära orbitalet (LUMO).
Läs mer på andra ställen i webboken Chemogenesis, här, eller titta på Ian Flemings Organic Chemistry and FMO theory här, där dessa idéer utvecklas ganska utförligt.
Med hjälp av ovanstående analys separeras och kvantifieras de bidragande aspekterna av laddningskontrollerad och FMO-kontrollerad Lewis syra/bas-komplexering, vilket är en avgörande utveckling.
Kombination av Pearsons och Klopmans idéer
Hårda Lewis-syror:
Atomcentra med liten jonisk radie
Hög positiv laddning
Arter som inte innehåller elektronpar i sina valensskal
Låg elektronaffinitet
Sannolikt starkt solvatiserade
LUMO med hög energiMjuka Lewis-syror:
Stor radie
Låg eller delvis δ+ positiv laddning
Elektronpar i valensskalet
Lätt att polarisera och oxidera
Låg energi LUMO, men stora LUMO-koefficienterHårda Lewisbaser:
Små, starkt solvatiserade, elektronegativa atomcentra: 3.0-4,0
Arterna är svagt polariserbara
Svårt att oxidera
Hög energi HOMOMjuka Lewisbaser:
Stora atomer med medelhög elektronegativitet: 2,5-3,0
Lätt att polarisera och oxidera
Låg energi HOMOs men stor storlek på HOMO-koefficienternaGränsspecifika arter har mellanliggande egenskaper.
Det finns ett förbehåll i Klopmans artikel som säger att: det är inte nödvändigt att arterna har alla egenskaper.
The Ho Paper
Pearson föreslog att hårda till mjuka tendenser kunde hittas bland grupperna 15, 16 och 17 i det periodiska systemet. År 1975 utvidgades idén av Tse Lok Ho som använde realistiska kemiska arter och myntade begreppet kongenererande (av samma familj), där kongenererande arter är isoelektroniska (har samma Lewisstruktur i det yttre skalet).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Hårda och mjuka syror och baser, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., Principen om hårda, mjuka syror och baser (HSAB) och organisk kemi Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
HSAB-principen för organiska ämnen. & Huvudgruppskemister
För våra syften huvudgruppskemi och organisk reaktionskemi är Pearson-metoden mest framgångsrik när man jämför par av arter:
Denna typ av analys kan vara mycket användbar när det gäller att förklara reaktions selektivitet.
Till exempel är β-propiolakton – en reaktiv cyklisk ester – som ringöppnas av nukleofila Lewisbaser. Attacken kan ske i två positioner och nukleofiler uppvisar regioselektivitet:
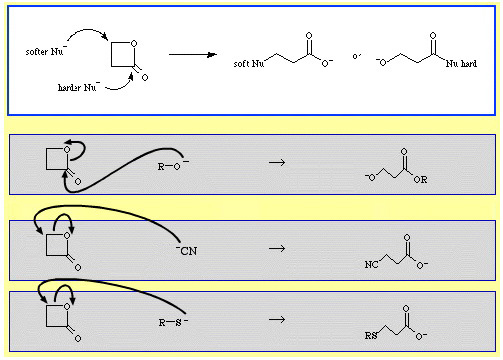
Det finns en hel del exempel på ambidentatselektivitet i The Chemical Thesaurus reaktionskemidatabas:
Problem, problem, problem, problem…
Det finns dock allvarliga problem med Pearsons analys. Även om Pearson-Klopmans HSAB-modell inte är helt fel … så förenklar den grovt den kända reaktionskemin, vilket Ralph Pearson själv erkänner:
I början av sin bok från 1997, Chemical Hardness, Wiley-VCH, s. 3-4, skriver Ralph Pearson uppriktigt:
”Med hjälp av nomenklaturen är det möjligt att göra ett enkelt, allmänt uttalande:
”Hårda syror föredrar att samordna sig med hårda baser och mjuka syror föredrar att samordna sig med mjuka baser.”
”Detta är principen om hårda och mjuka syror och baser, eller HSAB-principen.
”Observera att denna princip helt enkelt är en omformulering av de experimentella bevis som ledde till . Det är en kondenserad redogörelse för en mycket stor mängd kemisk information. Som sådan kan den kallas för en lag. Men denna etikett verkar pretentiös med tanke på avsaknaden av en kvantitativ definition av hårdhet.
”HSAB är inte en teori, eftersom den inte förklarar variationer i styrkan hos kemiska bindningar. Ordet ”föredrar” i HSAB-principen antyder en ganska blygsam effekt.
”Mjukhet är inte den enda faktor som bestämmer värdet av ΔH° i ekvationen:
A + :B → A:B
”Det finns många exempel på mycket starka bindningar mellan missanpassade par, till exempel H2, som bildas av hårt H+ och mjukt H.
”H2O, OH och O2 klassificeras alla som hårda baser, men det finns stora skillnader i deras basstyrka, oavsett kriterium.”
RP
Indeed so… (!)
Ett problem är att man helt enkelt inte tar hänsyn till hela uppsättningen av hårda-gränser-mjuka interaktioner och komplexeringar med hjälp av Pearson-analysen. Se hur tom HSAB:s interaktionsmatris är:
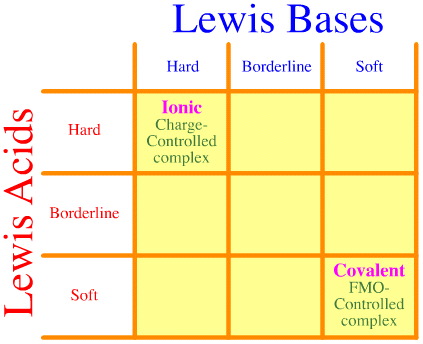
Pearsons HSAB-princip säger att ”hårda syror föredrar att binda till hårda baser och att mjuka syror föredrar att binda till mjuka baser”, vilket kan vara sant, men den säger ingenting om blandade hårda-mjuka komplex.
Klopman säger helt enkelt på ett mycket ohjälpsamt sätt att sådana växelverkningar är ”odefinierade”!
Men ändå är många av de mest intressanta reagenserna i organisk och oorganisk reaktionskemi hårda-mjuka ”ansträngda” komplex:
| Natriumhydrid |
NaH
|
Na+
|
H
|
|
| Litiumaluminiumhydrid |
LiAlH4
|
Al3+
|
H
|
|
| Bly(IV)acetat |
Pb(AcO)4
|
Pb4+
|
AcO
|
|
| Metyljodid |
CH3I
|
CH3+
|
I
|
|
| Metyllitium |
CH3Li
|
Li+
|
CH3
|
|
| Triethyloxoniumtetrafluoroborat |
+
|
CH3CH2+
|
CH3CH2+
|
:OR2
|
| Ferrocen |
Fe(Cp)2
|
Fe2+
|
|
|
Hård
|
Borderline
|
Mjuk
|
Till jämförelse, den rikedom av känd reaktionskemi uppstår naturligt i Lewis syra/basinteraktionsmatrisen, en central princip i kemogenesianalysen (men vi riskerar att gå före oss själva, se nästa sidor här & här).
Det finns två observationer/regler, och båda gäller kongeneriska matriser av isoelektroniska/isoreaktiva arter:
Fajans regler
Pearsons och Klopmans HSAB-analys står också i direkt motsättning till de välkända ”Fajans regler” (utvecklade under åren 1915-24), även om ingen annan författare tycks ha behandlat denna fråga hittills.
Ionisk-kovalent karaktär i binära material av metall plus icke-metall kan beräknas med hjälp av Pauling-ekvationen, här, men skillnaden i elektronegativitet underskattar effekten av polarisering: den utsträckning i vilken en atom förvränger eller polariserar elektronmolnet hos den andra atomen.
Fajans regler säger:
Ett exempel:
Konsultera berylliumklorid, BeCl2, i jämförelse med de andra jordalkalikloriderna: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Kation
|
Ionisk
Radius |
Eneg.
|
% jonisk av
till Cl-bindning |
Bindning & Material
Typ |
|
Be2+
|
41
|
1.57
|
34
|
Kovalent/Molekylär
|
|
Mg2+
|
86
|
1.31
|
42
|
Ioniskt salt
|
|
Ca2+
|
114
|
1.00
|
51
|
Ionsalt
|
|
Sr2+
|
132
|
0.95
|
52
|
Ionsalt
|
|
Ba2+
|
149
|
0.89
|
54
|
Ioniskt salt
|
Data om jonisk radie från webbelement
Berylliumklorid, BeCl2, är kovalent: det vattenfria materialet är lösligt i organiska lösningsmedel, det sublimerar (i vakuum) och det smälta materialet är en dålig ledare för elektricitet. MgCl2, CaCl2, SrCl2 och BaCl2 är joniska material och de smälta salterna är utmärkta elektriska ledare.
Så, vad är det som händer?
Punkten är att ingen fysisk parameter korrelerar med hårdhet över Pearsons valda uppsättning arter. Detta skapar tvetydigheter, till exempel med fluoridjonens organiska kemi, här, och motsättningen med Fajans regler, ovan.
Pearsons modell tar inte hänsyn till FMO-geometrin (de deltagande orbitalernas & former & faser). Hur lika är till exempel Pearsons hårda syror:
H+ + BF3 CO2 Cs+ Cu2+ ?
Och hur lika är Pearsons mjuka baser:
H R2S: H3C bensen ?
För organiska kemister och huvudgruppskemister säger HSAB-analysen lite/noll om den viktiga Lewis-syran för karbentiumjoner (karbokation), H3C+, eller Lewisbasen för karbanjoner, H3C.
Fet påstående
Det endimensionella hårda-gränser-linjebaserade mjuka kontinuumet i Pearsons analys har i själva verket till följd att det rika, linjära (förutsägbara) beteendet som kan hittas i kemirummet för Lewis-syror/baserreaktioner suddas ut.
Den nya kemogenesianalysen som presenteras i denna webbbok och som stöds av reaktionskemin i databasen The Chemical Thesaurus undviker och förklarar fallgroparna i Pearsons mycket omtalade HSAB-metod.
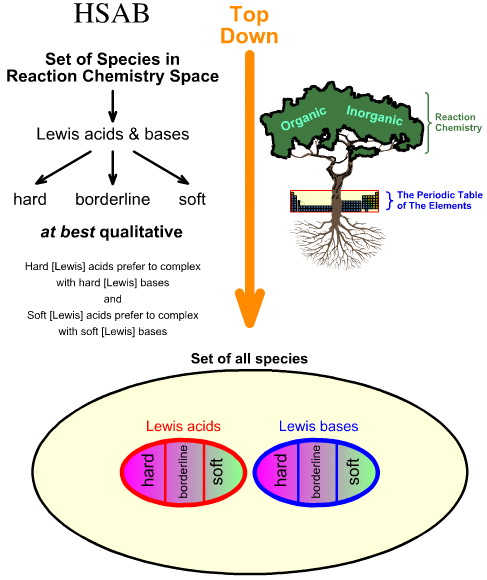
Varför jämför man HSAB-analysen ”uppifrån och ner” med kemogenesianalysen ”nedifrån och upp”
Pearsons hårda, mjuka syrabasanalys (HSAB) är uppifrån och ner.
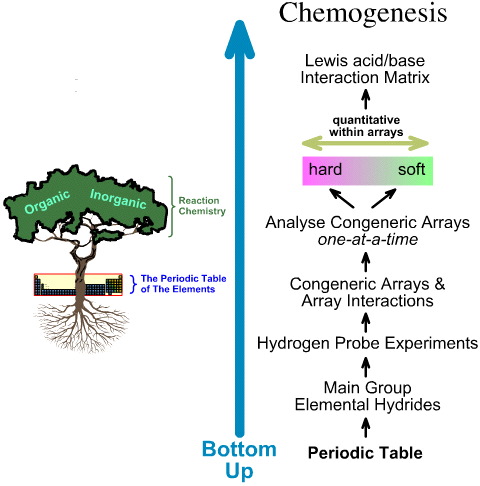
I motsats till detta är kemogenesianalysen nedifrån och upp:
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Se även här.
Other Post-Pearson Analysis
EECW-modellen är en semikvantitativ modell som beskriver och förutspår styrkan hos Lewis syra/bas-interaktioner. Initialt tilldelade modellen elektrostatiska (E) och kovalenta (C) parametrar till Lewis-syrorna och -baserna. Detta utvidgades senare till ECW-modellen för att täcka reaktioner som har en konstant energiterm, W, som beskriver processer som föregår syra/bas-interaktionen.
I Drago & Waylands ursprungliga analys från 1965 användes en ekvation med två termer så att varje Lewis-syra karakteriseras av EA- och CA-termerna och varje Lewis-bas av EB- och CB-termerna, där E- och C-parametrarna hänvisar till de elektrostatiska och kovalenta bidragen till styrkan hos de bindningar som syra-basinteraktionen kommer att bilda. (Detta är som Klopman-analysen, ovan.) Dessa parametrar erhölls empiriskt genom att använda enthalpier för addukter som endast bildar σ-bindningar mellan Lewis-syran och Lewis-basen och som inte har någon sterisk repulsion:
-ΔH = EAEB + CACB
I ECW-modellen lades en ny term W till ekvationen.
-ΔH = EAEB + CACB + W
där W-termen representerar en konstant energi för klyvning av en dimerisk Lewis-syra eller Lewis-bas.
Från An Overview of Lewis Basicity and Affinity Scales av Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
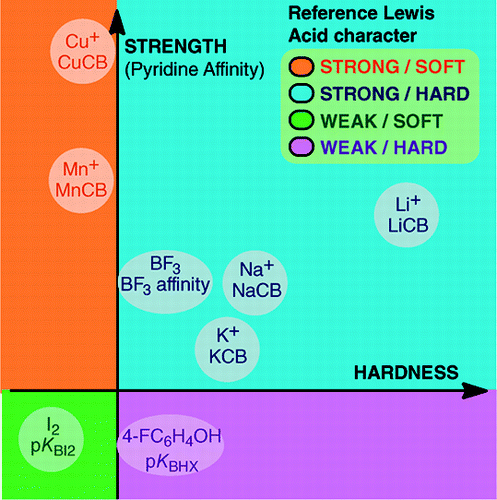
Omöjligheten att fastställa en universell skala för Lewisbasicitet hindrar inte fastställandet av Lewisbasernas kvantitativa beteende, tack vare skalor som konstruerats mot särskilda Lewis-syror: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ och CH3NH3+. Dessa skalor omfattar viktiga typer av bindningar som bildas i en addukt av en Lewis-syra-bas: den dativa bindningen, konventionella och joniska vätebindningar, halogenbindningen och kation-molekylbindningar för metallkatjoner i grupperna 1, 7, 10, 11 och 13. Även om dessa skalor i allmänhet inte är inbördes relaterade finns det familjeberoende relationer som gör det möjligt att i en ganska allmän ordning rangordna baser som tillhör en viss kemisk familj, t.ex. familjen av syrebaser. Skepsisen mot den kvantitativa användbarheten av Lewis-begreppet för syror och baser är därför inte längre grundad.och:
Bildningen av Lewis syra-basaddukter omfattar ett stort antal bindningsbildande processer, från den svaga van der Waals-bindningen i Ar—BF3 till den starka dativa bindningen i H3N-BF3. Begreppet ”bindning” kan vara olämpligt för svaga addukter. Dessa svagt bundna arter framställs i allmänhet i en överljudsstråle eller en kryogen matris. Här är vi främst intresserade av komplex som kan observeras i en rumstempererad blandning av Lewis-syran och Lewis-basen.I vatten är ordningen för komplexationskonstanter för halogenidjoner med syran Fe3+ F- > Cl- > Br- > I-, medan den med Hg2+ är I- > Br- > Cl- >F-. Denna omvändning förklaras av Pearsons princip om hårda och mjuka syror och baser.
Koordineringen av en serie aziner till metallocener har korrelerats med azinernas skala för vätebindningsbasicitet.
Ab initio-beräkning av Lewis-syrestyrkan hos kovalenta metallhalogenider i vacuo med fluoridanjonen som referens-Lewisbas.
Ett DN-värde för trietylamin uppskattades från en korrelation mellan DN och det kemiska NMR-skiftet för 23Na-kärnan för lösningar av natriumsalter i basiska lösningsmedel. Senare gav den direkta bestämningen ett värde som var hälften av det uppskattade värdet.
 |
 |
 |
| Lewis &Brønstedteorier om syra | Huvudgruppens elementära hydrider |
.