- meta-synteza
- About
- Our Websites
- Web Book Chapters
 |
 |
 |
Ralph Pearson wprowadził swoją zasadę Hard Soft Acid Base (HSAB) na początku lat sześćdziesiątych dziewiętnastego wieku, i w ten sposób próbował zjednoczyć chemię reakcji nieorganicznych i organicznych. Wpływ nowej idei był natychmiastowy, jednak z biegiem lat zasada HSAB raczej odeszła na bok, podczas gdy inne podejścia opracowane w tym samym czasie, takie jak teoria orbitali molekularnych (FMO) i mechanika molekularna, rozkwitły.
Ta strona omawia głębokie ograniczenia podejścia Pearsona i porównuje &kontrastuje zasadę HSAB z analizą chemogenezy przedstawioną w tej książce internetowej.
Uwaga, w tej książce internetowej:
| Kwasy Lewisa są CZERWONE | Zasady Lewisa są NIEBIESKIE |
- Seria stabilności Irvinga-Williamsa
- Ahrland’s Type A, Type B Analysis
- Analiza geochemiczna Railsbacka
- HSAB Principle Pearsona (The Hard Soft Acid Base Principle)
- System klasyfikacji HSAB Pearsona, stąd:
- Jensen’s Review of the HSAB Principle
- Klopman’s FMO Analysis
- Połączenie idei Pearsona i Klopmana
- Papier Ho
- Zasada HSAB dla chemii organicznej & Chemicy Grupy Głównej
- Problemy, problemy, problemy…
- Reguły Fajansa
- So, What’s Going On?
- Porównanie „odgórnej” analizy HSAB z „oddolną” analizą chemogenezy
- The HSAB Papers:
- Inne analizy po Pearsonie
Seria stabilności Irvinga-Williamsa
Seria stabilności Irvinga-Williamsa (1953) wskazała, że dla danego liganda wzrasta stabilność kompleksów dipozytywnych jonów metali:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Wiedziano również, że niektóre ligandy tworzą swoje najbardziej stabilne kompleksy z takimi jonami metali jak Al3+, Ti4+ & Co3+, podczas gdy inne tworzyły stabilne kompleksy z Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
W 1958 roku Ahrland i wsp. sklasyfikowali kationy metali jako typ A i typ B, gdzie:
Kationy metali typu A obejmują:
- Kationy metali alkalicznych: Li+ do Cs+
- Kationy metali ziem alkalicznych: Be2+ do Ba2+
- Kationy lżejszych metali przejściowych w wyższych stanach utlenienia: Ti4+, Cr3+, Fe3+, Co3+
- Proton, H+
Do kationów metali typu B należą:
- Cięższe kationy metali przejściowych w niższych stanach utlenienia: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Ligandy, jednostki chemiczne kompleksujące z kationami metali, zostały sklasyfikowane jako typ A lub typ B w zależności od tego, czy tworzyły bardziej stabilne kompleksy z kationami metali typu A, czy z kationami metali typu B, stąd:
|
Skłonność liganda do kompleksowania
z metalami typu A |
Skłonność liganda do. kompleksowania
z metalami typu B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb >. Bi O << S ~ Se ~ Te F < Cl < Br << I |
Z tej analizy, można wyprowadzić regułę empiryczną:
Metale typu A wolą wiązać się (kompleksować) z Ligandami typu A
i
Metale typu B wolą wiązać się (kompleksować) z Ligandami typu B
Te empiryczne – wyprowadzone doświadczalnie – reguły mówią nam, że Metale typu A częściej tworzą tlenki, węglany, azotki i fluorki, podczas gdy metale typu B są bardziej skłonne do tworzenia fosforków, siarczków i selinków.
Analiza geochemiczna Railsbacka
Analiza „Typ A, Typ B” ma duże znaczenie gospodarcze, ponieważ:
- Niektóre metale występują w przyrodzie jako minerały typu A metal + ligand typu A, np. węglany: MgCO3 i CaCO3 oraz tlenki: Fe2O3 i TiO2
- Inne natomiast występują jako minerały typu B metal + ligand typu B, na przykład rudy siarczkowe: PbS, CdS, NiS, etc.
To podejście zostało bardzo udanie rozwinięte w przez Bruce’a Railsbacka z jego doskonałą i wysoce zalecaną stroną internetową „Earth Scientist’s Periodic Table”.
Kliknij obrazek aby powiększyć:
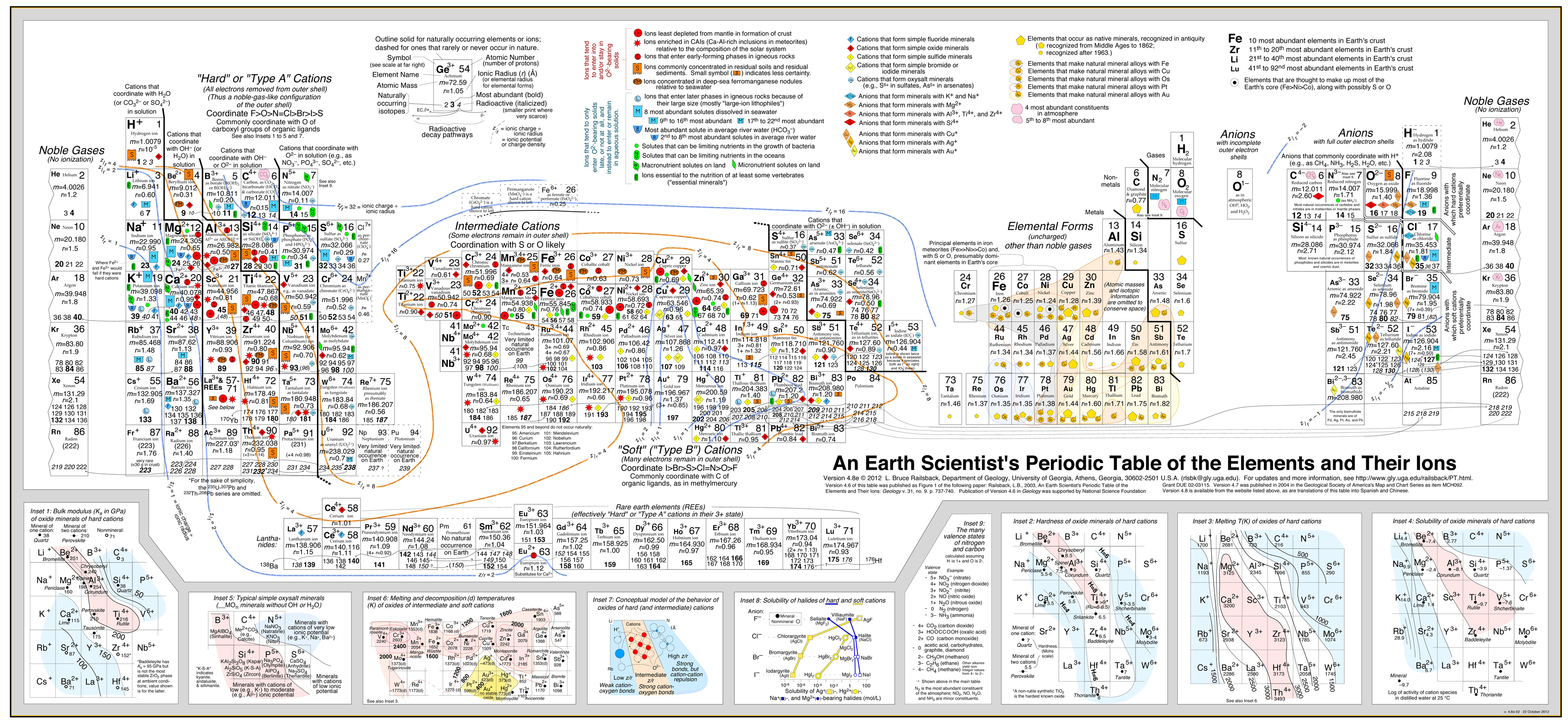
- Analiza Railsbacka używa konturów zachowania nałożonych na układ okresowy. .
- Zobacz artykuł: A Synthesis of Systematic Mineralogy Bruce’a Railsbacka, który rozwija tę analizę.
HSAB Principle Pearsona (The Hard Soft Acid Base Principle)
W latach sześćdziesiątych XIX wieku Ralph Pearson znacznie rozszerzył logikę Typu A-Typu B, wyjaśniając zróżnicowane zachowanie kompleksowania kationów i ligandów w kategoriach kwasów Lewisa akceptujących parę elektronową i zasad Lewisa oddających parę elektronową:
Kwas Lewisa + zasada Lewisa → kompleks kwas/ zasada Lewisa
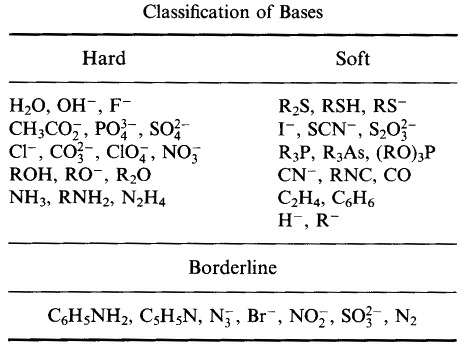
Pearson sklasyfikował kwasy Lewisa i zasady Lewisa jako twarde, graniczne lub miękkie.
Zgodnie z zasadą Pearsona twarde miękkie zasady kwasowe (HSAB):
Kwasy twarde wolą wiązać się z zasadami twardymi
i
Kwasy miękkie wolą wiązać się z zasadami miękkimi
Na pierwszy rzut oka analiza HSAB wydaje się dość podobna do systemu typu A i typu B.
Jednakże Pearson sklasyfikował bardzo szeroki zakres atomów, jonów, cząsteczek i jonów molekularnych jako twarde, graniczne lub miękkie, przenosząc analizę z tradycyjnej chemii nieorganicznej metal/ligand do – i łącząc się z – sfery chemii organicznej.
System klasyfikacji HSAB Pearsona, stąd:
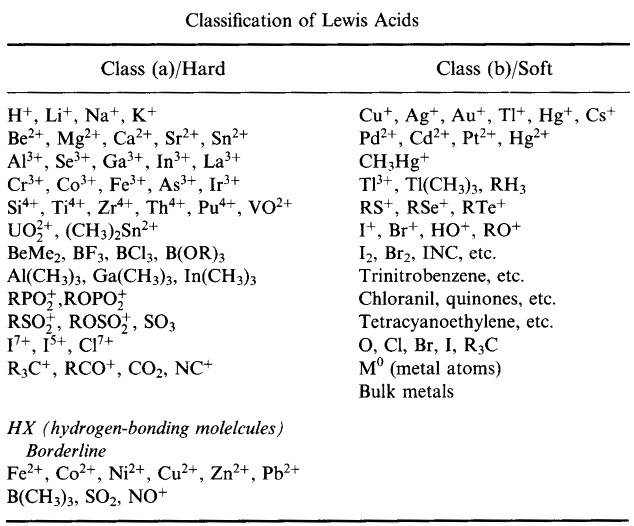
Pearson’s Hard Lewis Acids (z Chemical Thesaurus), stąd oraz z bazy danych congeneric array, stąd:
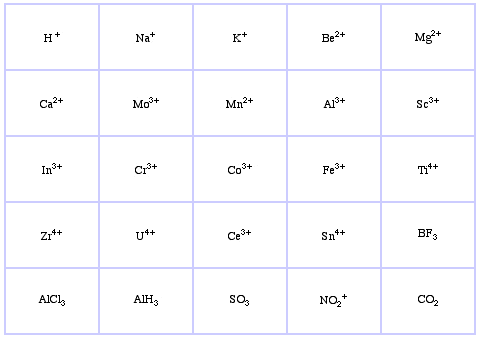
Pearson’s Borderline Lewis Acids, tutaj, oraz tutaj:
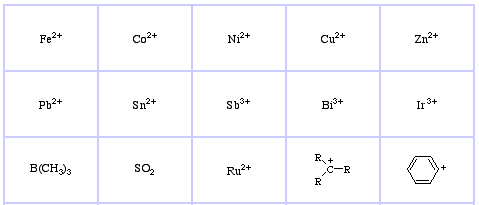
Pearson’s Soft Lewis Acids, tutaj, oraz tutaj:
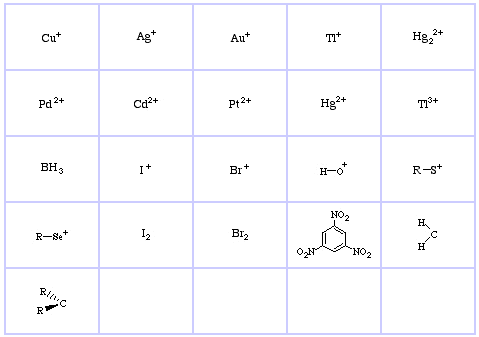
Pearson’s Hard Lewis Bases (z The Chemical Thesaurus), tutaj, oraz z bazy congeneric array, tutaj:
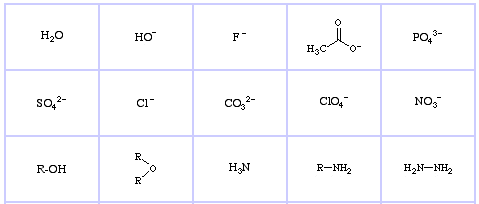
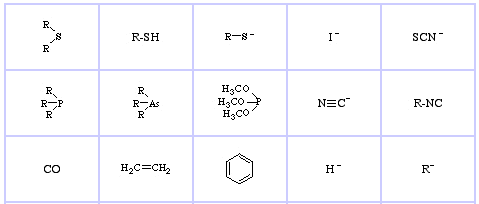
Pearson’s Borderline Lewis Bases, tutaj, oraz tutaj:

Pearson’s Soft Lewis Bases, tutaj, oraz tutaj:
Jensen’s Review of the HSAB Principle
William (Bill) Jensen przedstawił trzy prace w czasopiśmie ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Część I marzec str. 114; Część II kwiecień str. 13-18; Część III maj str. 14-18. Część III dotyczy analizy HSAB Pearsona.
Praca połączona – która jest zarówno doskonała i szczegółowa – jest dostępna na stronie internetowej Billa (a klon pliku można pobrać z tej strony).
Klopman’s FMO Analysis
W 1968 roku, G. Klopman próbował skwantyfikować zasadę HSAB Pearsona używając teorii FMO (Frontier Molecular Orbital), jak omówiono w innym miejscu tej książki, tutaj, z tym równaniem:
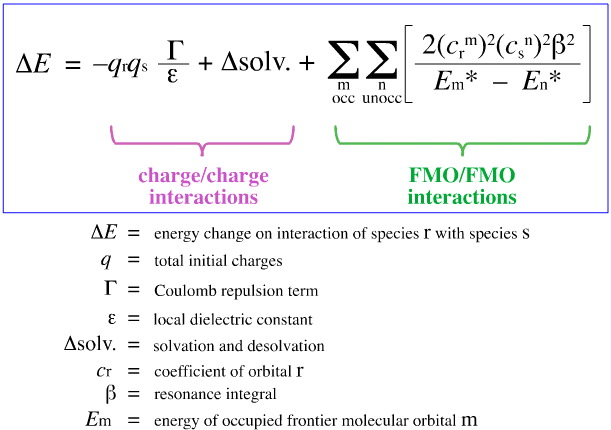
Klopman zaproponował, że:
Twarde kwasy wiążą się z twardymi zasadami, dając kompleksy o kontrolowanym ładunku (jonowe). Takie interakcje są zdominowane przez ładunki +/ na oddziałujących gatunkach.
i
Kwasy miękkie wiążą się z miękkimi zasadami dając kompleksy kontrolowane przez FMO. Oddziaływania te są zdominowane przez energie uczestniczących granicznych orbitali molekularnych (FMO), najwyższego zajętego orbitalu molekularnego (HOMO) i najniższego nie zajętego orbitalu molekularnego (LUMO).
Przeczytaj więcej w innym miejscu w książce internetowej Chemogenesis, tutaj, lub spójrz na Chemia organiczna Iana Fleminga i teoria FMO tutaj, gdzie te pomysły są rozwijane w pewnym stopniu.
Używając powyższej analizy, przyczyniające się aspekty kontrolowanego przez ładunek i FMO kontrolowanego kompleksowania kwasów/zasad Lewisa są oddzielone i określone ilościowo, co jest kluczowym osiągnięciem.
Połączenie idei Pearsona i Klopmana
Twarde kwasy Lewisa:
Centra atomowe o małym promieniu jonowym
Wysoki ładunek dodatni
Gatunki nie zawierają par elektronowych w swoich powłokach walencyjnych
Niskie powinowactwo elektronowe
Prawdopodobnie silnie rozpuszczalne
Wysoka energia LUMOMiękkie kwasy Lewisa:
Duży promień
Niski lub częściowy ładunek dodatni δ+
Pary elektronowe w ich powłokach walencyjnych
Łatwe do polaryzacji i utleniania
Niskoenergetyczne LUMO, ale współczynniki LUMO o dużej magnitudzieTwarde zasady Lewisa:
Małe, silnie rozpuszczalne, elektronegatywne centra atomowe: 3.0-4.0
Gatunki są słabo polaryzowalne
Trudne do utlenienia
Wysokoenergetyczne HOMOMiękkie zasady Lewisa:
Duże atomy o pośredniej elektronegatywności: 2.5-3.0
Łatwe do polaryzacji i utlenienia
Niskoenergetyczne HOMO, ale współczynniki HOMO dużej wielkościGatunki graniczne mają właściwości pośrednie.
W pracy Klopmana znajduje się kwalifikator mówiący, że: nie jest konieczne, aby gatunki posiadały wszystkie właściwości.
Papier Ho
Pearson zasugerował, że tendencje od twardych do miękkich można znaleźć wśród grup 15, 16 i 17 układu okresowego. W 1975 pomysł ten został rozszerzony przez Tse Lok Ho, który użył realistycznych gatunków chemicznych i ukuł termin congeneric (z tej samej rodziny), gdzie gatunki congeneric są izoelektronowe (mają tę samą strukturę Lewisa zewnętrznej powłoki).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Hard and Soft Acids and Bases (Twarde i miękkie kwasy i zasady), JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., Zasada Hard Soft Acids Bases (HSAB) a chemia organiczna Przegląd Chemiczny 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Zasada HSAB dla chemii organicznej & Chemicy Grupy Głównej
Dla naszych celów grupy głównej i chemii reakcji organicznych podejście Pearsona jest najbardziej skuteczne przy porównywaniu par gatunków:
- Jon sodu, Na+, jest twardszym kwasem Lewisa niż jon srebra, Ag+
- Jony alkoksydowe, RO, są twardszymi zasadami Lewisa niż tioaniony, RS
- Jon miedzi(II), Cu2+, jest twardszym kwasem Lewisa niż jon miedzi(I), Cu+
- Końcówka anionowa azotu ambidentnego jonu cyjankowego, CN, jest twardszą zasadą Lewisa niż bardziej miękki koniec anionu węglowego, NC
- Jon enolanowy ambidentatu, ma twarde oksyanionowe centrum zasady Lewisa, podczas gdy centrum karbanionu jest bardziej miękką zasadą Lewisa i jest bardziej nukleofilowe
Ten typ analizy może być bardzo przydatny w wyjaśnianiu selektywności reakcji.
Na przykład, β-propiolakton – reaktywny ester cykliczny – jest otwierany pierścieniowo przez nukleofilowe zasady Lewisa. Atak może wystąpić w dwóch pozycjach, a nukleofile wykazują regioselektywność:
- Twardsze nukleofile, takie jak jon alkoksydowy, R-O, atakują węgiel acylowy (karbonylowy).
- Miększe nukleofile, takie jak jon cyjankowy, NC, i tioanion, R-S, atakują węgiel β-alkilowy.
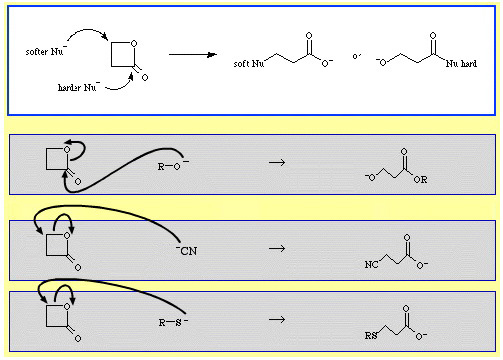
W bazie danych chemii reakcji The Chemical Thesaurus znajduje się dość dużo przykładów selektywności ambidentatu:
- Elimination vs Substitution with 1,2-Dichloroetanem
- Eliminacja vs Substytucja 2-Bromopropanem
- β-Propiolakton
- Jony cyjankowe
- Jony enolanowe
- Jony azotynowe
- Jony siarczanowe
- Jony tiocyjanianowe
Problemy, problemy, problemy…
Jednakże istnieją poważne problemy z analizą Pearsona. Podczas gdy model HSAB Pearsona-Klopmana nie jest do końca błędny… rażąco upraszcza znaną chemię reakcji, jak zauważył sam Ralph Pearson:
Na początku swojej książki z 1997 r., Chemical Hardness, Wiley-VCH, str. 3-4, Ralph Pearson szczerze pisze:
„Z nomenklaturą możliwe jest proste, ogólne stwierdzenie:
„Twarde kwasy wolą koordynować się z twardymi zasadami, a miękkie kwasy wolą koordynować się z miękkimi zasadami.”
„To jest Zasada Twardych i Miękkich Kwasów i Zasad, lub Zasada HSAB.
„Zauważ, że ta zasada jest po prostu powtórzeniem dowodów eksperymentalnych, które doprowadziły do . Jest to skondensowane stwierdzenie bardzo dużej ilości informacji chemicznych. Jako taki może być nazywany prawem. Ale ta etykieta wydaje się pretensjonalne w świetle braku ilościowej definicji twardości.
„HSAB nie jest teorią, ponieważ nie wyjaśnia zmian w sile wiązań chemicznych. Słowo „preferuje” w Zasadzie HSAB sugeruje raczej skromny efekt.
„Miękkość nie jest jedynym czynnikiem, który określa wartość ΔH° w równaniu:
A + :B → A:B
„Istnieje wiele przykładów bardzo silnych wiązań pomiędzy niedopasowanymi parami, takich jak H2, utworzonych z twardego H+ i miękkiego H.
„H2O, OH i O2 są wszystkie klasyfikowane jako twarde zasady, ale istnieją duże różnice w ich sile bazowej, według dowolnego kryterium.”
RP
I tak… (!)
Jednym z problemów jest to, że pełny zestaw twardych borderline-miękkich interakcji i kompleksów po prostu nie jest brany pod uwagę przy użyciu analizy Pearsona. Spójrz, jak pusta jest macierz interakcji HSAB:
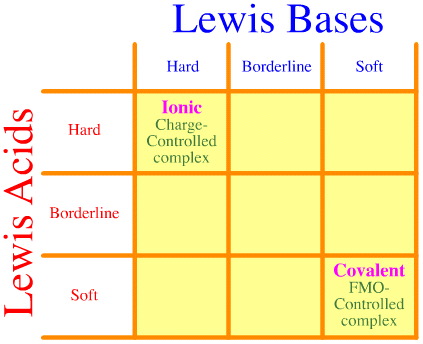
Zasada HSAB Pearsona stwierdza, że „twarde kwasy wolą wiązać się z twardymi zasadami i że miękkie kwasy wolą wiązać się z miękkimi zasadami”, co może być prawdą, ale nie mówi nic o mieszanych kompleksach twardo-miękkich.
Klopman po prostu stwierdza bardzo niepomocnie, że takie interakcje są „niezdefiniowane”!
Ale wiele z najciekawszych odczynników chemii reakcji organicznych i nieorganicznych to twardo-miękkie „napięte” kompleksy:
| Wodorek sodu |
NaH
|
Na+
|
H
|
| Wodorek glinowo-litowy |
LiAlH4
|
Al3+
|
H
|
| Octan(IV) ołowiu |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Jodek metylu |
CH3I
|
CH3+
|
I
|
| Metylolit |
CH3Li
|
Li+
|
CH3
|
| Tetrafluoroboran trietyloksonu |
+
|
CH3CH2+
|
:OR2
|
| Ferrocen |
Fe(Cp)2
|
Fe2+
|
|
|
Hard
|
Borderline
|
Soft
|
Przez porównanie, bogactwo znanej chemii reakcji powstaje naturalnie w macierzy interakcji kwas/zasada Lewisa, centralnym założeniu analizy chemogenezy (ale jesteśmy w niebezpieczeństwie wyprzedzenia siebie, patrz następne strony tutaj & tutaj).
Istnieją dwie obserwacje/zasady, i obie dotyczą kongenerycznych macierzy izoelektronowych/niereaktywnych gatunków:
- Kongeneryczne macierze zawsze znajdują się w komórkach matrycy oddziaływań kwas/zasada Lewisa, a nie przecinają komórki.
- Tendencje twarde do miękkich występują w obrębie kongenerycznych macierzy, ale nigdy nie krzyżują się między macierzami.
Reguły Fajansa
Analiza Pearsona-Klopmana HSAB jest również w bezpośredniej sprzeczności z dobrze znanymi „regułami Fajansa” (opracowanymi w latach 1915-24), chociaż wydaje się, że żaden inny autor nie zajął się tym zagadnieniem do tej pory.
Jonowy-kowalowy charakter w materiałach binarnych metal plus niemetal może być obliczony przy użyciu równania Paulinga, tutaj, ale różnica w elektronegatywności nie docenia efektu polaryzacji: stopień, do którego jeden atom zniekształca lub polaryzuje chmurę elektronową drugiego.
Reguły Fajansa mówią:
- Mały jon dodatni jest silnie polaryzowalny, sprzyja kowalencyjności, a dla danego kationu charakter kowalencyjny wzrasta w miarę jak anion staje się większy.
- Duże jony ujemne są silnie polaryzowalne, sprzyjają kowalencyjności, a dla danego anionu charakter kowalencyjny wzrasta w miarę jak kation staje się mniejszy.
- Charakter kowalencyjny wzrasta wraz ze wzrostem ładunku jonowego na każdym z jonów.
- Polaryzacja, a więc i kowalencyjność, jest preferowana, jeśli jon dodatni nie ma konfiguracji gazu szlachetnego. Jest to ważne dla takich kationów jak: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Przykład:
Patrząc na chlorek berylu, BeCl2 w porównaniu z innymi chlorkami metali ziem alkalicznych: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Kation
|
Jonowy
Radius |
Eneg.
|
% jonowy z
do wiązania Cl- |
Wiązanie &Materiał
Typ |
|
Be2+
|
41
|
1.57
|
34
|
Covalent/Molecular
|
|
Mg2+
|
86
|
1.31
|
42
|
Sól jonowa
|
|
Ca2+
|
114
|
1.00
|
51
|
Sól jonowa
|
|
Sr2+
|
132
|
0.95
|
52
|
Sól jonowa
|
|
Ba2+
|
149
|
0.89
|
54
|
Sól jonowa
|
Dane o promieniu jonowym z elementów sieci
Chlorek berylu, BeCl2, jest kowalencyjny: bezwodny materiał jest rozpuszczalny w rozpuszczalnikach organicznych, sublimuje (w próżni), a stopiony materiał jest słabym przewodnikiem elektryczności. MgCl2, CaCl2, SrCl2 i BaCl2 są materiałami jonowymi, a stopione sole są doskonałymi przewodnikami elektryczności.
- Reguły Fajansa jasno wyjaśniają tę chemię, mówiąc, że bardzo mały, silnie naładowany jon Be2+ jest w stanie spolaryzować (zniekształcić) chmury elektronowe stosunkowo dużych jonów chlorkowych do wiązania kowalencyjnego, a zatem do nadania struktury molekularnej.
- Analiza HSAB Pearsona-Klopmana stwierdza, że jon berylu, będąc najmniejszym z grupy II kationów metali jest również najtwardszy. Sole jonów berylu powinny zatem wykazywać ekstremalne wiązanie kontrolowane ładunkiem i dawać początek materiałom jonowym, ale tak nie jest.
- Analiza chemogenesis, tutaj, mówi, że kationy Grupy II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, tworzą kongeneryczny szereg naładowanych s-LUMO kwasów Lewisa, że nad tym szeregiem występują liniowe trendy zachowania.
Te liniowe trendy zachowania mogą być przypisane do „twardego-miękkiego” zachowania, jeśli tak chcesz, jednak terminy „twardy” i „miękki” mogą być używane tylko w odniesieniu do serii kongenerów, o których mowa i „twardy-miękki” porównania nie mogą być wykonane w odniesieniu do innych kwasów Lewisa.
So, What’s Going On?
Chodzi o to, że żaden parametr fizyczny nie koreluje z twardością w wybranym przez Pearsona zestawie gatunków. To tworzy niejasności, takie jak z chemii organicznej jonu fluorkowego, tutaj, i sprzeczność z zasadami Fajansa, powyżej.
Model Pearsona nie bierze pod uwagę geometrii FMO (kształty & faz uczestniczących orbitali). Na przykład, jak podobne są twarde kwasy Pearsona:
H+ + BF3 CO2 Cs+ Cu2+ ?
Albo, jak podobne są miękkie zasady Pearsona:
H R2S: H3C benzen ?
Niezwykle dla chemików organicznych i chemików grup głównych, analiza HSAB mówi niewiele/nic o ważnym jonie karbenu (karbokation) kwasu Lewisa, H3C+, lub karbionu Lewisa, H3C.
Śmiałe twierdzenie
Jednowymiarowe kontinuum twarda granica-miękkie analizy Pearsona faktycznie ma wpływ na rozmycie wiele z bogatego, liniowego (przewidywalnego) zachowania, które można znaleźć w przestrzeni chemii reakcji kwasów/ zasad Lewisa.
Nowa analiza chemogenezy przedstawiona w tej książce internetowej i poparta chemią reakcji znajdującą się w bazie danych The Chemical Thesaurus pozwala uniknąć i wyjaśnia pułapki podejścia HSAB Pearsona.
Porównanie „odgórnej” analizy HSAB z „oddolną” analizą chemogenezy
Analiza Hard Soft Acid Base (HSAB) Pearsona jest odgórna.
- Zaczynając od wszystkich gatunków w przestrzeni chemii reakcji, pewna liczba ważnych gatunków jest identyfikowana jako kwasy Lewisa i zasady Lewisa.
- Kwasy Lewisa i zasady Lewisa są następnie klasyfikowane jako twarde, graniczne lub miękkie z wykorzystaniem obserwacji empirycznych i zasady, że: twarde kwasy Lewisa wolą kompleksować z twardymi zasadami Lewisa, a miękkie kwasy Lewisa wolą kompleksować z miękkimi zasadami Lewisa:
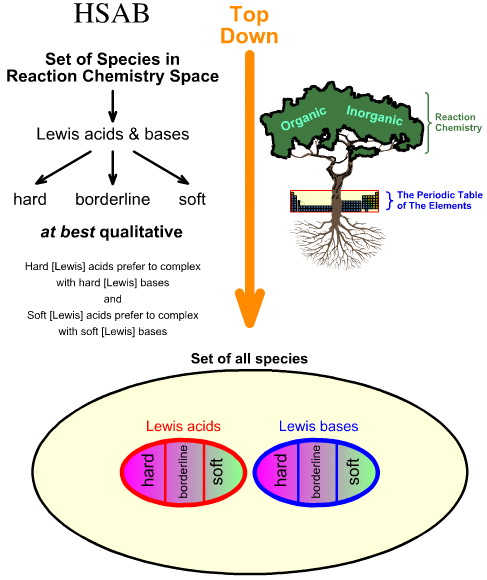
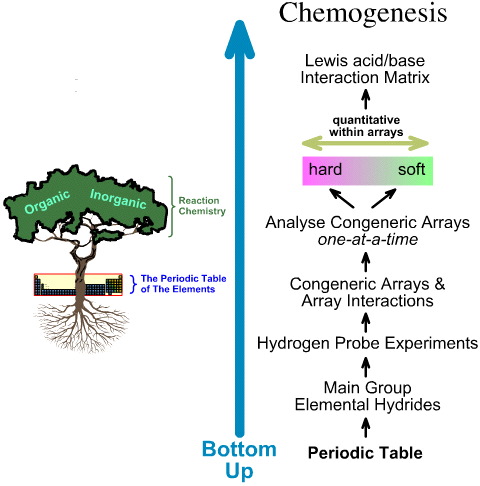
Natomiast analiza chemogenezy jest typu bottom up:
- Wodorki pierwiastków grupy głównej są poddawane eksperymentom z 5 sondami wodorowymi.
- Badane są generyczne tablice i interakcje tablicowe.
- Liniowe trendy strukturalne i reaktywności typu hard-to-soft są identyfikowane w obrębie tablic i uznaje się, że nie można oczekiwać liniowego zachowania pomiędzy tablicami.
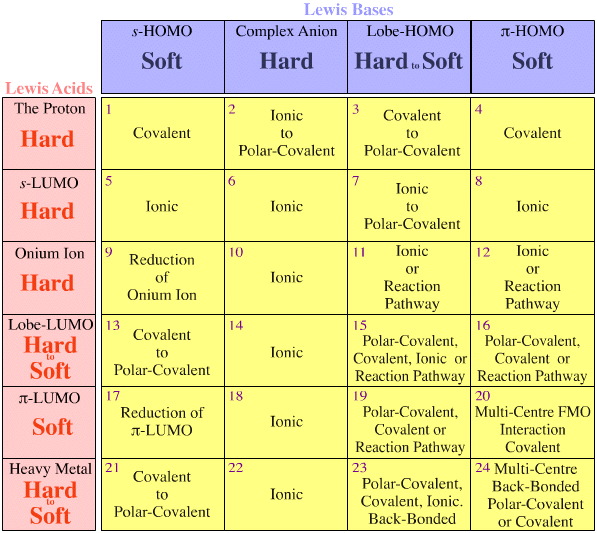
- Kwasy Lewisa i zasady Lewisa są klasyfikowane przez ich struktury elektronowe Lewisa i topologie FMO i są ułożone w macierz interakcji kwas/ zasada Lewisa, tutaj.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Patrz także tutaj.
Inne analizy po Pearsonie
Model ECW jest półilościowym modelem opisującym i przewidującym siłę oddziaływań kwas/zasada Lewisa. Początkowo model ten przypisywał kwasom i zasadom Lewisa parametry elektrostatyczne (E) i kowalencyjne (C). Później rozszerzono to do modelu ECW, aby objąć reakcje, które mają stały człon energetyczny, W, który opisuje procesy poprzedzające oddziaływanie kwas/zasada.
W Drago & Wayland oryginalnej analizy 1965, dwa równanie termin został zatrudniony tak, że każdy kwas Lewis jest scharakteryzowany przez EA i CA warunki i każdy Lewis zasady przez EB i CB, gdzie E i C parametry odnoszą się do elektrostatycznych i kowalencyjnych wkładów do siły wiązań, że kwas / zasada interakcji będzie tworzyć. (To jest jak analiza Klopmana, powyżej.) Parametry te zostały uzyskane empirycznie poprzez użycie entalpii dla adduktów, które tworzą tylko wiązania σ pomiędzy kwasem Lewisa i zasadą Lewisa i nie mają odpychania sterycznego:
-ΔH = EAEB + CACB
W modelu ECW, nowy termin W został dodany do równania.
-ΔH = EAEB + CACB + W
gdzie termin W reprezentuje stałą energię dla rozszczepienia dimerycznego kwasu Lewisa lub zasady Lewisa.
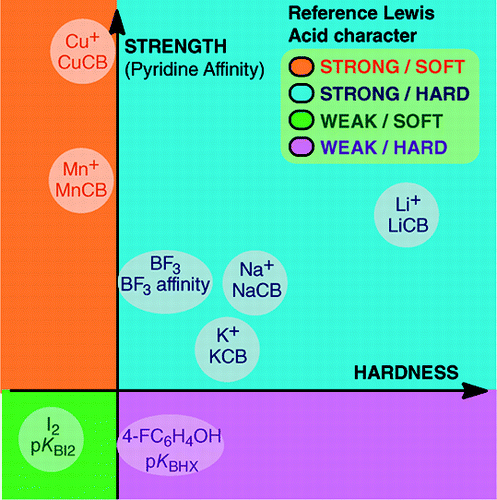
From An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstrakt:
Niemożność ustalenia uniwersalnej skali zasadowości Lewisa nie przeszkadza w określeniu ilościowego zachowania zasad Lewisa, dzięki skalom skonstruowanym względem poszczególnych kwasów Lewisa: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ i CH3NH3+. Skale te obejmują ważne typy wiązań tworzących się w adduktach kwasowo-zasadowych Lewisa: wiązanie datywne, konwencjonalne i jonowe wiązania wodorowe, wiązanie halogenowe oraz wiązania kationowo-molekularne dla kationów metali z grup 1, 7, 10, 11 i 13. Ponadto, mimo że skale te na ogół nie są ze sobą powiązane, istnieją zależności rodzinno-zależne, które pozwalają na uszeregowanie, w dość ogólnym porządku, zasad należących do danej rodziny chemicznej, np. rodziny zasad tlenowych. Dlatego sceptycyzm co do ilościowej przydatności Lewisowskiej koncepcji kwasów i zasad jest już nieuzasadniony.i:
Tworzenie adduktów kwasowo-zasadowych Lewisa obejmuje szeroką gamę procesów tworzenia wiązań, od słabego wiązania van der Waalsa w Ar—BF3 do silnego wiązania datywnego w H3N-BF3. Termin „wiązanie” może budzić zastrzeżenia w przypadku słabych adduktów. Te słabo związane gatunki są zazwyczaj wytwarzane w wiązce naddźwiękowej lub w matrycy kriogenicznej. Tutaj interesują nas głównie kompleksy, które można zaobserwować w temperaturze pokojowej w mieszaninie kwasu Lewisa i zasady Lewisa.W wodzie kolejność stałych kompleksowania jonów halogenkowych z kwasem Fe3+ wynosi F- > Cl- > Br- > I-, natomiast z Hg2+ jest to I- > Br- > Cl- >F-. To odwrócenie jest wyjaśnione przez twardy i miękki kwas i zasadę Pearsona.
Koordynacja serii azyn do metalocenów została skorelowana ze skalą zasadowości wiązań wodorowych azyn.
Obliczanie ab initio siły kwasowej Lewisa kowalencyjnych halogenków metali w vacuo przy użyciu anionu fluorkowego jako referencyjnej zasady Lewisa.
Oszacowano wartość DN trietyloaminy na podstawie korelacji pomiędzy DN a przesunięciem chemicznym NMR jądra 23Na dla roztworów soli sodowych w rozpuszczalnikach zasadowych. Później, bezpośrednie oznaczanie dało wartość, która była połową wartości oszacowanej.
 |
 |
 |
| Lewis & Brønsted Theories of Acidity | Wodorki pierwiastków grupy głównej |
.