- meta-syntese
- Om
- Vores websteder
- Web Bogkapitler
- Irving-Williams Stabilitetsserie
- Ahrland’s Type A, Type B Analysis
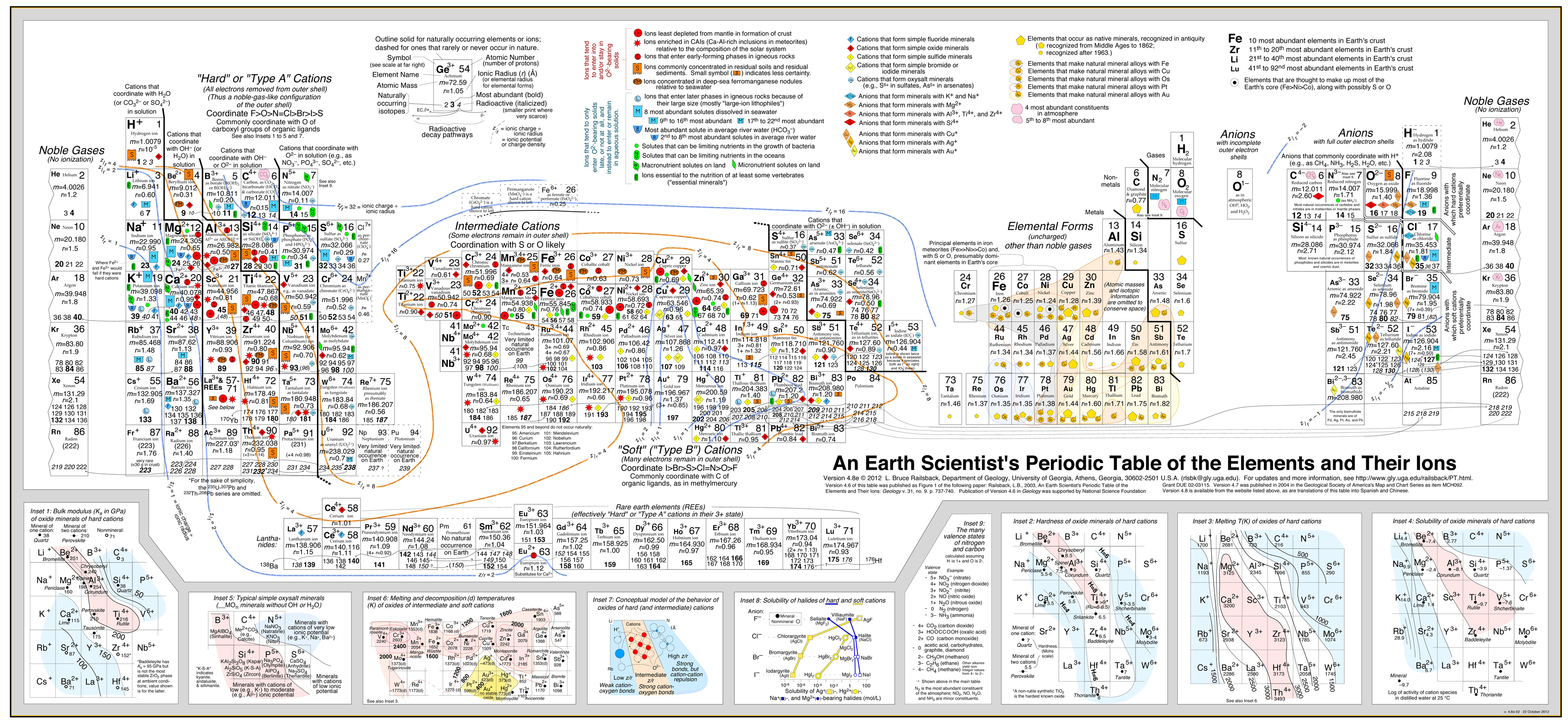
- Railsback’s geokemiske analyse
- Pearsons HSAB-princip (The Hard Soft Acid Base Principle)
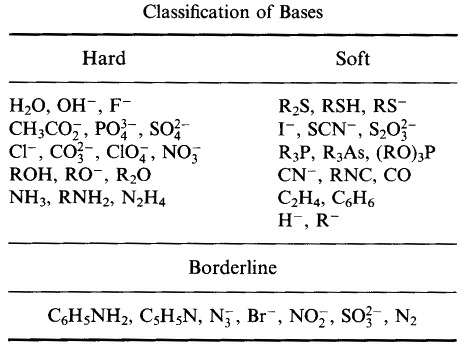
- Pearsons HSAB-klassifikationssystem, herfra:
- Jensen’s Review of the HSAB Principle
- Klopmans FMO-analyse
- Kombination af Pearsons og Klopmans ideer
- The Ho Paper
- HSAB-princippet for organiske & Hovedgruppekemikere
- Problemer, problemer, problemer…
- Fajans’ regler
- Hvad sker der så?
- Sammenligning af “Top Down” HSAB-analysen med “Bottom Up” kemogeneseanalysen
- The HSAB Papers:
- Other Post-Pearson Analysis
- Alkalimetallkationer: Li+ til Cs+
- Alkalimetallkationer:
- Alkalimetallkationer: Be2+ til Ba2+
- Lette overgangsmetalkationer i højere oxidationstrin: Be2+ til Ba2+
- Lette overgangsmetalkationer i højere oxidationstrin: Ti4+, Cr3+, Fe3+, Co3+
- Protonerne, H+
- Tungere overgangsmetalkationer i lavere oxidationstrin:
- Sværere overgangsmetalkationer i lavere oxidationstrin: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
- Nogle metaller findes i naturen som Type A metal + Type A ligandmineraler, f.eks. carbonater: MgCO3 og CaCO3 og oxider: Fe2O3 og TiO2
- Mens andre findes som type B-metal + type B-ligandmineraler, f.eks. sulfidmalme: PbS, CdS, NiS osv.
- Railsback-analysen anvender konturer af adfærd overlejret på det periodiske system. .
- Se artiklen: A Synthesis of Systematic Mineralogy af Bruce Railsback, der udvikler denne analyse.
- Natriumionen, Na+, er hårdere Lewis-syre end sølvionen, Ag+
- Alkoxid-ioner, RO, er hårdere Lewis-baser end di-ioner, RS
- Kobber(II)-ionen, Cu2+, er hårdere Lewis-syre end kobber(I)-ionen, Cu+
- Nitrogenanion-enden af den ambidentate cyanid-ion, CN, er hårdere Lewis-base end den blødere kulstofanionende, NC
- Den ambidentate enolat-ion, har et hårdt oxyanion-Lewis-basecenter, mens carbanioncentret er blødere Lewis-base og er mere nukleofilt
- Hårdere nukleofile som alkoxidion, R-O, angriber acyl(carbonyl)-kulstoffet.
- Blødere nukleofile som cyanidion, NC, og thioanion, R-S, angriber β-alkylkulstoffet.
- Elimination vs. Substitution med 1,2-dichlorethan
- Eliminering vs Substitution med 2-Brompropan
- β-Propiolacton
- Cyanid-ion
- Enolat-ioner
- Nitrit-ion
- Sulfinat-ion
- Thiocyanat-ion
- Kongeneriske arrays findes altid inden for cellerne i Lewis-syre/base-interaktionsmatrixen, og ikke på tværs af cellerne.
- Hårde-til-bløde tendenser forekommer inden for kongeneriske arrays, men de krydser aldrig mellem arrays.
- En lille positiv ion er stærkt polariserende, favoriserer kovalens, og for et givet kation øges den kovalente karakter, efterhånden som anionen bliver større.
- Store negative ioner er stærkt polariserende, favoriserer kovalens, og for en given anion øges den kovalente karakter, efterhånden som kationen bliver mindre.
- Kovalent karakter øges med stigende ionladning på begge ioner.
- Polarisation, og dermed kovalens, er begunstiget, hvis den positive ion ikke har en ædelgaskonfiguration. Dette er vigtigt for kationer som f.eks: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
- Fajans regler forklarer klart denne kemi ved at sige, at den meget lille, højt ladede Be2+-ion er i stand til at polarisere (forvrænge) elektronskyerne af de forholdsvis store chloridioner til kovalente bindinger og dermed give en molekylær struktur.
- Pearson-Klopman HSAB-analysen siger, at berylliumionen, der er den mindste af gruppe II-metalkationerne, også er den hårdeste. Berylliumion-salte burde derfor udvise ekstrem ladningskontrolleret binding og give anledning til ioniske materialer, men det gør de ikke.
- Den kemogenese-analyse, her, siger, at gruppe II-kationer: Be2+, Mg2+, Ca2+, Ca2+, Sr2+ & Ba2+, udgør en kongenerisk serie af ladede s-LUMO Lewis-syrer, at der findes lineære adfærdstendenser over denne serie.
Disse lineære adfærdstendenser kan om ønsket tilskrives “hård-blød” adfærd, men udtrykkene “hård” og “blød” kan kun anvendes med hensyn til den pågældende kongeneriske serie, og “hård-blød”-sammenligninger kan ikke foretages med hensyn til andre Lewis-syrer. - Med udgangspunkt i alle arter i reaktionskemirummet identificeres en række vigtige arter som Lewis-syrer og Lewis-baser.
- Lewissyrer og Lewisbaser klassificeres derefter som hårde, borderline eller bløde ved hjælp af empiriske observationer og princippet om, at: hårde Lewis-syrer foretrækker at indgå komplekser med hårde Lewis-baser og bløde Lewis-syrer foretrækker at indgå komplekser med bløde Lewis-baser:
- Hovedgruppens elementære hydrider underkastes de 5 hydrogen-sondeeksperimenter.
- Generiske arrays og array-interaktioner undersøges.
- Lineære hårde-til-bløde strukturelle og reaktivitetstendenser identificeres inden for arrays, og det erkendes, at lineær adfærd ikke kan forventes mellem arrays.
- Lewissyrer og Lewisbaser er klassificeret efter deres Lewis elektroniske strukturer og FMO-topologier og er arrangeret i en Lewis syre/base interaktionsmatrix, her.
Ligander, kemiske enheder, der danner komplekser med metalkationer, blev klassificeret som type A eller type B afhængigt af, om de danner mere stabile komplekser med type A metalkationer eller type B metalkationer, herfra:
Ligandens tendens til at danne komplekser
med type A-metallerLigandens tendens til at danne komplekser
med type A-metallerLigandens tendens til at danne komplekser kompleks
med type B-metallerN >> P > As > Sb > Bi
O >> S > Se > Te
F >> Cl > Br > I
N << P > As > Sb > Bi
O << S ~ Se ~ Te
F < Cl < Br <<< I
Fra denne analyse, kan der udledes en empirisk regel:
Type A-metaller foretrækker at binde (kompleksere) til type A-ligander
og
Type B-metaller foretrækker at binde (kompleksere) til type B-ligander
Disse empiriske – eksperimentelt udledte – regler fortæller os, at type A-metaller er mere tilbøjelige til at danne oxider, carbonater, nitrider og fluorider, mens type B-metaller er mere tilbøjelige til at danne fosfider, sulfider og selinider.
Railsback’s geokemiske analyse
Den “Type A, Type B”-analyse er af stor økonomisk betydning, fordi:
Denne fremgangsmåde er med stor succes blevet udviklet af Bruce Railsback med hans fremragende og stærkt anbefalelsesværdige “Earth Scientist’s Periodic Table website”.
Klik på billedet for at forstørre:
Pearsons HSAB-princip (The Hard Soft Acid Base Principle)
I tresserne udvidede Ralph Pearson i høj grad Type A-Type B-logikken ved at forklare den differentierede komplekseringsadfærd hos kationer og ligander i form af elektronpar accepterende Lewis-syrer og elektronpar afgivende Lewis-baser:
Lewissyre + Lewisbase → Lewis syre/base-kompleks
Pearson klassificerede Lewis-syrer og Lewis-baser som hårde, borderline eller bløde.
I henhold til Pearson’s hard soft acid base (HSAB) princip:
Hårde syrer foretrækker at binde sig til hårde baser
og
bløde syrer foretrækker at binde sig til bløde baser
Op det første øjekast synes HSAB-analysen at ligne type A- og type B-systemet ret meget.
Pearson klassificerede imidlertid en meget bred vifte af atomer, ioner, molekyler og molekylære ioner som hårde, borderline eller bløde, hvilket flyttede analysen fra den traditionelle uorganiske metal/ligand-kemi til – og kombinerede den med – den organiske kemis område.
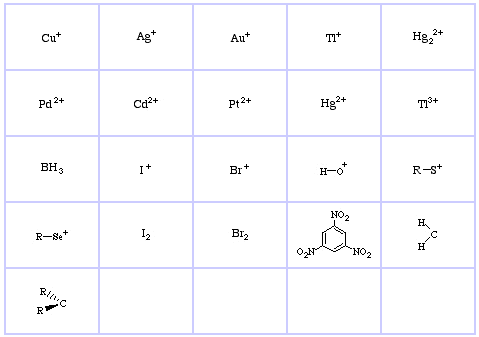
Pearsons HSAB-klassifikationssystem, herfra:
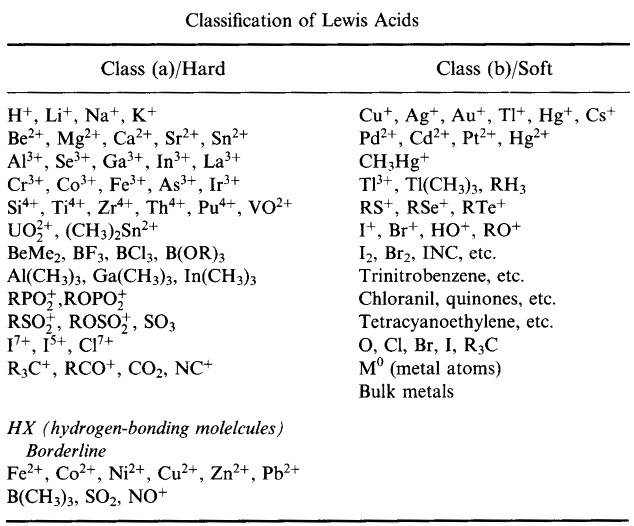
Pearson’s Hard Lewis Acids (fra Chemical Thesaurus), her, og fra congeneric array-databasen, her:
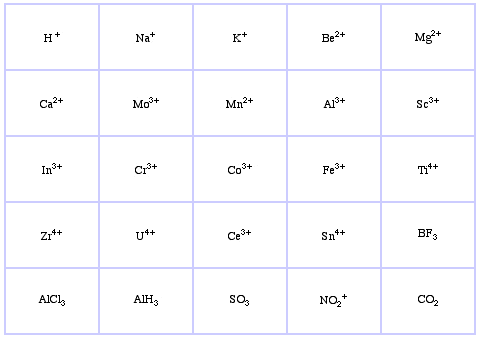
Pearson’s Borderline Lewis Acids, her, og her:
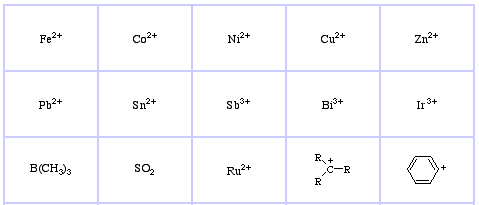
Pearson’s Soft Lewis Acids, her, og her:
Pearson’s Hard Lewis Bases (fra The Chemical Thesaurus), her, og fra congeneric array database, her:
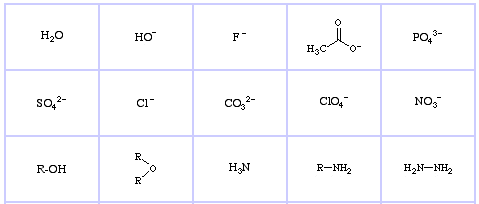
Pearson’s Borderline Lewis Bases, her, og her:

Pearson’s Soft Lewis Bases, her, og her:
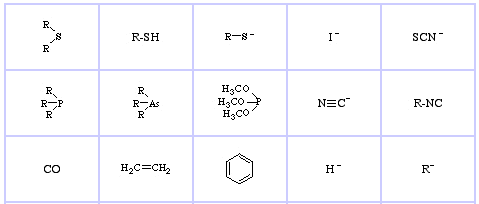
Jensen’s Review of the HSAB Principle
William (Bill) Jensen præsenterede tre artikler i ACS tidsskriftet Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Del I marts s. 11-14; Del II april s. 13-18; Del III maj s. 14-18. Del III omhandler Pearsons HSAB-analyse.
Den kombinerede artikel – som er både fremragende og detaljeret – er tilgængelig på Bills webspace (og en klon af filen kan downloades fra dette websted).Klopmans FMO-analyse
I 1968 forsøgte G. Klopman at kvantificere Pearsons HSAB-princip ved hjælp af frontier molecular orbital (FMO)-teori, som omtalt andetsteds i denne webbog, her med denne ligning:
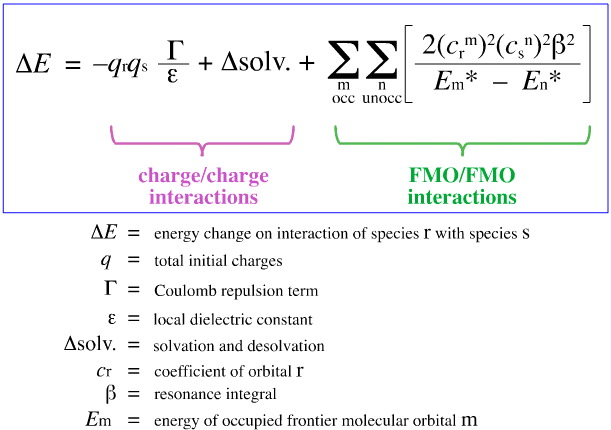
Klopman foreslog, at:
Hårde syrer binder sig til hårde baser for at give ladningskontrollerede (ioniske) komplekser. Sådanne vekselvirkninger er domineret af +/-ladningerne på de vekselvirkende arter.
og
Soft Acids binder sig til soft bases for at give FMO-kontrollerede komplekser. Disse vekselvirkninger er domineret af energierne for de deltagende grænsemolekylære orbitaler (FMO), den højest besatte molekylære orbital (HOMO) og den laveste ubesatte molekylære orbital (LUMO).
Læs mere andetsteds i webbogen Chemogenesis, her, eller se Ian Flemings Organic Chemistry and FMO theory her, hvor disse ideer er udførligt udviklet.
Med ovenstående analyse er de bidragende aspekter af ladningskontrolleret og FMO-kontrolleret Lewis syre/base-kompleksdannelse adskilt og kvantificeret, hvilket er en afgørende udvikling.
Kombination af Pearsons og Klopmans ideer
Hårde Lewis-syrer:
Atomcentre med lille ionradius
Høj positiv ladning
Arterne indeholder ikke elektronpar i deres valensskaller
Lav elektronaffinitet
Sandsynligvis stærkt solvateret
Høj energi LUMOBløde Lewis-syrer:
Stor radius
Lav eller delvis δ+ positiv ladning
Elektronpar i deres valensskaller
Let at polarisere og oxidere
Lav energi LUMO’er, men LUMO-koefficienter af stor størrelseHårde Lewisbaser:
Små, stærkt solvaterede, elektronegative atomare centre: 3.0-4,0
Arterne er svagt polariserbare
Svært at oxidere
Højt energimæssigt HOMOBløde Lewisbaser:
Store atomer med mellemliggende elektronegativitet: 2,5-3,0
Let at polarisere og oxidere
Lavt energimæssigt HOMO, men HOMO-koefficienter af stor størrelseGrænsearter har intermediære egenskaber.
Der er et forbehold i Klopmans artikel, der siger, at: det er ikke nødvendigt, at arterne besidder alle egenskaber.
The Ho Paper
Pearson foreslog, at man kunne finde hårde til bløde tendenser blandt gruppe 15, 16 og 17 i det periodiske system. I 1975 blev ideen udvidet af Tse Lok Ho, der anvendte realistiske kemiske arter og opfandt udtrykket kongenerisk (af samme familie), hvor kongeneriske arter er isoelektroniske (har den samme Lewis-struktur i den ydre skal).
 BiSbAsPN
BiSbAsPNPearson, R.G., Hårde og bløde syrer og baser, JACS 85, 3533-3539 (1963)
TeSeSOIBrClFR3Sb:R3As:R3P:R3N:Ho, T.-L., Princippet om hårde bløde syrer og baser (HSAB) og organisk kemi Chemistry Reviews 75, 1-20 (1975) H3C-H2N-HO-F-I-Br-Cl-F-F-H3C+(CH3)H2C+(CH3)2HC+(CH3)3C+HSAB-princippet for organiske & Hovedgruppekemikere
For vores formål hovedgruppe og organisk reaktionskemi er Pearson-tilgangen mest vellykket, når man sammenligner par af arter:
Denne type analyse kan være meget nyttig til at forklare reaktionsselektivitet.
For eksempel β-propiolacton – en reaktiv cyklisk ester – ringåbnes af nucleofile Lewisbaser. Angrebet kan ske i to positioner, og nukleofile udviser regioselektivitet:
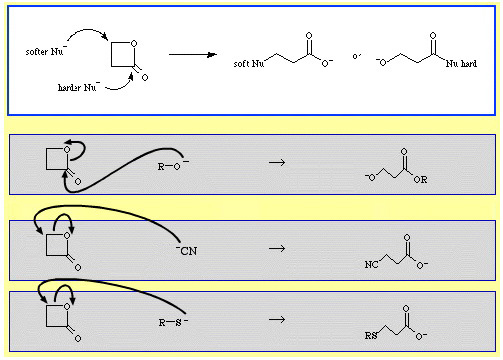
Der er en hel del eksempler på ambidentat-selektivitet i The Chemical Thesaurus reaktionskemidatabase:
Problemer, problemer, problemer…
Der er imidlertid alvorlige problemer med Pearsons analyse. Selv om Pearson-Klopman HSAB-modellen ikke er helt forkert … forenkler den groft den kendte reaktionskemi, hvilket Ralph Pearson selv erkender:
I begyndelsen af sin bog fra 1997, Chemical Hardness, Wiley-VCH, s. 3-4, skriver Ralph Pearson ærligt:
“Med nomenklaturen er det muligt at komme med en simpel, generel udtalelse:
“Hårde syrer foretrækker at koordinere sig til hårde baser, og bløde syrer foretrækker at koordinere sig til bløde baser.”
“Dette er princippet om hårde og bløde syrer og baser eller HSAB-princippet.
“Bemærk, at dette princip blot er en omformulering af de eksperimentelle beviser, der førte til . Det er en kondenseret erklæring af en meget stor mængde kemisk information. Som sådan kan det kaldes en lov. Men denne betegnelse virker prætentiøs i betragtning af manglen på en kvantitativ definition af hårdhed.
“HSAB er ikke en teori, da den ikke forklarer variationer i styrken af kemiske bindinger. Ordet “foretrækker” i HSAB-princippet antyder en ret beskeden virkning.
“Blødhed er ikke den eneste faktor, der bestemmer værdien af ΔH° i ligningen:
A + :B → A:B
“Der er mange eksempler på meget stærke bindinger mellem mismatchede par, som H2, der er dannet af hårdt H+ og blødt H.
“H2O, OH og O2 er alle klassificeret som hårde baser, men der er store forskelle i deres basestyrke, uanset kriteriet.”
RP
Sådan er det faktisk… (!)
Et problem er, at det fulde sæt af hårde-grænse-bløde interaktioner og komplekseringer simpelthen ikke tages i betragtning ved hjælp af Pearson-analysen. Se, hvor tom HSAB-interaktionsmatrixen er:
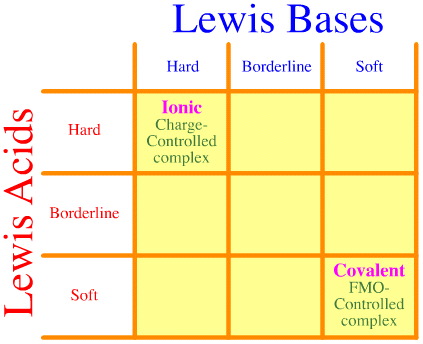
Pearson HSAB-princippet siger, at “hårde syrer foretrækker at binde til hårde baser, og at bløde syrer foretrækker at binde til bløde baser”, hvilket måske er rigtigt, men det siger intet om blandede hårdt-bløde komplekser.
Klopman siger blot meget ubehjælpsomt, at sådanne interaktioner er “udefinerede”!
Men alligevel er mange af de mest interessante reagenser i organisk og uorganisk reaktionskemi hårdt-bløde “spændte” komplekser:
Natriumhydrid NaHNa+HLithiumaluminiumhydrid LiAlH4Al3+HBly(IV)acetat Pb(AcO)4Pb4+AcOMethyljodid CH3ICH3+IMethyl lithium CH3LiLi+CH3Triethyloxoniumtetrafluoroborat +CH3CH2+CH3CH2+:OR2Ferrocene Fe(Cp)2Fe2+HårdBorderlineSoftTil sammenligning, opstår rigdommen af den kendte reaktionskemi naturligt i Lewis syre/base interaktionsmatrixen, et centralt princip i kemogeneseanalysen (men vi er i fare for at komme foran os selv, se de næste sider her & her).
Der er to observationer/regler, og begge vedrører kongeneriske arrays af isoelektroniske/isoreaktive arter:
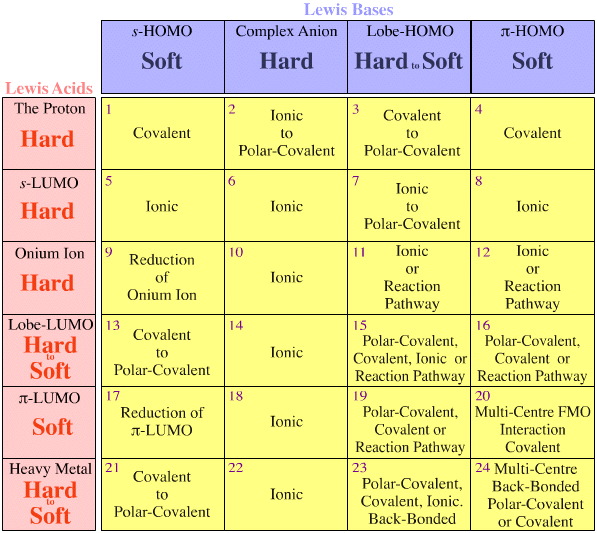
Fajans’ regler
Pearson-Klopman HSAB-analysen er også i direkte modstrid med de velkendte “Fajans’ regler” (udviklet i løbet af årene 1915-24), selv om ingen anden forfatter synes at have behandlet dette spørgsmål til dato.
Ionisk-kovalent karakter i binære materialer af metal plus ikke-metal kan beregnes ved hjælp af Pauling-ligningen, her, men forskellen i elektronegativitet undervurderer effekten af polarisering: det omfang, i hvilket det ene atom forvrænger eller polariserer det andet atoms elektronsky.
Fajans regler siger:
Et eksempel:
Tænk på berylliumchlorid, BeCl2 sammenlignet med de andre jordalkaliclorider: MgCl2, CaCl2, SrCl2, & BaCl2:
KationIonisk
RadiusEneg.% ionisk af
til Cl-bindingBinding & Materiale
TypeBe2+411.5734Kovalent/molekylærMg2+861.3142Ionisk saltCa2+1141.0051Ionisk saltSr2+1320.9552Ionisk saltBa2+1490.8954Ionisk saltIonisk radius data fra webelementer
Berylliumchlorid, BeCl2, er kovalent: det vandfri materiale er opløseligt i organiske opløsningsmidler, det sublimerer (i vakuum), og det smeltede materiale er en dårlig leder af elektricitet. MgCl2, CaCl2, SrCl2 og BaCl2 er ioniske materialer, og de smeltede salte er fremragende elektriske ledere.
Hvad sker der så?
Punktet er, at ingen fysisk parameter korrelerer med hårdhed over Pearsons udvalgte sæt af arter. Dette skaber tvetydigheder, som f.eks. med fluoridionens organiske kemi, her, og modsigelsen med Fajans’ regler, ovenfor.
Pearson-modellen tager ikke hensyn til FMO-geometrien (de deltagende orbitals former & faser). For eksempel, hvor ens er Pearsons hårde syrer:
H+ + BF3 CO2 Cs+ Cu2+ ?
Og hvor ens er Pearsons bløde baser:
H R2S: H3C benzen ?
Kræsentligt for organiske kemikere og hovedgruppekemikere siger HSAB-analysen lidt/intet om den vigtige carbenium-ion (karbokation) Lewis-syre, H3C+, eller carbanion-Lewis-basen, H3C.
Fed påstand
Det endimensionelle hårde-grænse-grænse-bløde kontinuum i Pearsons analyse har faktisk den virkning, at meget af den rige, lineære (forudsigelige) adfærd, der kan findes i Lewis-syre/base-reaktionskemirummet, udviskes.
Den nye kemogeneseanalyse, som præsenteres i denne webbog og understøttes af reaktionskemien, der findes i databasen The Chemical Thesaurus, undgår og forklarer faldgruberne i Pearsons meget hypede HSAB-tilgang.
Sammenligning af “Top Down” HSAB-analysen med “Bottom Up” kemogeneseanalysen
Pearsons Hard Soft Acid Base (HSAB)-analyse er top down.
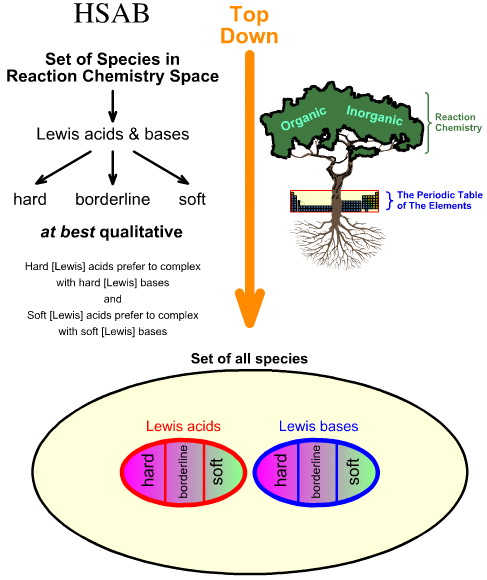
I modsætning hertil er kemogenese-analysen bottom-up:
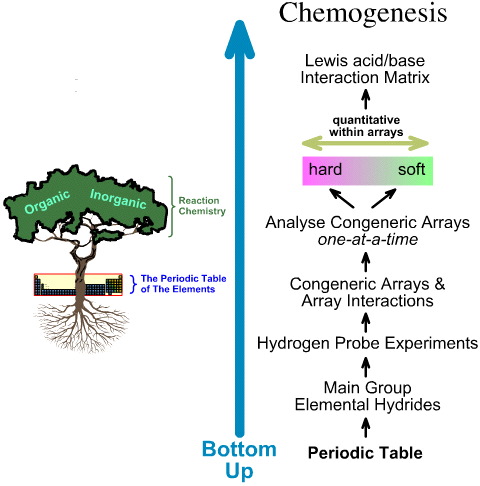
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Se også her.
Other Post-Pearson Analysis
EECW-modellen er en semi-kvantitativ model, der beskriver og forudsiger styrken af Lewis syre/base-interaktioner. Oprindeligt tildelte modellen elektrostatiske (E) og kovalente (C) parametre til Lewis-syrer og -baser. Dette blev senere udvidet til ECW-modellen for at dække reaktioner, der har et konstant energiterm, W, som beskriver de processer, der går forud for syre/base-interaktionen.
I Drago & Waylands oprindelige analyse fra 1965 blev der anvendt en ligning med to termer, således at hver Lewis-syre er karakteriseret ved EA- og CA-termer og hver Lewis-base ved EB- og CB-termer, hvor E- og C-parametrene henviser til de elektrostatiske og kovalente bidrag til styrken af de bindinger, som syre/base-interaktionen vil danne. (Dette er ligesom Klopman-analysen, ovenfor.) Disse parametre blev empirisk opnået ved at bruge enthalpier for addukter, der kun danner σ-bindinger mellem Lewis-syren og Lewis-basen og ikke har nogen sterisk repulsion:
-ΔH = EAEB + CACB
I ECW-modellen blev der tilføjet et nyt term W til ligningen.
-ΔH = EAEB + CACB + W
hvor W-termen repræsenterer en konstant energi for spaltning af en dimerisk Lewis-syre eller Lewis-base.
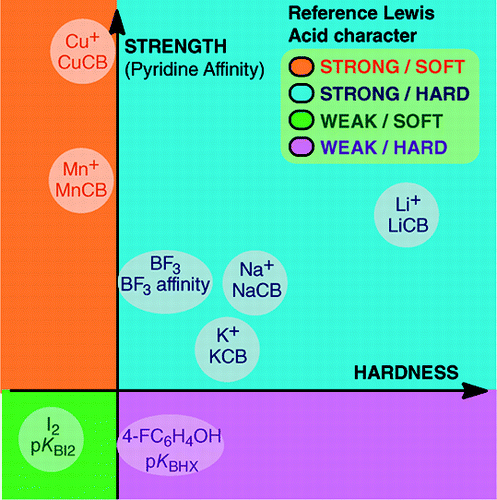
Fra An Overview of Lewis Basicity and Affinity Scales af Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
Den manglende mulighed for at etablere en universel skala for Lewisbasicitet forhindrer ikke bestemmelsen af Lewisbasernes kvantitative adfærd takket være skalaer konstrueret i forhold til bestemte Lewis-syrer: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ og CH3NH3+. Disse skalaer omfatter vigtige typer af bindinger, der dannes i et Lewis-syre-baseaddukt: dative bindinger, konventionelle og ioniske hydrogenbindinger, halogenbindinger og kation-molekylebindinger for metalkationer i gruppe 1, 7, 10, 11 og 13. Selv om disse skalaer generelt ikke er indbyrdes forbundne, findes der familieafhængige relationer, som gør det muligt at rangordne de baser, der tilhører en given kemisk familie, f.eks. familien af oxygenbaser, i en ret generel rækkefølge. Skepsissen over for den kvantitative anvendelighed af Lewis-begrebet om syrer og baser er derfor ikke længere begrundet.og:
Dannelsen af Lewis-syre-baseaddukter dækker en bred vifte af bindingsdannende processer, fra den svage van der Waals-binding i Ar—BF3 til den stærke dative binding i H3N-BF3. Udtrykket “binding” kan være uhensigtsmæssigt for svage addukter. Disse svagt bundne arter fremstilles generelt i en supersonisk stråle eller i en kryogen matrix. Her er vi hovedsagelig interesseret i komplekser, der kan observeres i en rumtemperaturblanding af Lewis-syre og Lewis-base.I vand er rækkefølgen af halogenidioners komplekseringskonstanter med syren Fe3+ F- > Cl- > Br- > I-, mens den med Hg2+ er I- > Br- > Cl- >F-. Denne omvending kan forklares ved Pearsons princip om hårde og bløde syrer og baser.
Koordineringen af en række aziner til metallocener er blevet korreleret med azinernes hydrogenbindingsbasiskala.
Ab initio beregning af Lewis-syrestyrken af kovalente metalhalogenider i vacuo ved hjælp af fluoridanionen som reference-Lewis-base.
En DN-værdi for triethylamin blev estimeret ud fra en korrelation mellem DN og det kemiske NMR-skift af 23Na-kernen for opløsninger af natriumsalte i basiske opløsningsmidler. Senere gav den direkte bestemmelse en værdi, der var halvdelen af den estimerede værdi.



Lewis & Brønsted-teorier om surhedsgrad Hovedgruppens grundstofhydrider
 |
 |
 |
Ralph Pearson introducerede sit Hard Soft Acid Base-princip (HSAB) i begyndelsen af halvfemserne, og forsøgte derved at forene uorganisk og organisk reaktionskemi. Virkningen af den nye idé var øjeblikkelig, men i årenes løb er HSAB-princippet snarere faldet ved siden af, mens andre tilgange, der blev udviklet på samme tid, såsom frontier molecular orbital (FMO)-teori og molekylær mekanik, har blomstret.
Denne side diskuterer de dybtgående begrænsninger i Pearson-tilgangen og sammenligner & kontrasterer HSAB-princippet med kemogeneseanalysen, som den præsenteres i denne webbog.
Bemærk, i denne webbog:
| Lewis-syrer er RØDE | Lewis-baser er BLÅ |
Irving-Williams Stabilitetsserie
Irving-Williams stabilitetsserie (1953) påpegede, at for en given ligand stiger stabiliteten af dipositive metalionkomplekser:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Det var også kendt, at visse ligander dannede deres mest stabile komplekser med metalioner som Al3+, Ti4+ & Co3+, mens andre dannede stabile komplekser med Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
I 1958 dannede Ahrland et al. klassificerede metalkationer som Type A og Type B, hvor:
Type A metalkationer omfatter:
Type B-metalkationer omfatter: