- meta-syntéza
- O nás
- Naše webové stránky
- Web Kapitoly z knih
 |
 |
 |
Ralph Pearson představil svůj princip Hard Soft Acid Base (HSAB) na počátku šedesátých let, a pokusil se tak sjednotit anorganickou a organickou reakční chemii. Dopad nové myšlenky byl okamžitý, nicméně v průběhu let princip HSAB spíše ustoupil do pozadí, zatímco jiné přístupy vyvinuté ve stejné době, jako teorie hraničních molekulových orbitalů (FMO) a molekulová mechanika, vzkvétaly.
Tato stránka pojednává o hlubokých omezeních Pearsonova přístupu a srovnává & princip HSAB s analýzou chemogeneze, jak je prezentována v této webové knize.
Poznámka, v této webové knize:
| Lewisovy kyseliny jsou ČERVENÉ | Lewisovy báze jsou MODRÉ |
- Irving-Williamsova řada stability
- Ahrlandova analýza typu A, typu B
- Railsbackův geochemický rozbor
- Pearsonův princip HSAB (The Hard Soft Acid Base Principle)
- Pearsonův klasifikační systém HSAB, odtud:
- Jensen’s Review of HSAB Principle
- Klopmanova analýza FMO
- Kombinace Pearsonových a Klopmanových myšlenek
- Ho Paper
- Princip HSAB pro organické látky. & Chemie hlavních skupin
- Problémy, problémy, problémy…
- Fajansova pravidla
- Tak o co jde?
- Srovnání analýzy HSAB „shora dolů“ s analýzou chemogeneze „zdola nahoru“
- The HSAB Papers:
- Další post-Pearsonova analýza
Irving-Williamsova řada stability
Irving-Williamsova řada stability (1953) poukázala na to, že pro daný ligand se stabilita dipozitivních komplexů kovových iontů zvyšuje:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Bylo také známo, že některé ligandy tvoří nejstabilnější komplexy s ionty kovů, jako je Al3+, Ti4+ & Co3+, zatímco jiné tvořily stabilní komplexy s Ag+, Hg2+ & Pt2+
Ahrlandova analýza typu A, typu B
V roce 1958 Ahrland a kol. klasifikoval kationty kovů jako kationty typu A a typu B, přičemž:
Kationty kovů typu A zahrnují:
- kationty alkalických kovů: Kationty kovů alkalických zemin: Li+ až Cs+
- Kationty kovů alkalických zemin: Be2+ až Ba2+
- Kationy lehkých přechodných kovů ve vyšších oxidačních stavech: Mezi kationty kovů typu B patří:
- Těžší kationty přechodných kovů v nižších oxidačních stavech: Ti4+, Cr3+, Fe3+, Co3+
- Proton, H+
Mezi kationty kovů typu B patří:
- Těžší kationty přechodných kovů v nižších oxidačních stavech:
Ligandy, chemické entity, které se komplexují s kationty kovů, byly odtud klasifikovány jako typ A nebo typ B podle toho, zda vytvářejí stabilnější komplexy s kationty kovů typu A nebo kationty kovů typu B.
Ligandy, chemické entity, které se komplexují s kationty kovů, byly odtud klasifikovány jako typ A nebo typ B podle toho, zda vytvářejí stabilnější komplexy s kationty kovů typu A nebo kationty kovů typu B:
|
Tendence ligandů ke komplexaci
s kovy typu A |
Tendence ligandů ke komplexaci
s kovy typu A |
Tendence ligandů ke komplexaci
s kovy typu A komplexovat s kovy typu B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Z této analýzy, lze odvodit empirické pravidlo:
Kovy typu A se raději vážou (komplexuji) s ligandy typu A
a
Kovy typu B se raději vážou (komplexuji) s ligandy typu B
Tato empirická – experimentálně odvozená – pravidla nám říkají, že kovy typu A spíše tvoří oxidy, uhličitany, nitridy a fluoridy, zatímco Kovy typu B spíše tvoří fosfidy, sulfidy a selinidy.
Railsbackův geochemický rozbor
Rozbor „typ A, typ B“ má velký hospodářský význam, protože:
- Některé kovy se v přírodě vyskytují jako kov typu A + ligandové minerály typu A, například uhličitany: MgCO3 a CaCO3 a oxidy: Fe2O3 a TiO2
- Jiné se vyskytují jako minerály typu B kov + ligand typu B, například sulfidické rudy: PbS, CdS, NiS atd.
Tento přístup velmi úspěšně rozvinul Bruce Railsback se svou vynikající a velmi doporučovanou „Earth Scientist’s Periodic Table website“.
Klikněte na obrázek pro zvětšení:
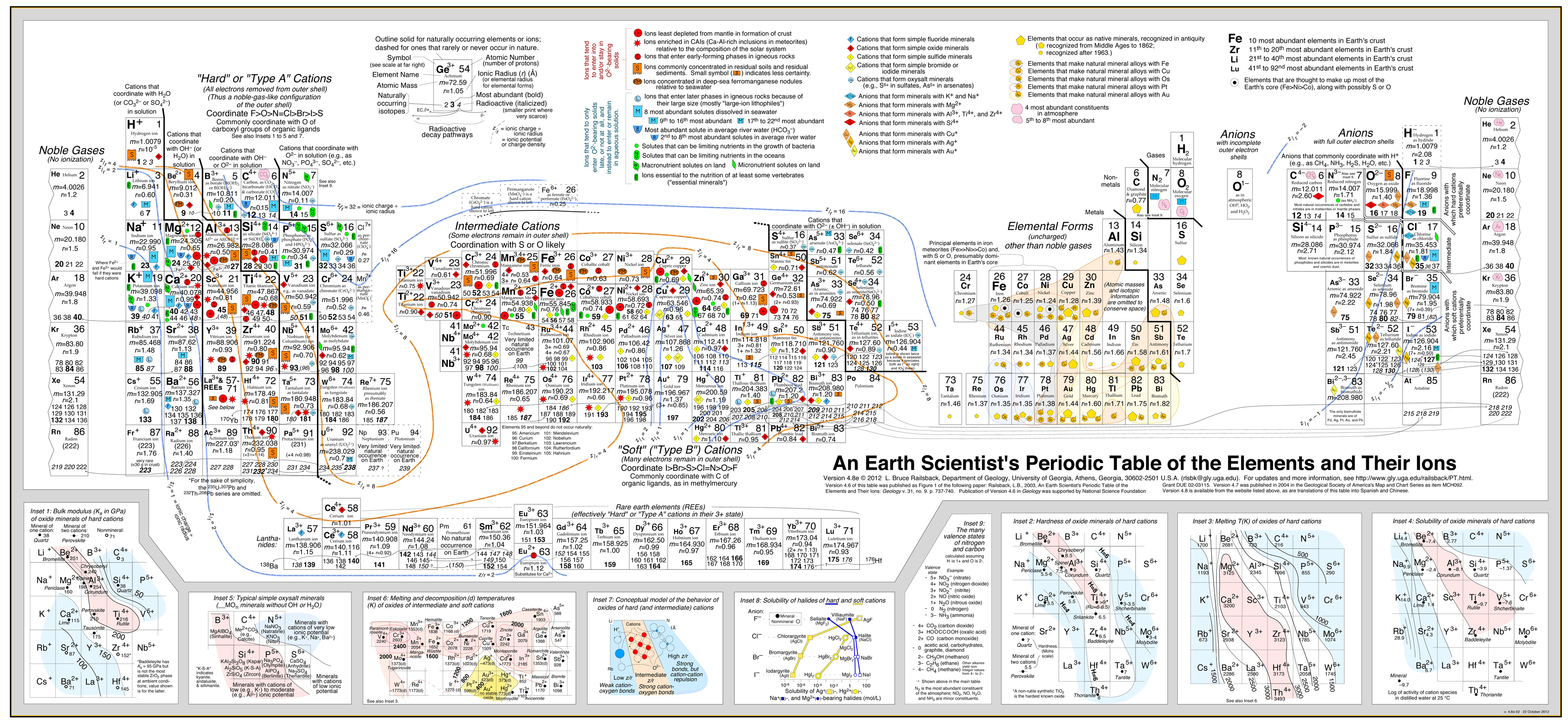
- Railsbackova analýza používá obrysy chování překryté periodickou tabulkou. .
- Podívejte se na článek: A Synthesis of Systematic Mineralogy od Bruce Railsbacka, který tuto analýzu rozvíjí.
Pearsonův princip HSAB (The Hard Soft Acid Base Principle)
V šedesátých letech Ralph Pearson výrazně rozšířil logiku typu A-Type B tím, že vysvětlil rozdílné komplexační chování kationtů a ligandů v termínech Lewisových kyselin přijímajících elektronové páry a Lewisových bází darujících elektronové páry:
Lewisova kyselina + Lewisova báze → komplex Lewisovy kyseliny a báze
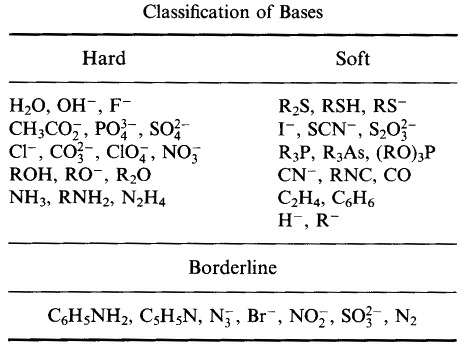
Pearson klasifikoval Lewisovy kyseliny a Lewisovy báze jako tvrdé, hraniční nebo měkké.
Podle Pearsonova principu tvrdých měkkých kyselých bází (HSAB):
Tvrdé kyseliny dávají přednost vazbě na tvrdé báze
a
Měkké kyseliny dávají přednost vazbě na měkké báze
Na první pohled se zdá, že analýza HSAB je spíše podobná systému typu A a typu B.
Pearson však klasifikoval velmi širokou škálu atomů, iontů, molekul a molekulových iontů jako tvrdé, hraniční nebo měkké, čímž posunul analýzu z tradiční anorganické chemie kovů/ligandů do oblasti organické chemie – a spojil ji s ní.
Pearsonův klasifikační systém HSAB, odtud:
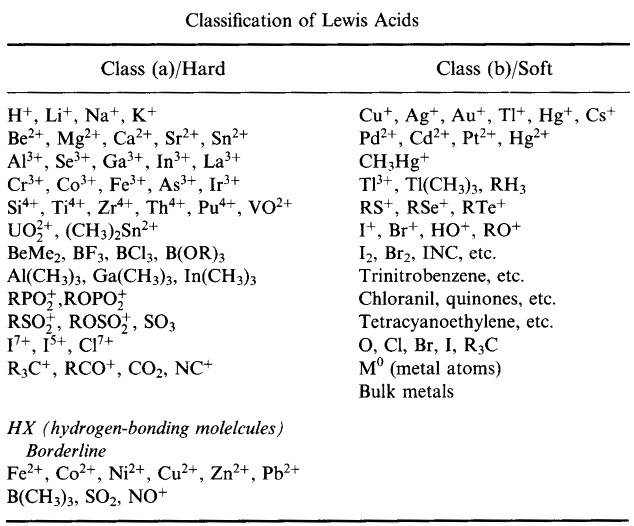
Pearsonovy tvrdé Lewisovy kyseliny (z chemického tezauru), zde, a z databáze kongeneračního pole, zde:
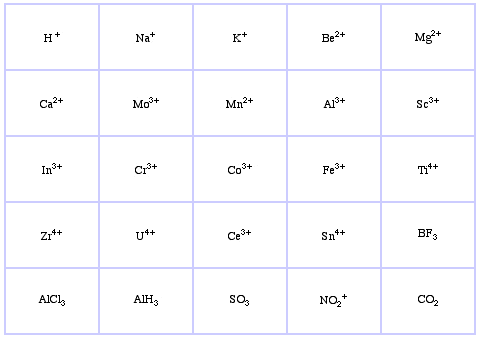
Pearsonovy hraniční Lewisovy kyseliny, zde, a zde:
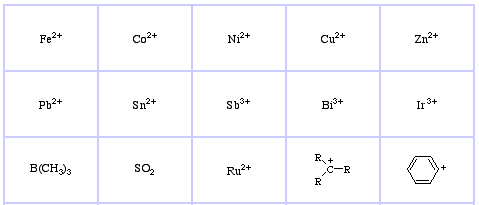
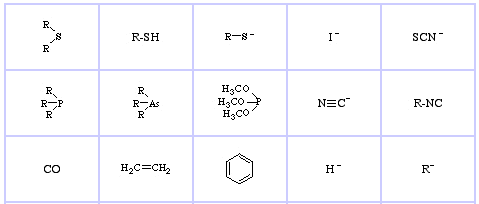
Pearson’s Soft Lewis Acids, zde a zde:
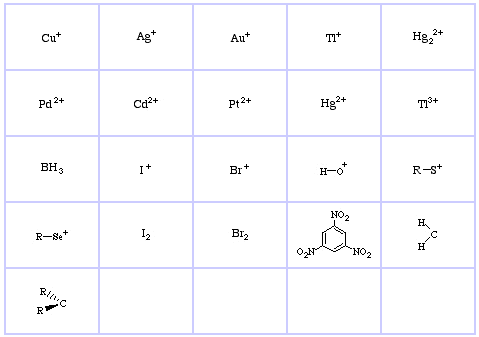
Pearson’s Hard Lewis Bases (z The Chemical Thesaurus), zde, a z databáze kongenerických řad, zde:
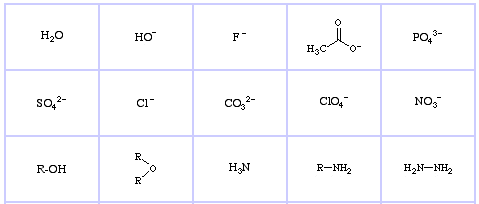
Pearsonovy hraniční Lewisovy báze, zde, a zde:

Pearson’s Soft Lewis Bases, zde a zde:
Jensen’s Review of HSAB Principle
William (Bill) Jensen prezentoval tři články v časopise ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Část I březen s. 11-14; část II duben s. 13-18; část III květen s. 14-18. Část III se zabývá Pearsonovou analýzou HSAB.
Kombinovaný článek – který je vynikající a podrobný – je k dispozici na Billově webovém prostoru (a klon souboru lze stáhnout z této webové stránky).
Klopmanova analýza FMO
V roce 1968 se G. Klopman pokusil kvantifikovat Pearsonův princip HSAB pomocí teorie hraničních molekulových orbitalů (FMO), jak je uvedeno na jiném místě této webové knihy, zde pomocí této rovnice:
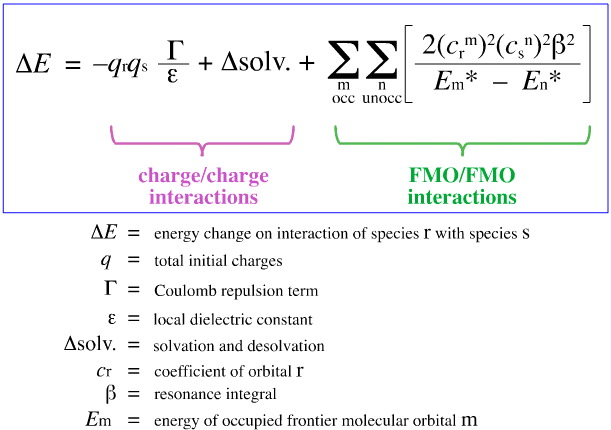
Klopman navrhl, že:
Tvrdé kyseliny se vážou na tvrdé báze za vzniku nábojově řízených (iontových) komplexů. Takovým interakcím dominují náboje +/ na interagujících druzích.
a
Měkké kyseliny se vážou na měkké báze za vzniku komplexů řízených FMO. Těmto interakcím dominují energie zúčastněných hraničních molekulových orbitalů (FMO), nejvyššího obsazeného molekulového orbitalu (HOMO) a nejnižšího neobsazeného molekulového orbitalu (LUMO).
Přečtěte si více na jiném místě webové knihy Chemogenesis, zde, nebo se podívejte na Ian Fleming’s Organic Chemistry and FMO theory zde, kde jsou tyto myšlenky podrobně rozvedeny.
Pomocí výše uvedené analýzy jsou odděleny a kvantifikovány přispívající aspekty nábojově řízené a FMO řízené komplexace Lewisových kyselin a zásad, což je zásadní vývoj.
Kombinace Pearsonových a Klopmanových myšlenek
Tvrdé Lewisovy kyseliny:
Atomová centra s malým iontovým poloměrem
Vysoký kladný náboj
Druhy neobsahují elektronové páry ve svých valenčních obalech
Nízká elektronová afinita
Pravděpodobnost silné solvatace
Vysoká energie LUMOMěkké Lewisovy kyseliny:
Velký poloměr
Nízký nebo částečný kladný náboj δ+
Elektronové páry v jejich valenčních slupkách
Snadná polarizace a oxidace
Nízkoenergetické LUMO, ale velká velikost LUMO koeficientůTvrdé Lewisovy báze:
Malá, silně solvatovaná, elektronegativní atomová centra: 3.0-4,0
Druhy jsou slabě polarizovatelné
Obtížně se oxidují
Vysoká energie HOMOMěkké Lewisovy báze:
Velké atomy střední elektronegativity: 2,5-3,0
Snadno se polarizují a oxidují
Nízká energie HOMO, ale velká velikost koeficientů HOMOHraniční druhy mají přechodné vlastnosti.
V Klopmanově článku je upřesnění, které říká, že: není nutné, aby druhy měly všechny vlastnosti.
Ho Paper
Pearson navrhl, že mezi skupinami 15, 16 a 17 periodické tabulky lze nalézt trendy od tvrdých k měkkým. V roce 1975 tuto myšlenku rozšířil Tse Lok Ho, který použil realistické chemické druhy a zavedl termín kongenerické (ze stejné rodiny), přičemž kongenerické druhy jsou izoelektronové (mají stejnou Lewisovu strukturu vnější slupky).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Tvrdé a měkké kyseliny a zásady, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., The Hard Soft Acids Bases (HSAB) Principle and Organic Chemistry Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Princip HSAB pro organické látky. & Chemie hlavních skupin
Pro naše účely chemie hlavních skupin a organických reakcí je Pearsonův přístup nejúspěšnější při porovnávání dvojic druhů:
- Sodný ion, Na+, je tvrdší Lewisovou kyselinou než stříbrný ion, Ag+
- Alkoxidové ionty, RO, jsou tvrdší Lewisovou zásadou než thioanionty, RS
- Iont mědi(II), Cu2+, je tvrdší Lewisovou kyselinou než ion mědi(I), Cu+
- Dusíkatý aniontový konec ambidentního kyanidového iontu, CN, je tvrdší Lewisova báze než měkčí konec uhlíkového aniontu, NC
- Ambidentátový enolátový ion, má tvrdé oxyaniontové Lewisovo bazické centrum, zatímco karbaniontové centrum je měkčí Lewisova báze a je nukleofilnější
Tento typ analýzy může být velmi užitečný při vysvětlování selektivity reakcí.
Například β-propiolakton – reaktivní cyklický ester – otevírá kruh nukleofilní Lewisovou bází. K útoku může dojít ve dvou polohách a nukleofily vykazují regioselektivitu:
- Tvrdší nukleofily, jako je alkoxidový ion, R-O, útočí na acylový (karbonylový) uhlík.
- Měkčí nukleofily, jako je kyanidový ion, NC, a thioanion, R-S, útočí na β-alkylový uhlík.
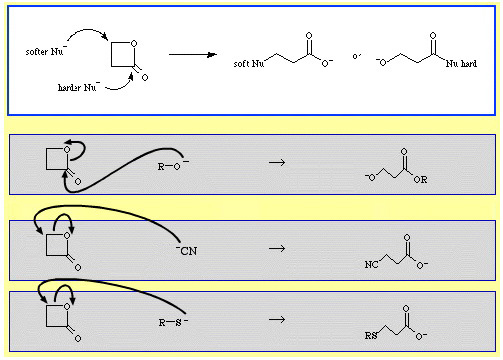
V databázi The Chemical Thesaurus reaction chemistry je poměrně velké množství příkladů ambidentní selektivity:
- Eliminace vs Substituce s 1,2-dichlorethanem
- Eliminace vs Substituce 2-bromopropanem
- β-Propiolakton
- Kyanidový ion
- Enolátové ionty
- Nitritový ion
- Sulfinátový ion
- Thiokyanátový ion
Problémy, problémy, problémy…
S Pearsonovou analýzou jsou však vážné problémy. Pearsonův-Klopmanův model HSAB sice není úplně špatný… ale hrubě zjednodušuje známou chemii reakcí, což uznává i sám Ralph Pearson:
Na začátku své knihy z roku 1997, Chemical Hardness, Wiley-VCH, str. 3-4, Ralph Pearson otevřeně píše:
„S nomenklaturou je možné učinit jednoduché, obecné prohlášení:
„Tvrdé kyseliny dávají přednost koordinaci s tvrdými zásadami a měkké kyseliny dávají přednost koordinaci s měkkými zásadami.“
„To je princip tvrdých a měkkých kyselin a zásad neboli princip HSAB.
„Všimněte si, že tento princip je pouhým převyprávěním experimentálních důkazů, které vedly k . Je to zhuštěné vyjádření velmi velkého množství chemických informací. Jako takový by mohl být nazván zákonem. Toto označení se však zdá být domýšlivé vzhledem k tomu, že chybí kvantitativní definice tvrdosti.
„HSAB není teorie, protože nevysvětluje rozdíly v pevnosti chemických vazeb. Slovo „preferovat“ v principu HSAB naznačuje spíše skromný účinek.
„Měkkost není jediným faktorem, který určuje hodnotu ΔH° v rovnici:
A + :B → A:B
„Existuje mnoho příkladů velmi silných vazeb mezi nesourodými dvojicemi, jako je H2, které vznikají z tvrdých H+ a měkkých H. Vazby mezi tvrdými H+ a měkkými H jsou velmi silné.
„H2O, OH a O2 jsou klasifikovány jako tvrdé báze, ale podle jakéhokoli kritéria jsou mezi nimi velké rozdíly v pevnosti bází.“
RP
Jistě tak… (!)
Jedním z problémů je, že pomocí Pearsonovy analýzy se jednoduše nezohledňuje celý soubor interakcí a komplexací tvrdá-měkká. Podívejte se, jak prázdná je matice interakcí HSAB:
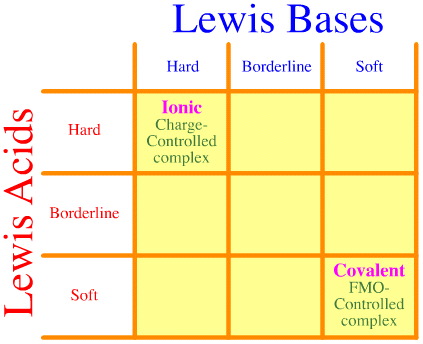
Pearsonův princip HSAB říká, že „tvrdé kyseliny se raději vážou na tvrdé báze a že měkké kyseliny se raději vážou na měkké báze“, což může být pravda, ale neříká to nic o smíšených hard-soft komplexech.
Klopman prostě velmi neužitečně uvádí, že takové interakce jsou „nedefinované“!“
A přesto mnoho z nejzajímavějších činidel organické a anorganické reakční chemie jsou hard-soft „napjaté“ komplexy:
| hydrid sodný |
NaH
|
Na+
|
H
|
| hydrid hlinito- lithný |
LiAlH4
|
Al3+
|
H
|
| Octan olovnatý(IV) |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Methyljodid |
CH3I
|
CH3+
|
I
|
| Methyllithium |
CH3Li
|
Li+
|
CH3
|
| Triethyloxonium tetrafluoroborát |
+
|
CH3CH2+
|
:OR2
|
| Ferrocen |
Fe(Cp)2
|
Fe2+
|
|
|
Tvrdý
|
Hraniční
|
Měkký
|
Pro srovnání, bohatství známé reakční chemie vzniká přirozeně v Lewisově matrici interakcí kyselin a zásad, což je ústřední princip analýzy chemogeneze (ale hrozí, že předbíháme, viz další stránky zde & zde).
Existují dvě pozorování/pravidla a obě se týkají kongenerických polí izoelektronických/izoreaktivních druhů:
- Kongenerická pole se vždy nacházejí uvnitř buněk Lewisovy interakční matice kyseliny/baze, nikoliv napříč buňkami.
- Trendy od tvrdých k měkkým se vyskytují v rámci kongenerických matic, ale nikdy se nekříží mezi maticemi.
Fajansova pravidla
Pearsonova-Klopmanova analýza HSAB je také v přímém rozporu se známými „Fajansovými pravidly“ (vyvinutými v letech 1915-24), i když se zdá, že žádný jiný autor se touto otázkou dosud nezabýval.
Ionicko-kovalentní charakter v binárních materiálech kov plus nekov lze vypočítat pomocí Paulingovy rovnice, zde však rozdíl v elektronegativitě podceňuje vliv polarizace: míru, do jaké jeden atom deformuje nebo polarizuje elektronový oblak druhého.
Fajansova pravidla říkají:
- Malý kladný iont je silně polarizující, upřednostňuje kovalenci a pro daný kation se kovalentní charakter zvyšuje s tím, jak se anion zvětšuje.
- Velké záporné ionty jsou silně polarizující, upřednostňují kovalenci a pro daný anion se kovalentní charakter zvyšuje s tím, jak se kation zmenšuje.
- Kovalentní charakter se zvyšuje s rostoucím iontovým nábojem obou iontů.
- Polarizace, a tedy kovalence, je zvýhodněna, pokud kladný iont nemá konfiguraci vzácného plynu. To je důležité pro kationty jako např: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Příklad:
Považte chlorid berylia, BeCl2 ve srovnání s ostatními chloridy alkalických zemin: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Kationt
|
Iontový
radius |
Eneg.
|
% iontové vazby
na Cl- |
Vazba & Materiál
Typ |
|
Be2+
|
41
|
1.57
|
34
|
Kovalentní/molekulární
|
|
Mg2+
|
86
|
1.31
|
42
|
Iontová sůl
|
|
Ca2+
|
114
|
1.00
|
51
|
Iontová sůl
|
|
Sr2+
|
132
|
0.95
|
52
|
Iontová sůl
|
|
Ba2+
|
149
|
0.89
|
54
|
Iontová sůl
|
Údaje o poloměru iontu z webových prvků
Chlorid berylia, BeCl2, je kovalentní: bezvodý materiál je rozpustný v organických rozpouštědlech, sublimuje (ve vakuu) a roztavený materiál je špatným vodičem elektřiny. MgCl2, CaCl2, SrCl2 a BaCl2 jsou iontové materiály a roztavené soli jsou vynikajícími elektrickými vodiči.
- Fajansova pravidla jasně vysvětlují tuto chemii tím, že velmi malý, vysoce nabitý Be2+ iont je schopen polarizovat (deformovat) elektronová mračna relativně velkých chloridových iontů do kovalentní vazby, a tím dát molekulární strukturu.
- Pearsonova-Klopmanova analýza HSAB uvádí, že iont berylia, který je nejmenší z kationtů kovů skupiny II, je také nejtvrdší. Soli iontů berylia by tedy měly vykazovat extrémní vazbu řízenou nábojem a dávat vznik iontovým materiálům, což se však neděje.
- Analýza chemogeneze zde říká, že kationty skupiny II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, tvoří kongenerickou řadu nabitých s-LUMO Lewisových kyselin, že v této řadě se vyskytují lineární trendy chování.
Tyto lineární trendy chování lze připsat „tvrdému a měkkému“ chování, pokud si to přejete, nicméně termíny „tvrdý“ a „měkký“ lze použít pouze s ohledem na danou kongenerickou řadu a „tvrdé a měkké“ srovnání nelze provést s ohledem na jiné Lewisovy kyseliny.
Tak o co jde?
Jde o to, že žádný fyzikální parametr nekoreluje s tvrdostí v Pearsonově zvoleném souboru druhů. To vytváří nejasnosti, jako například u organické chemie fluoridového iontu, zde, a rozpor s Fajansovými pravidly, výše.
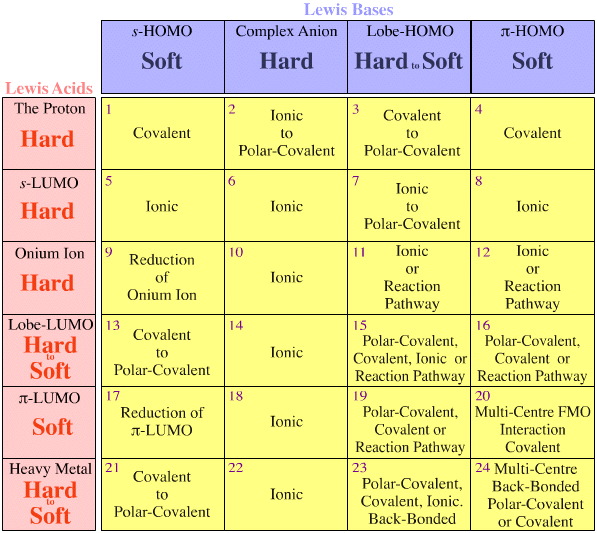
Pearsonův model nebere v úvahu geometrii FMO (tvary & fází zúčastněných orbitalů). Jak podobné jsou si například Pearsonovy tvrdé kyseliny:
H+ + BF3 CO2 Cs+ Cu2+ ?
Nebo jak podobné jsou Pearsonovy měkké báze:
H R2S: H3C benzen ?
Pro chemiky organických a hlavních skupin je důležité, že analýza HSAB říká málo/nic o důležité Lewisově kyselině s karbenovým iontem (karbokationtem), H3C+, nebo Lewisově bázi s karbaniontem, H3C.
Odvážné tvrzení
Jednorozměrné hard-hraniční-měkké kontinuum Pearsonovy analýzy má ve skutečnosti za následek rozmazání velké části bohatého, lineárního (předvídatelného) chování, které lze nalézt v prostoru reakční chemie Lewisovy kyseliny/baze.
Nová analýza chemogeneze, jak je prezentována v této webové knize a podpořena chemií reakcí vedenou v databázi The Chemical Thesaurus, se vyhýbá úskalím Pearsonova tolik propagovaného přístupu HSAB a vysvětluje je.
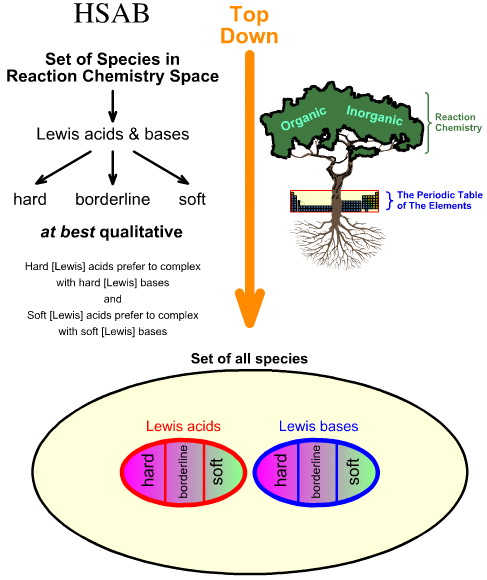
Srovnání analýzy HSAB „shora dolů“ s analýzou chemogeneze „zdola nahoru“
Pearsonova analýza tvrdých a měkkých kyselin a zásad (HSAB) je analýzou shora dolů.
- Vychází se ze všech druhů v prostoru reakční chemie a řada důležitých druhů je identifikována jako Lewisovy kyseliny a Lewisovy báze.
- Lewisovy kyseliny a Lewisovy báze jsou pak klasifikovány jako tvrdé, hraniční nebo měkké pomocí empirického pozorování a principu, že: tvrdé Lewisovy kyseliny dávají přednost komplexům s tvrdými Lewisovými bázemi a měkké Lewisovy kyseliny dávají přednost komplexům s měkkými Lewisovými bázemi:
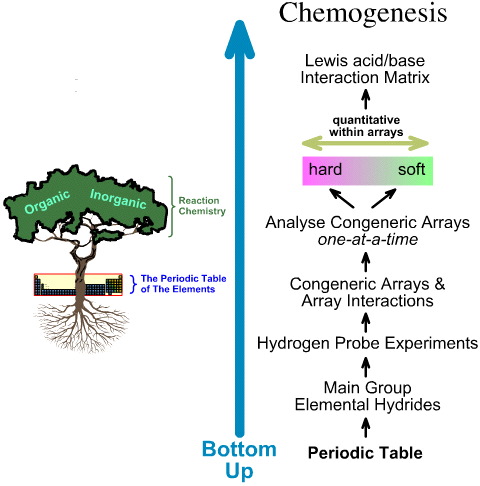
Naproti tomu chemogenetická analýza je zdola nahoru:
- Hlavní skupina elementárních hydridů je podrobena 5 experimentům s vodíkovou sondou.
- Studují se obecná pole a interakce polí.
- V rámci polí se identifikují lineární trendy od tvrdé k měkké struktuře a reaktivitě a uznává se, že lineární chování nelze očekávat mezi poli.
- Lewisovy kyseliny a Lewisovy báze jsou klasifikovány podle svých Lewisových elektronických struktur a topologií FMO a jsou zde uspořádány do matice interakcí Lewisovy kyseliny a báze.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Také se podívejte sem.
Další post-Pearsonova analýza
Model ECW je semikvantitativní model, který popisuje a předpovídá sílu interakcí Lewisových kyselin a zásad. Původně model přiřazoval Lewisovým kyselinám a zásadám elektrostatické (E) a kovalentní (C) parametry. Později byl model ECW rozšířen na reakce, které mají konstantní energetický člen W, jenž popisuje procesy, které předcházejí interakci kyseliny a zásady.
V původní analýze Draga & Waylanda z roku 1965 byla použita dvoučlenná rovnice tak, že každá Lewisova kyselina je charakterizována členy EA a CA a každá Lewisova zásada členy EB a CB, kde parametry E a C odkazují na elektrostatický a kovalentní příspěvek k síle vazeb, které interakce kyseliny a zásady vytvoří. (To je jako výše uvedená Klopmanova analýza.) Tyto parametry byly získány empiricky pomocí entalpií pro adukty, které vytvářejí pouze σ vazby mezi Lewisovou kyselinou a Lewisovou bází a nemají žádné sterické odpuzování:
-ΔH = EAEB + CACB
V modelu ECW byl do rovnice přidán nový člen W. V modelu ECW byl do rovnice přidán nový člen W.
-ΔH = EAEB + CACB + W
kde člen W představuje konstantní energii pro štěpení dimerní Lewisovy kyseliny nebo Lewisovy báze.
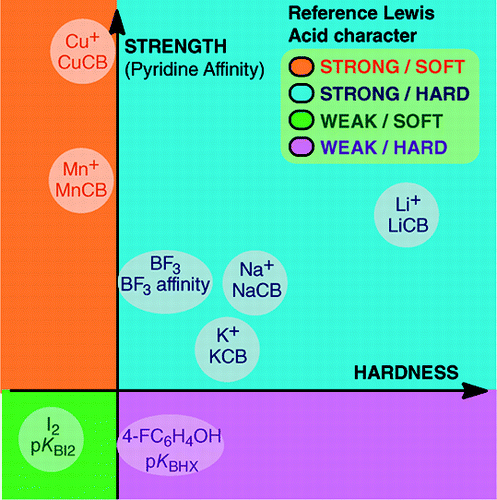
Z An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstrakt:
Nemožnost stanovit univerzální stupnici Lewisovy bazicity nebrání určení kvantitativního chování Lewisových zásad díky stupnicím sestrojeným vůči jednotlivým Lewisovým kyselinám: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ a CH3NH3+. Tyto stupnice zahrnují důležité typy vazeb vznikajících v aduktu Lewisovy kyseliny a zásady: dativní vazbu, konvenční a iontovou vodíkovou vazbu, halogenovou vazbu a vazby mezi kationtem a molekulou pro kationty kovů skupin 1, 7, 10, 11 a 13. Kromě toho, ačkoli tyto stupnice spolu obecně nesouvisejí, existují vztahy závislé na rodině, které umožňují seřadit v poměrně obecném pořadí báze patřící do dané chemické rodiny, například do rodiny kyslíkových bází. Proto skepse ohledně kvantitativní užitečnosti Lewisova pojetí kyselin a zásad již není opodstatněná.a:
Tvorba Lewisových aduktů kyselin a zásad zahrnuje širokou škálu vazebných procesů, od slabé van der Waalsovy vazby v Ar—BF3 až po silnou dativní vazbu v H3N-BF3. Termín „vazba“ může být u slabých aduktů sporný. Tyto slabě vázané druhy se obvykle vytvářejí v nadzvukovém svazku nebo v kryogenní matrici. Zde nás zajímají především komplexy, které lze pozorovat ve směsi Lewisovy kyseliny a Lewisovy báze za pokojové teploty.Ve vodě je pořadí komplexačních konstant halogenidových iontů s kyselinou Fe3+ následující: F- > Cl- > Br- > I-, zatímco s Hg2+ je to I- > Br- > Cl- > F-. Tento zvrat se vysvětluje Pearsonovým principem tvrdých a měkkých kyselin a zásad.
Koordinace řady azinů s metallocenem byla korelována se stupnicí bazicity vodíkových vazeb azinů.
Ab initio výpočet síly Lewisovy kyseliny kovalentních halogenidů kovů ve vakuu s použitím fluoridového aniontu jako referenční Lewisovy báze.
Hodnota DN triethylaminu byla odhadnuta z korelace mezi DN a NMR chemickým posunem jádra 23Na pro roztoky sodných solí v bazických rozpouštědlech. Později byla přímým stanovením získána hodnota, která byla o polovinu nižší než odhadovaná hodnota.
 |
 |
 |
| Lewis & Brønstedovy teorie kyselosti | Hlavní skupina hydridů prvků |
.