- meta-síntesis
- Acerca de
- Nuestros sitios web
- Capítulos de libros web
 |
 |
 |
Ralph Pearson introdujo su principio Hard Soft Acid Base (HSAB) a principios de los años sesenta, y con ello intentó unificar la química de las reacciones inorgánicas y orgánicas. El impacto de la nueva idea fue inmediato, sin embargo, con el paso de los años el principio HSAB se ha quedado más bien en el camino mientras que otros enfoques desarrollados al mismo tiempo, como la teoría de orbitales moleculares de frontera (FMO) y la mecánica molecular, han florecido.
Esta página discute las profundas limitaciones del enfoque de Pearson y compara & contrasta el principio HSAB con el análisis de la quimiogénesis tal y como se presenta en este libro web.
Nota, en este libro web:
| Los ácidos de Lewis son de color ROJO | Las bases de Lewis son de color AZUL |
- Serie de estabilidad de Irving-Williams
- Análisis Tipo A y Tipo B de Ahrland
- El análisis geoquímico de Railsback
- El principio HSAB de Pearson (The Hard Soft Acid Base Principle)
- Sistema de clasificación HSAB de Pearson, desde aquí:
- Revisión de Jensen del Principio HSAB
- Análisis FMO de Klopman
- Combinando las ideas de Pearson y Klopman
- El artículo de Ho
- El principio HSAB para orgánicos & Químicos de grupo principal
- Problemas, problemas, problemas…
- Reglas de Fajans
- Entonces, ¿qué está pasando?
- Comparación del análisis HSAB «descendente» con el análisis de quimogénesis «ascendente»
- Los documentos HSAB:
- Otros análisis posteriores a Pearson
Serie de estabilidad de Irving-Williams
La serie de estabilidad de Irving-Williams (1953) señaló que para un ligando dado la estabilidad de los complejos de iones metálicos dipositivos aumenta:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
También se sabía que ciertos ligandos formaban sus complejos más estables con iones metálicos como Al3+, Ti4+ & Co3+ mientras que otros formaban complejos estables con Ag+, Hg2+ & Pt2+
Análisis Tipo A y Tipo B de Ahrland
En 1958 Ahrland et al. clasificaron los cationes metálicos como Tipo A y Tipo B, donde:
Los cationes metálicos Tipo A incluyen:
- Cationes de metales alcalinos: Li+ a Cs+
- Cationes metálicos alcalinotérreos: Be2+ a Ba2+
- Cationes de metales de transición ligeros en estados de oxidación superiores: Ti4+, Cr3+, Fe3+, Co3+
- El protón, H+
Los cationes metálicos de tipo B incluyen:
- Cationes metálicos de transición más pesados en estados de oxidación inferiores: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Los ligandos, entidades químicas que forman complejos con cationes metálicos, se clasificaron como Tipo A o Tipo B en función de si formaban complejos más estables con cationes metálicos de Tipo A o de Tipo B, a partir de aquí:
|
Tendencia del ligando a formar complejos
con metales de Tipo A |
Tendencia del ligando a complejo
con metales de tipo B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
De este análisis, se puede derivar una regla empírica:
Los Metales de Tipo A prefieren unirse (formar complejos) a Ligandos de Tipo A
y
Los Metales de Tipo B prefieren unirse (formar complejos) a Ligandos de Tipo B
Estas reglas empíricas -derivadas experimentalmente- nos dicen que los Metales de Tipo A son más propensos a formar óxidos, carbonatos, nitruros y fluoruros, mientras que los Metales de Tipo B son más propensos a formar fosfuros, sulfuros y selinuros.
El análisis geoquímico de Railsback
El análisis «Tipo A, Tipo B» es de gran importancia económica porque:
- Algunos metales se encuentran en la naturaleza como metal de Tipo A + minerales de ligando de Tipo A, como los carbonatos: MgCO3 y CaCO3 y óxidos: Fe2O3 y TiO2
- Mientras que otros se encuentran como metal Tipo B + minerales de ligando Tipo B, por ejemplo los minerales de sulfuro: PbS, CdS, NiS, etc.
Este enfoque ha sido muy exitoso desarrollado en por Bruce Railsback con su excelente y muy recomendable «Earth Scientist’s Periodic Table website».
Haga clic en la imagen para ampliarla:
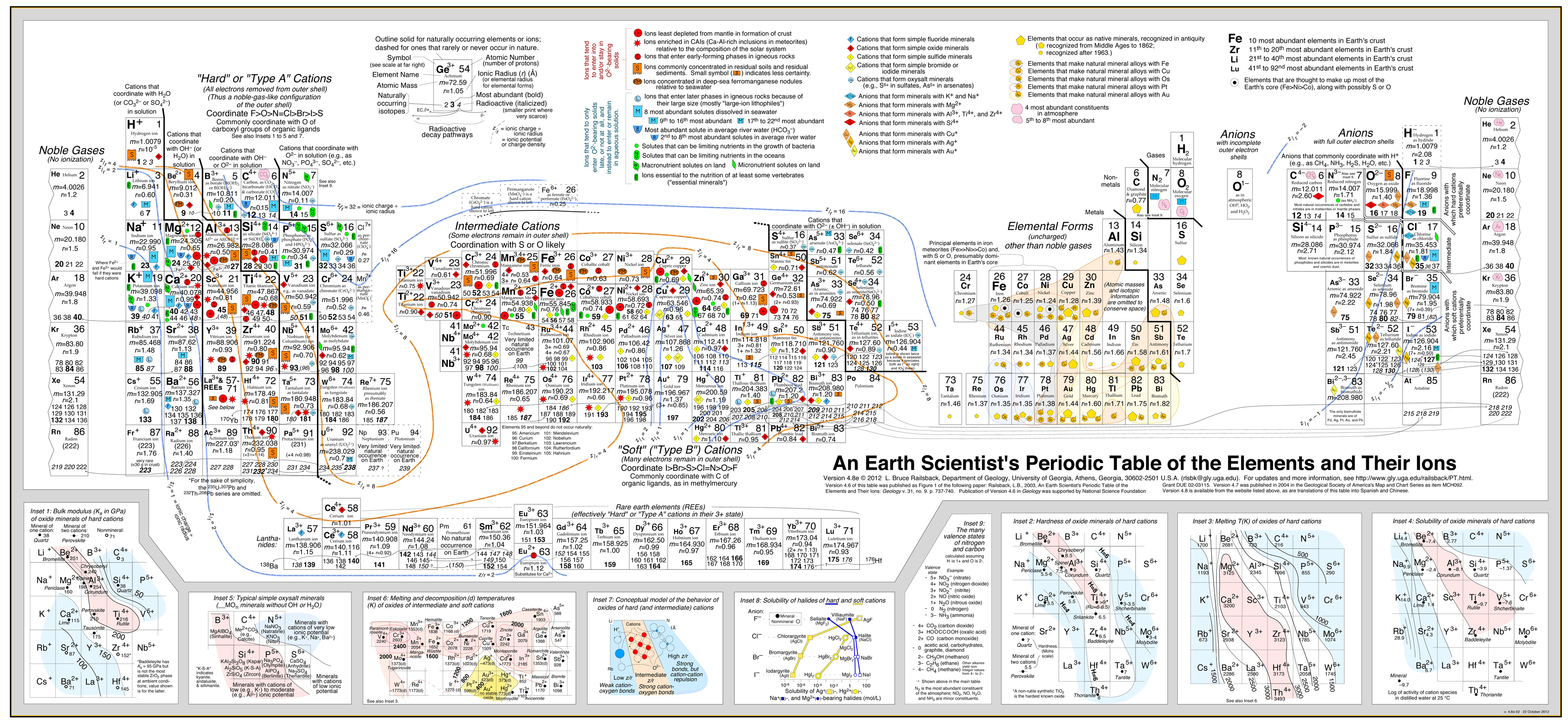
- El análisis de Railsback utiliza contornos de comportamiento superpuestos a la tabla periódica. .
- Ver el documento: A Synthesis of Systematic Mineralogy de Bruce Railsback que desarrolla este análisis.
El principio HSAB de Pearson (The Hard Soft Acid Base Principle)
En los años sesenta, Ralph Pearson amplió en gran medida la lógica Tipo A-Tipo B explicando el comportamiento de complejación diferencial de cationes y ligandos en términos de ácidos de Lewis que aceptan pares de electrones y bases de Lewis que donan pares de electrones:
Ácido de Lewis + base de Lewis → complejo ácido/base de Lewis
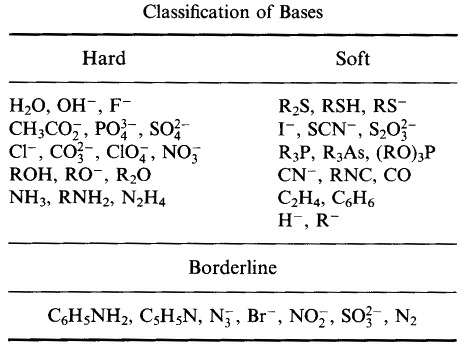
Pearson clasificó los ácidos de Lewis y las bases de Lewis como duros, limítrofes o blandos.
Según el principio de base ácida dura blanda (HSAB) de Pearson:
Los ácidos duros prefieren unirse a bases duras
y
Los ácidos blandos prefieren unirse a bases blandas
A primera vista, el análisis HSAB parece bastante similar al sistema de Tipo A y Tipo B.
Sin embargo, Pearson clasificó una gama muy amplia de átomos, iones, moléculas e iones moleculares como duros, limítrofes o blandos, trasladando el análisis de la química inorgánica tradicional de metales/ligandos al ámbito de la química orgánica -y combinándolo-.
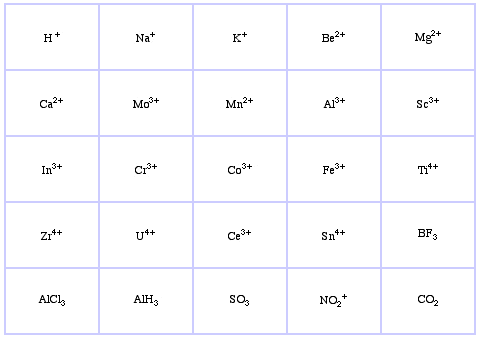
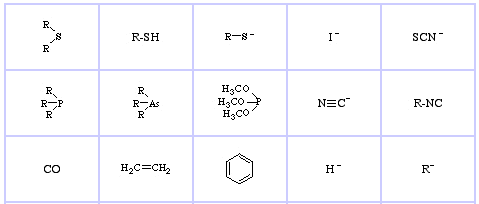
Sistema de clasificación HSAB de Pearson, desde aquí:
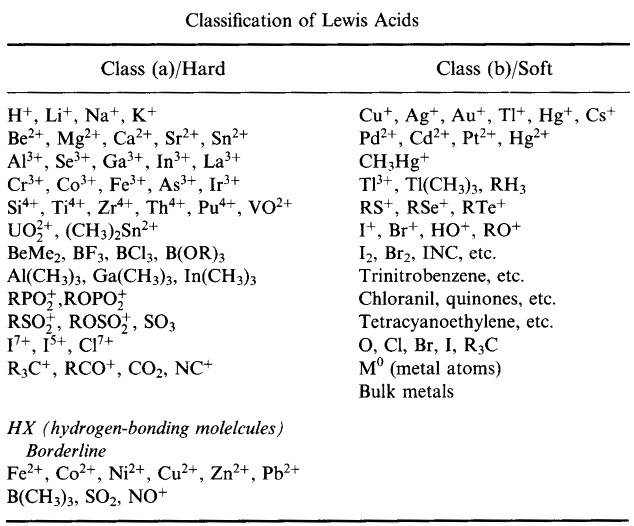
Ácidos Hard Lewis de Pearson (del Tesauro de Química), aquí, y de la base de datos de conjuntos congéneres, aquí:
Ácidos de Lewis limítrofes de Pearson, aquí, y aquí:
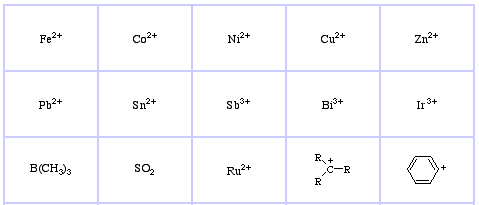
Ácidos de Lewis suaves de Pearson, aquí, y aquí:
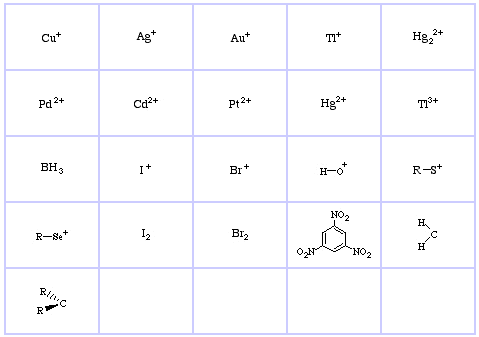
Bases de Lewis duras de Pearson (de The Chemical Thesaurus), aquí, y de la base de datos de conjuntos congéneres, aquí:
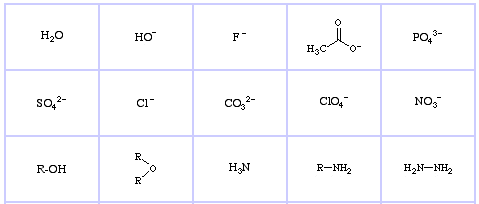
Pearson’s Borderline Lewis Bases, aquí, y aquí:

Bases de Lewis Suaves de Pearson, aquí, y aquí:
Revisión de Jensen del Principio HSAB
William (Bill) Jensen presentó tres artículos en la revista ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Parte I Marzo pp 11-14; Parte II Abril pp 13-18; Parte III Mayo pp 14-18. La parte III trata del análisis HSAB de Pearson.
El artículo combinado -que es excelente y detallado- está disponible en el espacio web de Bill (y puede descargarse un clon del archivo desde este sitio web).
Análisis FMO de Klopman
En 1968, G. Klopman intentó cuantificar el principio HSAB de Pearson utilizando la teoría del orbital molecular de frontera (FMO), como se discute en otra parte de este libro web, aquí, con esta ecuación:
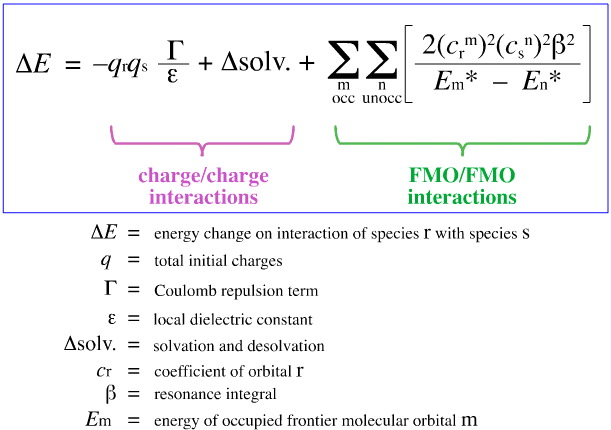
Klopman propuso que:
Los ácidos duros se unen a las bases duras para dar complejos (iónicos) de carga controlada. Estas interacciones están dominadas por las cargas +/ de las especies que interactúan.
y
Los ácidos blandos se unen a las bases blandas para dar complejos controlados por FMO. Estas interacciones están dominadas por las energías de los orbitales moleculares de frontera (FMO) participantes, el orbital molecular más ocupado (HOMO) y el orbital molecular más desocupado (LUMO).
Lea más en el libro web de Chemogenesis, aquí, o mire la Química Orgánica de Ian Fleming y la teoría FMO aquí, donde estas ideas se desarrollan con cierta amplitud.
Usando el análisis anterior, se separan y cuantifican los aspectos que contribuyen a la complejación ácido/base de Lewis controlada por carga y controlada por FMO, un desarrollo crucial.
Combinando las ideas de Pearson y Klopman
Ácidos de Lewis duros:
Centros atómicos de pequeño radio iónico
Alta carga positiva
Las especies no contienen pares de electrones en sus cáscaras de valencia
Baja afinidad electrónica
Probabilidad de ser fuertemente solvatados
LUMO de alta energíaÁcidos de Lewis blandos:
Radio grande
Carga positiva baja o parcial δ+
Pares de electrones en sus cáscaras de valencia
Fáciles de polarizar y oxidar
LUMOs de baja energía, pero coeficientes LUMO de gran magnitudBases de Lewis duras:
Centros atómicos pequeños, altamente solvatados y electronegativos: 3.0-4,0
Las especies son débilmente polarizables
Difíciles de oxidar
HOMO de alta energíaBases de Lewis blandas:
Átomos grandes de electronegatividad intermedia: 2,5-3,0
Fáciles de polarizar y oxidar
HOMOs de baja energía pero coeficientes HOMO de gran magnitudLas especies fronterizas tienen propiedades intermedias.
Hay un calificativo en el artículo de Klopman que dice que: no es necesario que las especies posean todas las propiedades.
El artículo de Ho
Pearson sugirió que se podían encontrar tendencias de duro a blando entre los grupos 15, 16 y 17 de la tabla periódica. En 1975 la idea fue ampliada por Tse Lok Ho, que utilizó especies químicas realistas y acuñó el término congenérico (de la misma familia), donde las especies congenéricas son isoelectrónicas (tienen la misma estructura de Lewis de la capa externa).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Hard and Soft Acids and Bases, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., El Principio de Ácidos y Bases Duros y Blandos (HSAB) y la Química Orgánica Revisiones de Química 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
El principio HSAB para orgánicos & Químicos de grupo principal
Para nuestros propósitos química de grupo principal y de reacción orgánica el enfoque de Pearson es más exitoso cuando se comparan pares de especies:
- El ion sodio, Na+, es más duro ácido de Lewis que el ion plata, Ag+
- Los iones alcóxido, RO, son más duros bases de Lewis que los tioaniones, RS
- El ion cobre(II), Cu2+, es un ácido de Lewis más duro que el ion cobre(I), Cu+
- El extremo aniónico nitrogenado del ion cianuro ambidentado CN, es una base de Lewis más dura que el extremo aniónico de carbono más blando, NC
- El ion enolato de ambidentato, tiene un centro oxianiónico duro de base de Lewis mientras que el centro carbaniónico es una base de Lewis más blanda y es más nucleófilo
Este tipo de análisis puede ser muy útil para explicar la selectividad de la reacción.
Por ejemplo, la β-propiolactona -un éster cíclico reactivo- es abierta en anillo por bases de Lewis nucleófilas. El ataque puede producirse en dos posiciones y los nucleófilos presentan regioselectividad:
- Los nucleófilos más duros como el ion alcóxido, R-O, atacan el carbono acil (carbonilo).
- Los nucleófilos más blandos como el ion cianuro, NC, y el tioanión, R-S, atacan el carbono β-alquilo.
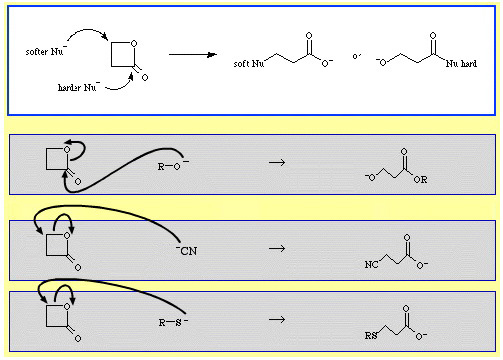
Hay bastantes ejemplos de selectividad ambidentada en la base de datos de química de reacciones de The Chemical Thesaurus:
- Eliminación vs Sustitución con 1,2-Dicloroetano
- Eliminación vs Sustitución con 2-Bromopropano
- β-Propiolactona
- Ión cianuro
- Iones enolato
- Ión nitrito
- Ión sulfato
- Ión tiocianato
Problemas, problemas, problemas…
Sin embargo, hay graves problemas con el análisis de Pearson. Aunque el modelo HSAB de Pearson-Klopman no es exactamente erróneo… sí simplifica groseramente la química de reacción conocida, como reconoce el propio Ralph Pearson:
Al principio de su libro de 1997, Chemical Hardness, Wiley-VCH, pp 3-4, Ralph Pearson escribe cándidamente:
«Con la nomenclatura es posible hacer una afirmación simple y general:
«Los ácidos duros prefieren coordinarse con las bases duras, y los ácidos blandos prefieren coordinarse con las bases blandas»
«Este es el Principio de Ácidos y Bases Duros y Blandos, o el Principio HSAB.
«Nótese que este Principio es simplemente una reafirmación de la evidencia experimental que condujo a… Es una declaración condensada de una gran cantidad de información química. Como tal, podría llamarse una ley. Pero esta etiqueta parece pretenciosa en vista de la falta de una definición cuantitativa de la dureza.
«La HSAB no es una teoría, ya que no explica las variaciones en la fuerza de los enlaces químicos. La palabra «prefiere» en el Principio HSAB implica un efecto más bien modesto.
«La blandura no es el único factor que determina el valor de ΔH° en la ecuación:
A + :B → A:B
«Hay muchos ejemplos de enlaces muy fuertes entre pares no coincidentes, como el H2, formado a partir de H+ duro y H blando.
«El H2O, el OH y el O2 se clasifican como bases duras, pero hay grandes diferencias en su fuerza de base, según cualquier criterio.»
RP
De hecho así… (!)
Un problema es que el conjunto completo de interacciones duro-borde-suave y complejidades simplemente no se considera utilizando el análisis de Pearson. Mira lo vacía que está la matriz de interacción HSAB:
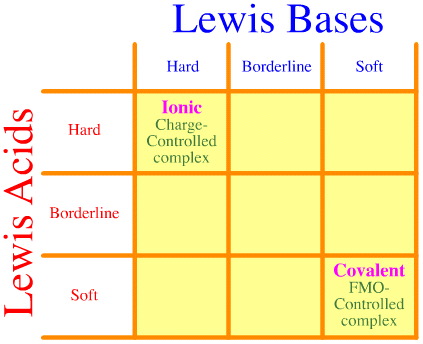
El principio HSAB de Pearson afirma que «los ácidos duros prefieren unirse a las bases duras y que los ácidos blandos prefieren unirse a las bases blandas», lo cual puede ser cierto, pero no dice nada acerca de los complejos mixtos duros-blandos.
¡Klopman simplemente afirma de forma muy poco útil que tales interacciones son «indefinidas»!
Sin embargo, muchos de los reactivos más interesantes de la química de reacción orgánica e inorgánica son complejos «tensos» duros-blandos:
| Hidruro de sodio |
NaH
|
Na+
|
H
|
| Hidruro de aluminio y litio |
LiAlH4
|
Al3+
|
H
|
| Acetato de plomo(IV) |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Yoduro de metilo |
CH3I
|
CH3+
|
I
|
| Litio de metilo |
CH3Li
|
Li+
|
CH3
|
| Tetrafluoroborato de tritiloxonio |
+
|
CH3CH2+
|
:OR2
|
| Ferroceno |
Fe(Cp)2
|
Fe2+
|
|
|
Duro
|
Límite
|
Suave
|
En comparación, la riqueza de la química de las reacciones conocidas surge de forma natural en la matriz de interacción ácido/base de Lewis, un principio central del análisis de la quimiogénesis (pero corremos el peligro de adelantarnos, ver las siguientes páginas aquí & aquí).
Hay dos observaciones/reglas, y ambas se refieren a matrices congéneres de especies isoelectrónicas/isorreactivas:
- Las matrices congéneres se encuentran siempre dentro de las celdas de la matriz de interacción ácido/base de Lewis, y no cruzando celdas.
- Las tendencias de duro a blando ocurren dentro de las matrices congéneres, pero nunca se cruzan entre las matrices.
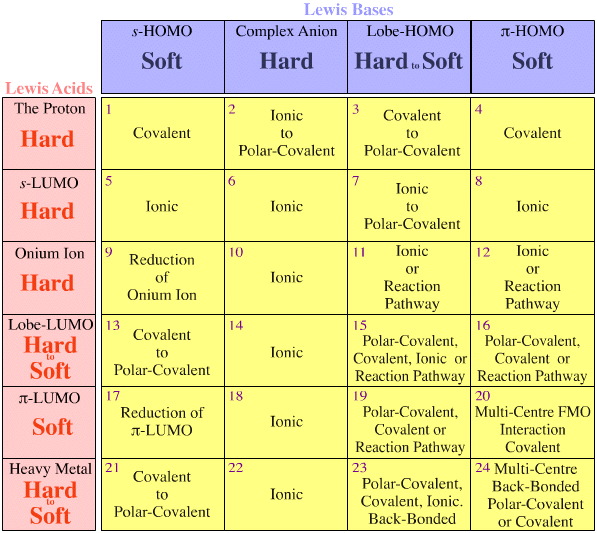
Reglas de Fajans
El análisis HSAB de Pearson-Klopman también está en contradicción directa con las bien conocidas «reglas de Fajans» (desarrolladas durante los años 1915-24), aunque ningún otro autor parece haber abordado esta cuestión hasta la fecha.
El carácter iónico-covalente en materiales binarios de metal más no metal puede calcularse utilizando la ecuación de Pauling, aquí, pero la diferencia de electronegatividad subestima el efecto de la polarización: la medida en que un átomo distorsiona o polariza la nube de electrones del otro.
Las reglas de Fajans dicen:
- Un ion positivo pequeño es altamente polarizante, favorece la covalencia, y para un catión dado el carácter covalente aumenta a medida que el anión se hace más grande.
- Los iones negativos grandes son altamente polarizables, favorecen la covalencia, y para un anión dado el carácter covalente aumenta a medida que el catión se hace más pequeño.
- El carácter covalente aumenta con el incremento de la carga iónica de cualquiera de los iones.
- La polarización, y por tanto la covalencia, se ve favorecida si el ion positivo no tiene una configuración de gas noble. Esto es importante para cationes como: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Un ejemplo:
Considere el cloruro de berilio, BeCl2 en comparación con los otros cloruros alcalinotérreos: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Catión
|
Iónico
Radio |
Eneg.
|
% Iónico de
enlace Cl- |
Enlace &Material
Tipo |
|
Be2+
|
41
|
1.57
|
34
|
Covalente/Molecular
|
|
Mg2+
|
86
|
1.31
|
42
|
Sal iónica
|
|
Ca2+
|
114
|
1.00
|
51
|
Sal iónica
|
|
Sr2+
|
132
|
0.95
|
52
|
Sal iónica
|
|
Ba2+
|
149
|
0.89
|
54
|
Sal iónica
|
Datos del radio iónico de los elementos de la web
El cloruro de berilio, BeCl2, es covalente: el material anhidro es soluble en disolventes orgánicos, se sublima (en el vacío) y el material fundido es un mal conductor de la electricidad. MgCl2, CaCl2, SrCl2 y BaCl2 son materiales iónicos y las sales fundidas son excelentes conductores de la electricidad.
- Las reglas de Fajans explican claramente esta química diciendo que el ion Be2+, muy pequeño y altamente cargado, es capaz de polarizar (distorsionar) las nubes de electrones de los iones de cloruro comparativamente grandes en enlace covalente y, por tanto, dar una estructura molecular.
- El análisis HSAB de Pearson-Klopman establece que el ion berilio, siendo el más pequeño de los cationes metálicos del Grupo II es también el más duro. Las sales de iones de berilio deberían, por lo tanto, exhibir un enlace controlado por carga extrema y dar lugar a materiales iónicos, pero no lo hacen.
- El análisis de quimiogénesis, aquí, dice que los cationes del Grupo II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, constituyen una serie congénere de ácidos de Lewis cargados s-LUMO, que se encuentran tendencias de comportamiento lineal sobre esta serie.
Estas tendencias de comportamiento lineal pueden atribuirse a un comportamiento «duro-blando», si así se desea, sin embargo, los términos «duro» y «blando» sólo pueden utilizarse con respecto a la serie congénere en cuestión y las comparaciones «duro-blando» no pueden hacerse con respecto a otros ácidos de Lewis.
Entonces, ¿qué está pasando?
La cuestión es que ningún parámetro físico se correlaciona con la dureza sobre el conjunto de especies elegido por Pearson. Esto crea ambigüedades, como con la química orgánica del ion fluoruro, aquí, y la contradicción con las reglas de Fajans, arriba.
El modelo de Pearson no tiene en cuenta la geometría FMO (las formas & fases de los orbitales participantes). Por ejemplo, ¿qué similitud tienen los ácidos duros de Pearson:
H+ + BF3 CO2 Cs+ Cu2+ ?
¿O qué similitud tienen las bases blandas de Pearson:
H R2S: H3C benceno ?
Crucialmente para los químicos orgánicos y de grupos principales, el análisis HSAB dice poco/nada sobre el importante ácido de Lewis de iones de carbenio (carbocación), H3C+, o la base de Lewis de carbaniones, H3C.
Afirmación audaz
El continuo unidimensional duro-borde-suave del análisis de Pearson tiene en realidad el efecto de desdibujar gran parte del comportamiento rico y lineal (predecible) que puede encontrarse en el espacio de la química de reacción de los ácidos/bases de Lewis.
El nuevo análisis de quimogénesis presentado en este libro web y respaldado por la química de reacción contenida en la base de datos The Chemical Thesaurus evita y explica los escollos del tan publicitado enfoque HSAB de Pearson.
Comparación del análisis HSAB «descendente» con el análisis de quimogénesis «ascendente»
El análisis Hard Soft Acid Base (HSAB) de Pearson es descendente.
- Comenzando con todas las especies en el espacio de la química de reacción, un número de especies importantes son identificadas como ácidos de Lewis y bases de Lewis.
- Los ácidos de Lewis y las bases de Lewis se clasifican entonces como duros, limítrofes o blandos utilizando la observación empírica y el principio de que: los ácidos de Lewis duros prefieren formar complejos con bases de Lewis duras y los ácidos de Lewis blandos prefieren formar complejos con bases de Lewis blandas:
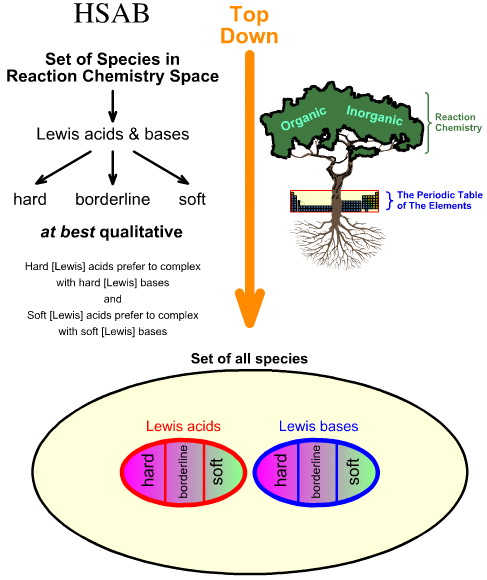
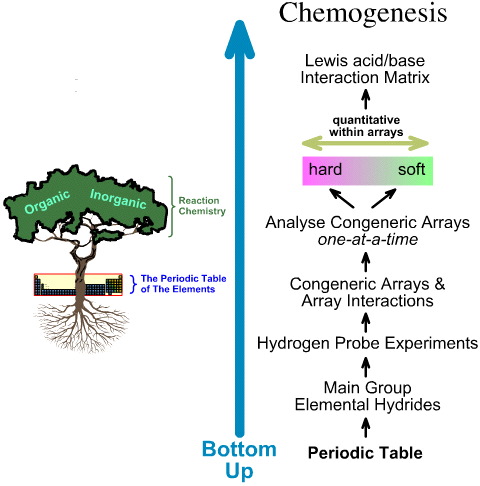
En cambio, el análisis de quimiogénesis es ascendente:
- Los hidruros elementales del grupo principal se someten a los 5 experimentos de sondeo de hidrógeno.
- Se estudian las matrices y las interacciones de las matrices.
- Se identifican tendencias estructurales y de reactividad lineales entre matrices, y se reconoce que no se puede esperar un comportamiento lineal entre matrices.
- Los ácidos de Lewis y las bases de Lewis se clasifican por sus estructuras electrónicas de Lewis y topologías FMO y se organizan en una matriz de interacción ácido/base de Lewis, aquí.
Los documentos HSAB:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman y R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968También se puede consultar aquí.
Otros análisis posteriores a Pearson
El modelo ECW es un modelo semicuantitativo que describe y predice la fuerza de las interacciones ácido/base de Lewis. Inicialmente, el modelo asignaba parámetros electrostáticos (E) y covalentes (C) a los ácidos y bases de Lewis. Posteriormente se amplió al modelo ECW para cubrir las reacciones que tienen un término de energía constante, W, que describe los procesos que preceden a la interacción ácido/base.
En el análisis original de 1965 de Drago & Wayland, se empleó una ecuación de dos términos de tal manera que cada ácido de Lewis se caracteriza por los términos EA y CA y cada base de Lewis por EB y CB donde los parámetros E y C se refieren a las contribuciones electrostáticas y covalentes a la fuerza de los enlaces que formará la interacción ácido/base. (Esto es como el análisis de Klopman, arriba.) Estos parámetros se obtuvieron empíricamente utilizando entalpías para aductos que forman sólo enlaces σ entre el ácido de Lewis y la base de Lewis y no tienen repulsión estérica:
-ΔH = EAEB + CACB
En el modelo ECW, se añadió un nuevo término W a la ecuación.
-ΔH = EAEB + CACB + W
donde el término W representa una energía constante para la escisión de un ácido de Lewis dimérico o una base de Lewis.
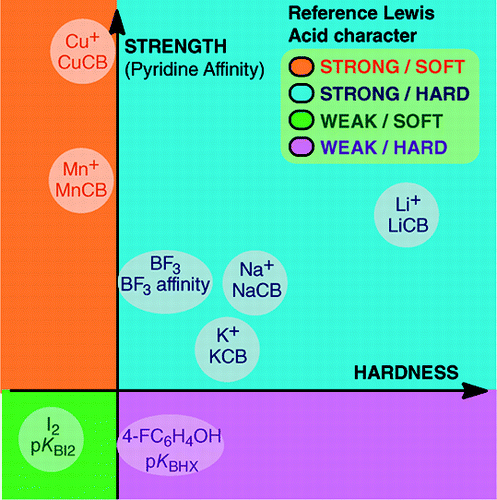
De An Overview of Lewis Basicity and Affinity Scales por Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
La imposibilidad de establecer una escala universal de basicidad de Lewis no impide determinar el comportamiento cuantitativo de las bases de Lewis, gracias a las escalas construidas frente a ácidos de Lewis particulares: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, y CH3NH3+. Estas escalas abarcan importantes tipos de enlaces formados en un aducto ácido-base de Lewis: el enlace dativo, los enlaces de hidrógeno convencionales e iónicos, el enlace halógeno y los enlaces catión-molécula para los cationes metálicos de los grupos 1, 7, 10, 11 y 13. Además, aunque estas escalas no suelen estar interrelacionadas, existen relaciones dependientes de la familia que permiten clasificar, en un orden bastante general, las bases pertenecientes a una familia química determinada, por ejemplo, la familia de las bases de oxígeno. Por lo tanto, el escepticismo sobre la utilidad cuantitativa del concepto de Lewis de los ácidos y las bases ya no tiene fundamento.y:
La formación de aductos ácido-base de Lewis abarca una amplia variedad de procesos de formación de enlaces, desde el débil enlace de van der Waals en Ar—BF3 hasta el fuerte enlace dativo en H3N-BF3. El término «enlace» puede ser objetable para los aductos débiles. Estas especies con enlaces débiles se producen generalmente en un haz supersónico o en una matriz criogénica. Aquí nos interesan principalmente los complejos que pueden observarse en una mezcla a temperatura ambiente del ácido de Lewis y de la base de Lewis.En el agua, el orden de las constantes de complejación de los iones haluro con el ácido Fe3+ es F- > Cl- > Br- > I-, mientras que con Hg2+, es I- > Br- > Cl- >F-. Esta inversión se explica por el principio de ácido y base duros y blandos de Pearson.
La coordinación de una serie de azinas con metalocenos se ha correlacionado con la escala de basicidad de los enlaces de hidrógeno de las azinas.
El cálculo ab initio de la fuerza del ácido de Lewis de los haluros metálicos covalentes en vacío utilizando el anión fluoruro como base de Lewis de referencia.
Se estimó un valor de DN de la trietilamina a partir de una correlación entre el DN y el desplazamiento químico de RMN del núcleo 23Na para soluciones de sales de sodio en disolventes básicos. Posteriormente, la determinación directa dio un valor que era la mitad del valor estimado.
 |
 |
 |
| Teorías de Brønsted de la acidez | Hidruros elementales del grupo principal |