- meta-sinteză
- Despre
- Site-urile noastre
- Web Book Chapters
- Seria de stabilitate Irving-Williams
- Analiză de tip A, tip B a lui Ahrland
- Analiza geochimică a lui Railsback
- Principiul HSAB al lui Pearson (The Hard Soft Acid Base Principle)
- Sistemul de clasificare HSAB al lui Pearson, de aici:
- Jensen’s Review of the HSAB Principle
- Analiza FMO a lui Klopman
- Combinarea ideilor lui Pearson și Klopman
- Cartetul Ho
- Principiul HSAB pentru organică. & Chimia grupelor principale
- Probleme, probleme, probleme, probleme…
- Regulele lui Fajans
- Deci, ce se întâmplă?
- Compararea analizei HSAB „de sus în jos” cu analiza de chimiogeneză „de jos în sus”
- The HSAB Papers:
- Alte analize post-Pearson
- Cationii metalelor alcaline: Li+ până la Cs+
- Cații metalelor alcalino-pământoase: Be2+ până la Ba2+
- Cationi de metale de tranziție mai ușoare în stări de oxidare superioare: Ti4+, Cr3+, Fe3+, Co3+
- Protonul, H+
- Cații metalici de tranziție mai grei în stări de oxidare inferioare: Cu+, Ag+, Cd2+, Hg+, Hg+, Ni2+, Pd2+, Pt2+
- Câteva metale se găsesc în natură sub formă de minerale cu metal de tip A + ligand de tip A, cum ar fi carbonații: MgCO3 și CaCO3 și oxizi: Fe2O3 și TiO2
- În timp ce altele se găsesc ca minerale de tip B metal + ligand de tip B, de exemplu minereurile de sulfuri: PbS, CdS, NiS, etc.
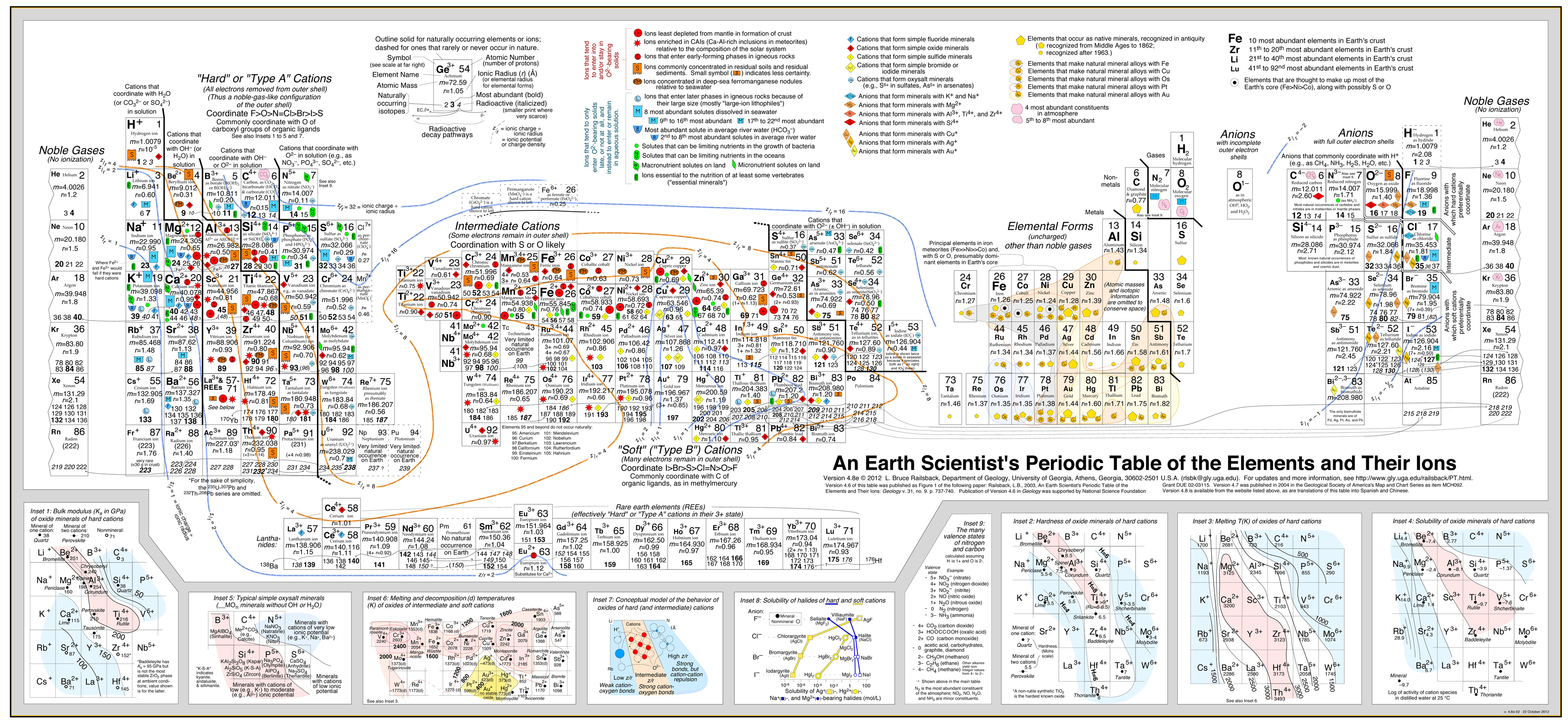
- Analiza lui Railsback folosește contururi de comportament suprapuse peste tabelul periodic. .
- Vezi lucrarea: A Synthesis of Systematic Mineralogy de Bruce Railsback care dezvoltă această analiză.
- Ionul de sodiu, Na+, este un acid Lewis mai dur decât ionul de argint, Ag+
- Ionii de alcoxid, RO, sunt baze Lewis mai dure decât tioanionii, RS
- Ionul de cupru(II), Cu2+, este un acid Lewis mai tare decât ionul de cupru(I), Cu+
- Extremitatea anionică azotată a ionului de cianură ambidentat, CN, este o bază Lewis mai dură decât capătul mai moale al anionului de carbon, NC
- Ionul enolat de ambidentat, are un centru de bază Lewis dur de oxianion, în timp ce centrul carbanionului este o bază Lewis mai moale și este mai nucleofilă
- Nucleofili mai duri, cum ar fi ionul alcoxid, R-O, atacă carbonul acil (carbonil).
- Nucleofili mai moi, cum ar fi ionul cianură, NC, și tioanionul, R-S, atacă carbonul β-alchil.
- Eliminare vs. Substituție cu 1,2-Dicloroetan
- Eliminare vs substituție cu 2-Bromopropan
- β-Propiolactona
- Ion cianură
- Ion enolat
- Ion nitrit
- Ion sulfinat
- Ion tiocianat
- Rețelele congenerice se găsesc întotdeauna în interiorul celulelor Matricei de interacțiune acid/base Lewis, și nu traversând celulele.
- Tendințele de la greu la moale apar în cadrul matricelor congenerice, dar nu se încrucișează niciodată între matrici.
- Un ion pozitiv mic este foarte polarizabil, favorizează covalența, iar pentru un anumit cation caracterul covalent crește pe măsură ce anionul devine mai mare.
- Ionii negativi mari sunt foarte polarizabili, favorizează covalența, iar pentru un anumit anion caracterul covalent crește pe măsură ce cationul devine mai mic.
- Caracterul covalent crește odată cu creșterea sarcinii ionice pe oricare dintre ioni.
- Polarizarea și, prin urmare, covalența, este favorizată dacă ionul pozitiv nu are o configurație de gaz nobil. Acest lucru este important pentru cationi precum: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
- Regula Fajans explică clar această chimie spunând că ionul Be2+ foarte mic și foarte încărcat este capabil să polarizeze (distorsioneze) norii de electroni ai ionilor de clorură relativ mari în legături covalente și, prin urmare, să dea o structură moleculară.
- Analiza HSAB Pearson-Klopman afirmă că ionul de beriliu, fiind cel mai mic dintre cationii metalelor din Grupul II, este și cel mai dur. Sărurile ionului de beriliu ar trebui, prin urmare, să prezinte o legătură controlată de sarcină extremă și să dea naștere la materiale ionice, dar nu este așa.
- Analiza chimiogenetică, aici, spune că cationii din Grupul II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, alcătuiesc o serie congenerică de acizi Lewis s-LUMO încărcați, că pe această serie se găsesc tendințe de comportament liniar.
Aceste tendințe de comportament liniar pot fi atribuite unui comportament „hard-soft”, dacă se dorește acest lucru, cu toate acestea, termenii „hard” și „soft” pot fi utilizați numai în ceea ce privește seria congenerică în cauză, iar comparațiile „hard-soft” nu pot fi făcute în ceea ce privește alți acizi Lewis. - Începând cu toate speciile din spațiul chimiei de reacție, o serie de specii importante sunt identificate ca fiind acizi Lewis și baze Lewis.
- Acizii Lewis și bazele Lewis sunt apoi clasificați ca fiind tari, la limită sau moi, folosind observația empirică și principiul conform căruia: acizii Lewis tari preferă să se complexeze cu baze Lewis tari și acizii Lewis moi preferă să se complexeze cu baze Lewis moi:
- Idridele elementare din grupele principale sunt supuse celor 5 experimente cu sonde de hidrogen.
- Se studiază rețelele congenerice și interacțiunile dintre rețele.
- În cadrul rețelelor se identifică tendințe liniare de structură și reactivitate hard-to-soft și se recunoaște că nu se poate aștepta un comportament liniar între rețele.
- Acizii Lewis și bazele Lewis sunt clasificate în funcție de structurile lor electronice Lewis și topologiile FMO și sunt aranjate într-o matrice de interacțiune acid/bază Lewis, aici.
 |
 |
 |
Ralph Pearson a introdus principiul său Hard Soft Acid Base (HSAB) la începutul anilor șaizeci, și prin aceasta a încercat să unifice chimia reacțiilor anorganice și organice. Impactul noii idei a fost imediat, cu toate acestea, de-a lungul anilor, principiul HSAB a căzut mai degrabă pe marginea drumului, în timp ce alte abordări dezvoltate în același timp, cum ar fi teoria orbitalului molecular de frontieră (FMO) și mecanica moleculară, au înflorit.
Această pagină discută limitările profunde ale abordării lui Pearson și compară & contrastează principiul HSAB cu analiza chimiogenezei, așa cum este prezentată în această carte web.
Rețineți, în această carte web:
| Acizii Lewis sunt ROȘII | Bazele Lewis sunt ALBASTRE |
Seria de stabilitate Irving-Williams
Seria de stabilitate Irving-Williams (1953) a evidențiat faptul că, pentru un ligand dat, stabilitatea complecșilor ionilor metalici dipozitivi crește:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Se știa, de asemenea, că anumiți liganzi formează complecșii lor cei mai stabili cu ioni metalici precum Al3+, Ti4+ & Co3+ în timp ce alții au format complecși stabili cu Ag+, Hg2+ & Pt2+
Analiză de tip A, tip B a lui Ahrland
În 1958 Ahrland și colab. a clasificat cationii metalici în tipul A și tipul B, unde:
Cazații metalici de tip A includ:
Cații metalici de tip B includ:
Liganzii, entități chimice care se complexează cu cationi metalici, au fost clasificați ca fiind de tip A sau de tip B în funcție de faptul că formează complexe mai stabile cu cationi metalici de tip A sau cu cationi metalici de tip B, de aici:
|
Tendința ligandului de a complexa
cu metale de tip A |
Tendința ligandului de a complexa
cu metale de tip B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb >. Bi O << S ~ Se ~ Te F < Cl < Br << I |
Din această analiză, poate fi derivată o regulă empirică:
Metalele de tip A preferă să se lege (complexeze) cu liganzi de tip A
și
Metalele de tip B preferă să se lege (complexeze) cu liganzi de tip B
Aceste reguli empirice – derivate experimental – ne spun că metalele de tip A au mai multe șanse să formeze oxizi, carbonați, nitruri și fluoruri, în timp ce Metalele de tip B sunt mai susceptibile de a forma fosfuri, sulfuri și selinuri.
Analiza geochimică a lui Railsback
Analiza „Tip A, Tip B” are o mare importanță economică deoarece:
Această abordare a fost dezvoltată cu mare succes în de Bruce Railsback cu al său excelent și foarte recomandat „Earth Scientist’s Periodic Table website”.
Click pe imagine pentru a o mări:
Principiul HSAB al lui Pearson (The Hard Soft Acid Base Principle)
În anii șaizeci, Ralph Pearson a extins foarte mult logica de tip A-Tip B explicând comportamentul diferențial de complexare al cationilor și liganzilor în termeni de acizi Lewis acceptanți de perechi de electroni și baze Lewis donatoare de perechi de electroni:
Acid Lewis + bază Lewis → complexul acid/baza Lewis
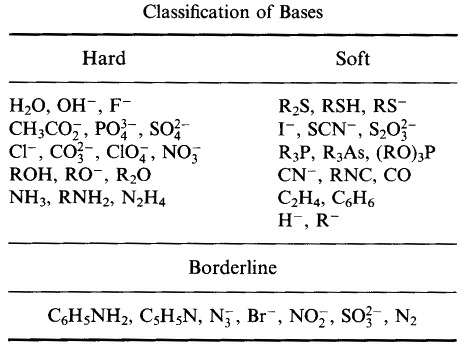
Pearson a clasificat acizii Lewis și bazele Lewis ca fiind tari, la limită sau moi.
Conform principiului lui Pearson al bazelor acide tari și moi (HSAB):
Acizii tari preferă să se lege de bazele tari
și
Acizii moi preferă să se lege de bazele moi
La prima vedere, analiza HSAB pare destul de asemănătoare cu sistemul de tip A și tip B.
Cu toate acestea, Pearson a clasificat o gamă foarte largă de atomi, ioni, molecule și ioni moleculari ca hard, borderline sau soft, mutând analiza de la chimia anorganică tradițională metal/ligand în – și combinându-se cu – domeniul chimiei organice.
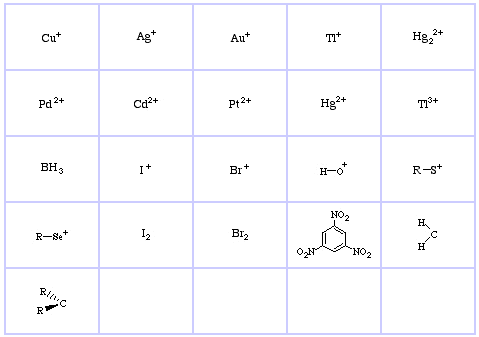
Sistemul de clasificare HSAB al lui Pearson, de aici:
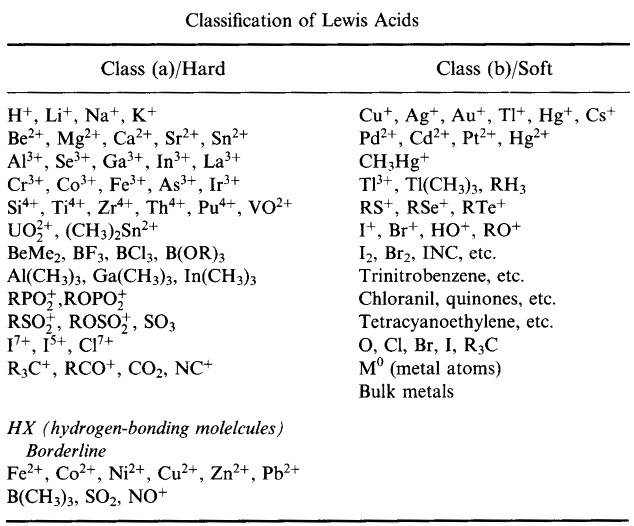
Pearson’s Hard Lewis Acids (din Chemical Thesaurus), aici, și din baza de date congeneric array, aici:
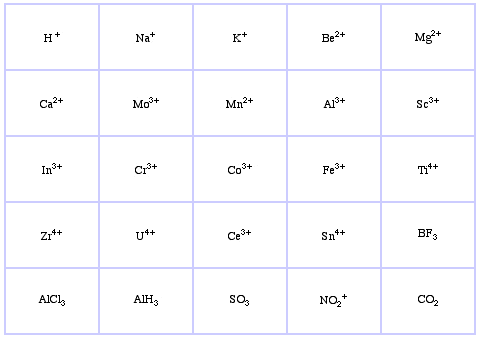
Pearson’s Borderline Lewis Acids, aici, și aici:
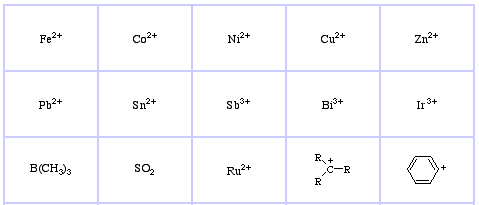
Pearson’s Soft Lewis Acids, aici, și aici:
Pearson’s Hard Lewis Bases (din The Chemical Thesaurus), aici, și din baza de date congeneric array, aici:
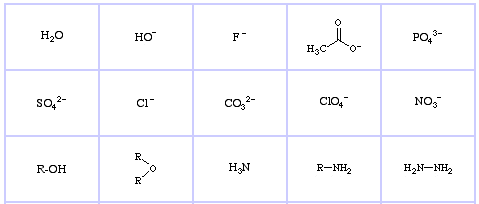
Pearson’s Borderline Lewis Bases, aici, și aici:

Pearson’s Soft Lewis Bases, aici, și aici: 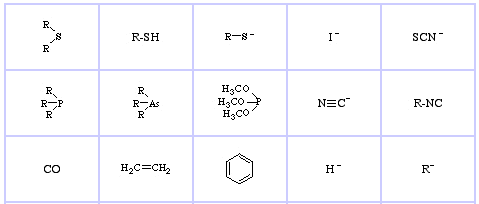
Jensen’s Review of the HSAB Principle
William (Bill) Jensen a prezentat trei lucrări în revista ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Partea I martie pp. 11-14; Partea II aprilie pp. 13-18; Partea III mai pp. 14-18. Partea a III-a se ocupă de analiza HSAB a lui Pearson.
Articolul combinat – care este atât excelent cât și detaliat – este disponibil pe spațiul web al lui Bill (și o clonă a fișierului poate fi descărcată de pe acest site).
Analiza FMO a lui Klopman
În 1968, G. Klopman a încercat să cuantifice principiul HSAB al lui Pearson folosind teoria orbitalului molecular de frontieră (FMO), așa cum se discută în altă parte în această carte web, aici, cu această ecuație:
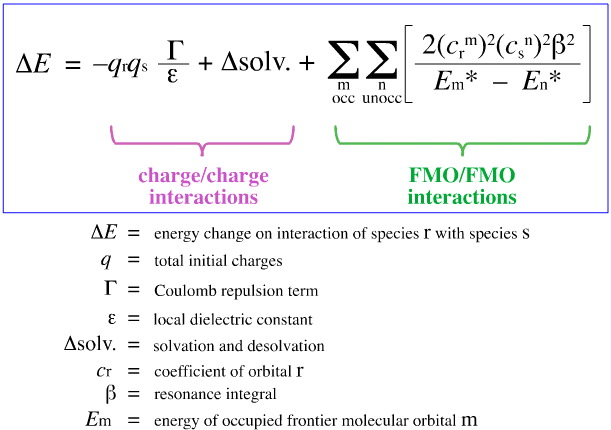
Klopman a propus că:
Acizii tari se leagă de bazele tari pentru a da complexe (ionice) cu sarcină controlată. Astfel de interacțiuni sunt dominate de sarcinile +/ de pe speciile care interacționează.
și
Acizii moi se leagă de bazele moi pentru a da complexe controlate de FMO. Aceste interacțiuni sunt dominate de energiile orbitalilor moleculari de frontieră (FMO) participanți, cel mai înalt orbital molecular ocupat (HOMO) și cel mai mic orbital molecular neocupat (LUMO).
Citește mai multe în altă parte în cartea web Chemogenesis, aici, sau consultă Organic Chemistry and FMO theory a lui Ian Fleming aici, unde aceste idei sunt dezvoltate pe larg.
Utilizând analiza de mai sus, aspectele care contribuie la complexarea acizilor/bazelor Lewis controlate de sarcină și controlate de FMO sunt separate și cuantificate, o evoluție crucială.
Combinarea ideilor lui Pearson și Klopman
Acizi Lewis tari:
Centre atomice cu rază ionică mică
Sarcină pozitivă ridicată
Speciile nu conțin perechi de electroni în învelișurile lor de valență
Afinitate electronică scăzută
Probabilitate de a fi puternic solvatate
LUMO de energie ridicatăAcizi Lewis moi:
Raza mare
Sarcina pozitivă δ+ scăzută sau parțială
Perechi de electroni în straturile lor de valență
Ușor de polarizat și oxidat
LUMO de energie scăzută, dar coeficienți LUMO de mare magnitudineBaze Lewis dure:
Centre atomice mici, puternic solvatate, electronegative: 3.0-4,0
Speciile sunt slab polarizabile
Dificil de oxidat
HOMO de energie mareBaze Lewis moi:
Atomi mari de electronegativitate intermediară: 2,5-3,0
Ușor de polarizat și oxidat
HOMO de energie mică, dar coeficienți HOMO de mărime mareSpeciile de graniță au proprietăți intermediare.
Există un calificativ în lucrarea lui Klopman care spune că: nu este necesar ca speciile să posede toate proprietățile.
Cartetul Ho
Pearson a sugerat că tendințele de la greu la moale pot fi găsite printre grupele 15, 16 și 17 din tabelul periodic. În 1975, ideea a fost extinsă de Tse Lok Ho, care a folosit specii chimice realiste și a inventat termenul congeneric (din aceeași familie), unde speciile congenerice sunt izoelectronice (au aceeași structură Lewis a învelișului exterior).
 |
||||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Hard and Soft Acids and Bases, JACS 85, 3533-3539 (1963) |
|
|
Te
|
Se
|
S
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
|||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., The Hard Soft Acids Bases (HSAB) Principle and Organic Chemistry Chemistry Reviews 75, 1-20 (1975) | ||
|
H3C-
|
H2N-
|
HO-
|
F-
|
|||
|
I-
|
Br-
|
Cl-
|
F-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
(CH3)3C+
|
||
Principiul HSAB pentru organică. & Chimia grupelor principale
Pentru scopurile noastre chimia grupelor principale și a reacțiilor organice, abordarea Pearson este cea mai reușită atunci când se compară perechi de specii:
Acest tip de analiză poate fi foarte util în explicarea selectivității reacției.
De exemplu, β-propiolactona – un ester ciclic reactiv – este deschisă în inel de către bazele Lewis nucleofile. Atacul poate avea loc în două poziții, iar nucleofilii prezintă regioselectivitate:
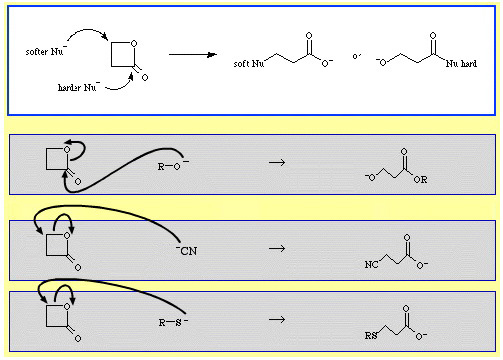
Există un număr destul de mare de exemple de selectivitate ambidentată în baza de date The Chemical Thesaurus reaction chemistry database:
Probleme, probleme, probleme, probleme…
Cu toate acestea, există probleme grave cu analiza lui Pearson. Deși modelul Pearson-Klopman HSAB nu este chiar greșit… el simplifică în mod grosolan chimia reacțiilor cunoscute, așa cum a recunoscut Ralph Pearson însuși:
La începutul cărții sale din 1997, Chemical Hardness, Wiley-VCH, pp 3-4, Ralph Pearson scrie cu sinceritate:
„Cu ajutorul nomenclaturii este posibil să se facă o afirmație simplă, generală:
„Acizii tari preferă să se coordoneze cu bazele tari, iar acizii moi preferă să se coordoneze cu bazele moi.”
„Acesta este Principiul acizilor și bazelor tari și moi, sau Principiul HSAB.
„Rețineți că acest Principiu este pur și simplu o reafirmare a dovezilor experimentale care au condus la . Este o declarație condensată a unei cantități foarte mari de informații chimice. Ca atare, ar putea fi numit o lege. Dar această etichetă pare pretențioasă având în vedere lipsa unei definiții cantitative a durității.
„HSAB nu este o teorie, deoarece nu explică variațiile în rezistența legăturilor chimice. Cuvântul „preferă” din Principiul HSAB implică un efect mai degrabă modest.
„Moliciunea nu este singurul factor care determină valoarea lui ΔH° în ecuația:
A + :B → A:B
„Există multe exemple de legături foarte puternice între perechi nepotrivite, cum ar fi H2, formată din H+ dur și H moale.
„H2O, OH și O2 sunt toate clasificate ca baze tari, dar există mari diferențe în puterea bazei lor, după orice criteriu.”
RP
Într-adevăr, așa… (!)
O problemă este aceea că întregul set de interacțiuni și complexări hard-borderline-soft pur și simplu nu este luat în considerare folosind analiza Pearson. Priviți cât de goală este matricea de interacțiune HSAB:
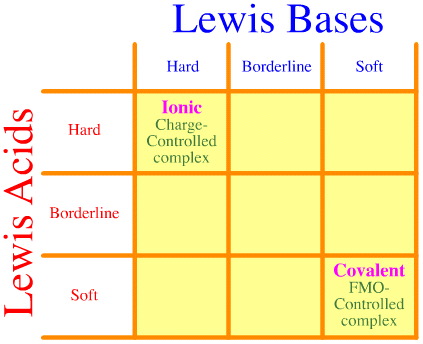
Principiul Pearson HSAB afirmă că „acizii tari preferă să se lege de bazele tari și că acizii moi preferă să se lege de bazele moi”, ceea ce poate fi adevărat, dar nu spune nimic despre complexele mixte tari-moale.
Klopman afirmă pur și simplu, foarte nefolositor, că astfel de interacțiuni sunt „nedefinite”!
Și totuși, mulți dintre cei mai interesanți reactivi din chimia reacțiilor organice și anorganice sunt complexe tari-moale „tensionate”:
| Hidrură de sodiu |
NaH
|
Na+
|
H
|
|
| Hidrură de litiu și aluminiu |
LiAlH4
|
Al3+
|
H
|
|
| Acetat de plumb(IV) |
Pb(AcO)4
|
Pb4+
|
AcO
|
|
| Iodură de metil |
CH3I
|
CH3+
|
I
|
|
| Litiu de metil |
CH3Li
. |
Li+
|
CH3
|
|
| Tetrafluoroborat de terciloxoniu |
+
|
CH3CH2+
|
:OR2
|
|
| Ferrocena |
Fe(Cp)2
|
Fe2+
|
Fe2+
|
|
|
Dură
|
La limită
|
Moale
|
Pe comparație, bogăția chimiei reacțiilor cunoscute apare în mod natural în matricea de interacțiune a acizilor/bazelor Lewis, un principiu central al analizei chimiogenezei (dar riscăm să ne devansăm, vezi paginile următoare aici & aici).
Există două observații/reguli, și ambele se referă la rețele congenerice de specii izoelectronice/izoreactive:
Regulele lui Fajans
Analiza HSAB Pearson-Klopman este, de asemenea, în contradicție directă cu binecunoscutele „reguli ale lui Fajans” (dezvoltate de-a lungul anilor 1915-24), chiar dacă niciun alt autor nu pare să fi abordat această problemă până în prezent.
Caracterul ionic-covalent în materialele binare metal plus nemetal poate fi calculat cu ajutorul ecuației Pauling, aici, dar diferența de electronegativitate subestimează efectul polarizării: măsura în care un atom distorsionează sau polarizează norul de electroni al celuilalt.
Regulele lui Fajans spun:
Un exemplu:
Considerați clorura de beriliu, BeCl2 în comparație cu celelalte cloruri alcalino-pământoase: MgCl2, CaCl2, CaCl2, SrCl2, & BaCl2:
|
Cation
|
Ionic
Radiu |
Eneg.
|
% ionic al legăturii
cu Cl- |
Legătură & Material
Tip |
|
Be2+
|
41
|
1.57
|
34
|
Covalent/Molecular
|
|
Mg2+
|
86
|
1.31
|
42
|
Sare ionică
|
|
Ca2+
|
114
|
1.00
|
51
|
Sare ionică
|
|
Sr2+
|
132
|
0.95
|
52
|
Sare ionică
|
|
Ba2+
|
149
|
0.89
|
54
|
Sare ionică
|
Date privind raza ionică din elementele web
Clorura de beriliu, BeCl2, este covalentă: materialul anhidru este solubil în solvenți organici, se sublimează (în vid), iar materialul topit este un slab conductor de electricitate. MgCl2, CaCl2, SrCl2 și BaCl2 sunt materiale ionice, iar sărurile topite sunt excelente conductoare de electricitate.
Deci, ce se întâmplă?
Este vorba de faptul că nici un parametru fizic nu se corelează cu duritatea în cazul setului de specii ales de Pearson. Acest lucru creează ambiguități, cum ar fi în cazul chimiei organice a ionului fluorură, aici, și contradicția cu regulile lui Fajans, mai sus.
Modelul Pearson nu ia în considerare geometria FMO (formele & fazelor orbitalilor participanți). De exemplu, cât de asemănători sunt acizii tari ai lui Pearson:
H+ + BF3 CO2 Cs+ Cu2+ ?
Sau, cât de asemănătoare sunt bazele moi ale lui Pearson:
H R2S: H3C benzen ?
În mod crucial pentru chimiștii organici și cei din grupele principale, analiza HSAB spune puțin/nimic despre importantul acid Lewis cu ioni de carbeniu (carbocation), H3C+, sau despre baza Lewis cu carbanioni, H3C.
Afirmație importantă
Continuitatea unidimensională hard-borderline-soft a analizei lui Pearson are de fapt efectul de a estompa o mare parte din comportamentul bogat și liniar (previzibil) care poate fi găsit în spațiul chimic al reacțiilor cu acizi/ baze Lewis.
Noua analiză de chimiogeneză, așa cum este prezentată în această carte web și susținută de chimia reacțiilor deținute în baza de date The Chemical Thesaurus, evită și explică capcanele abordării HSAB mult mediatizate a lui Pearson.
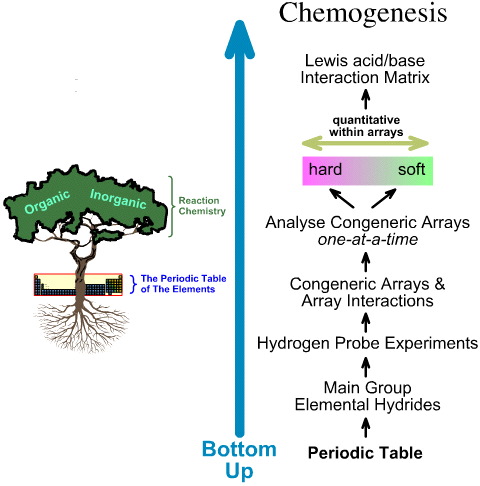
Compararea analizei HSAB „de sus în jos” cu analiza de chimiogeneză „de jos în sus”
Analiza Hard Soft Acid Base (HSAB) a lui Pearson este de sus în jos.
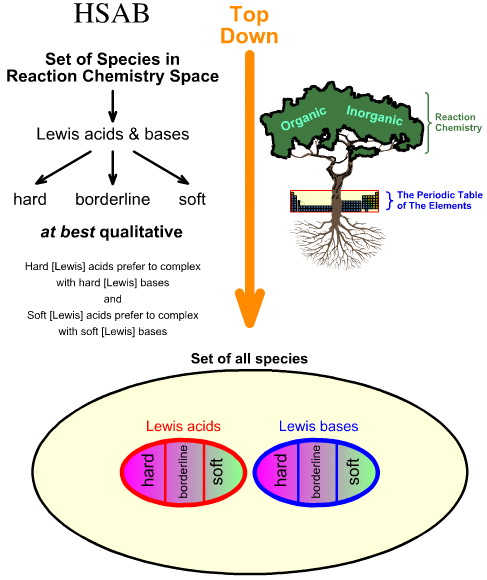
În schimb, analiza chemogenezei este de jos în sus:
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman și R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Vezi și aici.
Alte analize post-Pearson
Modelul ECW este un model semicantitativ care descrie și prezice puterea interacțiunilor acid/baza Lewis. Inițial, modelul a atribuit parametrii electrostatici (E) și covalenți (C) acizilor și bazelor Lewis. Acesta a fost extins ulterior la modelul ECW pentru a acoperi reacțiile care au un termen de energie constantă, W, care descrie procesele care preced interacțiunea acid/bază.
În analiza originală a lui Drago & Wayland din 1965, a fost utilizată o ecuație cu doi termeni, astfel încât fiecare acid Lewis este caracterizat prin termenii EA și CA și fiecare bază Lewis prin EB și CB, unde parametrii E și C se referă la contribuțiile electrostatice și covalente la rezistența legăturilor pe care le va forma interacțiunea acid/baza. (Acest lucru este asemănător cu analiza Klopman, de mai sus.) Acești parametri au fost obținuți empiric prin utilizarea entalpiilor pentru aduși care formează numai legături σ între acidul Lewis și baza Lewis și nu au repulsie sterică:
-ΔH = EAEB + CACB
În modelul ECW, un nou termen W a fost adăugat la ecuație.
-ΔH = EAEB + CACB + W
unde termenul W reprezintă o energie constantă pentru scindarea unui acid Lewis sau a unei baze Lewis dimerice.
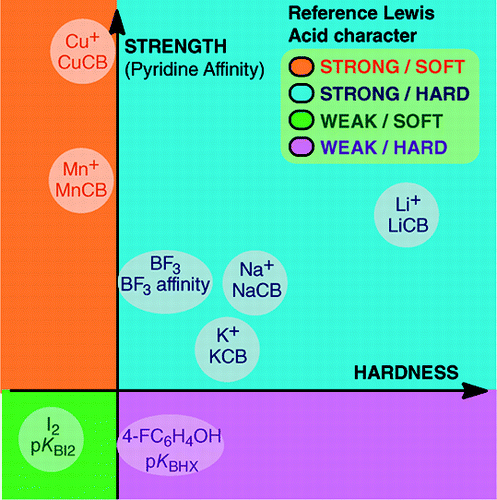
Din An Overview of Lewis Basicity and Affinity Scales de Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
Imposibilitatea de a stabili o scală universală de bazicitate Lewis nu împiedică determinarea comportamentului cantitativ al bazelor Lewis, datorită scalelor construite față de anumiți acizi Lewis: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, și CH3NH3+. Aceste scale cuprind tipuri importante de legături formate într-un aduct de acid-bază Lewis: legătura dativă, legăturile de hidrogen convenționale și ionice, legătura halogenată și legăturile cation-moleculă pentru cationii metalici din grupele 1, 7, 10, 11 și 13. Mai mult, deși aceste scale nu sunt în general legate între ele, există relații dependente de familie care permit clasificarea, într-o ordine destul de generală, a bazelor aparținând unei anumite familii chimice, de exemplu, familia bazelor de oxigen. Prin urmare, scepticismul cu privire la utilitatea cantitativă a conceptului de Lewis al acizilor și bazelor nu mai este fondat.și:
Formația produșilor de adaos acid-bază Lewis acoperă o mare varietate de procese de formare a legăturilor, de la legătura slabă van der Waals din Ar—BF3 la legătura dativă puternică din H3N-BF3. Termenul de „legătură” poate fi criticabil în cazul aducerilor slabe. Aceste specii cu legături slabe sunt în general produse într-un fascicul supersonic sau într-o matrice criogenică. Aici, suntem interesați în principal de complecșii care pot fi observați într-un amestec la temperatura camerei al acidului Lewis și al bazei Lewis.În apă, ordinea constantelor de complexare a ionilor de halogenură cu acidul Fe3+ este F- > Cl- > Br- > I-, în timp ce cu Hg2+, este I- > Br- > Cl- >F-. Această inversare se explică prin principiul acidului și bazei tari și moi al lui Pearson.
Coordonarea unei serii de azine la metalogene a fost corelată cu scara de bazicitate a legăturilor de hidrogen ale azinelor.
Calculul ab initio al puterii acidului Lewis al halogenurilor metalice covalente in vacuo folosind anionul fluorură ca bază Lewis de referință.
O valoare DN a trietilaminei a fost estimată dintr-o corelație între DN și deplasarea chimică RMN a nucleului 23Na pentru soluții de săruri de sodiu în solvenți bazici. Ulterior, determinarea directă a dat o valoare care a fost la jumătate din valoarea estimată.
 |
 |
 |
| Lewis & Teorii Brønsted ale acidității | Hidruri elementare din grupa principală |
.