>
- meta-síntese
- Sobre
- Nossos Websites
- Capítulos de Web Book
 |
 |
 |
Ralph Pearson introduziu o seu princípio da base dura de ácido mole (HSAB) no início dos anos sessenta, e ao fazê-lo, tentou unificar a química de reacção inorgânica e orgânica. O impacto da nova idéia foi imediato, entretanto, ao longo dos anos o princípio HSAB caiu por terra enquanto outras abordagens desenvolvidas ao mesmo tempo, como a teoria orbital molecular de fronteira (FMO) e a mecânica molecular, floresceram.
Esta página discute as profundas limitações da abordagem de Pearson e compara & contrasta o princípio HSAB com a análise da quimogênese apresentada neste livro da web.
Nota, neste web book:
| Lewis acids are RED | Lewis bases are BLUE |
- Irving-Williams Stability Series
- Ahrland’s Type A, Type B Analysis
- Análise geoquímica de Railsback
- Princípio HSAB de Pearson (The Hard Soft Acid Base Principle)
- Sistema de Classificação HSAB da Pearson, a partir daqui:
- Revisão de Jensen do Princípio HSAB
- Klopman’s FMO Analysis
- Combinando as ideias de Pearson e Klopman
- The Ho Paper
- O Princípio HSAB para Orgânicos & Químicos do Grupo Principal
- Problemas, problemas, problemas…
- Regras de Fajans
- Então, o que é que se passa?
- Comparando a Análise de HSAB “Top Down” com a Análise de Quimiogênese “Bottom Up”
- Os Papers HSAB:
- Outra Análise Pós-Pearson
Irving-Williams Stability Series
A série de estabilidade Irving-Williams (1953) apontou que para um determinado ligando a estabilidade dos complexos de iões metálicos dipositivos aumenta:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Também se sabia que certos ligandos formavam os seus complexos mais estáveis com iões metálicos como o Al3+, Ti4+ & Co3+ enquanto outros formaram complexos estáveis com Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
Em 1958 Ahrland et al. classificaram cátions metálicos como Tipo A e Tipo B, onde:
Catiões metálicos Tipo A incluem:
- Catiões metálicos alcalinos: Li+ a Cs+
- Catiões metálicos alcalinos de terra: Be2+ a Ba2+
- Catiões metálicos de transição mais leves em estados de oxidação mais elevados: Ti4+, Cr3+, Fe3+, Co3+
- O próton, H+
Catiões metálicos tipo B incluem:
- Catiões metálicos de transição mais pesados em estados de oxidação mais baixos: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
- Alguns metais são encontrados na natureza como metal Tipo A + minerais ligantes Tipo A, tais como carbonatos: MgCO3 e CaCO3 e óxidos: Fe2O3 e TiO2
- Alguns outros metais são encontrados na natureza como metal tipo B + minerais ligantes tipo B, por exemplo, os minérios de sulfureto: PbS, CdS, NiS, etc.
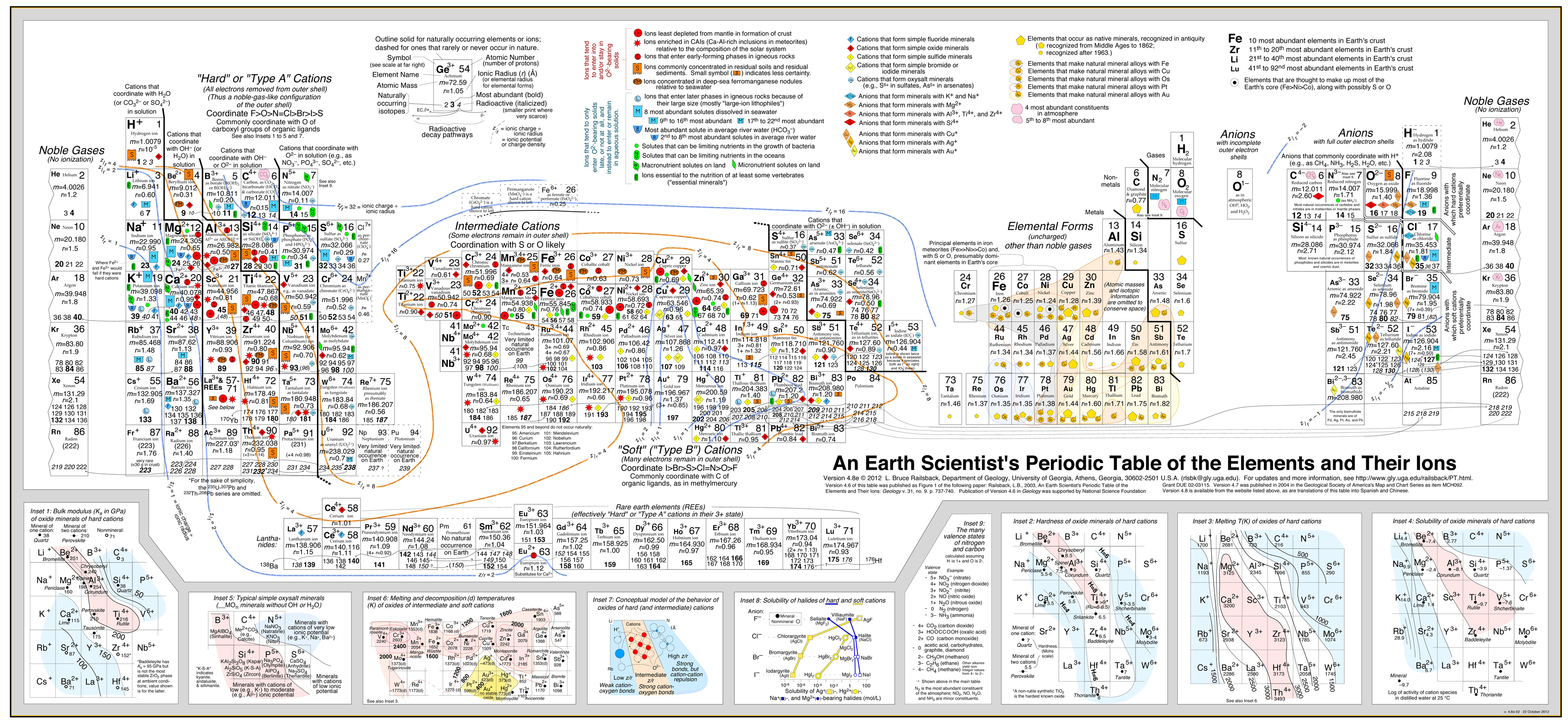
- A análise de Railsback utiliza contornos de comportamento sobrepostos à tabela periódica. .
- Veja o papel: Uma Síntese de Mineralogia Sistemática de Bruce Railsback que desenvolve esta análise.
- O ião sódio, Na+, é mais duro que o ião prata, Ag+
- Os iões alcóxido, RO, são bases de Lewis mais duras que os tioaniões, RS
- O íon Cobre(II), Cu2+, é ácido Lewis mais duro que o íon Cobre(I), Cu+
- A extremidade aniônica de nitrogênio do íon Cianeto ambidentate, CN, é uma base de Lewis mais dura que a base de anião de carbono mais macia, NC
- O ião enolato de ambidentate, tem uma base de Lewis de oxianião duro, enquanto o centro de Lewis é mais macio e é mais nucleofílico
- Nucleófilos mais duros como o ião alcóxido, R-O, atacam o carbono acyl (carbonilo).
- Nucleófilos mais macios como o ião cianeto, NC, e o tioanião, R-S, atacam o carbono acyl (carbonilo) β.
- Eliminação vs Substituição por 1,2-Dicloroetano
- Eliminação vs Substituição com 2-Bromopropano
- β-Propiolactona
- Ião Cianeto
- Iões Enolados
- Ião Nitrito
- Ião Sulfato
- Ião Tiocianato
- As matrizes congêneres são sempre encontradas dentro das células da Matriz de Interação Ácido/base de Lewis, e não cruzando células.
- Tendências de Dureza para Suavidade ocorrem dentro de matrizes congêneres, mas elas nunca cruzam entre matrizes.
- Um pequeno íon positivo é altamente polarizador, favorece a covalência, e para um determinado catião o caráter covalente aumenta conforme o ânion se torna maior.
- Iões negativos grandes são altamente polarizáveis, favorecem a covalência, e para um determinado ânion o caráter covalente aumenta conforme o catião se torna menor.
- O carácter covalente aumenta com o aumento da carga iónica em qualquer um dos iões.
- Polarização, e portanto covalência, é favorecida se o ião positivo não tiver uma configuração de gás nobre. Isto é importante para catiões como: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+, Ce3+ & Eu2+.
- Fajans regras explicam claramente esta química dizendo que o íon Be2+ muito pequeno e altamente carregado é capaz de polarizar (distorcer) as nuvens de elétrons de íons cloreto comparativamente grandes em ligação covalente e, portanto, dar uma estrutura molecular.
- A análise do Pearson-Klopman HSAB afirma que o íon berílio, sendo o menor dos cátions metálicos do Grupo II, é também o mais duro. Portanto, os sais de íons de berílio devem apresentar uma ligação de carga extrema controlada e dar origem a materiais iônicos, mas eles não.
- A análise de quimiogênese, aqui, diz que os cátions do Grupo II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, compõem uma série congénere de ácidos s-LUMO Lewis carregados, que tendências de comportamento linear são encontradas ao longo desta série.
Estas tendências de comportamento linear podem ser atribuídas ao comportamento ‘hard-soft’, se assim o desejar, no entanto, os termos ‘hard’ e ‘soft’ só podem ser utilizados em relação à série congénere em questão e as comparações ‘hard-soft’ não podem ser feitas em relação a outros ácidos Lewis. - Iniciando com todas as espécies no espaço da química de reacção, uma série de espécies importantes são identificadas como ácidos de Lewis e bases de Lewis.
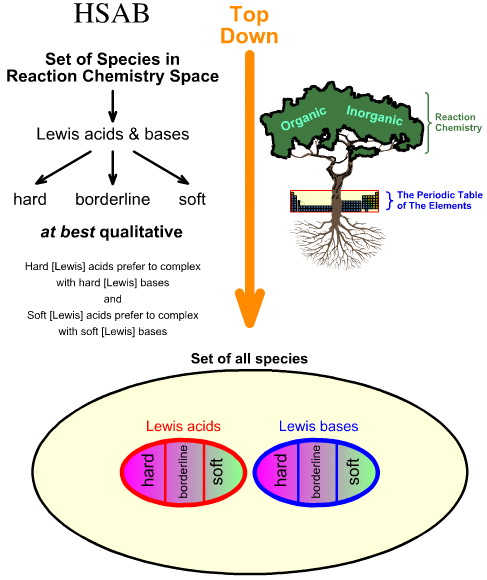
- Os ácidos de Lewis e as bases de Lewis são então classificados como duros, borderline ou moles usando observação empírica e o princípio de que: ácidos de Lewis duros preferem complexar com bases de Lewis duras e ácidos de Lewis moles preferem complexar com bases de Lewis moles:
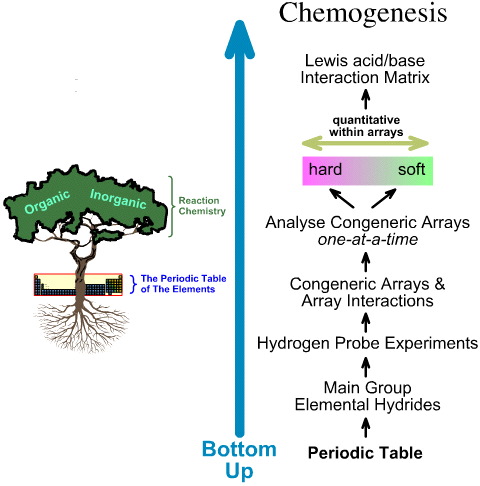
- Os hidretos elementares do grupo principal são submetidos aos 5 experimentos com sondas de hidrogênio.
- São estudadas as interacções entre matrizes e matrizes.
- Tendências estruturais e de reactividade linearmente difíceis de macia são identificadas dentro das matrizes, e é reconhecido que não se pode esperar um comportamento linear entre matrizes.
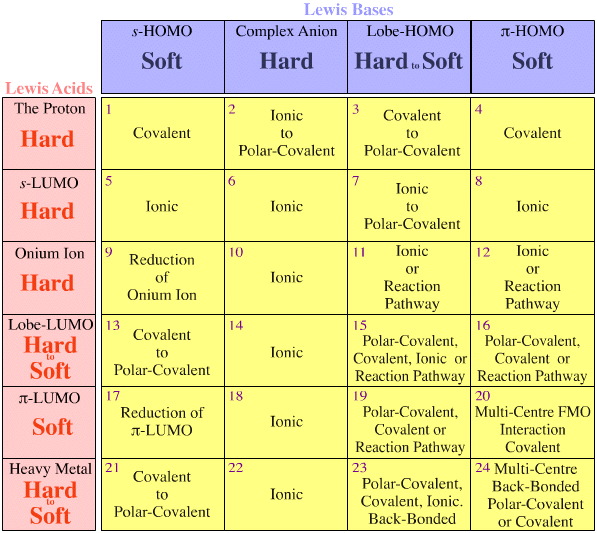
- Os ácidos Lewis e as bases Lewis são classificados pelas suas estruturas electrónicas Lewis e topologias FMO e estão dispostos numa matriz de interacção ácido/base Lewis, aqui.
Ligandos, entidades químicas que complexam com cátions metálicos, foram classificadas como Tipo A ou Tipo B, dependendo se formaram complexos mais estáveis com cátions metálicos Tipo A ou cátions metálicos Tipo B, a partir daqui:
|
Tendência de Ligand para complexar
com Metais Tipo A |
Tendência de Ligand para complexo
com Metais Tipo B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Desta análise, uma regra empírica pode ser derivada:
Os Metais Tipo A preferem ligar (complexo) a ligandos Tipo A
e
Os Metais Tipo B preferem ligar (complexo) a ligandos Tipo B
Estas regras empíricas – derivadas experimentalmente – dizem-nos que os Metais Tipo A são mais propensos a formar óxidos, carbonatos, nitretos e fluoretos, enquanto os metais tipo B são mais propensos a formar fosforetos, sulfuretos e selinetos.
Análise geoquímica de Railsback
A análise “Tipo A, Tipo B” é de grande importância económica porque:
Esta abordagem foi muito bem sucedida desenvolvida por Bruce Railsback com seu excelente e altamente recomendado “Earth Scientist’s Periodic Table website”.
Click image to enlarge:
Princípio HSAB de Pearson (The Hard Soft Acid Base Principle)
Nos anos sessenta, Ralph Pearson expandiu grandemente a lógica do Tipo A – Tipo B explicando o comportamento diferencial de complexação de cátions e ligandos em termos de par de elétrons aceitando ácidos de Lewis e par de elétrons doando bases de Lewis:
Ácido de Lewis + base de Lewis → Complexo ácido/base de Lewis
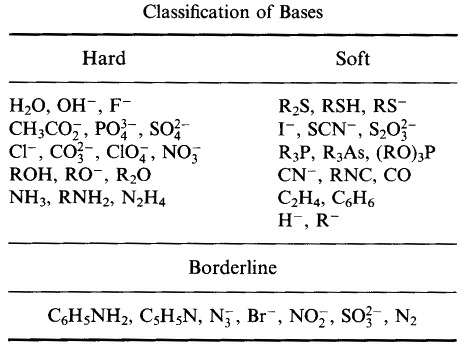
Pearson classificou os ácidos de Lewis e as bases de Lewis como duros, limítrofes ou moles.
De acordo com o princípio da base ácida dura e macia (HSAB) de Pearson:
Ácidos duros preferem ligar-se a bases duras
e
Ácidos moles preferem ligar-se a bases macias
À primeira vista, a análise HSAB parece bastante semelhante ao sistema Tipo A e Tipo B.
No entanto, Pearson classificou uma grande variedade de átomos, íons, moléculas e íons moleculares como duros, borderline ou moles, movendo a análise da química tradicional metal/ligoe inorgânica para – e combinando com – o reino da química orgânica.
Sistema de Classificação HSAB da Pearson, a partir daqui:
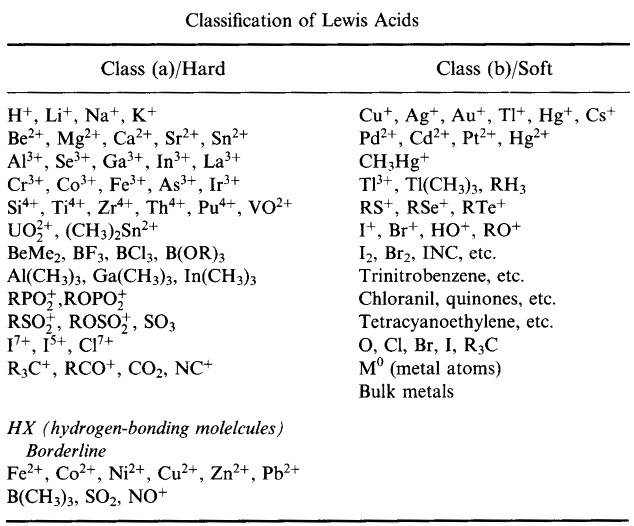
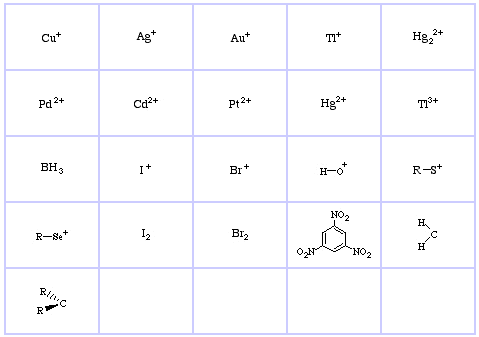
Ácidos de Lewis Duros da Pearson (do Chemical Thesaurus), aqui, e da base de dados de matriz congénere, aqui:
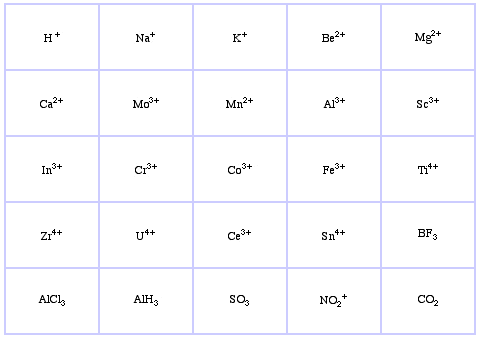
Ácidos Borderline Lewis da Pearson, aqui, e aqui:
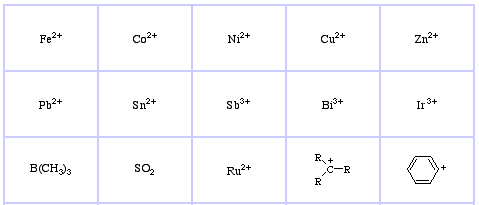
Ácidos Lewis Macios da Pearson, aqui, e aqui:
Bases de Lewis Duros da Pearson (do The Chemical Thesaurus), aqui, e da base de dados da matriz congénere, aqui:
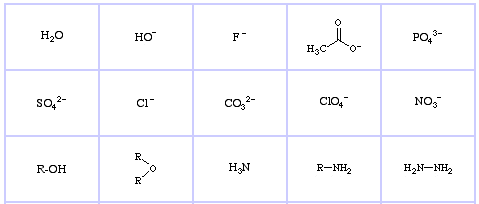
Bases de Lewis Borderline da Pearson, aqui, e aqui:

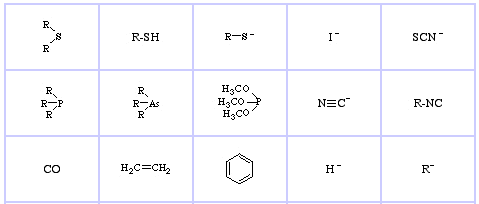
Bases de Lewis Soft da Pearson, aqui, e aqui:
Revisão de Jensen do Princípio HSAB
William (Bill) Jensen apresentou três artigos na revista ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Parte I Março pp 11-14; Parte II Abril pp 13-18; Parte III Maio pp 14-18. Parte III trata da análise HSAB de Pearson.
O artigo combinado – que é excelente e detalhado – está disponível no espaço web do Bill (e um clone do arquivo pode ser baixado deste site).
Klopman’s FMO Analysis
Em 1968, G. Klopman tentou quantificar o princípio HSAB de Pearson usando a teoria orbital molecular de fronteira (FMO), como discutido em outra parte deste web book, aqui, com esta equação:
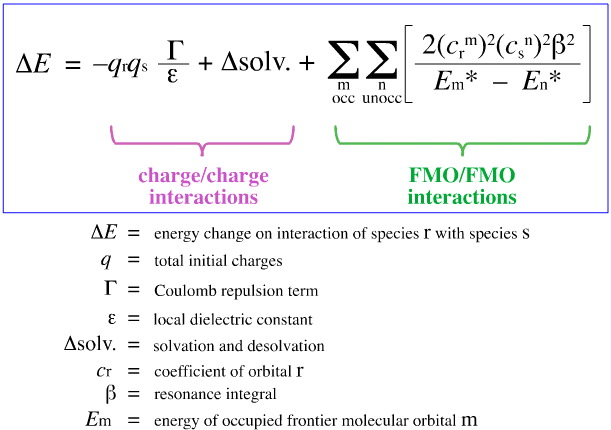
Klopman propôs isso:
Ácidos duros ligam-se a bases duras para dar complexos (iónicos) controlados por carga. Tais interações são dominadas pelas cargas +/ nas espécies que interagem.
e
Ácidos duros ligam-se a bases macias para dar complexos FMO-controlados. Estas interações são dominadas pelas energias dos orbitais moleculares de fronteira participantes (FMO), o orbital molecular mais ocupado (HOMO) e o orbital molecular menos desocupado (LUMO).
Ler mais em outro lugar no livro da Quimogênese, aqui, ou veja a Química Orgânica e a teoria FMO de Ian Fleming aqui, onde estas idéias são desenvolvidas em algum comprimento.
Usando a análise acima, os aspectos contribuidores da carga controlada e da complexação ácido/base FMO de Lewis são separados e quantificados, um desenvolvimento crucial.
Combinando as ideias de Pearson e Klopman
Ácidos de Lewis duro:
Centros atómicos de pequeno raio iónico
Carga positiva alta
Espécies que não contêm pares de electrões nas suas conchas de valência
Baixa afinidade dos electrões
Provavelmente fortemente solváveis
Ácidos de Lewis de alta energia LUMOÁcidos de Lewis macio:
Grande raio
Carga positiva baixa ou parcial δ+ carga positiva
Pares de electrões nas suas conchas de valência
Fácil de polarizar e oxidar
LUMOs de baixa energia, mas coeficientes LUMO de grande magnitudeBases Lewis duras:
Pequenos centros atómicos atómicos electronegativos, altamente solúveis: 3.0-4.0
Espécies fracamente polarizáveis
Difíceis de oxidar
HOMO de alta energiaBases Lewis macias:
Grandes átomos de eletronegatividade intermediária: 2.5-3.0
Fácil de polarizar e oxidar
HOMO de baixa energia, mas coeficientes HOMO de grande magnitudeEspécies limítrofes têm propriedades intermediárias.
Existe um qualificador no trabalho de Klopman que diz que: não é necessário que as espécies possuam todas as propriedades.
The Ho Paper
Pearson sugeriu que as tendências difíceis de suavizar poderiam ser encontradas entre os grupos 15, 16 e 17 da tabela periódica. Em 1975 a idéia foi estendida por Tse Lok Ho que usou espécies químicas realistas e cunhou o termo congenérico (da mesma família), onde as espécies congenéricas são isoelectronc (têm a mesma estrutura exterior de concha Lewis).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Ácidos e Bases Duras e Suaves, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., The Hard Soft Acids Bases (HSAB) Principle and Organic Chemistry Chemistry Chemistry Reviews 75, 1-20 (1975) | |
| H3C- |
H2N-
|
HO- | F- | ||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
O Princípio HSAB para Orgânicos & Químicos do Grupo Principal
Para os nossos propósitos grupo principal e química de reação orgânica a abordagem Pearson é mais bem sucedida quando se compara pares de espécies:
Este tipo de análise pode ser muito útil na explicação da selectividade da reacção.
Por exemplo, β-propiolactona – um éster cíclico reativo – é um anel aberto pelas bases nucleofílicas de Lewis. O ataque pode ocorrer em duas posições e os nucleófilos exibem regioselectividade:
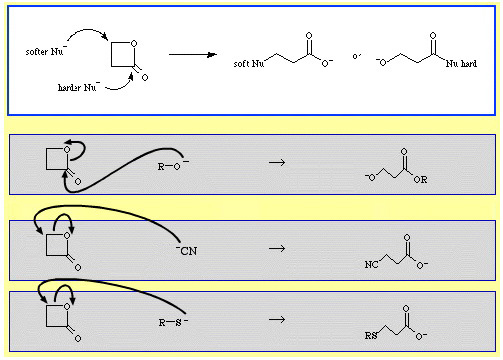
Existem vários exemplos de seletividade de ambidentate no banco de dados de química de reação do Chemical Thesaurus:
Problemas, problemas, problemas…
No entanto, há problemas graves com a análise da Pearson. Embora o modelo Pearson-Klopman HSAB não esteja exatamente errado… ele simplifica grosseiramente a conhecida química de reação, como reconhecido pelo próprio Ralph Pearson:
No início de seu livro de 1997, Chemical Hardness, Wiley-VCH, pp 3-4, Ralph Pearson francamente escreve:
“Com a nomenclatura é possível fazer uma afirmação simples e geral:
“Ácidos duros preferem coordenar a bases duras, e ácidos moles preferem coordenar bases macias”
“Este é o Princípio dos Ácidos Duros e Macios e Bases, ou o Princípio do HSAB.
“Note que este Princípio é simplesmente uma reformulação da evidência experimental que levou a . É uma declaração condensada de uma quantidade muito grande de informação química. Como tal, pode ser chamada de lei. Mas este rótulo parece pretensioso em vista da falta de uma definição quantitativa de dureza.
“HSAB não é uma teoria, pois não explica as variações na força das ligações químicas. A palavra “preferir” no Princípio do HSAB implica um efeito bastante modesto.
“A suavidade não é o único fator que determina o valor de ΔH° na equação:
A + :B → A:B
“Há muitos exemplos de ligações muito fortes entre pares desajustados, como o H2, formado a partir de H+ duro e H suave.
“H2O, OH e O2 são todos classificados como bases duras, mas existem grandes diferenças na sua força de base, por qualquer critério”
RP
Indeed so… (!)
Um problema é que o conjunto completo de interacções e complexações hard-borderline-soft não é simplesmente considerado utilizando a análise Pearson. Veja como a matriz de interação HSAB está vazia:
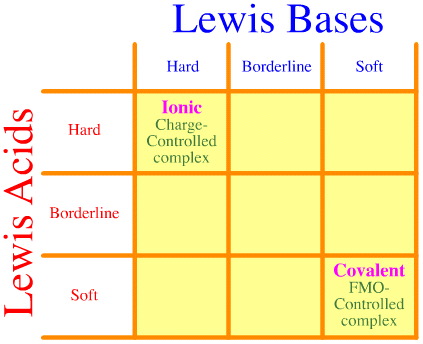
O princípio do Pearson HSAB afirma que “ácidos duros preferem ligar-se a bases duras e que ácidos moles preferem ligar-se a bases moles”, o que pode ser verdade, mas não diz nada sobre complexos miscigenados de dura-macia.
Klopman simplesmente afirma que tais interacções são “indefinidas”!
Yet, muitos dos reagentes mais interessantes da química de reacções orgânicas e inorgânicas são complexos “tensos” de dura-macia:
| Hidreto de sódio |
NaH
|
Na+
|
H
|
|
| Hidreto de alumínio lítio |
LiAlH4
|
Al3+
|
H
|
|
| Acetato de chumbo(IV) |
Pb(AcO)4
|
Pb4+
|
AcO
> |
|
| Iodeto de metilo |
CH3I
|
CH3+
|
I
|
|
| Lítio de metilo |
CH3Li
|
Li+
|
CH3
|
|
| Triethyloxonium tetrafluoroborate |
+
|
CH3CH2+
|
:OR2
|
|
| Ferrocene |
Fe(Cp)2
|
Fe2+
|
|
|
Reduto
|
Borderline
|
Soft
|
Por comparação, a riqueza da química de reação conhecida surge naturalmente na matriz de interação ácido/base de Lewis, um princípio central da análise da quimogênese (mas corremos o risco de nos anteciparmos, veja as próximas páginas aqui & aqui).
Existem duas observações/regras, e ambas dizem respeito a matrizes congêneres de espécies isoeletrônicas/isoreativas:
Regras de Fajans
A análise Pearson-Klopman HSAB também está em contradição direta com as bem conhecidas “regras de Fajans” (desenvolvidas ao longo dos anos 1915-24), embora nenhum outro autor pareça ter abordado esta questão até hoje.
Carácter iónico-covalente em metal mais materiais binários não metálicos podem ser calculados usando a equação de Pauling, aqui, mas a diferença na electronegatividade subestima o efeito da polarização: a medida em que um átomo distorce ou polariza a nuvem de electrões do outro.
As regras de Fajans dizem:
Um exemplo:
Cloreto de berílio, BeCl2 comparado com os outros cloretos alcalinos de terra: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Cation
|
Iónico
Radius |
Eneg.
|
% Iônico de
para Cl- bond |
Bond & Material
Tipo |
|
Be2+
|
41
|
1.57
|
34
|
Covalente/Molecular
|
|
Mg2+
|
86
|
1.31
|
42
|
>Salônico
|
|
Ca2+
|
114
|
1.00
|
51
|
>Salônico
|
|
Sr2+
|
132
|
0.95
|
52
|
>Salônico
|
|
Ba2+
|
149
|
0.89
|
54
|
Salônico
|
Dados de raio de radiação dos elementos da teia
Cloreto de berílio, BeCl2, é covalente: o material anidro é solúvel em solventes orgânicos, sublima (em vácuo), e o material fundido é um pobre condutor de eletricidade. MgCl2, CaCl2, SrCl2 e BaCl2 são materiais iônicos e os sais fundidos são excelentes condutores elétricos.
Então, o que é que se passa?
O ponto é que nenhum parâmetro físico se correlaciona com a dureza em relação ao conjunto de espécies escolhido de Pearson. Isto cria ambigüidades, como com a química orgânica do íon fluoreto, aqui, e a contradição com as regras de Fajans, acima.
O modelo Pearson não leva em conta a geometria FMO (as formas & fases dos orbitais participantes). Por exemplo, quão semelhantes são os ácidos duros do Pearson:
H+ + BF3 CO2 Cs+ Cu2+ ?
Or, quão semelhantes são as bases macias de Pearson:
H R2S: H3C benzeno ?
Crucialmente para químicos orgânicos e do grupo principal, a análise do HSAB diz pouco/nada sobre o importante íon carbenium (carbocalização) ácido de Lewis, H3C+, ou a base de Lewis carbônico, H3C.
Reivindicação arrojada
O contínuo unidimensional de linha dura e macia da análise de Pearson tem o efeito de embaçar muito do comportamento rico e linear (previsível) que pode ser encontrado no espaço da química da reação ácido/base de Lewis.
A nova análise de quimiogênese apresentada neste livro da Web e apoiada pela química de reação mantida no banco de dados do Chemical Thesaurus evita e explica as armadilhas da muito hipotética abordagem HSAB da Pearson.
Comparando a Análise de HSAB “Top Down” com a Análise de Quimiogênese “Bottom Up”
Análise da Base de Ácido Macio Duro (HSAB) da Pearson é de cima para baixo.
Em contraste, a análise da quimogénese é de baixo para cima:
Os Papers HSAB:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman e R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968>
Tambem veja aqui.
>
Outra Análise Pós-Pearson
O modelo ECW é um modelo semi-quantitativo que descreve e prevê a força das interações ácido/base de Lewis. Inicialmente, o modelo atribuiu parâmetros eletrostáticos (E) e covalentes (C) aos ácidos e bases de Lewis. Isto foi posteriormente expandido para o modelo ECW para cobrir reações que têm um termo de energia constante, W, que descreve processos que precedem a interação ácido/base.
Em Drago & Análise original de Wayland de 1965, uma equação de dois termos foi empregada de tal forma que cada ácido de Lewis é caracterizado pelos termos EA e CA e cada base de Lewis por EB e CB onde os parâmetros E e C referem-se às contribuições eletrostáticas e covalentes para a força das ligações que a interação ácido/base irá formar. (Isto é como a análise Klopman, acima.) Estes parâmetros foram obtidos empiricamente usando entalpias para adutos que formam apenas ligações σ entre o ácido de Lewis e a base de Lewis e não têm repulsão estérica:
-ΔH = EAEB + CACB
No modelo ECW, um novo termo W foi adicionado à equação.
-ΔH = EAEB + CACB + W
onde o termo W representa uma energia constante para clivagem de um ácido Lewis dimérico ou base Lewis.
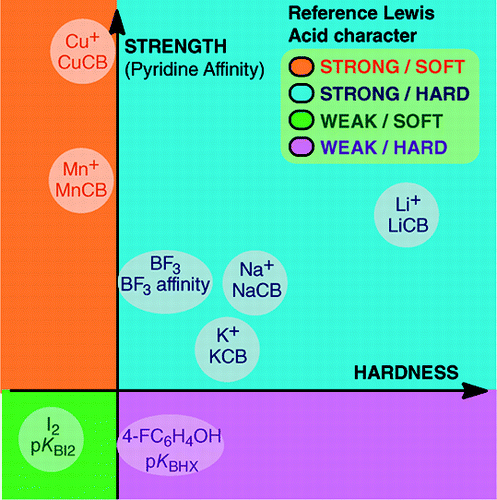
From An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
A impossibilidade de estabelecer uma escala universal de basicidade de Lewis não impede a determinação do comportamento quantitativo das bases de Lewis, graças a escalas construídas contra ácidos particulares de Lewis: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, e CH3NH3+. Estas escalas abrangem importantes tipos de ligações formadas em um adutor à base de ácido de Lewis: a ligação dativa, as ligações convencionais e iônicas de hidrogênio, a ligação halógena e as ligações catiônicas-moléculas para cátions metálicos dos grupos 1, 7, 10, 11 e 13. Além disso, embora estas escalas não estejam geralmente inter-relacionadas, existem relações familiares que permitem classificar, numa ordem bastante geral, as bases pertencentes a uma determinada família química, por exemplo, a família das bases de oxigénio. Portanto, o ceticismo sobre a utilidade quantitativa do conceito Lewis de ácidos e bases não está mais fundado.e:
A formação dos adutos ácido-base de Lewis cobre uma grande variedade de processos de formação de ligações, desde a fraca ligação van der Waals em Ar—BF3 até a forte ligação dativa em H3N-BF3. O termo “ligação” pode ser censurável para os adutos fracos. Estas espécies com ligações fracas são geralmente produzidas num feixe supersónico ou numa matriz criogénica. Aqui, estamos principalmente interessados por complexos que podem ser observados em uma mistura de temperatura ambiente do ácido Lewis e da base Lewis.Em água, a ordem das constantes de complexação dos íons haleto com o ácido Fe3+ é F- > Cl- > Br- > I-, enquanto que com Hg2+, é I- > Br- > Cl- > F-. Esta inversão é explicada pelo princípio do ácido duro e suave e da base de Pearson.
A coordenação de uma série de azines com metalocenos foi correlacionada com a escala de basicidade da liga de hidrogênio dos azines.
O cálculo ab initio da força ácida de Lewis de halogenetos metálicos covalentes no vacuo usando o anion fluoreto como base de referência de Lewis.
Um valor de DN de trietilamina foi estimado a partir de uma correlação entre DN e a mudança química NMR do núcleo 23Na para soluções de sais de sódio em solventes básicos. Mais tarde, a determinação direta deu um valor que era metade do valor estimado.
 |
 |
 |
| Lewis & Teorias Brønsted de Acidez | Hidretos elementares do grupo principal |