- meta-sintesi
- A proposito di
- I nostri siti web
- Capitoli di libri web
 |
 |
 |
Ralph Pearson ha introdotto il suo principio Hard Soft Acid Base (HSAB) nei primi anni sessanta, e così facendo tentò di unificare la chimica delle reazioni inorganiche e organiche. L’impatto della nuova idea fu immediato, tuttavia, nel corso degli anni il principio HSAB è piuttosto caduto nel dimenticatoio mentre altri approcci sviluppati nello stesso periodo, come la teoria degli orbitali molecolari di frontiera (FMO) e la meccanica molecolare, sono fioriti.
Questa pagina discute i profondi limiti dell’approccio di Pearson e confronta &il principio HSAB con l’analisi della chemiogenesi come presentata in questo libro web.
Nota, in questo libro web:
| Gli acidi di Lewis sono ROSSI | Le basi di Lewis sono BLU |
- Serie di stabilità Irving-Williams
- Ahrland’s Type A, Type B Analysis
- L’analisi geochimica di Railsback
- Principio HSAB di Pearson (The Hard Soft Acid Base Principle)
- Il sistema di classificazione HSAB di Pearson, da qui:
- Jensen’s Review of the HSAB Principle
- L’analisi FMO di Klopman
- Combinando le idee di Pearson e Klopman
- Il documento Ho
- Il principio HSAB per l’organico & Chimici del gruppo principale
- Problemi, problemi, problemi…
- Regole di Fajans
- Quindi, cosa sta succedendo?
- Confronto dell’analisi HSAB “Top Down” con l’analisi Chemogenesis “Bottom Up”
- The HSAB Papers:
- Altra analisi post-Pearson
Serie di stabilità Irving-Williams
La serie di stabilità Irving-Williams (1953) ha evidenziato che per un dato ligando la stabilità dei complessi di ioni metallici dipositivi aumenta:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Si sapeva anche che certi ligandi formavano i loro complessi più stabili con ioni metallici come Al3+, Ti4+ & Co3+ mentre altri formavano complessi stabili con Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
Nel 1958 Ahrland et al. classificò i cationi metallici come Tipo A e Tipo B, dove:
I cationi metallici di Tipo A includono:
- Cationi metallici alcalini: Li+ a Cs+
- Cationi metallici alcalini terrosi: Be2+ a Ba2+
- Cationi di metalli di transizione più leggeri in stati di ossidazione superiori: Ti4+, Cr3+, Fe3+, Co3+
- Il protone, H+
I cationi metallici di tipo B includono:
- Cationi metallici di transizione più pesanti in stati di ossidazione inferiori: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
I ligandi, entità chimiche che complessano con cationi metallici, sono stati classificati come Tipo A o Tipo B a seconda che formino complessi più stabili con cationi metallici di Tipo A o cationi metallici di Tipo B, da qui:
|
Tendenza del ligando a complessare
con metalli di tipo A |
Tendenza del ligando a complesso
con metalli di tipo B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Da questa analisi, si può ricavare una regola empirica:
I metalli di tipo A preferiscono legarsi (complessarsi) ai ligandi di tipo A
e
I metalli di tipo B preferiscono legarsi (complessarsi) ai ligandi di tipo B
Queste regole empiriche – derivate sperimentalmente – ci dicono che i metalli di tipo A hanno maggiori probabilità di formare ossidi, carbonati, nitruri e fluoruri, mentre i metalli di tipo B hanno più probabilità di formare fosfuri, solfuri e selinidi.
L’analisi geochimica di Railsback
L’analisi “Tipo A, Tipo B” è di grande importanza economica perché:
- Alcuni metalli si trovano in natura come metallo di tipo A + minerali ligandi di tipo A, come i carbonati: MgCO3 e CaCO3 e gli ossidi: Fe2O3 e TiO2
- Mentre altri si trovano come metallo di tipo B + minerali leganti di tipo B, per esempio i minerali di solfuro: PbS, CdS, NiS, ecc.
Questo approccio è stato sviluppato con molto successo da Bruce Railsback con il suo eccellente e altamente raccomandato “Earth Scientist’s Periodic Table website”.
Clicca l’immagine per ingrandire:
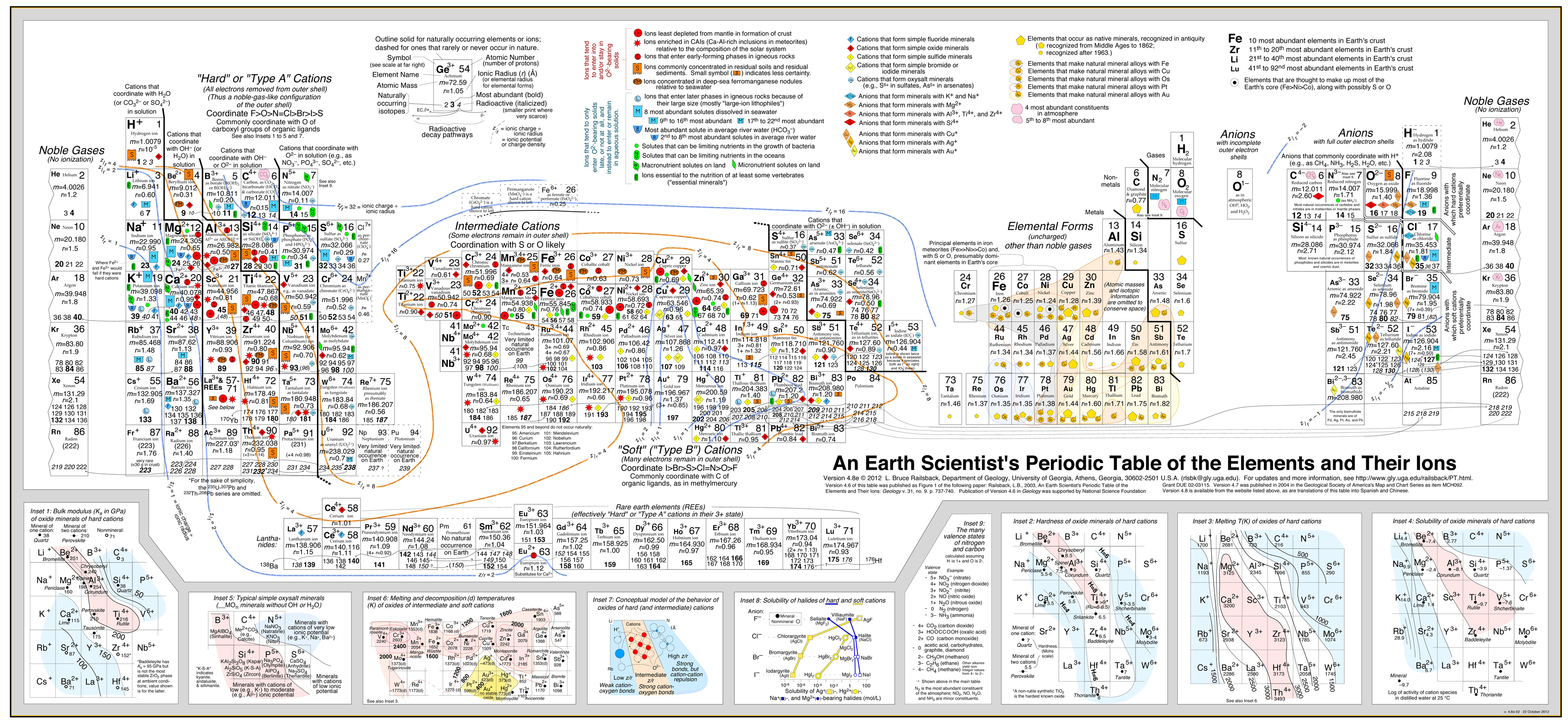
- L’analisi di Railsback usa contorni di comportamento sovrapposti alla tavola periodica.
- Vedi il documento: A Synthesis of Systematic Mineralogy di Bruce Railsback che sviluppa questa analisi.
Principio HSAB di Pearson (The Hard Soft Acid Base Principle)
Negli anni sessanta, Ralph Pearson ampliò notevolmente la logica di tipo A-tipo B spiegando il comportamento di complessazione differenziale di cationi e ligandi in termini di acidi di Lewis che accettano coppie di elettroni e basi di Lewis che donano coppie di elettroni:
Acido di Lewis + base di Lewis → complesso acido/base di Lewis
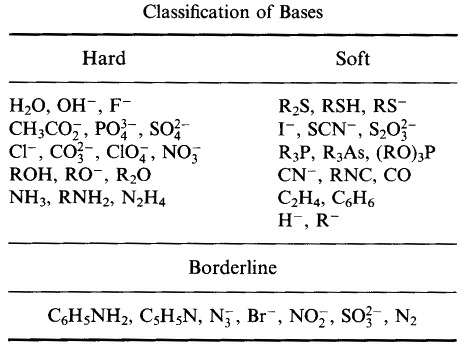
Pearson classificò gli acidi e le basi di Lewis come duri, borderline o morbidi.
Secondo il principio delle basi acide dure e morbide (HSAB) di Pearson:
Gli acidi duri preferiscono legarsi alle basi dure
e
Gli acidi morbidi preferiscono legarsi alle basi morbide
A prima vista, l’analisi HSAB sembra piuttosto simile al sistema di Tipo A e Tipo B.
Tuttavia, Pearson classificò una gamma molto ampia di atomi, ioni, molecole e ioni molecolari come duri, borderline o morbidi, spostando l’analisi dalla tradizionale chimica inorganica dei metalli/ligandi nel – e combinandosi con – il regno della chimica organica.
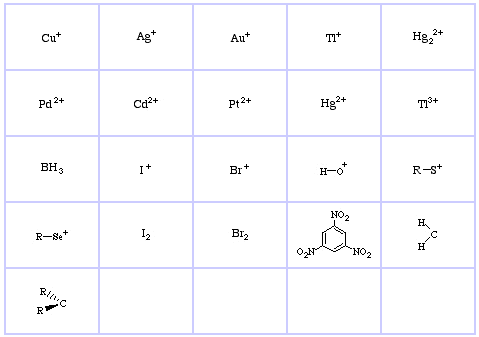
Il sistema di classificazione HSAB di Pearson, da qui:
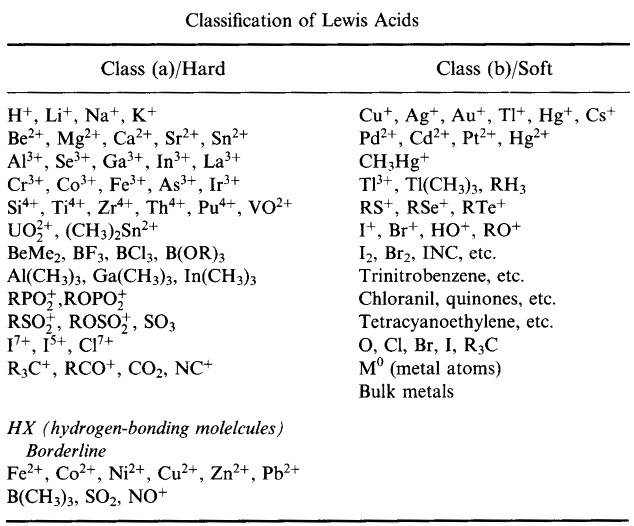
Pearson’s Hard Lewis Acids (dal Chemical Thesaurus), qui, e dal database delle matrici congeneriche, qui:
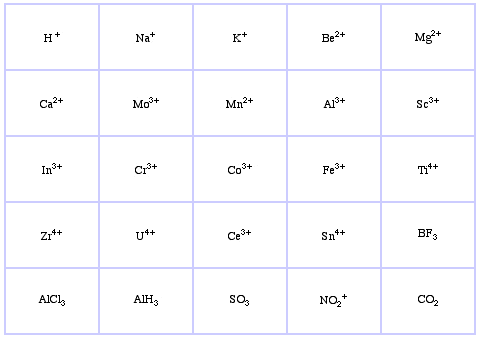
Pearson’s Borderline Lewis Acids, qui, e qui:
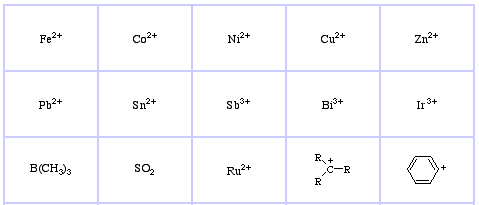
Pearson’s Soft Lewis Acids, qui, e qui:
Pearson’s Hard Lewis Bases (da The Chemical Thesaurus), qui, e dal database degli array congenerici, qui:
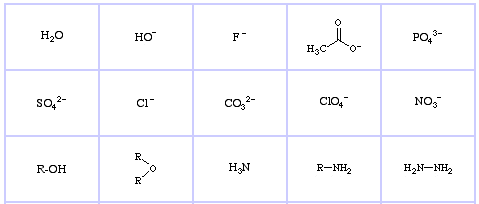
Pearson’s Borderline Lewis Bases, qui, e qui:

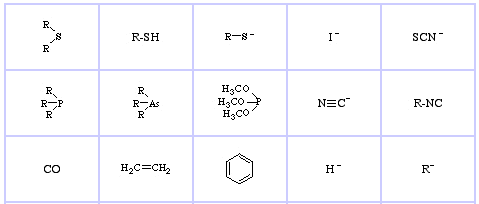
Pearson’s Soft Lewis Bases, qui, e qui:
Jensen’s Review of the HSAB Principle
William (Bill) Jensen ha presentato tre articoli nella rivista ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Parte I marzo pp 11-14; Parte II aprile pp 13-18; Parte III maggio pp 14-18. La parte III tratta l’analisi HSAB di Pearson.
L’articolo combinato – che è eccellente e dettagliato – è disponibile sullo spazio web di Bill (e un clone del file può essere scaricato da questo sito).
L’analisi FMO di Klopman
Nel 1968, G. Klopman tentò di quantificare il principio HSAB di Pearson usando la teoria degli orbitali molecolari di frontiera (FMO), come discusso altrove in questo libro web, qui, con questa equazione:
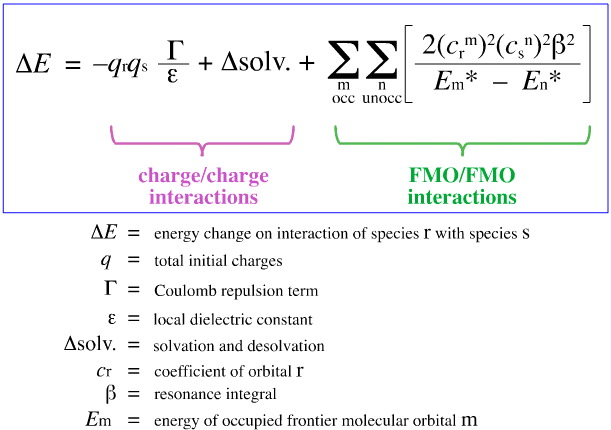
Klopman propose che:
Gli acidi si legano alle basi dure per dare complessi (ionici) a carica controllata. Tali interazioni sono dominate dalle cariche +/ sulle specie interagenti.
e
Gli acidi morbidi si legano a basi morbide per dare complessi controllati da FMO. Queste interazioni sono dominate dalle energie degli orbitali molecolari di frontiera partecipanti (FMO), il più alto orbitale molecolare occupato (HOMO) e il più basso orbitale molecolare non occupato (LUMO).
Leggi di più altrove nel libro web Chemogenesis, qui, o guarda Ian Fleming’s Organic Chemistry and FMO theory qui, dove queste idee sono sviluppate più a lungo.
Utilizzando l’analisi di cui sopra, gli aspetti che contribuiscono alla complessazione acido/base di Lewis controllata da carica e FMO sono separati e quantificati, uno sviluppo fondamentale.
Combinando le idee di Pearson e Klopman
Acidi di Lewis duri:
Centri atomici di piccolo raggio ionico
Alta carica positiva
Le specie non contengono coppie di elettroni nei loro gusci di valenza
Bassa affinità elettronica
Probabilità di essere fortemente solvati
Alta energia LUMOAcidi di Lewis morbidi:
Grande raggio
Bassa o parziale carica positiva δ+
Coppie di elettroni nei loro gusci di valenza
Facile da polarizzare e ossidare
LUMO a bassa energia, ma coefficienti LUMO di grande ampiezzaBasi di Lewis dure:
Piccoli centri atomici altamente solvibili ed elettronegativi: 3.0-4.0
Le specie sono debolmente polarizzabili
Difficile da ossidare
Alta energia HOMOBasi Lewis morbide:
Grandi atomi di elettronegatività intermedia: 2.5-3.0
Facile da polarizzare e ossidare
HOMO di bassa energia ma coefficienti HOMO di grande ampiezzaLe specie borderline hanno proprietà intermedie.
Nel documento di Klopman c’è un qualificatore che dice che: non è necessario che le specie possiedano tutte le proprietà.
Il documento Ho
Pearson suggerì che le tendenze hard-to-soft potevano essere trovate nei gruppi 15, 16 e 17 della tavola periodica. Nel 1975 l’idea fu estesa da Tse Lok Ho che usò specie chimiche realistiche e coniò il termine congenerico (della stessa famiglia), dove le specie congeneriche sono isoelettroniche (hanno la stessa struttura esterna di Lewis).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Hard and Soft Acids and Bases, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., Il principio Hard Soft Acids Bases (HSAB) e la chimica organica Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Il principio HSAB per l’organico & Chimici del gruppo principale
Per i nostri scopi la chimica del gruppo principale e delle reazioni organiche l’approccio Pearson ha più successo quando si confrontano coppie di specie:
- Lo ione sodio, Na+, è un acido di Lewis più duro dello ione argento, Ag+
- Gli ioni alcossido, RO, sono basi di Lewis più dure dei tioanioni, RS
- Lo ione rame(II), Cu2+, è un acido di Lewis più duro dello ione rame(I), Cu+
- L’anione azoto finale dello ione cianuro ambidentato, CN, è una base di Lewis più dura rispetto all’estremità dell’anione di carbonio più morbida, NC
- Lo ione enolato ambidentato ha un centro ossianione duro di base di Lewis mentre il centro carbanione è una base di Lewis più morbida ed è più nucleofilo
Questo tipo di analisi può essere molto utile per spiegare la selettività di reazione.
Per esempio, il β-propiolattone – un estere ciclico reattivo – è aperto ad anello da basi di Lewis nucleofile. L’attacco può avvenire in due posizioni e i nucleofili mostrano una regioselettività:
- I nucleofili più duri come lo ione alcossido, R-O, attaccano il carbonio acile (carbonile).
- I nucleofili più morbidi come lo ione cianuro, NC, e il tioanione, R-S, attaccano il carbonio β-alchile.
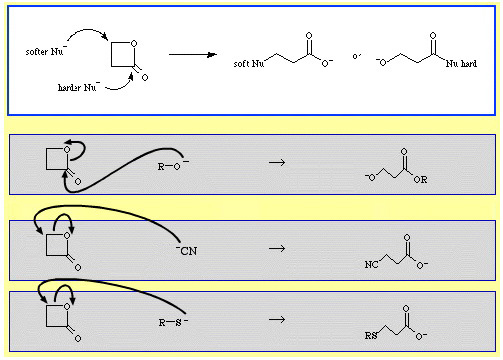
Ci sono parecchi esempi di selettività ambidestra nel database di chimica delle reazioni del The Chemical Thesaurus:
- Eliminazione vs Sostituzione con 1,2-Dicloroetano
- Eliminazione vs Sostituzione con 2-Bromopropano
- β-Propiolattone
- Ione cianuro
- Ioni enolato
- Ione nitrito
- Ione solfonato
- Ione tiocianato
Problemi, problemi, problemi…
Tuttavia, ci sono gravi problemi con l’analisi di Pearson. Mentre il modello HSAB di Pearson-Klopman non è esattamente sbagliato… semplifica grossolanamente la chimica di reazione conosciuta, come riconosciuto dallo stesso Ralph Pearson:
All’inizio del suo libro del 1997, Chemical Hardness, Wiley-VCH, pp 3-4, Ralph Pearson scrive candidamente:
“Con la nomenclatura è possibile fare una semplice dichiarazione generale:
“Gli acidi duri preferiscono coordinarsi alle basi dure, e gli acidi molli preferiscono coordinare le basi molli.”
“Questo è il principio degli acidi e delle basi dure e molli, o il principio HSAB.
“Si noti che questo principio è semplicemente una riaffermazione dell’evidenza sperimentale che ha portato a . È una dichiarazione condensata di una grande quantità di informazioni chimiche. Come tale potrebbe essere chiamato una legge. Ma questa etichetta sembra pretenziosa in vista della mancanza di una definizione quantitativa della durezza.
“HSAB non è una teoria, poiché non spiega le variazioni nella forza dei legami chimici. La parola ‘preferire’ nel principio HSAB implica un effetto piuttosto modesto.
“La morbidezza non è l’unico fattore che determina il valore di ΔH° nell’equazione:
A + :B → A:B
“Ci sono molti esempi di legami molto forti tra coppie non corrispondenti, come H2, formati da H+ duro e H morbido.
“H2O, OH e O2 sono tutti classificati come basi dure, ma ci sono grandi differenze nella loro forza di base, secondo qualsiasi criterio.”
RP
In effetti così… (!)
Un problema è che l’intera serie di interazioni e complessazioni hard-borderline-soft semplicemente non viene considerata usando l’analisi di Pearson. Guardate come è vuota la matrice di interazione HSAB:
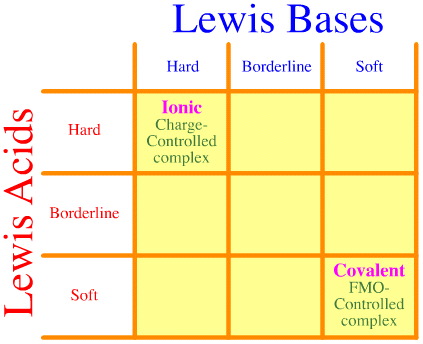
Il principio HSAB di Pearson afferma che “gli acidi duri preferiscono legarsi alle basi dure e che gli acidi morbidi preferiscono legarsi alle basi morbide”, il che può essere vero, ma non dice nulla sui complessi misti duri-morbidi.
Klopman afferma semplicemente in modo poco utile che tali interazioni sono “indefinite”!
Eppure, molti dei reagenti più interessanti della chimica di reazione organica e inorganica sono complessi “tesi” duro-morbidi:
| Idruro di sodio |
NaH
|
Na+
|
H
|
| Idruro di litio alluminio |
LiAlH4
|
Al3+
|
H
|
| Acetato di piombo (IV) |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Ioduro di metile |
CH3I
|
CH3+
|
I
|
| Litio metile |
CH3Li
|
Li+
|
CH3
|
| Trietiloxonium tetrafluoroborato |
+
|
CH3CH2+
|
:OR2
|
| Ferrocene |
Fe(Cp)2
|
Fe2+
|
|
|
Hard
|
Borderline
|
Soft
|
In confronto, la ricchezza della chimica delle reazioni conosciute nasce naturalmente nella matrice di interazione acido/base di Lewis, un principio centrale dell’analisi della chemiogenesi (ma rischiamo di andare avanti, vedi le prossime pagine qui & qui).
Ci sono due osservazioni/regole, ed entrambe riguardano gli array congenerici di specie isoelettroniche/isoreattive:
- Gli array congenerici si trovano sempre all’interno delle celle della matrice di interazione acido/base di Lewis, e non attraversano le celle.
- Le tendenze hard-to-soft si trovano all’interno delle matrici congeneriche, ma non si incrociano mai tra le matrici.
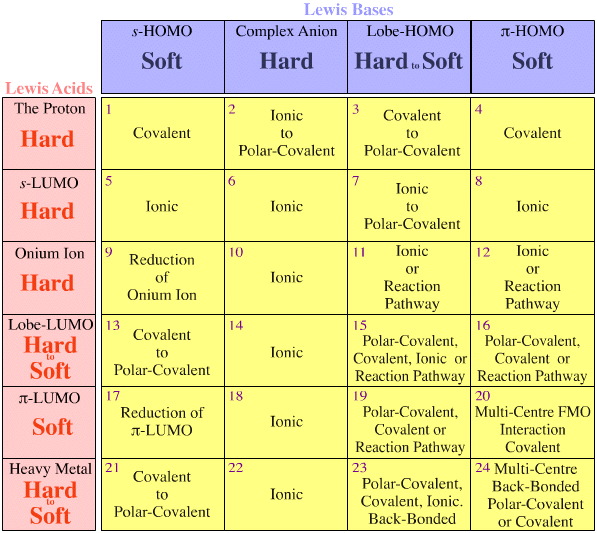
Regole di Fajans
L’analisi HSAB di Pearson-Klopman è anche in diretta contraddizione con le ben note “regole di Fajans” (sviluppate negli anni 1915-24), anche se nessun altro autore sembra aver affrontato questo problema fino ad oggi.
Il carattere ionico-covalente nei materiali binari metallo più non-metallo può essere calcolato usando l’equazione di Pauling, qui, ma la differenza di elettronegatività sottostima l’effetto della polarizzazione: la misura in cui un atomo distorce o polarizza la nuvola elettronica dell’altro.
Le regole di Fajan dicono:
- Un piccolo ione positivo è altamente polarizzante, favorisce la covalenza, e per un dato catione il carattere covalente aumenta man mano che l’anione diventa più grande.
- Grandi ioni negativi sono altamente polarizzanti, favoriscono la covalenza, e per un dato anione il carattere covalente aumenta man mano che il catione diventa più piccolo.
- Il carattere covalente aumenta con l’aumentare della carica ionica su entrambi gli ioni.
- La polarizzazione, e quindi la covalenza, è favorita se lo ione positivo non ha una configurazione di gas nobile. Questo è importante per cationi come: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Un esempio:
Considera il cloruro di berillio, BeCl2 rispetto agli altri cloruri alcalino terrosi: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Catione
|
Ionico
Radius |
Eneg.
|
% ionica del legame
a Cl- |
Bond & Materiale
Tipo |
|
Be2+
|
41
|
1.57
|
34
|
Covalente/Molecolare
|
|
Mg2+
|
86
|
1.31
|
42
|
Sale ionico
|
|
Ca2+
|
114
|
1.00
|
51
|
Sale ionico
|
|
Sr2+
|
132
|
0.95
|
52
|
Sale ionico
|
|
Ba2+
|
149
|
0.89
|
54
|
Sale ionico
|
Dati sul raggio ionico da elementi web
Il cloruro di berillio, BeCl2, è covalente: il materiale anidro è solubile in solventi organici, sublima (nel vuoto), e il materiale fuso è un povero conduttore di elettricità. MgCl2, CaCl2, SrCl2 e BaCl2 sono materiali ionici e i sali fusi sono eccellenti conduttori elettrici.
- Le regole di Fajans spiegano chiaramente questa chimica dicendo che lo ione Be2+, molto piccolo e molto carico, è in grado di polarizzare (distorcere) le nuvole di elettroni degli ioni cloruro relativamente grandi in legame covalente e quindi di dare una struttura molecolare.
- L’analisi HSAB di Pearson-Klopman afferma che lo ione berillio, essendo il più piccolo dei cationi metallici del gruppo II è anche il più duro. I sali dello ione berillio dovrebbero quindi esibire un legame estremo controllato dalla carica e dare origine a materiali ionici, ma non è così.
- L’analisi della chemiogenesi, qui, dice che i cationi del gruppo II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, costituiscono una serie congenerica di acidi di Lewis carichi s-LUMO, che le tendenze di comportamento lineare si trovano su questa serie.
Queste tendenze di comportamento lineare possono essere attribuite al comportamento ‘hard-soft’, se lo si desidera, tuttavia, i termini ‘hard’ e ‘soft’ possono essere usati solo rispetto alla serie congenerica in questione e i confronti ‘hard-soft’ non possono essere fatti rispetto ad altri acidi Lewis.
Quindi, cosa sta succedendo?
Il punto è che nessun parametro fisico è correlato alla durezza nell’insieme di specie scelte da Pearson. Questo crea ambiguità, come con la chimica organica dello ione fluoruro, qui, e la contraddizione con le regole di Fajans, sopra.
Il modello di Pearson non tiene conto della geometria FMO (le forme & fasi degli orbitali partecipanti). Per esempio, quanto sono simili gli acidi duri di Pearson:
H+ + BF3 CO2 Cs+ Cu2+ ?
Oppure, quanto sono simili le basi morbide di Pearson:
H R2S: H3C benzene?
Crucialmente per i chimici organici e dei gruppi principali, l’analisi HSAB dice poco/nulla sull’importante ione carbenio (carbocation) acido di Lewis, H3C+, o sul carbanione base di Lewis, H3C.
Affermazione in grassetto
Il continuum unidimensionale hard-borderline-soft dell’analisi di Pearson ha effettivamente l’effetto di offuscare molto del ricco, lineare (prevedibile) comportamento che può essere trovato nello spazio della chimica delle reazioni acido/base di Lewis.
La nuova analisi di chemogenesi presentata in questo libro web e supportata dalla chimica di reazione contenuta nel database The Chemical Thesaurus evita e spiega le insidie del tanto pubblicizzato approccio HSAB di Pearson.
Confronto dell’analisi HSAB “Top Down” con l’analisi Chemogenesis “Bottom Up”
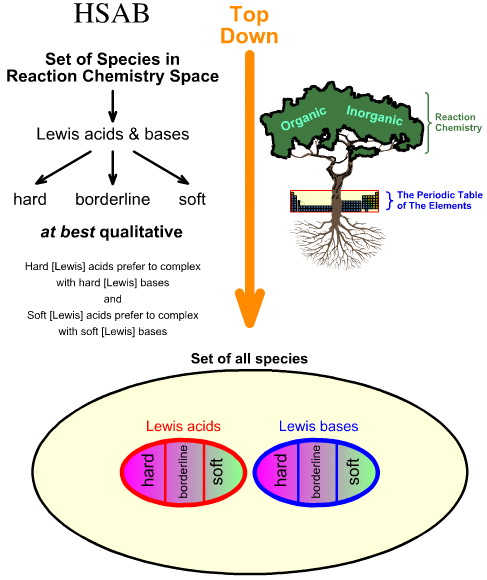
L’analisi Hard Soft Acid Base (HSAB) di Pearson è top down.
- Partendo da tutte le specie nello spazio chimico di reazione, un certo numero di specie importanti sono identificate come acidi e basi di Lewis.
- Gli acidi di Lewis e le basi di Lewis sono poi classificati come duri, borderline o morbidi usando l’osservazione empirica e il principio che: gli acidi di Lewis duri preferiscono complessare con basi di Lewis dure e gli acidi di Lewis morbidi preferiscono complessare con basi di Lewis morbide:
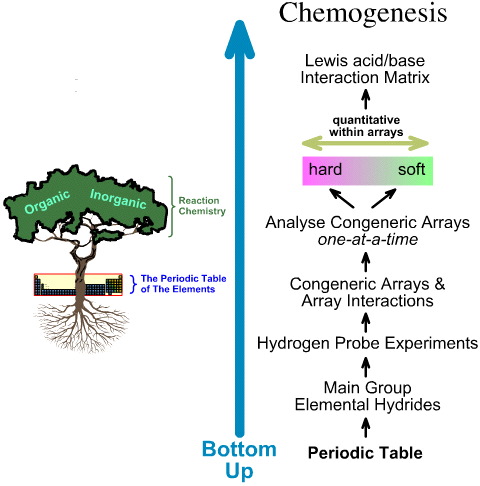
Al contrario, l’analisi della chemiogenesi è bottom up:
- Gli idruri elementari del gruppo principale sono sottoposti a 5 esperimenti di sonda idrogeno.
- Si studiano gli array generici e le interazioni degli array.
- Tendenze strutturali e di reattività lineari hard-to-soft sono identificate all’interno degli array, e si riconosce che non ci si può aspettare un comportamento lineare tra gli array.
- Gli acidi di Lewis e le basi di Lewis sono classificati dalle loro strutture elettroniche di Lewis e topologie FMO e sono organizzati in una matrice di interazione acido/base di Lewis, qui.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman e R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Anche qui.
Altra analisi post-Pearson
Il modello ECW è un modello semi-quantitativo che descrive e predice la forza delle interazioni acido/base Lewis. Inizialmente, il modello assegnava parametri elettrostatici (E) e covalenti (C) agli acidi e alle basi di Lewis. Questo è stato poi ampliato al modello ECW per coprire le reazioni che hanno un termine di energia costante, W, che descrive i processi che precedono l’interazione acido/base.
Nell’analisi originale di Drago & Wayland del 1965, è stata impiegata un’equazione a due termini in modo che ogni acido di Lewis sia caratterizzato dai termini EA e CA e ogni base di Lewis da EB e CB dove i parametri E e C si riferiscono ai contributi elettrostatici e covalenti alla forza dei legami che l’interazione acido/base formerà. (Questi parametri sono stati ottenuti empiricamente usando le entalpie per addotti che formano solo legami σ tra l’acido di Lewis e la base di Lewis e non hanno repulsione sterica:
-ΔH = EAEB + CACB
Nel modello ECW, un nuovo termine W è stato aggiunto all’equazione.
-ΔH = EAEB + CACB + W
dove il termine W rappresenta un’energia costante per la scissione di un acido o una base di Lewis dimerici.
Da An Overview of Lewis Basicity and Affinity Scales di Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
L’impossibilità di stabilire una scala universale di basicità di Lewis non impedisce la determinazione del comportamento quantitativo delle basi di Lewis, grazie a scale costruite contro particolari acidi di Lewis: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, e CH3NH3+. Queste scale comprendono importanti tipi di legami formati in un addotto acido-base di Lewis: il legame dativo, i legami idrogeno convenzionali e ionici, il legame alogeno e i legami catione-molecola per i cationi metallici dei gruppi 1, 7, 10, 11 e 13. Inoltre, anche se queste scale non sono generalmente interrelate, esistono relazioni famiglia-dipendenti che permettono di classificare, in un ordine piuttosto generale, le basi appartenenti a una data famiglia chimica, per esempio, la famiglia delle basi di ossigeno. Pertanto, lo scetticismo sull’utilità quantitativa del concetto di Lewis di acidi e basi non è più fondato.e:
La formazione di addotti acido-base di Lewis copre un’ampia varietà di processi di formazione del legame, dal debole legame di van der Waals in Ar—BF3 al forte legame dativo in H3N-BF3. Il termine “legame” può essere discutibile per gli addotti deboli. Queste specie debolmente legate sono generalmente prodotte in un fascio supersonico o in una matrice criogenica. Qui, siamo principalmente interessati dai complessi che possono essere osservati in una miscela a temperatura ambiente dell’acido di Lewis e della base di Lewis.In acqua, l’ordine delle costanti di complessazione degli ioni alogenuri con l’acido Fe3+ è F- > Cl- > Br- > I-, mentre con Hg2+, è I- > Br- > Cl- >F-. Questa inversione è spiegata dal principio di acido e base dura e morbida di Pearson.
La coordinazione di una serie di azine ai metalloceni è stata correlata alla scala di basicità dei legami a idrogeno delle azine.
Il calcolo ab initio della forza acida di Lewis degli alogenuri metallici covalenti nel vuoto usando l’anione fluoruro come base di Lewis di riferimento.
Un valore DN della trietilammina è stato stimato da una correlazione tra DN e lo spostamento chimico NMR del nucleo 23Na per soluzioni di sali di sodio in solventi basici. In seguito, la determinazione diretta ha dato un valore che era la metà del valore stimato.
 |
 |
 |
| Lewis & Teorie di Brønsted dell’acidità | Idruri elementari del gruppo principale |