- meta-synteesi
- Tietoa
- Verkkosivumme
- Verkkokirjan luvut
 |
 |
 |
Ralph Pearson esitteli Hard Soft Acid Base (HSAB) -periaatteensa 1960-luvun alussa, ja pyrki näin yhdistämään epäorgaanisen ja orgaanisen reaktiokemian. Uuden idean vaikutus oli välitön, mutta vuosien mittaan HSAB-periaate on kuitenkin jäänyt pikemminkin taka-alalle muiden samaan aikaan kehitettyjen lähestymistapojen, kuten frontier molecular orbital (FMO) -teorian ja molekyylimekaniikan, kukoistettua.
Tällä sivulla käsitellään Pearsonin lähestymistavan syvällisiä rajoituksia ja verrataan & vastakkain HSAB-periaate ja kemogeneesianalyysi, sellaisina kuin ne esitellään tässä verkkokirjassa.
Huomautus, tässä verkkokirjassa:
| Lewisin hapot ovat PUNAISIA | Lewisin emäkset ovat SINISIÄ |
- Irving-Williamsin stabiilisuussarja
- Ahrlandin A-tyypin, B-tyypin analyysi
- Railsbackin geokemiallinen analyysi
- Pearsonin HSAB-periaate (The Hard Soft Acid Base Principle)
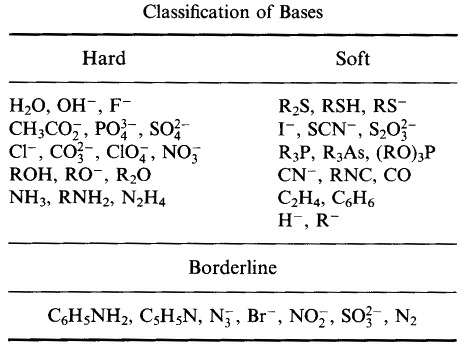
- Pearsonin HSAB-luokitusjärjestelmä, täältä:
- Jensen’s Review of the HSAB Principle
- Klopmanin FMO-analyysi
- Pearsonin ja Klopmanin ajatusten yhdistäminen
- Ho-paperi
- Organisten aineiden HSAB-periaate. & Pääryhmäkemistit
- ongelmia, ongelmia, ongelmia…
- Fajansin säännöt
- Mistä on siis kyse?
- Vertaamalla ”ylhäältä alaspäin suuntautuvaa” HSAB-analyysiä ”alhaalta ylöspäin suuntautuvaan” kemogeneesianalyysiin
- The HSAB Papers:
- Muut Pearsonin jälkeiset analyysit
Irving-Williamsin stabiilisuussarja
Irving-Williamsin stabiilisuussarjat (1953) huomauttivat siitä, että tietylle ligandille dipositiivisen metalli-ionin kompleksien stabiilisuus kasvaa:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Tiedettiin myös, että tietyt ligandit muodostivat stabiileimpia kompleksejaan metalli-ionien, kuten Al3+ kanssa, Ti4+ & Co3+ kun taas toiset muodostivat stabiileja komplekseja Ag+, Hg2+ & Pt2+
Ahrlandin A-tyypin, B-tyypin analyysi
Vuonna 1958 Ahrland et al. luokitteli metallikationit A-tyypin ja B-tyypin kationeiksi, joissa:
A-tyypin metallikationeja ovat:
- Alkalimetallikationit: Li+ – Cs+
- Alkalimetallien metallikationit: Be2+ – Ba2+
- Kevyempien siirtymämetallien kationit korkeammissa hapetusasteissa: B-tyypin metallikationit:
- Raskaammat siirtymämetallikationit alemmissa hapetusasteissa: Ti4+, Cr3+, Fe3+, Co3+
- Protonit, H+
B-tyypin metallikationit:
- Raskaammat siirtymämetallikationit alemmissa hapetusasteissa: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Ligandit, kemialliset yksiköt, jotka kompleksoituvat metallikationien kanssa, luokiteltiin A- tai B-tyypin kationeiksi sen mukaan, muodostavatko ne stabiilimpia komplekseja A-tyypin metallikationien vai B-tyypin metallikationien kanssa, tästä:
Ligandin taipumus kompleksoitua
A-tyypin metallien kanssaLigandin taipumus kompleksoitua
A-tyypin metallien kanssaLigandin taipumus B-tyypin metallien kanssaN >> P > As > Sb > Bi
O >> S > Se > Te
F >> Cl > Br > I
N << P > As > Sb > Bi
O << S ~ Se ~ Te
F < Cl < Br << I
Tästä analyysistä, voidaan johtaa empiirinen sääntö:
A-tyypin metallit sitoutuvat (kompleksoituvat) mieluummin A-tyypin ligandeihin
ja
B-tyypin metallit sitoutuvat (kompleksoituvat) mieluummin B-tyypin ligandeihin
Nämä empiiriset – kokeellisesti johdetut – säännöt kertovat meille, että A-tyypin metallit muodostavat todennäköisemmin oksideja, karbonaatteja, nitridejä ja fluorideja, kun taas B-tyypin metallit muodostavat todennäköisemmin fosfideja, sulfideja ja selinidejä.
Railsbackin geokemiallinen analyysi
”A-tyypin, B-tyypin” analyysillä on suuri taloudellinen merkitys, koska:
- Joitakin metalleja esiintyy luonnossa A-tyypin metalli + A-tyypin ligandimineraaleina, kuten karbonaatteina: MgCO3 ja CaCO3 sekä oksidit: Fe2O3 ja TiO2
- Kun taas toiset esiintyvät B-tyypin metalli + B-tyypin ligandimineraaleina, esimerkiksi sulfidimalmit: Tätä lähestymistapaa on menestyksekkäästi kehittänyt Bruce Railsback erinomaisella ja erittäin suositeltavalla ”Earth Scientist’s Periodic Table -verkkosivustollaan”.
Klikkaa kuvaa suurentaaksesi:
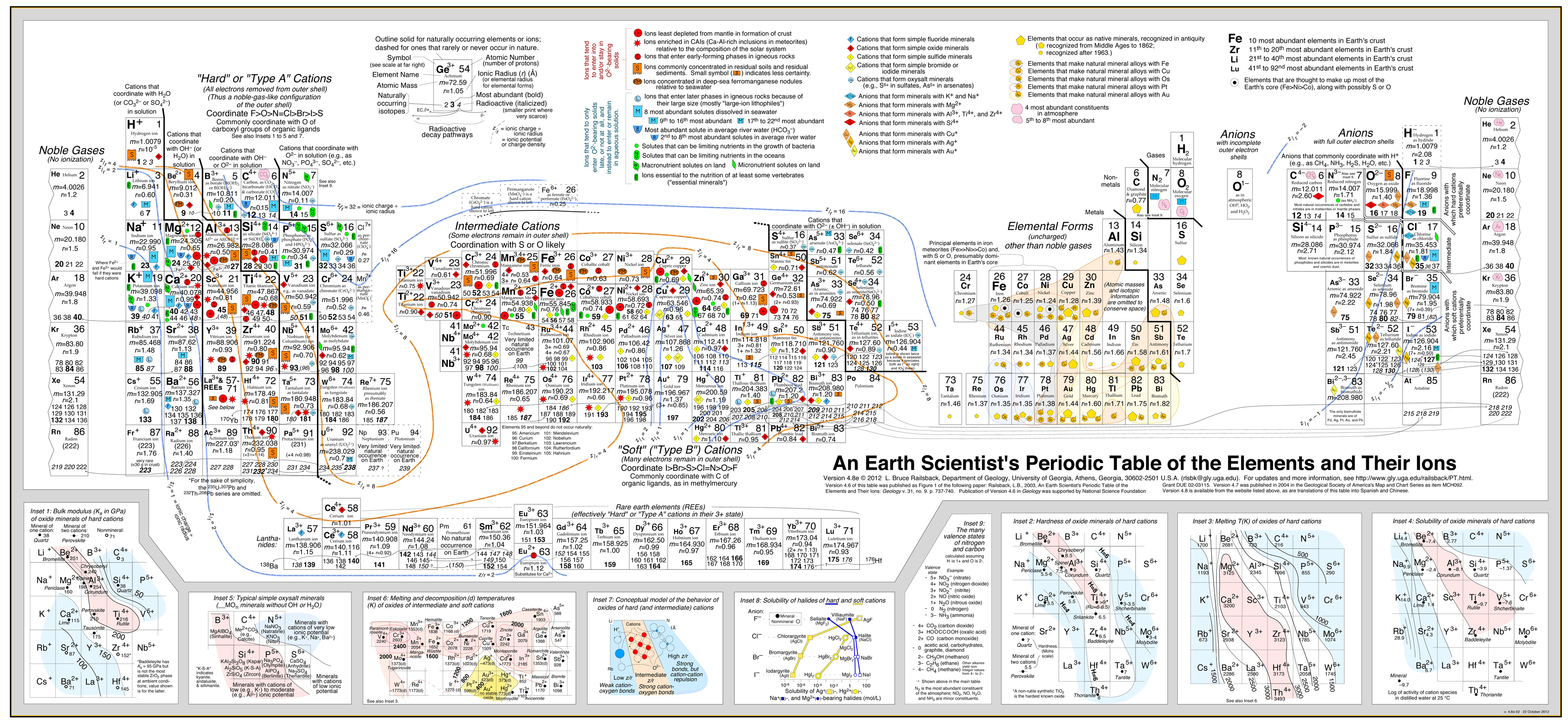
- Railsbackin analyysi käyttää käyttäytymisen ääriviivoja, jotka on asetettu jaksollisen järjestelmän päälle. .
- Katso artikkeli: A Synthesis of Systematic Mineralogy by Bruce Railsback, jossa kehitetään tätä analyysia.
Pearsonin HSAB-periaate (The Hard Soft Acid Base Principle)
Kuusikymmenluvulla Ralph Pearson laajensi huomattavasti A-tyypin ja B-tyypin logiikkaa selittämällä kationien ja ligandien erilaista kompleksoitumiskäyttäytymistä elektronipareja vastaanottavien Lewisin happojen ja elektronipareja luovuttavien Lewisin emästen avulla:
Lewishappo + Lewis-emäs → Lewishappo/emäs-kompleksi
Pearson luokitteli Lewishapot ja Lewis-emäkset koviksi, rajallisiksi tai pehmeiksi.
Pearsonin kova pehmeä happoemäs (HSAB) -periaatteen mukaan:
Kovat hapot sitoutuvat mieluummin koviin emäksiin
ja
Pehmeät hapot sitoutuvat mieluummin pehmeisiin emäksiin
Ensimmäisellä silmäyksellä HSAB-analyysi vaikuttaa melko samankaltaiselta kuin A- ja B-tyypin järjestelmä.
Pearson kuitenkin luokitteli hyvin laajan joukon atomeja, ioneja, molekyylejä ja molekyyli-ioneja koviksi, rajallisiksi tai pehmeiksi, mikä siirsi analyysin perinteisestä metalli/ligandi epäorgaanisesta kemiasta orgaanisen kemian alueelle – ja yhdisti sen siihen.
Pearsonin HSAB-luokitusjärjestelmä, täältä:
Pearson’s Hard Lewis Acids (Chemical Thesauruksesta), täältä, ja congeneric array -tietokannasta, täältä:
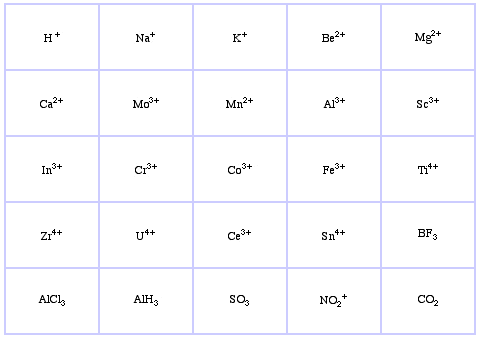
Pearsonin Borderline Lewis Acids, täältä ja täältä:
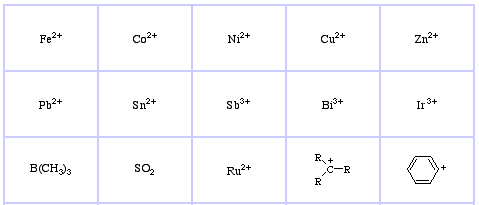
Pearsonin pehmeät Lewis-hapot, täällä ja täällä:
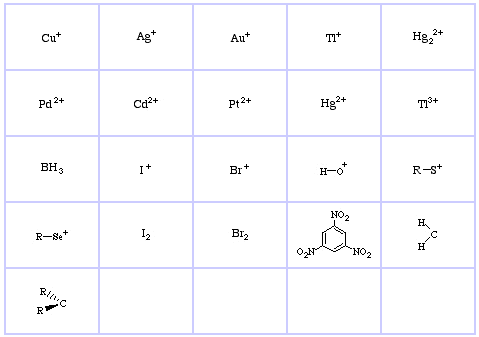
Pearsonin kovat Lewis-emäkset (The Chemical Thesaurus -tietokannasta), täältä, ja congeneric array -tietokannasta, täältä:
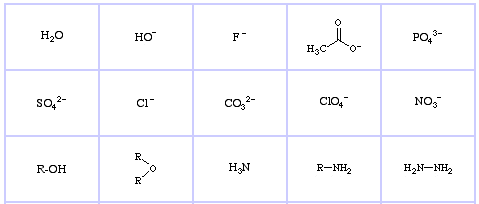
Pearson’s Borderline Lewis Bases, täällä, ja täällä:

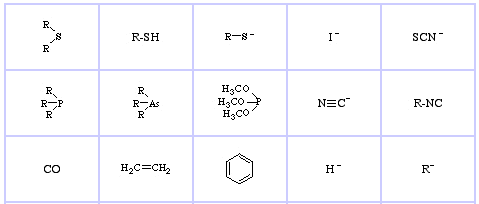
Pearson’s Soft Lewis Bases, täällä, ja täällä:
Jensen’s Review of the HSAB Principle
William (Bill) Jensen esitti kolme artikkelia ACS:n lehdessä Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Osa I maaliskuu s. 11-14; osa II huhtikuu s. 13-18; osa III toukokuu s. 14-18. Osa III käsittelee Pearsonin HSAB-analyysia.
Yhdistetty artikkeli – joka on sekä erinomainen että yksityiskohtainen – on saatavilla Billin verkkotilasta (ja tiedoston klooni on ladattavissa tältä verkkosivustolta).Klopmanin FMO-analyysi
G. Klopman yritti vuonna 1968 kvantifioida Pearsonin HSAB-periaatteen FMO-teorian (frontier molecular orbital theory) avulla, kuten muualla tässä verkkokirjassa on käsitelty, tässä, tällä yhtälöllä:
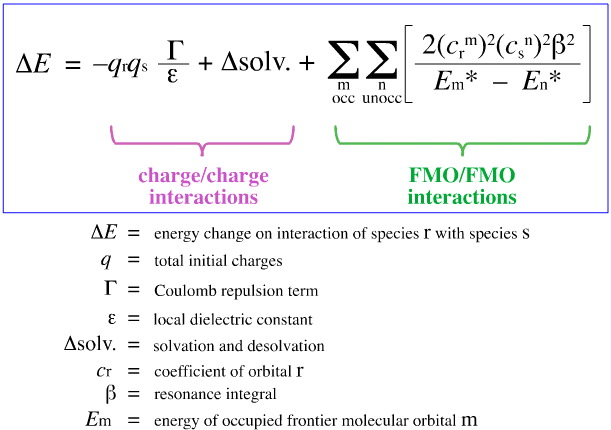
Klopman ehdotti, että:
Kovat hapot sitoutuvat koviin emäksiin muodostaen varausohjattuja (ionisia) komplekseja. Tällaisia vuorovaikutuksia hallitsevat vuorovaikutuksessa olevien lajien +/ -varaukset.
ja
Pehmeät hapot sitoutuvat pehmeisiin emäksiin antaen FMO-ohjattuja komplekseja. Näitä vuorovaikutuksia hallitsevat osallistuvien rajamolekyyliorbitaalien (frontier molecular orbitals, FMO), korkeimmin miehitetyn molekyyliorbitaalin (highest occupied molecular orbital, HOMO) ja alhaisimman miehittämättömän molekyyliorbitaalin (lowest unoccupied molecular orbital, LUMO) energiat.
Lue lisää muualta Chemogenesis-verkkokirjasta, täältä, tai katso Ian Flemingin Organic Chemistry and FMO theory täältä, jossa näitä ajatuksia kehitellään jonkin verran.
Ylläolevan analyysin avulla erotetaan toisistaan ja kvantifioidaan varauksen ja FMO:n kontrolloiman Lewisin happo/emäs-kompleksin muodostumiseen vaikuttavat osatekijät, mikä on ratkaisevaa kehitystä.
Pearsonin ja Klopmanin ajatusten yhdistäminen
Kovat Lewis-hapot:
Atomikeskukset, joiden ionisäde on pieni
Korkea positiivinen varaus
Lajit eivät sisällä elektronipareja valenssikuorissaan
Alhainen elektroniaffiniteetti
Todennäköisesti voimakkaasti solvatoituvia
Korkea energia LUMOPehmeät Lewis-hapot:
Suuri säde
Matala tai osittainen δ+ positiivinen varaus
Elektroniparit valenssikuorissaan
Helposti polarisoituvat ja hapettuvat
Matalaenergiaiset LUMO:t, mutta suurisuuntaiset LUMO-kertoimetKovat Lewis-emäkset:
Pienet, vahvasti solvoituneet, elektronegatiiviset atomi-keskukset: 3.0-4.0
Lajit ovat heikosti polarisoituvia
Vaikea hapettaa
Suuri energia HOMOPehmeät Lewis-emäkset:
Suuret atomikeskukset, joiden elektronegatiivisuus on keskinkertainen: 2.5-3.0
Helppo polarisoitua ja hapettaa
Matalaenergiaiset HOMO:t, mutta suuri suuruusluokkaiset HOMO-kertoimetRajalajeilla on väliominaisuuksia.
Klopmanin paperissa on tarkennus, jossa sanotaan, että: ei ole välttämätöntä, että lajeilla on kaikki ominaisuudet.
Ho-paperi
Pearson ehdotti, että jaksollisen järjestelmän ryhmien 15, 16 ja 17 joukosta löytyisi kova-pehmeä-suuntauksia. Vuonna 1975 ideaa laajensi Tse Lok Ho, joka käytti realistisia kemiallisia lajeja ja keksi termin congeneric (samaan perheeseen kuuluvat), jolloin congeneric-lajit ovat isoelektronisia (niillä on sama ulkokuoren Lewis-rakenne).
 BiSbAsPN
BiSbAsPNPearson, R.G., Kovat ja pehmeät hapot ja emäkset, JACS 85, 3533-3539 (1963)
TeSSOOIBrClFR3Sb:R3As:R3P:R3N:Ho, T.-L., Kovat pehmeät hapot ja emäkset (HSAB) -periaate ja orgaaninen kemia Chemistry Reviews 75, 1-20 (1975) H3C-H2N-HO-F-I-Br-Cl-F-H3C+(CH3)H2C+(CH3)2HC+(CH3)3C+Organisten aineiden HSAB-periaate. & Pääryhmäkemistit
Meidän tarkoituksiimme pääryhmä- ja orgaanisessa reaktiokemiassa Pearsonin lähestymistapa onnistuu parhaiten, kun vertaillaan lajipareja:
- Natriumioni, Na+, on kovempi Lewis-happo kuin hopeaioni, Ag+
- Alkoksidi-ionit, RO, ovat kovempia Lewis-baseja kuin tioanionit, RS
- Kupari(II)-ioni, Cu2+, on kovempi Lewis-happo kuin kupari(I)-ioni, Cu+
- Ambidentaatti-syanidi-ionin typpianionin pää, CN, on kovempi Lewis-emäs kuin pehmeämpi hiilianionin pää, NC
- Ambidentaattienolaatti- enolaatti-ionilla, on kova oksianionin Lewis-emäs-keskus, kun taas karbanionin keskus on pehmeämpi Lewis-emäs ja nukleofiilisempi
Tämmöinen analyysi voi olla erittäin hyödyllinen selitettäessä reaktion selektiivisyyttä.
Esimerkiksi β-propiolaktoni – reaktiivinen syklinen esteri – avataan rengas nukleofiilisten Lewis-emästen avulla. Hyökkäys voi tapahtua kahdessa kohdassa, ja nukleofiilit osoittavat regioselektiivisyyttä:
- Kovemmat nukleofiilit, kuten alkoksidi-ioni, R-O, hyökkäävät asyyli- (karbonyyli-) hiileen.
- Pehmeämmät nukleofiilit, kuten syanidi-ioni, NC, ja tioanioni, R-S, hyökkäävät β-alkyylihiileen.
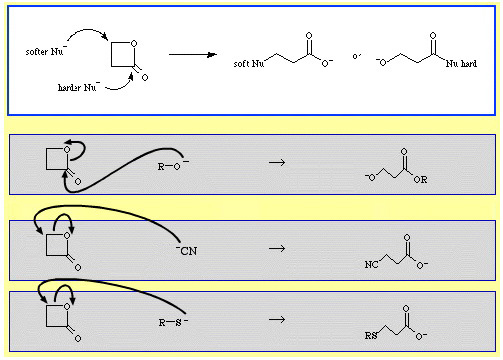
The Chemical Thesaurus -reaktiokemian tietokannassa on melko paljon esimerkkejä ambidenttiselektiivisyydestä:
- Eliminaatio vs. substituutio 1:llä,2-dikloorietaani
- Eliminaatio vs. substituutio 2-bromipropaanilla
- β-Propiolaktoni
- Syanidi-ioni
- Enolaatti-ionit
- Nitriitti-ioni
- Sulfinaatti-ioni
- Tiosyanaatti-ioni
ongelmia, ongelmia, ongelmia…
Pearsonin analyysissä on kuitenkin vakavia ongelmia. Vaikka Pearson-Klopmanin HSAB-malli ei olekaan aivan väärässä… se kuitenkin yksinkertaistaa törkeästi tunnettua reaktiokemiaa, kuten Ralph Pearson itse myöntää:
Vuonna 1997 ilmestyneen kirjansa, Chemical Hardness, Wiley-VCH, s. 3-4, alussa Ralph Pearson kirjoittaa avoimesti:
”Nomenklatuurin avulla on mahdollista tehdä yksinkertainen, yleinen väite:
”Kovat hapot koordinoivat mieluiten kovia emäksiä, ja pehmeät hapot koordinoivat mieluiten pehmeitä emäksiä.”
”Tämä on kovien ja pehmeiden happojen ja emästen periaate eli HSAB-periaate.
”Huomaa, että tämä periaate on vain uudelleen muotoilu kokeellisesta todistusaineistosta, joka johti . Se on tiivistetty lausunto hyvin suuresta määrästä kemiallista tietoa. Sellaisena sitä voisi kutsua laiksi. Mutta tämä nimitys tuntuu teennäiseltä, kun otetaan huomioon kovuuden määrällisen määritelmän puuttuminen.
”HSAB ei ole teoria, koska se ei selitä kemiallisten sidosten lujuuden vaihtelua. Sana ’prefer’ HSAB-periaatteessa viittaa melko vaatimattomaan vaikutukseen.
”Pehmeys ei ole ainoa tekijä, joka määrää ΔH°:n arvon yhtälössä:
A + :B → A:B
”On olemassa monia esimerkkejä erittäin vahvoista sidoksista epäsopivien parien välillä, kuten H2, joka muodostuu kovasta H+:sta ja pehmeästä H:sta.
”H2O, OH ja O2 luokitellaan kaikki koviksi emäksiksi, mutta niiden emäslujuudessa on suuria eroja, millä tahansa kriteerillä mitattuna.”
RP
Todellakin niin… (!)
Yksi ongelmaksi muodostuu se, että Pearsonin analyysin avulla ei yksinkertaisesti oteta huomioon kaikkia kovan rajan ja pehmeän vuorovaikutusten ja kompleksitusten kokonaisuutta. Katsokaa, kuinka tyhjä HSAB:n vuorovaikutusmatriisi on:
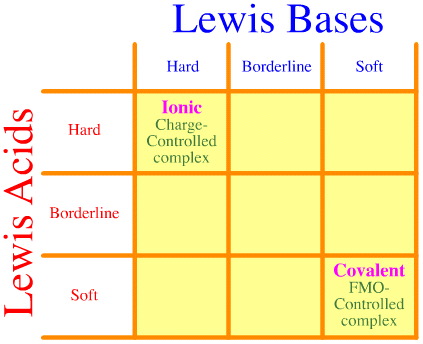
Pearsonin HSAB-periaatteessa sanotaan, että ”kovat hapot sitoutuvat mieluummin koviin emäksiin ja pehmeät hapot mieluummin pehmeisiin emäksiin”, mikä voi olla totta, mutta se ei sano mitään sekamuotoisista kova-pehmeä-komplekseista.
Klopman vain toteaa hyvin epäedullisesti, että tällaiset vuorovaikutukset ovat ”määrittelemättömiä!”
Siltikin monet mielenkiintoisimmista orgaanisen- ja epäorgaanisen reaktiokemian reagoinnin reagoivista reagenssikemikaaleista ovat kova-pehmeä- ”jännitteisiä”-komplekseja:
Natriumhydridi NaHNa+HLithiumalumiinihydridi LiAlH4Al3+HLyijy(IV) asetaatti Pb(AcO)4Pb4+AcOMetyylijodidi CH3ICH3+IMetyylilithium CH3Li.
Li+CH3Trietyloxoniumtetrafluoroboraatti +CH3CH2+:OR2Ferrokseeni Fe(Cp)2Fe2+KovarajapehmeäVertaillen, tunnetun reaktiokemian rikkaus syntyy luonnollisesti Lewisin happo/emäs-vuorovaikutusmatriisissa, joka on kemogeneesianalyysin keskeinen lähtökohta (mutta olemme vaarassa mennä asioiden edelle, ks. seuraavat sivut täällä & täällä).
On kaksi havaintoa/sääntöä, ja molemmat koskevat isoelektronisten/isoreaktiivisten lajien kongeneerisiä matriiseja:
- Kongeneeriset matriisit löytyvät aina Lewisin happo/emäs-vuorovaikutusmatriisin solujen sisältä, eivätkä soluja ylittäen.
- Kovasta pehmeään suuntauksia esiintyy kongeneeristen matriisien sisällä, mutta ne eivät koskaan risteä matriisien välillä.
Fajansin säännöt
Pearson-Klopmanin HSAB-analyysi on myös suorassa ristiriidassa tunnettuihin ”Fajansin sääntöihin” (kehitetty vuosina 1915-24) nähden, vaikka yksikään muu kirjoittaja ei näytä tähän mennessä käsitelleen tätä asiaa.
Ionis-kovalenttinen luonne metalli plus ei-metalli kaksoismateriaaleissa voidaan laskea Paulingin yhtälön avulla, tässä, mutta elektronegatiivisuusero aliarvioi polarisaation vaikutusta: sitä, missä määrin yksi atomi vääristää tai polarisoi toisen atomin elektronipilveä.
Fajansin säännöt sanovat:
- Pieni positiivinen ioni on voimakkaasti polarisoituva, suosii kovalenssia, ja tietylle kationille kovalenttinen luonne kasvaa anionin kasvaessa suuremmaksi.
- Suuret negatiiviset ionit ovat voimakkaasti polarisoituvia, suosivat kovalenssia, ja tietylle anionille kovalenttinen luonne kasvaa kationin kasvaessa.
- Kovalenttinen luonne kasvaa jommankumman ionin ionivarauksen kasvaessa.
- Polarisaatiota ja siten kovalenttisuutta suosii, jos positiivisella ionilla ei ole jalokaasukonfiguraatiota. Tämä on tärkeää kationeille, kuten: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Esimerkki:
Katsotaan berylliumkloridia, BeCl2 verrattuna muihin maa-alkaliklorideihin: MgCl2, CaCl2, SrCl2, & BaCl2:
KationIoninen
SädeEneg.5734Kovalenttinen/molekulaarinenMg2+861.3142Ioninen suolaCa2+1141.0051Ioninen suolaSr2+1320.9552Ioninen suolaBa2+1490.8954IonisuolaIonisädetiedot web-alkuaineista
Berylliumkloridi, BeCl2, on kovalenttinen: vedetön aine liukenee orgaanisiin liuottimiin, se sublimisoituu (tyhjiössä) ja sula aine on huono sähkönjohdin. MgCl2, CaCl2, SrCl2 ja BaCl2 ovat ionisia aineita, ja sulatetut suolat ovat erinomaisia sähkönjohtimia.
- Fajansin säännöt selittävät tämän kemian selkeästi sanomalla, että hyvin pieni, vahvasti varautunut Be2+-ioni pystyy polarisoimaan (vääristämään) verrattain suurten kloridi-ionien elektronipilvet kovalenttisiksi sidoksiksi ja näin ollen saamaan aikaan molekyylirakenteen.
- Pearson-Klopmanin HSAB-analyysin mukaan berylliumioni, joka on II ryhmän metallikationeista pienin, on myös kovin. Berylliumionisuoloissa pitäisi siis esiintyä äärimmäistä varauksen hallittua sidosta ja niistä pitäisi syntyä ionisia materiaaleja, mutta näin ei tapahdu.
- Kemogeneesianalyysi, tässä, sanoo, että ryhmän II kationit: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, muodostavat samankaltaisen sarjan varattuja s-LUMO-Lewishappoja, että lineaariset käyttäytymissuunnat löytyvät tästä sarjasta.
Näitä lineaarisen käyttäytymisen trendejä voidaan haluttaessa pitää ”kovana-pehmeänä” käyttäytymisenä, mutta termejä ”kova” ja ”pehmeä” voidaan käyttää vain kyseisen samankaltaisen sarjan suhteen, eikä ”kovaa-pehmeää” vertailua voida tehdä muiden Lewishappojen suhteen.
Mistä on siis kyse?
Pointtina on, että mikään fysikaalinen parametri ei korreloi kovuuden kanssa Pearsonin valitsemassa lajijoukossa. Tämä aiheuttaa epäselvyyksiä, kuten fluoridi-ionin orgaanisen kemian kanssa, tässä, ja ristiriitaa Fajansin sääntöjen kanssa, edellä.
Pearsonin malli ei ota huomioon FMO-geometriaa (osallistuvien orbitaalien muodot & vaiheet). Kuinka samanlaisia ovat esimerkiksi Pearsonin kovat hapot:
H+ + BF3 CO2 Cs+ Cu2+ ?
Vai kuinka samanlaisia ovat Pearsonin pehmeät emäkset:
H R2S: H3C bentseeni ?
Organisten ja pääryhmäkemistien kannalta ratkaisevaa on, että HSAB-analyysi ei sano juuri mitään tärkeästä karbeniumionin (karbokationin) Lewis-haposta, H3C+, tai karbanionin Lewis emäksestä, H3C.
Kylläinen väite
Pearsonin analyysin yksiulotteinen kova-rajainen-pehmeä-jatkuvuus itseasiassa vaikuttaa niin, että se hämärtää suurelta osin rikkaan lineaarisen (ennustettavan) käyttäytymisen, joka on löydettävissä Lewis-happojen/emästen reaktioavaruudesta kemiaa varten.
Uusi kemogeneesianalyysi, sellaisena kuin se esitetään tässä verkkokirjassa ja jota tukee The Chemical Thesaurus -tietokannassa oleva reaktiokemia, välttää ja selittää Pearsonin paljon hypetetyn HSAB-lähestymistavan sudenkuopat.
Vertaamalla ”ylhäältä alaspäin suuntautuvaa” HSAB-analyysiä ”alhaalta ylöspäin suuntautuvaan” kemogeneesianalyysiin
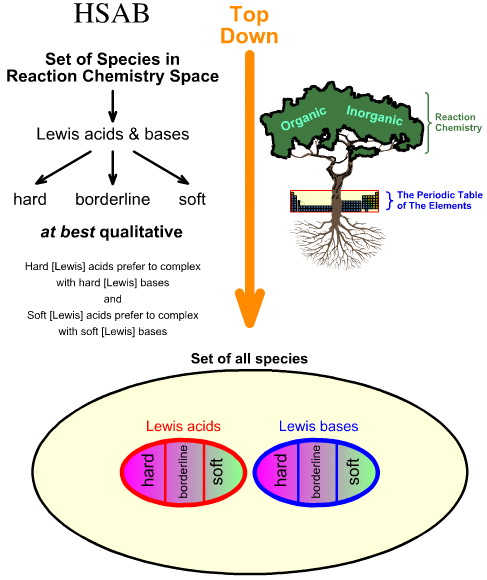
Pearsonin kova-pehmeä happoemäs-analyysi (Hard Soft Acid Base (HSAB) -analyysi) on ylhäältä alaspäin.
- Alkaen kaikista reaktiokemia-avaruuden lajeista, joukko tärkeitä lajeja tunnistetaan Lewis-hapoiksi ja Lewis-baseiksi.
- Lewishapot ja -emäkset luokitellaan sitten koviksi, rajallisiksi tai pehmeiksi käyttäen empiiristä havaintoa ja periaatetta, jonka mukaan: kovat Lewishapot kompleksoituvat mieluummin kovien Lewis-emästen kanssa ja pehmeät Lewishapot kompleksoituvat mieluummin pehmeiden Lewis-emästen kanssa:
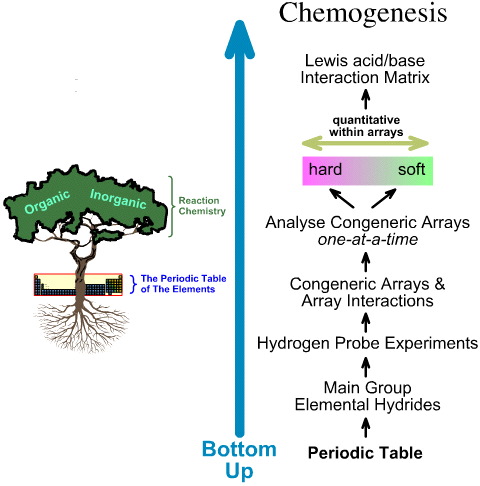
Kemogeneesianalyysi sen sijaan on alhaalta ylöspäin suuntautuva:
- Pääryhmään kuuluvien alkuainehydrideille tehdään 5 vetykeihdytinkoetta.
- Tutkitaan geneerisiä joukkoja ja joukkovuorovaikutuksia.
- Lineaariset kovasta pehmeään -rakenne- ja reaktiivisuustrendit tunnistetaan joukkojen sisällä, ja tunnustetaan, että lineaarista käyttäytymistä ei voida odottaa joukkojen välillä.
- Lewishapot ja -emäkset luokitellaan Lewisin elektronirakenteiden ja FMO-topologioiden mukaan ja järjestetään Lewishappo/emäs-vuorovaikutusmatriisiin, tässä.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman ja R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Katso myös täältä.
Muut Pearsonin jälkeiset analyysit
EcW-malli on puolikvantitatiivinen malli, joka kuvaa ja ennustaa Lewisin happo/emäs-vuorovaikutusten voimakkuutta. Alun perin malli osoitti Lewis-hapoille ja -emäksille sähköstaattiset (E) ja kovalenttiset (C) parametrit. Myöhemmin tämä laajennettiin ECW-malliin kattamaan reaktiot, joissa on vakioenergiatermi W, joka kuvaa happo-/emäsvuorovaikutusta edeltäviä prosesseja.
Drago & Waylandin alkuperäisessä vuoden 1965 analyysissä käytettiin kahden termin yhtälöä siten, että kutakin Lewishappoa luonnehditaan EA- ja CA-termeillä ja kutakin Lewis-emästä EB- ja CB-termeillä, joissa E- ja C-parametrit viittaavat sähköstaattiseen ja kovalenttiseen osuuteen niiden sidosten lujuudesta, jotka happo/emäs-vuorovaikutus muodostaa. (Tämä on kuin Klopmanin analyysi edellä.) Nämä parametrit saatiin empiirisesti käyttämällä entalpioita adduktioille, jotka muodostavat vain σ-sidoksia Lewishapon ja Lewis-emäksen välille ja joilla ei ole steeristä repulsiota:
-ΔH = EAEB + CACB
ECW-mallissa yhtälöön lisättiin uusi termi W.
-ΔH = EAEB + CACB + W
jossa termi W edustaa vakioenergiaa dimeerisen Lewishapon tai Lewis-emäksen pilkkoutumiselle.
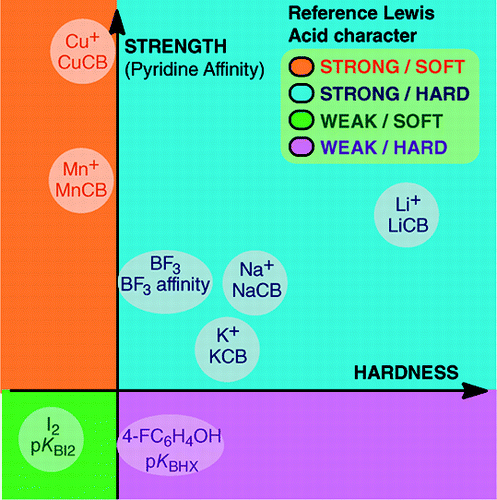
Vasta An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
Yleismaailmallisen Lewis-emäksisyyden asteikon luomisen mahdottomuus ei estä määrittelemästä Lewis-emästen kvantitatiivista käyttäytymistä, kiitos tiettyjen Lewis-emäksisten happojen suhteen rakennettujen asteikkojen: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ ja CH3NH3+. Nämä asteikot kattavat Lewisin happo-emäs-adduktissa muodostuvat tärkeät sidostyypit: datiivisidos, tavanomaiset ja ioniset vetysidokset, halogeenisidos ja kationi-molekyylisidokset ryhmien 1, 7, 10, 11 ja 13 metallikationeille. Vaikka nämä asteikot eivät yleensä liity toisiinsa, on olemassa perheestä riippuvaisia suhteita, jotka mahdollistavat tiettyyn kemialliseen perheeseen, esimerkiksi happiperäisten emästen perheeseen, kuuluvien emästen asettamisen melko yleiseen järjestykseen. Näin ollen skeptisyys happojen ja emästen Lewis-konseptin kvantitatiivista käyttökelpoisuutta kohtaan ei ole enää perusteltua.ja:
Lewisin happo-emäsadduktien muodostuminen kattaa monenlaisia sidoksia muodostavia prosesseja Ar—BF3:n heikosta van der Waalsin sidoksesta H3N-BF3:n vahvaan datiivisidokseen. Termi ”sidos” voi olla vastenmielinen heikkojen adduktien osalta. Nämä heikosti sidoksissa olevat lajit tuotetaan yleensä yliäänisäteessä tai kryogeenisessä matriisissa. Tässä olemme pääasiassa kiinnostuneita komplekseista, joita voidaan havaita huoneenlämpötilassa Lewishapon ja Lewis-emäksen seoksessa.Vedessä halogenidi-ionien kompleksoitumisvakioiden järjestys hapon Fe3+ kanssa on F- > Cl- > Br- > I-, kun taas Hg2+:n kanssa se on I- > Br- > Cl- >F-. Tämä kääntyminen selittyy Pearsonin kovan ja pehmeän hapon ja emäksen periaatteella.
Atsiinisarjan koordinaatio metalloseeneihin on korreloitu atsiinien vetysidosten emäksisyysasteikon kanssa.
Kovalenttisten metallihalogenidien Lewis-happovoiman ab initio -laskenta tyhjiössä käyttäen referenssi-Lewis-emäksinä fluoridi-anionia.
Trietyyliamiinin DN-arvo arvioitiin DN:n ja 23Na-ytimen NMR-kemiallisen siirtymän välisen korrelaation perusteella natriumsuolojen liuoksille emäksisissä liuottimissa. Myöhemmin suora määritys antoi arvon, joka oli puolet arvioidusta arvosta.



Lewis & Brønstedin happamuusteoriat Pääryhmän alkuainehydridit .