- meta-Synthese
- Über
- Unsere Websites
- Web Buchkapitel
 |
 |
 |
Ralph Pearson führte Anfang der sechziger Jahre sein Hard Soft Acid Base (HSAB) Prinzip ein, und versuchte damit, die anorganische und organische Reaktionschemie zu vereinen. Die Wirkung der neuen Idee war unmittelbar, doch im Laufe der Jahre ist das HSAB-Prinzip eher auf der Strecke geblieben, während andere zur gleichen Zeit entwickelte Ansätze wie die Theorie der Grenzmolekülorbitale (FMO) und die Molekularmechanik ihre Blütezeit erlebten.
Diese Seite erörtert die tiefgreifenden Einschränkungen des Pearson-Ansatzes und vergleicht & das HSAB-Prinzip mit der Chemogenese-Analyse, wie sie in diesem Webbuch vorgestellt wird.
Hinweis, in diesem Webbuch:
| Lewis-Säuren sind ROT | Lewis-Basen sind BLAU |
- Irving-Williams-Stabilitätsreihe
- Ahrland’s Type A, Type B Analysis
- Railsbacks geochemische Analyse
- Pearsons HSAB-Prinzip (Das Hard-Soft-Acid-Base-Prinzip)
- Pearson’s HSAB Classification System, von hier:
- Jensen’s Review of the HSAB Principle
- Klopmans FMO-Analyse
- Kombination der Ideen von Pearson und Klopman
- Das Ho-Papier
- Das HSAB-Prinzip für organische & Hauptgruppenchemiker
- Probleme, Probleme, Probleme…
- Fajans‘ Regeln
- Was ist also los?
- Vergleich der „Top Down“-HSAB-Analyse mit der „Bottom Up“-Chemogenese-Analyse
- Die HSAB Papers:
- Andere Post-Pearson-Analysen
Irving-Williams-Stabilitätsreihe
Die Irving-Williams-Stabilitätsreihe (1953) wies darauf hin, dass für einen bestimmten Liganden die Stabilität von dipositiven Metallionenkomplexen zunimmt:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Es war auch bekannt, dass bestimmte Liganden ihre stabilsten Komplexe mit Metallionen wie Al3+ bilden, Ti4+ & Co3+ bilden, während andere stabile Komplexe mit Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
Im Jahr 1958 klassifizierten Ahrland et al. klassifizierten Metallkationen als Typ A und Typ B, wobei:
Typ A Metallkationen umfassen:
- Alkalimetallkationen: Li+ bis Cs+
- Erdalkalimetallkationen: Be2+ bis Ba2+
- Leichtere Übergangsmetallkationen in höheren Oxidationsstufen: Ti4+, Cr3+, Fe3+, Co3+
- Das Proton, H+
Zu den Metallkationen des Typs B gehören:
- Schwere Übergangsmetallkationen in niedrigeren Oxidationsstufen: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Liganden, chemische Einheiten, die mit Metallkationen einen Komplex bilden, wurden als Typ A oder Typ B klassifiziert, je nachdem, ob sie stabilere Komplexe mit Metallkationen vom Typ A oder vom Typ B bilden:
|
Tendenz des Liganden zur Komplexbildung
mit Metallen vom Typ A |
Tendenz des Liganden zur Komplexen
mit Typ-B-Metallen |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Aus dieser Analyse, lässt sich eine empirische Regel ableiten:
Metalle des Typs A binden (komplexieren) bevorzugt an Liganden des Typs A
und
Metalle des Typs B binden (komplexieren) bevorzugt an Liganden des Typs B
Diese empirischen – experimentell abgeleiteten – Regeln sagen uns, dass Metalle des Typs A eher Oxide bilden, Carbonate, Nitride und Fluoride bilden, während Metalle vom Typ B eher Phosphide, Sulfide und Selinide bilden.
Railsbacks geochemische Analyse
Die „Typ A, Typ B“-Analyse ist von großer wirtschaftlicher Bedeutung, weil:
- Einige Metalle kommen in der Natur als Typ A-Metall + Typ A-Ligandenmineralien vor, wie z. B. Karbonate: MgCO3 und CaCO3 und Oxide: Fe2O3 und TiO2
- Während andere als Typ B Metall + Typ B Ligand Minerale gefunden werden, zum Beispiel die Sulfiderze: PbS, CdS, NiS usw.
Dieser Ansatz wurde sehr erfolgreich von Bruce Railsback mit seiner ausgezeichneten und sehr empfehlenswerten „Earth Scientist’s Periodic Table website“ entwickelt.
Klicken Sie auf das Bild, um es zu vergrößern:
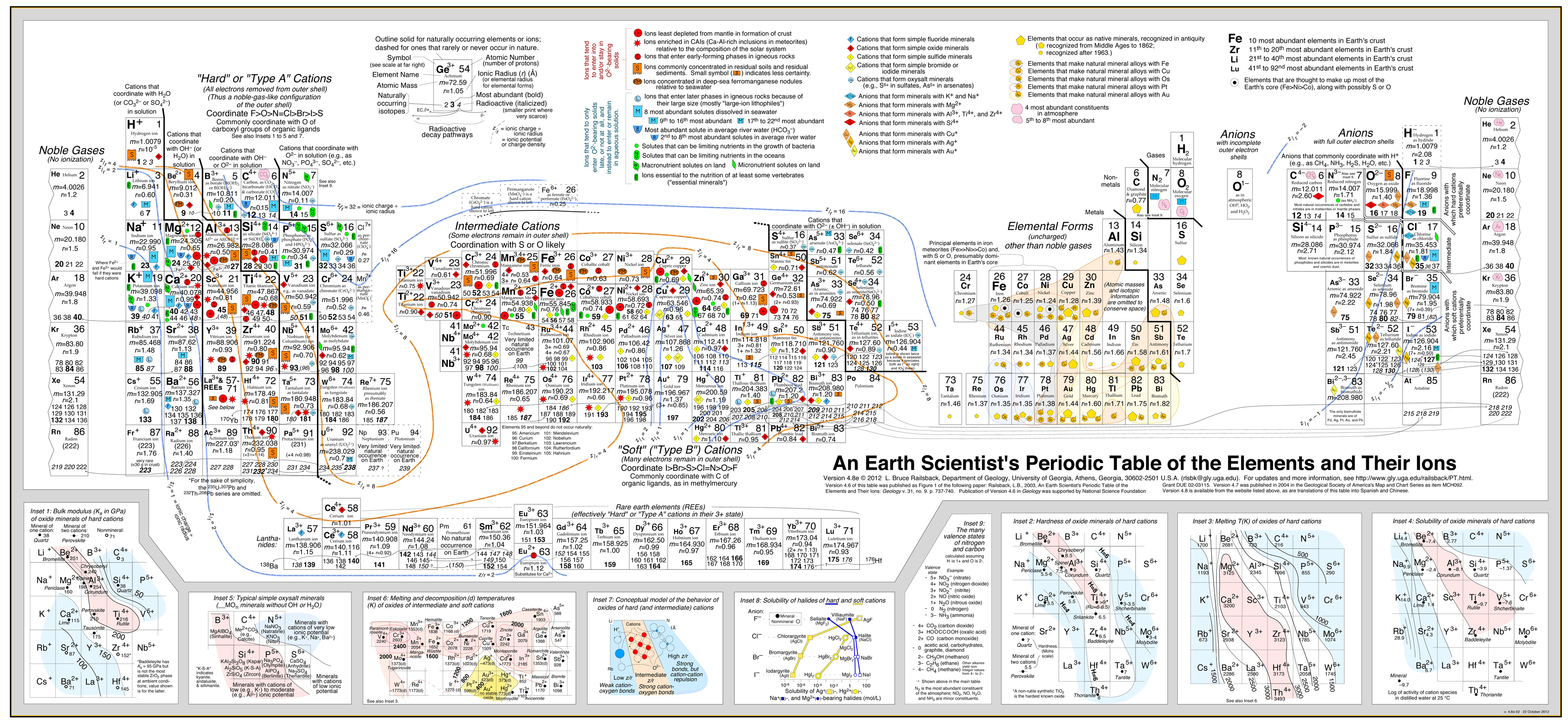
- Die Railsback-Analyse verwendet Verhaltenskonturen, die dem Periodensystem überlagert sind.
- Siehe den Artikel: A Synthesis of Systematic Mineralogy von Bruce Railsback, der diese Analyse entwickelt.
Pearsons HSAB-Prinzip (Das Hard-Soft-Acid-Base-Prinzip)
In den sechziger Jahren erweiterte Ralph Pearson die Typ-A-Typ-B-Logik erheblich, indem er das unterschiedliche Komplexierungsverhalten von Kationen und Liganden in Form von elektronenpaarakzeptierenden Lewis-Säuren und elektronenpaarabgebenden Lewis-Basen erklärte:
Lewissäure + Lewis-Base → Lewis-Säure/Base-Komplex
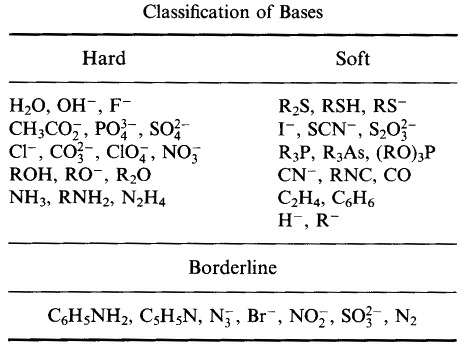
Pearson klassifizierte Lewis-Säuren und Lewis-Basen als hart, grenzwertig oder weich.
Nach dem Pearson’schen Prinzip der harten weichen Säure-Base (HSAB):
Harte Säuren binden sich bevorzugt an harte Basen
und
weiche Säuren binden sich bevorzugt an weiche Basen
Auf den ersten Blick scheint die HSAB-Analyse dem Typ-A- und Typ-B-System recht ähnlich zu sein.
Pearson klassifizierte jedoch eine sehr breite Palette von Atomen, Ionen, Molekülen und Molekülionen als hart, grenzwertig oder weich und verlagerte die Analyse von der traditionellen anorganischen Metall/Liganden-Chemie in den Bereich der organischen Chemie – und verband sie mit ihr.
Pearson’s HSAB Classification System, von hier:
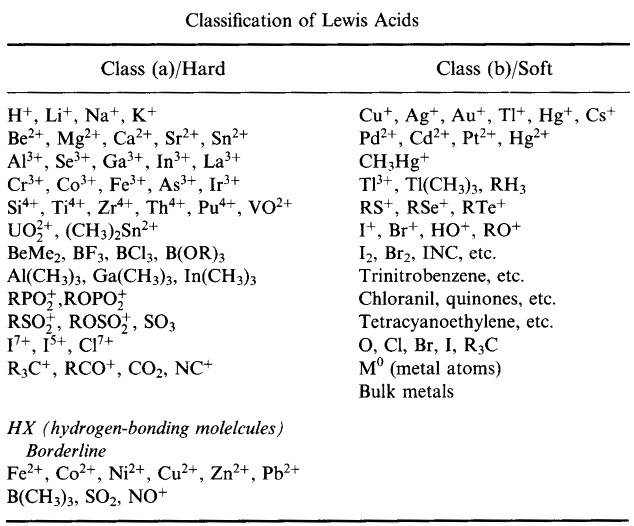
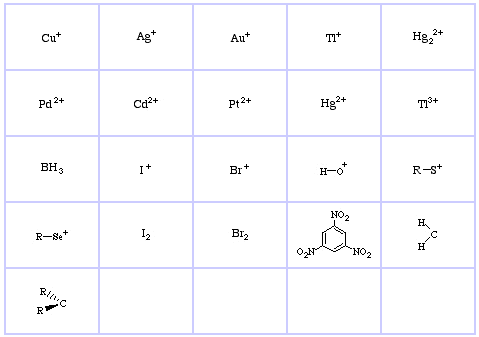
Pearson’s Hard Lewis Acids (aus dem Chemical Thesaurus), hier, und aus der congeneric array database, hier:
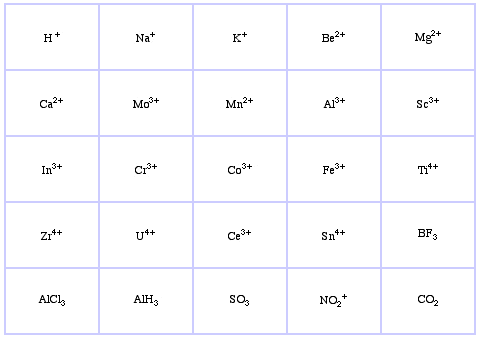
Pearson’s Borderline Lewis Acids, hier, und hier:
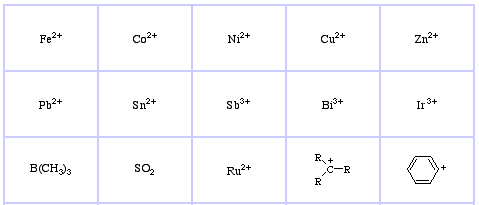
Pearson’s Soft Lewis Acids, hier, und hier:
Pearson’s Hard Lewis Bases (aus The Chemical Thesaurus), hier, und aus der congeneric array database, hier:
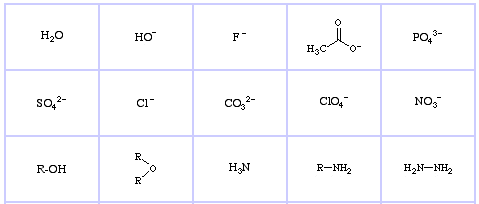
Pearson’s Borderline Lewis Bases, hier, und hier:

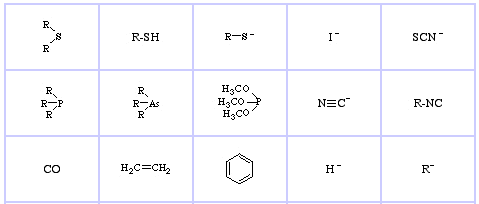
Pearson’s Soft Lewis Bases, hier und hier:
Jensen’s Review of the HSAB Principle
William (Bill) Jensen hat in der ACS-Zeitschrift Chemistry, vol 47 (1974), Lewis Acid-Base Theory, drei Abhandlungen vorgelegt: Teil I März S. 11-14; Teil II April S. 13-18; Teil III Mai S. 14-18. Teil III befasst sich mit der HSAB-Analyse von Pearson
Das kombinierte Papier – das sowohl ausgezeichnet als auch detailliert ist – ist auf Bills Webspace verfügbar (und ein Klon der Datei kann von dieser Website heruntergeladen werden).
Klopmans FMO-Analyse
Im Jahr 1968 versuchte G. Klopman, Pearsons HSAB-Prinzip mit Hilfe der Theorie des Grenzmolekularorbitals (FMO) zu quantifizieren, wie an anderer Stelle in diesem Web-Book, hier, mit dieser Gleichung:
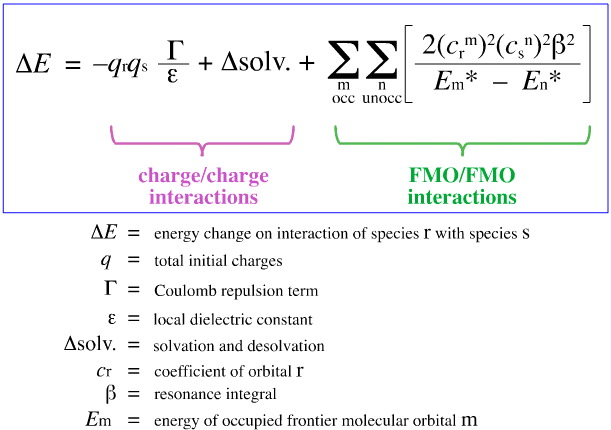
Klopman schlug vor, dass:
Harte Säuren binden sich an harte Basen, um ladungsgesteuerte (ionische) Komplexe zu bilden. Diese Wechselwirkungen werden von den +/-Ladungen der wechselwirkenden Spezies dominiert.
und
Weiche Säuren binden an weiche Basen, um FMO-gesteuerte Komplexe zu bilden. Diese Wechselwirkungen werden von den Energien der beteiligten Grenzmolekülorbitale (FMO), dem höchsten besetzten Molekülorbital (HOMO) und dem niedrigsten unbesetzten Molekülorbital (LUMO) dominiert.
Lesen Sie mehr dazu im Chemogenesis-Webbuch, hier, oder schauen Sie sich Ian Flemings Organische Chemie und FMO-Theorie hier an, wo diese Ideen ausführlich entwickelt werden.
Mit der obigen Analyse werden die beitragenden Aspekte der ladungsgesteuerten und FMO-gesteuerten Lewis-Säure/Base-Komplexierung getrennt und quantifiziert, eine entscheidende Entwicklung.
Kombination der Ideen von Pearson und Klopman
Harte Lewis-Säuren:
Atomare Zentren mit kleinem Ionenradius
Hohe positive Ladung
Spezies enthalten keine Elektronenpaare in ihren Valenzschalen
Geringe Elektronenaffinität
Wahrscheinlich stark solvatisiert
Hohe Energie LUMOWeiche Lewis-Säuren:
Großer Radius
Niedrige oder teilweise δ+ positive Ladung
Elektronenpaare in ihren Valenzschalen
Leicht zu polarisieren und zu oxidieren
Niedrige Energie-LUMOs, aber große LUMO-KoeffizientenHarte Lewis-Basen:
Kleine, stark solvatisierte, elektronegative Atomzentren: 3.0-4,0
Die Spezies sind schwach polarisierbar
Schwer zu oxidieren
HOMO mit hoher EnergieWeiche Lewis-Basen:
Große Atome mit mittlerer Elektronegativität: 2,5-3,0
Leicht zu polarisieren und zu oxidieren
HOMOs mit niedriger Energie, aber großen HOMO-KoeffizientenGrenzspezies haben mittlere Eigenschaften.
In Klopmans Arbeit gibt es eine Einschränkung, die besagt, dass es nicht notwendig ist, dass die Spezies alle Eigenschaften besitzen.
Das Ho-Papier
Pearson schlug vor, dass in den Gruppen 15, 16 und 17 des Periodensystems Trends von hart zu weich zu finden sind. 1975 wurde die Idee von Tse Lok Ho erweitert, der realistische chemische Spezies verwendete und den Begriff „congeneric“ (aus derselben Familie) prägte, wobei „congeneric“ Spezies isoelektronisch sind (dieselbe Lewis-Struktur der äußeren Schale haben).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Harte und weiche Säuren und Basen, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., Das Hard Soft Acids Bases (HSAB) Prinzip und die Organische Chemie Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Das HSAB-Prinzip für organische & Hauptgruppenchemiker
Für unsere Zwecke der Hauptgruppen- und organischen Reaktionschemie ist der Pearson-Ansatz beim Vergleich von Speziespaaren am erfolgreichsten:
- Das Natriumion, Na+, ist eine härtere Lewis-Säure als das Silberion, Ag+
- Alkoxidionen, RO, sind härtere Lewis-Basen als Thioanionen, RS
- Das Kupfer(II)-Ion, Cu2+, ist eine härtere Lewis-Säure als das Kupfer(I)-Ion, Cu+
- Das Stickstoffanionenende des zweizähnigen Cyanidions, CN, ist eine härtere Lewis-Base als das weichere Ende des Kohlenstoffanions, NC
- Das zweizähnige Enolat-Ion hat ein hartes Oxyanion-Lewis-Base-Zentrum, während das Carbanion-Zentrum eine weichere Lewis-Base ist und nukleophiler ist
Diese Art der Analyse kann bei der Erklärung der Reaktionsselektivität sehr nützlich sein.
Zum Beispiel wird β-Propiolacton – ein reaktiver cyclischer Ester – durch nucleophile Lewis-Basen ringgeöffnet. Der Angriff kann an zwei Stellen erfolgen, und die Nucleophile zeigen Regioselektivität:
- Härtere Nucleophile wie das Alkoxidion, R-O, greifen den Acyl-(Carbonyl-)Kohlenstoff an.
- Weichere Nucleophile wie das Cyanidion, NC, und das Thioanion, R-S, greifen den β-Alkylkohlenstoff an.
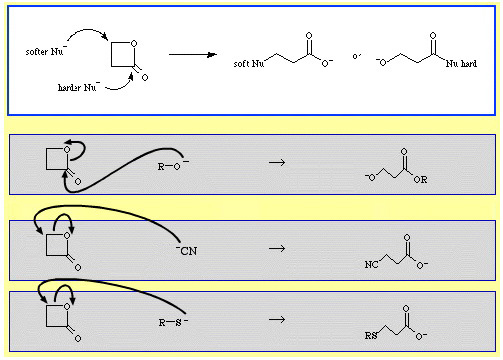
In der Datenbank The Chemical Thesaurus Reaktionschemie gibt es eine ganze Reihe von Beispielen für ambidentate Selektivität:
- Eliminierung vs. Substitution mit 1,2-Dichlorethan
- Eliminierung vs. Substitution mit 2-Brompropan
- β-Propiolacton
- Cyanid-Ion
- Enolat-Ionen
- Nitrit-Ion
- Sulfinat-Ion
- Thiocyanat-Ion
Probleme, Probleme, Probleme…
Es gibt jedoch schwerwiegende Probleme mit der Analyse von Pearson. Das Pearson-Klopman-HSAB-Modell ist zwar nicht ganz falsch… aber es vereinfacht die bekannte Reaktionschemie grob, wie Ralph Pearson selbst einräumt:
Am Anfang seines 1997 erschienenen Buches, Chemical Hardness, Wiley-VCH, S. 3-4, schreibt Ralph Pearson ganz offen:
„Mit der Nomenklatur ist es möglich, eine einfache, allgemeine Aussage zu machen:
„Harte Säuren koordinieren bevorzugt mit harten Basen, und weiche Säuren koordinieren bevorzugt mit weichen Basen.“
„Dies ist das Prinzip der harten und weichen Säuren und Basen oder das HSAB-Prinzip.
„Man beachte, dass dieses Prinzip einfach eine Wiederholung der experimentellen Beweise ist, die zu dem HSAB-Prinzip geführt haben. Es ist eine komprimierte Aussage einer sehr großen Menge chemischer Informationen. Als solches könnte man es ein Gesetz nennen. Aber diese Bezeichnung scheint angesichts des Fehlens einer quantitativen Definition der Härte anmaßend zu sein.
„Die HSAB ist keine Theorie, da sie die Schwankungen in der Stärke der chemischen Bindungen nicht erklärt. Das Wort ‚bevorzugen‘ im HSAB-Prinzip impliziert eine eher bescheidene Wirkung.
„Die Weichheit ist nicht der einzige Faktor, der den Wert von ΔH° in der Gleichung bestimmt:
A + :B → A:B
„Es gibt viele Beispiele für sehr starke Bindungen zwischen ungleichen Paaren, wie H2, das aus hartem H+ und weichem H gebildet wird.
„H2O, OH und O2 werden alle als harte Basen eingestuft, aber es gibt große Unterschiede in ihrer Basenstärke, nach jedem Kriterium.“
RP
In der Tat… (!)
Ein Problem besteht darin, dass bei der Pearson-Analyse einfach nicht die gesamte Palette der Wechselwirkungen zwischen harten und weichen Grenzflächen und Komplexen berücksichtigt wird. Sehen Sie, wie leer die HSAB-Interaktionsmatrix ist:
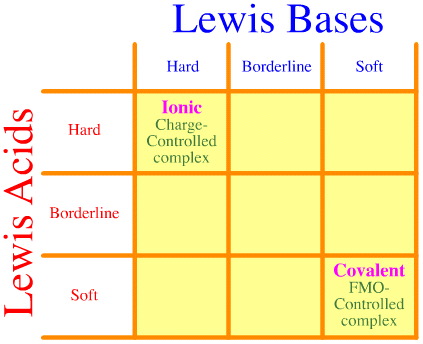
Das Pearson-HSAB-Prinzip besagt, dass „harte Säuren bevorzugt an harte Basen und weiche Säuren bevorzugt an weiche Basen binden“, was stimmen mag, aber es sagt nichts über gemischte Hart-Weich-Komplexe aus.
Klopman stellt einfach sehr wenig hilfreich fest, dass solche Wechselwirkungen „undefiniert“ sind!
Gegenwärtig sind viele der interessantesten Reagenzien der organischen und anorganischen Reaktionschemie hart-weiche „gespannte“ Komplexe:
| Natriumhydrid |
NaH
|
Na+
|
H
|
| Lithiumaluminiumhydrid |
LiAlH4
|
Al3+
|
H
|
| Blei(IV)-Acetat |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Methyljodid |
CH3I
|
CH3+
|
I
|
| Methyl-Lithium |
CH3Li
|
Li+
|
CH3
|
| Triethyloxoniumtetrafluoroborat |
+
|
CH3CH2+
|
:OR2
|
| Ferrocen |
Fe(Cp)2
|
Fe2+
|
|
|
Hart
|
Grenzbereich
|
Weich
|
Im Vergleich dazu, Der Reichtum der bekannten Reaktionschemie ergibt sich natürlich aus der Lewis-Säure/Base-Wechselwirkungsmatrix, einem zentralen Grundsatz der Chemogenese-Analyse (aber wir laufen Gefahr, uns selbst vorzugreifen, siehe die nächsten Seiten hier & hier).
Es gibt zwei Beobachtungen/Regeln, und beide betreffen kongenerische Anordnungen isoelektronischer/isoreaktiver Spezies:
- Kongenerische Anordnungen sind immer innerhalb der Zellen der Lewis-Säure/Base-Wechselwirkungsmatrix zu finden, und nicht zellübergreifend.
- Hart-zu-weich-Trends treten innerhalb kongenerischer Arrays auf, aber sie kreuzen nie zwischen Arrays.
Fajans‘ Regeln
Die Pearson-Klopman-HSAB-Analyse steht auch in direktem Widerspruch zu den bekannten „Fajans’schen Regeln“ (die in den Jahren 1915-24 entwickelt wurden), auch wenn sich bis heute kein anderer Autor mit diesem Thema befasst zu haben scheint.
Der ionisch-kovalente Charakter in binären Materialien aus Metall und Nichtmetall kann mit Hilfe der Pauling-Gleichung berechnet werden, aber der Unterschied in der Elektronegativität unterschätzt den Effekt der Polarisation: das Ausmaß, in dem ein Atom die Elektronenwolke des anderen verzerrt oder polarisiert.
Fajans Regeln besagen:
- Ein kleines positives Ion ist stark polarisierend, begünstigt Kovalenz, und für ein gegebenes Kation nimmt der kovalente Charakter zu, je größer das Anion wird.
- Große negative Ionen sind stark polarisierend, begünstigen Kovalenz, und für ein gegebenes Anion nimmt der kovalente Charakter zu, je kleiner das Kation wird.
- Der kovalente Charakter nimmt mit zunehmender Ionenladung eines der beiden Ionen zu.
- Die Polarisierung und damit die Kovalenz wird begünstigt, wenn das positive Ion keine Edelgaskonfiguration aufweist. Dies ist wichtig für Kationen wie: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Ein Beispiel:
Betrachten wir Berylliumchlorid, BeCl2 im Vergleich zu den anderen Erdalkalichloriden: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Kation
|
Ionisch
Radius |
Eneg.
|
% Ionisch von
zu Cl- Bindung |
Bindung & Material
Typ |
|
Be2+
|
41
|
1.57
|
34
|
Kovalent/Molekular
|
|
Mg2+
|
86
|
1.31
|
42
|
Ionisches Salz
|
|
Ca2+
|
114
|
1.00
|
51
|
Ionisches Salz
|
|
Sr2+
|
132
|
0.95
|
52
|
Ionisches Salz
|
|
Ba2+
|
149
|
0.89
|
54
|
Ionische Salze
|
Ionische Radiusdaten von Web Elements
Berylliumchlorid, BeCl2, ist kovalent: Das wasserfreie Material ist in organischen Lösungsmitteln löslich, es sublimiert (im Vakuum), und das geschmolzene Material ist ein schlechter elektrischer Leiter. MgCl2, CaCl2, SrCl2 und BaCl2 sind ionische Stoffe, und die geschmolzenen Salze sind ausgezeichnete elektrische Leiter.
- Fajans Regeln erklären diese Chemie eindeutig, indem sie besagen, dass das sehr kleine, stark geladene Be2+-Ion in der Lage ist, die Elektronenwolken der vergleichsweise großen Chloridionen zu polarisieren (zu verzerren), so dass eine kovalente Bindung und somit eine Molekularstruktur entsteht.
- Die Pearson-Klopman-HSAB-Analyse besagt, dass das Beryllium-Ion als das kleinste der Metallkationen der Gruppe II auch das härteste ist. Berylliumionensalze sollten daher eine extrem ladungsgesteuerte Bindung aufweisen und zu ionischen Materialien führen, was jedoch nicht der Fall ist.
- Die Chemogenese-Analyse besagt, dass Kationen der Gruppe II: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, eine kongenerische Reihe von geladenen s-LUMO-Lewis-Säuren bilden, dass über diese Reihe lineare Verhaltenstrends gefunden werden.
Diese linearen Verhaltenstendenzen können auf Wunsch als „hart-weich“-Verhalten bezeichnet werden, allerdings können die Begriffe „hart“ und „weich“ nur in Bezug auf die betreffende kongenerische Reihe verwendet werden, und „hart-weich“-Vergleiche können nicht in Bezug auf andere Lewissäuren angestellt werden.
Was ist also los?
Der Punkt ist, dass kein physikalischer Parameter mit der Härte über die von Pearson ausgewählte Reihe von Spezies korreliert. Dies führt zu Unklarheiten, wie z. B. bei der organischen Chemie des Fluoridions (hier) und dem Widerspruch zu den Fajans-Regeln (oben).
Das Pearson-Modell berücksichtigt nicht die FMO-Geometrie (die Formen & der Phasen der beteiligten Orbitale). Wie ähnlich sind zum Beispiel die harten Säuren von Pearson:
H+ + BF3 CO2 Cs+ Cu2+ ?
Oder wie ähnlich sind sich die weichen Basen von Pearson:
H R2S: H3C Benzol ?
Besonders für Chemiker der organischen Chemie und der Hauptgruppen sagt die HSAB-Analyse wenig/nichts über die wichtige Lewis-Säure H3C+ mit Carbenium-Ionen (Carbokationen) oder die Lewis-Base H3C mit Carbanionen aus.
Fette Behauptung
Das eindimensionale Kontinuum aus harter Grenzlinie und weicher Base der Pearson-Analyse hat den Effekt, dass ein Großteil des reichhaltigen, linearen (vorhersagbaren) Verhaltens, das im Raum der Lewis-Säure/Base-Reaktionschemie zu finden ist, verwischt wird.
Die neue Chemogenese-Analyse, wie sie in diesem Webbuch vorgestellt wird und durch die Reaktionschemie in der Datenbank The Chemical Thesaurus unterstützt wird, vermeidet und erklärt die Fallstricke von Pearsons viel gepriesenem HSAB-Ansatz.
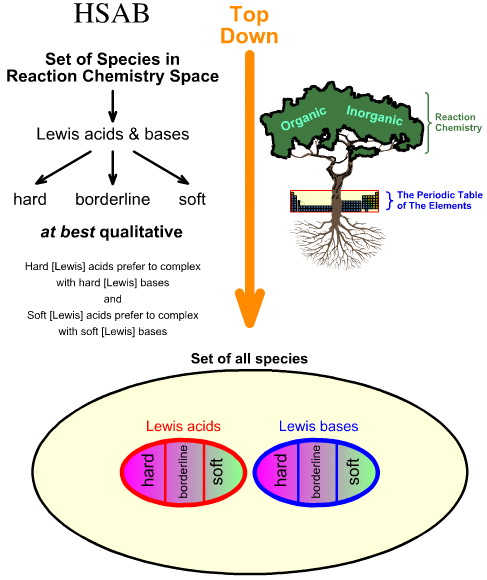
Vergleich der „Top Down“-HSAB-Analyse mit der „Bottom Up“-Chemogenese-Analyse
Pearsons Hard Soft Acid Base (HSAB)-Analyse ist eine Top Down-Analyse.
- Ausgehend von allen Spezies im Raum der Reaktionschemie wird eine Reihe wichtiger Spezies als Lewis-Säuren und Lewis-Basen identifiziert.
- Lewis-Säuren und Lewis-Basen werden dann als hart, grenzwertig oder weich klassifiziert, wobei empirische Beobachtungen und das Prinzip verwendet werden, dass harte Lewis-Säuren bevorzugt mit harten Lewis-Basen und weiche Lewis-Säuren bevorzugt mit weichen Lewis-Basen komplexiert werden:
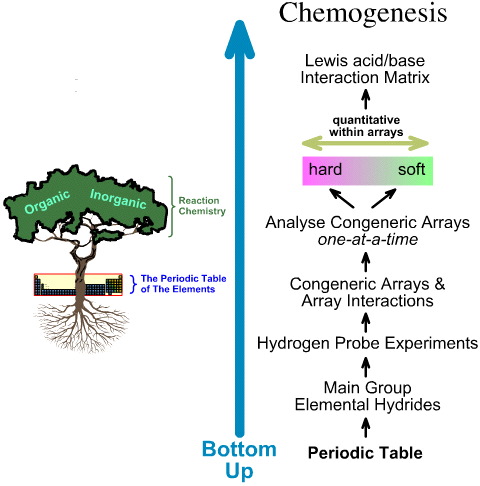
Im Gegensatz dazu erfolgt die Chemogenese-Analyse von unten nach oben:
- Die elementaren Hydride der Hauptgruppe werden den 5 Wasserstoffsonden-Experimenten unterzogen.
- Generische Arrays und Array-Wechselwirkungen werden untersucht.
- Lineare hart-zu-weich Struktur- und Reaktivitätstrends werden innerhalb der Arrays identifiziert, und es wird erkannt, dass lineares Verhalten zwischen den Arrays nicht zu erwarten ist.
- Lewis-Säuren und Lewis-Basen werden nach ihren elektronischen Lewis-Strukturen und FMO-Topologien klassifiziert und in einer Lewis-Säure/Base-Wechselwirkungsmatrix angeordnet.
Die HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman und R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Siehe auch hier.
Andere Post-Pearson-Analysen
Das ECW-Modell ist ein halbquantitatives Modell, das die Stärke von Lewis-Säure/Base-Wechselwirkungen beschreibt und vorhersagt. Ursprünglich wies das Modell den Lewis-Säuren und -Basen elektrostatische (E) und kovalente (C) Parameter zu. Später wurde es zum ECW-Modell erweitert, um Reaktionen zu erfassen, die einen konstanten Energieterm W haben, der Prozesse beschreibt, die der Säure-Base-Wechselwirkung vorausgehen.
In der ursprünglichen Analyse von Drago & Wayland aus dem Jahr 1965 wurde eine Gleichung mit zwei Termen verwendet, so dass jede Lewis-Säure durch die Terme EA und CA und jede Lewis-Base durch EB und CB charakterisiert wird, wobei sich die Parameter E und C auf die elektrostatischen und kovalenten Beiträge zur Stärke der Bindungen beziehen, die durch die Säure-Base-Wechselwirkung entstehen werden. (Diese Parameter wurden empirisch ermittelt, indem Enthalpien für Addukte verwendet wurden, die nur σ-Bindungen zwischen der Lewis-Säure und der Lewis-Base bilden und keine sterische Abstoßung aufweisen:
-ΔH = EAEB + CACB
Im ECW-Modell wurde der Gleichung ein neuer Term W hinzugefügt.
-ΔH = EAEB + CACB + W
wobei der Term W eine konstante Energie für die Spaltung einer dimeren Lewis-Säure oder Lewis-Base darstellt.
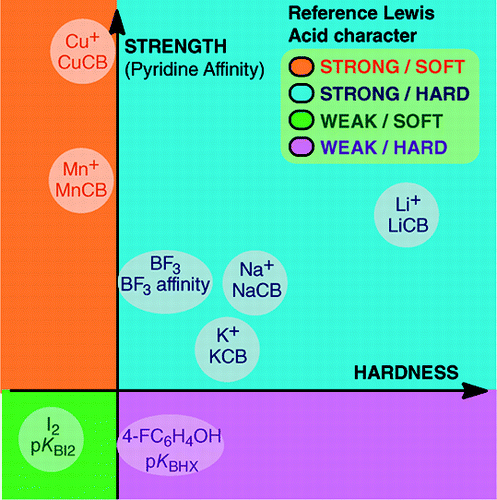
Aus An Overview of Lewis Basicity and Affinity Scales von Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
Die Unmöglichkeit, eine universelle Skala der Lewis-Basizität zu etablieren, verhindert nicht die Bestimmung des quantitativen Verhaltens von Lewis-Basen, dank der Skalen, die für bestimmte Lewis-Säuren konstruiert wurden: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ und CH3NH3+. Diese Skalen umfassen wichtige Arten von Bindungen, die in einem Lewis-Säure-Base-Addukt gebildet werden: die dative Bindung, die konventionellen und ionischen Wasserstoffbrückenbindungen, die Halogenbindung und Kationen-Molekül-Bindungen für Metallkationen der Gruppen 1, 7, 10, 11 und 13. Obwohl diese Skalen im Allgemeinen nicht miteinander verknüpft sind, gibt es familienabhängige Beziehungen, die es ermöglichen, die Basen, die zu einer bestimmten chemischen Familie gehören, wie z. B. die Familie der Sauerstoffbasen, in eine recht allgemeine Reihenfolge zu bringen. Daher ist die Skepsis gegenüber der quantitativen Nützlichkeit des Lewis-Konzepts von Säuren und Basen nicht mehr begründet.und:
Die Bildung von Lewis-Säure-Basen-Addukten umfasst eine große Vielfalt von Bindungsbildungsprozessen, von der schwachen van-der-Waals-Bindung in Ar—BF3 bis zur starken dativen Bindung in H3N-BF3. Der Begriff „Bindung“ kann bei schwachen Addukten anstößig sein. Diese schwach gebundenen Spezies werden im Allgemeinen in einem Überschallstrahl oder einer Tieftemperaturmatrix erzeugt. Wir interessieren uns hier vor allem für Komplexe, die in einer Mischung aus Lewis-Säure und Lewis-Base bei Raumtemperatur beobachtet werden können.In Wasser ist die Reihenfolge der Komplexierungskonstanten von Halogenidionen mit der Säure Fe3+ F- > Cl- > Br- > I-, während sie mit Hg2+ I- > Br- > Cl- >F- ist. Diese Umkehrung wird durch das Prinzip der harten und weichen Säuren und Basen von Pearson erklärt.
Die Koordination einer Reihe von Azinen an Metallocenen wurde mit der Wasserstoffbrückenbindungs-Basisskala der Azine korreliert.
Die ab initio Berechnung der Lewis-Säurestärke von kovalenten Metallhalogeniden im Vakuum unter Verwendung des Fluoridanions als Referenz-Lewis-Base.
Ein DN-Wert von Triethylamin wurde aus einer Korrelation zwischen DN und der chemischen NMR-Verschiebung des 23Na-Kerns für Lösungen von Natriumsalzen in basischen Lösungsmitteln geschätzt. Später ergab die direkte Bestimmung einen Wert, der die Hälfte des geschätzten Wertes betrug.
 |
 |
 |
| Lewis &Brønsted-Theorien der Säure | Hauptgruppe Elementarhydride |