- méta…synthèse
- A propos de
- Nos sites web
- Web Chapitres de livres
 |
 |
 |
Ralph Pearson a introduit son principe Hard Soft Acid Base (HSAB) au début des années soixante, et, ce faisant, a tenté d’unifier la chimie des réactions inorganiques et organiques. L’impact de cette nouvelle idée a été immédiat, cependant, au fil des ans, le principe HSAB est plutôt tombé dans l’oubli alors que d’autres approches développées à la même époque, comme la théorie des orbitales moléculaires de frontière (FMO) et la mécanique moléculaire, ont prospéré.
Cette page discute des limites profondes de l’approche de Pearson et compare &contraint le principe HSAB à l’analyse de la chimiogenèse telle que présentée dans ce livre web.
Note, dans ce livre web:
| Les acides de Lewis sont ROUGES | Les bases de Lewis sont BLEUES |
- Série de stabilité d’Irving-Williams
- Analyse de type A, type B d’Ahrland
- Analyse géochimique de Railsback
- Le principe HSAB de Pearson (The Hard Soft Acid Base Principle)
- Système de classification HSAB de Pearson, d’ici :
- Revue de Jensen sur le principe HSAB
- Analyse FMO de Klopman
- Combinaison des idées de Pearson et de Klopman
- Le papier Ho
- Le principe de la HSAB pour la chimie organique. & Chimistes du groupe principal
- Problèmes, problèmes, problèmes…
- Règles de Fajans
- Alors, qu’est-ce qui se passe ?
- Comparaison de l’analyse HSAB « Top Down » avec l’analyse Chemogenesis « Bottom Up »
- The HSAB Papers:
- Autres analyses post-Pearson
Série de stabilité d’Irving-Williams
La série de stabilité d’Irving-Williams (1953) a souligné que pour un ligand donné, la stabilité des complexes d’ions métalliques dipositifs augmente :
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
On savait également que certains ligands formaient leurs complexes les plus stables avec des ions métalliques comme Al3+, Ti4+ & Co3+ tandis que d’autres formaient des complexes stables avec Ag+, Hg2+ & Pt2+
Analyse de type A, type B d’Ahrland
En 1958, Ahrland et al. ont classé les cations métalliques en type A et type B, où:
Les cations métalliques de type A comprennent:
- Les cations de métaux alcalins : Li+ à Cs+
- Cations de métaux alcalino-terreux : Be2+ à Ba2+
- Cations de métaux de transition plus légers dans les états d’oxydation supérieurs : Ti4+, Cr3+, Fe3+, Co3+
- Le proton, H+
Les cations métalliques de type B comprennent :
- Les cations de métaux de transition plus lourds aux états d’oxydation inférieurs : Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Les ligands, entités chimiques qui se complexent avec les cations métalliques, ont été classés comme type A ou type B selon qu’ils forment des complexes plus stables avec les cations métalliques de type A ou de type B, d’ici :
|
Tendance du ligand à se complexer
avec des métaux de type A |
Tendance du ligand à . complexe
avec les métaux de type B |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
De cette analyse, une règle empirique peut être dérivée :
Les métaux de type A préfèrent se lier (complexer) à des ligands de type A
et
Les métaux de type B préfèrent se lier (complexer) à des ligands de type B
Ces règles empiriques – dérivées expérimentalement – nous indiquent que les métaux de type A sont plus susceptibles de former des oxydes, carbonates, nitrures et fluorures, tandis que les métaux de type B sont plus susceptibles de former des phosphures, sulfures et sélinides.
Analyse géochimique de Railsback
L’analyse « Type A, Type B » est d’une grande importance économique car :
- Certains métaux se retrouvent dans la nature sous forme de minéraux métal de type A + ligand de type A, comme les carbonates : MgCO3 et CaCO3 et les oxydes : Fe2O3 et TiO2
- Alors que d’autres se trouvent sous forme de minéraux métal + ligand de type B, par exemple les minerais sulfurés : PbS, CdS, NiS, etc.
Cette approche a été très bien développée dans par Bruce Railsback avec son excellent et très recommandé « Earth Scientist’s Periodic Table website ».
Cliquez sur l’image pour l’agrandir:
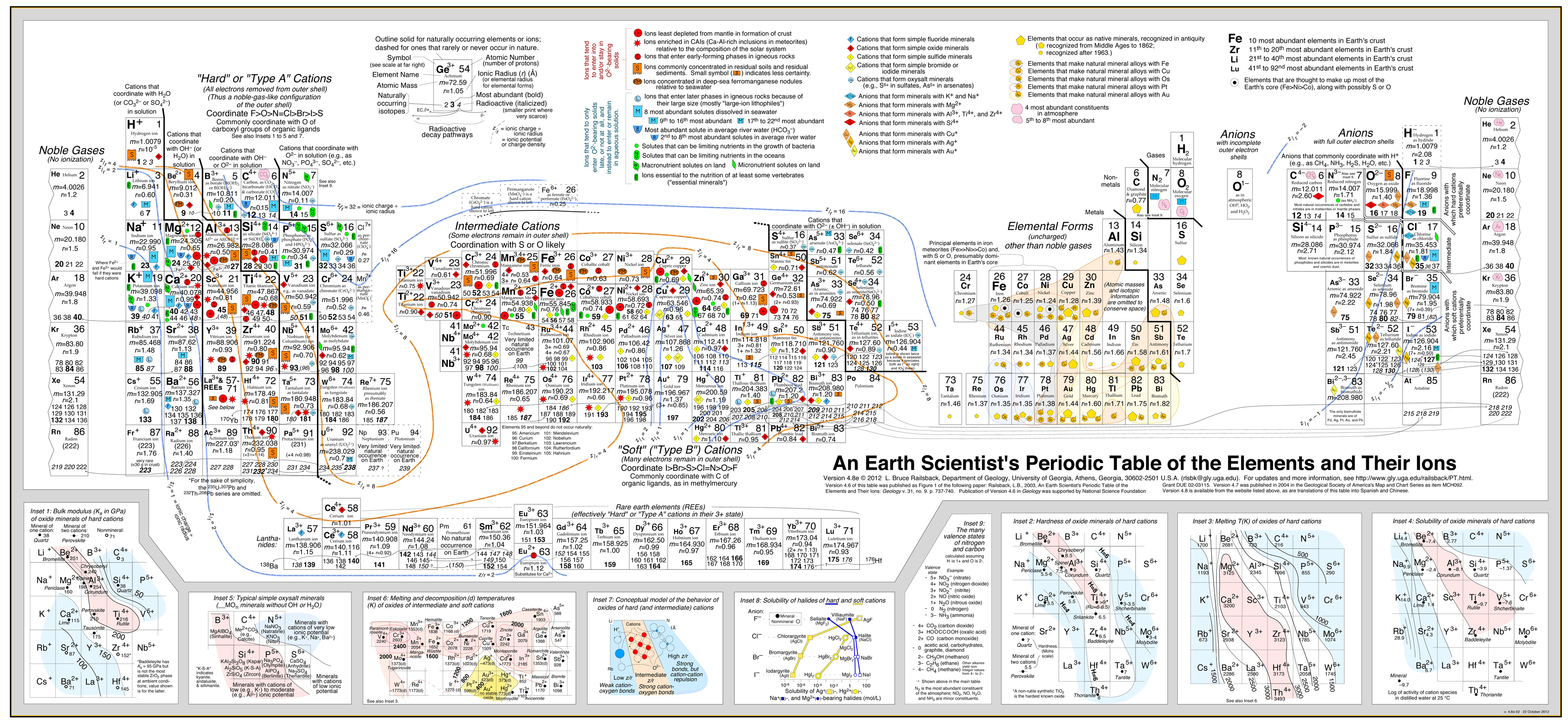
- L’analyse de Railsback utilise des contours de comportement superposés au tableau périodique. .
- Voir l’article : A Synthesis of Systematic Mineralogy de Bruce Railsback qui développe cette analyse.
Le principe HSAB de Pearson (The Hard Soft Acid Base Principle)
Dans les années soixante, Ralph Pearson a considérablement élargi la logique du type A-Type B en expliquant le comportement différentiel de complexation des cations et des ligands en termes d’acides de Lewis accepteurs de paires d’électrons et de bases de Lewis donneuses de paires d’électrons :
Acide de Lewis + base de Lewis → complexe acide/base de Lewis
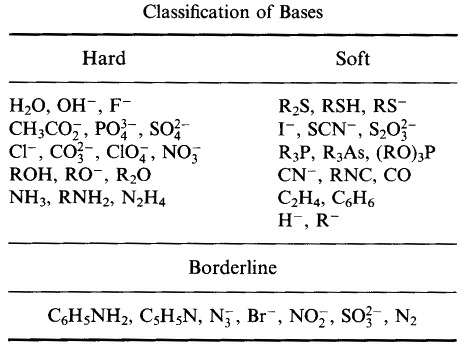
Pearson a classé les acides et les bases de Lewis comme durs, limites ou mous.
Selon le principe de la base acide molle dure de Pearson (HSAB) :
Les acides durs préfèrent se lier aux bases dures
et
Les acides mous préfèrent se lier aux bases molles
A première vue, l’analyse HSAB semble assez similaire au système de type A et de type B.
Cependant, Pearson a classé une très large gamme d’atomes, d’ions, de molécules et d’ions moléculaires comme durs, limites ou mous, déplaçant l’analyse de la chimie inorganique traditionnelle métal/ligand vers – et en la combinant avec – le domaine de la chimie organique.
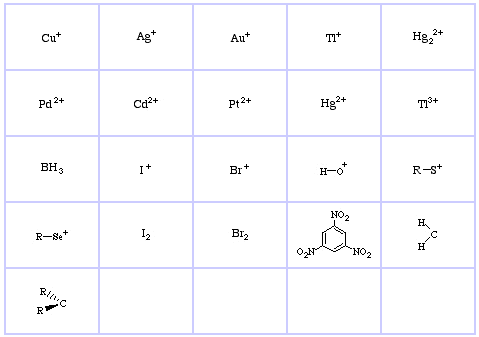
Système de classification HSAB de Pearson, d’ici :
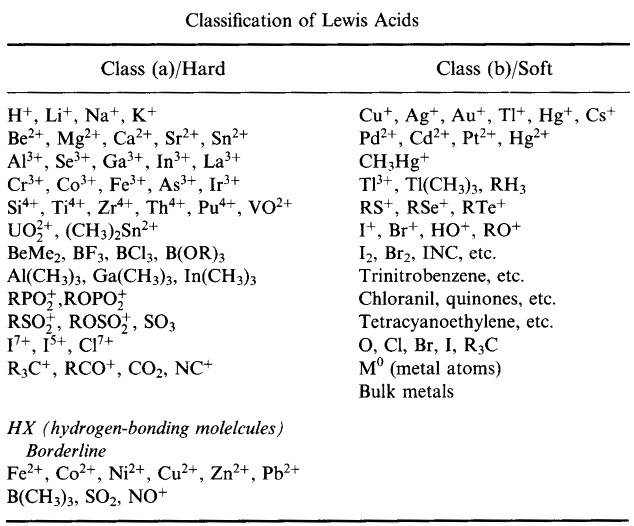
Acides de Lewis durs de Pearson (du Thésaurus chimique), d’ici, et de la base de données des réseaux congénères, d’ici :
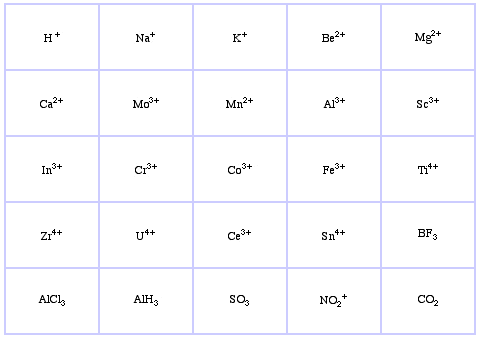
Acides de Lewis limites de Pearson, ici, et ici :
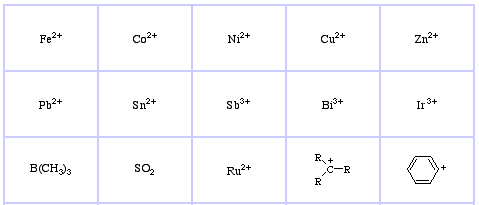
Les acides de Lewis mous de Pearson, ici, et ici :
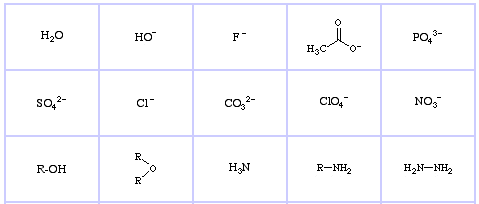
Bases de Lewis dures de Pearson (du Thésaurus chimique), ici, et de la base de données des réseaux congénères, ici :
Bases de Lewis limites de Pearson, ici, et ici :

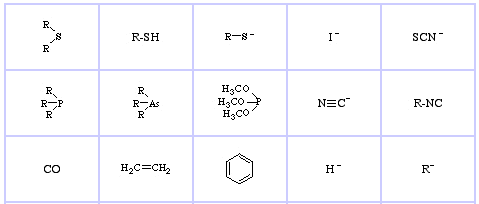
Bases de Lewis douces de Pearson, ici, et ici :
Revue de Jensen sur le principe HSAB
William (Bill) Jensen a présenté trois articles dans la revue ACS Chemistry, vol 47 (1974), Lewis Acid-Base Theory : Partie I mars pp 11-14 ; Partie II avril pp 13-18 ; Partie III mai pp 14-18. La partie III traite de l’analyse HSAB de Pearson.
L’article combiné – qui est à la fois excellent et détaillé – est disponible sur l’espace web de Bill (et un clone du fichier peut être téléchargé sur ce site).
Analyse FMO de Klopman
En 1968, G. Klopman a tenté de quantifier le principe HSAB de Pearson en utilisant la théorie de l’orbite moléculaire de frontière (FMO), comme discuté ailleurs dans ce livre web, ici, avec cette équation:
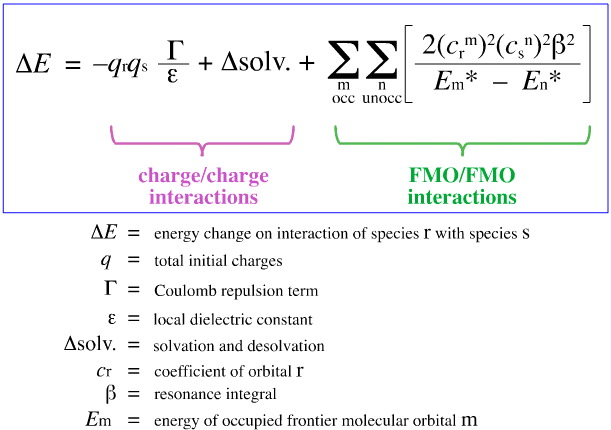
Klopman a proposé que :
Les acides durs se lient aux bases dures pour donner des complexes (ioniques) à charge contrôlée. Ces interactions sont dominées par les charges +/ sur les espèces en interaction.
et
Les acides mous se lient aux bases molles pour donner des complexes contrôlés par les FMO. Ces interactions sont dominées par les énergies des orbitales moléculaires frontières (FMO) participantes, l’orbitale moléculaire la plus haute occupée (HOMO) et l’orbitale moléculaire inoccupée la plus basse (LUMO).
Lisez plus ailleurs dans le livre web Chemogenesis, ici, ou regardez la chimie organique de Ian Fleming et la théorie FMO ici, où ces idées sont développées assez longuement.
En utilisant l’analyse ci-dessus, les aspects contribuant à la complexation acide/base de Lewis contrôlée par la charge et contrôlée par les FMO sont séparés et quantifiés, un développement crucial.
Combinaison des idées de Pearson et de Klopman
Acides de Lewis durs:
Centres atomiques de petit rayon ionique
Charge positive élevée
Les espèces ne contiennent pas de paires d’électrons dans leurs coquilles de valence
Faible affinité électronique
Susceptibles d’être fortement solvatés
LUMO de haute énergieAcides de Lewis mous :
Grand rayon
Charge positive δ+ faible ou partielle
Paires d’électrons dans leurs coquilles de valence
Faciles à polariser et à oxyder
LUMO de faible énergie, mais coefficients LUMO de grande amplitudeBases de Lewis dures:
Centres atomiques petits, fortement solvatés et électronégatifs : 3.0-4,0
Les espèces sont faiblement polarisables
Difficile à oxyder
HOMO de haute énergieBases de Lewis douces:
Grands atomes d’électronégativité intermédiaire : 2,5-3,0
Facile à polariser et à oxyder
HOMO de basse énergie mais coefficients HOMO de grande magnitudeLes espèces limites ont des propriétés intermédiaires.
Il y a un qualificatif dans le papier de Klopman disant que : il n’est pas nécessaire que les espèces possèdent toutes les propriétés.
Le papier Ho
Pearson a suggéré que des tendances de dur à mou pouvaient être trouvées parmi les groupes 15, 16 et 17 du tableau périodique. En 1975, l’idée a été étendue par Tse Lok Ho qui a utilisé des espèces chimiques réalistes et a inventé le terme congénère (de la même famille), où les espèces congénères sont isoelectronc (ont la même structure de Lewis de la coquille externe).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Acides et bases durs et mous, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb :
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., Le principe des acides mous durs et des bases (HSAB) et la chimie organique Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Le principe de la HSAB pour la chimie organique. & Chimistes du groupe principal
Pour nos objectifs de chimie du groupe principal et de la réaction organique, l’approche de Pearson est la plus efficace lorsqu’il s’agit de comparer des paires d’espèces :
- L’ion sodium, Na+, est un acide de Lewis plus dur que l’ion argent, Ag+
- Les ions alkoxyde, RO, sont des bases de Lewis plus dures que les thioanions, RS
- L’ion cuivre (II), Cu2+, est un acide de Lewis plus dur que l’ion cuivre (I), Cu+
- L’extrémité anionique azotée de l’ion cyanure ambidenté, CN, est une base de Lewis plus dure que l’extrémité anionique carbonée plus douce, NC
- L’ion énolate ambidenté, a un centre de base de Lewis oxyanion dur tandis que le centre carbanion est une base de Lewis plus douce et est plus nucléophile
Ce type d’analyse peut être très utile pour expliquer la sélectivité de la réaction.
Par exemple, la β-propiolactone – un ester cyclique réactif – est ouverte en cycle par des bases de Lewis nucléophiles. L’attaque peut se produire à deux positions et les nucléophiles présentent une régiosélectivité :
- Des nucléophiles plus durs comme l’ion alcoxyde, R-O, attaquent le carbone acyle (carbonyle).
- Des nucléophiles plus doux comme l’ion cyanure, NC, et le thioanion, R-S, attaquent le carbone β-alkyle.
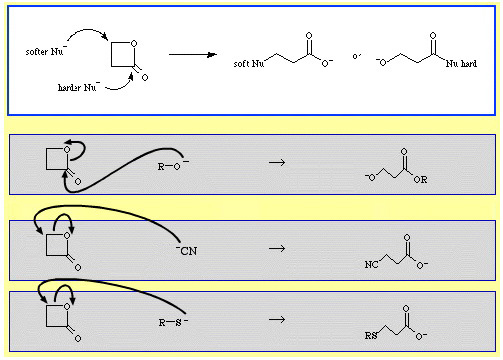
Il existe un assez grand nombre d’exemples de sélectivité ambidentate dans la base de données de chimie réactionnelle The Chemical Thesaurus :
- Elimination vs Substitution avec 1,2-Dichloroéthane
- Elimination vs Substitution avec 2-Bromopropane
- β-Propiolactone
- Ion cyanure
- Ion énolate
- Ion nitrite
- Ion sulfinate
- Ion thiocyanate
Problèmes, problèmes, problèmes…
Cependant, il y a de graves problèmes avec l’analyse de Pearson. Bien que le modèle Pearson-Klopman HSAB ne soit pas exactement faux… il simplifie grossièrement la chimie des réactions connues, comme le reconnaît Ralph Pearson lui-même:
Au début de son livre de 1997, Chemical Hardness, Wiley-VCH, pp 3-4, Ralph Pearson écrit candidement:
« Avec la nomenclature, il est possible de faire une déclaration simple et générale :
« Les acides durs préfèrent se coordonner aux bases dures, et les acides mous préfèrent se coordonner aux bases molles. »
« C’est le principe des acides et des bases durs et mous, ou le principe HSAB.
« Notez que ce Principe est simplement une reformulation de la preuve expérimentale qui a conduit à . C’est un énoncé condensé d’une très grande quantité d’informations chimiques. En tant que tel, il pourrait être appelé une loi. Mais cette étiquette semble prétentieuse compte tenu de l’absence d’une définition quantitative de la dureté.
« La HSAB n’est pas une théorie, car elle n’explique pas les variations de la force des liaisons chimiques. Le mot ‘préférer’ dans le principe de la HSAB implique un effet plutôt modeste.
« La douceur n’est pas le seul facteur qui détermine la valeur de ΔH° dans l’équation:
A + :B → A:B
« Il existe de nombreux exemples de liaisons très fortes entre des paires mal assorties, comme H2, formé de H+ dur et de H mou.
« H2O, OH et O2 sont tous classés comme des bases dures, mais il y a de grandes différences dans la force de leur base, selon n’importe quel critère. »
RP
Indeed so…. ( !)
Un problème est que l’ensemble des interactions et complexations dur-frère-mou n’est tout simplement pas pris en compte par l’analyse de Pearson. Regardez comme la matrice d’interaction de la HSAB est vide :
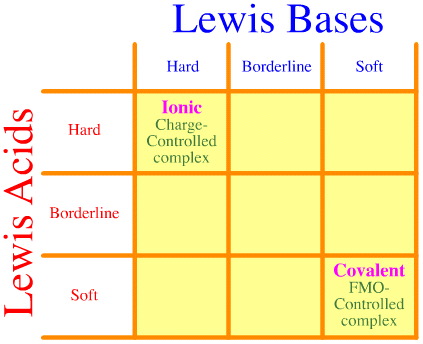
Le principe HSAB de Pearson stipule que « les acides durs préfèrent se lier aux bases dures et que les acides mous préfèrent se lier aux bases molles », ce qui peut être vrai, mais il ne dit rien sur les complexes mixtes durs-mous.
Klopman déclare simplement de manière très peu utile que de telles interactions sont « indéfinies » !
Pourtant, beaucoup des réactifs les plus intéressants de la chimie de réaction organique et inorganique sont des complexes « tendus » durs-mous :
| Hydrure de sodium |
NaH
|
Na+
|
H
|
| Hydrure de lithium et d’aluminium |
LiAlH4
|
Al3+
|
H
|
| Acétate de plomb(IV) |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Iodure de méthyle |
CH3I
|
CH3+
|
I
|
| Méthyl lithium |
CH3Li
. |
Li+
|
CH3
|
| Tétrafluoroborate de triéthyloxonium |
+
|
CH3CH2+
|
:OR2
|
| Ferrocène |
Fe(Cp)2
|
Fe2+
|
|
|
Dur
|
Frontalier
|
Doux
|
Par comparaison, la richesse de la chimie des réactions connues découle naturellement de la matrice d’interaction acide/base de Lewis, un principe central de l’analyse de la chimiogenèse (mais nous risquons de nous emballer, voir les pages suivantes ici & ici).
Il y a deux observations/règles, et toutes deux concernent les réseaux congénères d’espèces isoélectroniques/isoréactives :
- Les réseaux congénères se trouvent toujours à l’intérieur des cellules de la matrice d’interaction acide/base de Lewis, et non en traversant les cellules.
- Des tendances dures à douces se produisent à l’intérieur des matrices congénères, mais elles ne se croisent jamais entre les matrices.
Règles de Fajans
L’analyse HSAB de Pearson-Klopman est également en contradiction directe avec les « règles de Fajans » bien connues (développées au cours des années 1915-24), même si aucun autre auteur ne semble avoir abordé cette question à ce jour.
Le caractère ionique-covalent dans les matériaux binaires métal plus non-métal peut être calculé en utilisant l’équation de Pauling, ici, mais la différence d’électronégativité sous-estime l’effet de la polarisation : la mesure dans laquelle un atome déforme ou polarise le nuage électronique de l’autre.
Les règles de Fajans disent :
- Un petit ion positif est très polarisable, favorise la covalence, et pour un cation donné, le caractère covalent augmente à mesure que l’anion devient plus grand.
- Les grands ions négatifs sont très polarisables, favorisent la covalence, et pour un anion donné, le caractère covalent augmente à mesure que le cation devient plus petit.
- Le caractère covalent augmente avec l’augmentation de la charge ionique de l’un ou l’autre ion.
- La polarisation, et donc la covalence, est favorisée si l’ion positif n’a pas une configuration de gaz noble. Ceci est important pour les cations tels que : Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Un exemple:
Considérez le chlorure de béryllium, BeCl2 par rapport aux autres chlorures alcalino-terreux : MgCl2, CaCl2, SrCl2, & BaCl2:
|
Cation
|
Ionique
Radius |
Eneg.
|
% ionique de
à la liaison Cl- |
La liaison &Matériau
Type |
|
Be2+
|
41
|
1.57
|
34
|
Covalent/Moléculaire
|
|
Mg2+
|
86
|
1.31
|
42
|
Sel ionique
|
|
Ca2+
|
114
|
1.00
|
51
|
Sel ionique
|
|
Sr2+
|
132
|
0.95
|
52
|
Sel ionique
|
|
Ba2+
|
149
|
0.89
|
54
|
Sel ionique
|
Données sur le rayon ionique d’après les éléments du web
Le chlorure de béryllium, BeCl2, est covalent : la matière anhydre est soluble dans les solvants organiques, elle se sublime (sous vide), et la matière fondue est un mauvais conducteur d’électricité. Le MgCl2, le CaCl2, le SrCl2 et le BaCl2 sont des matériaux ioniques et les sels fondus sont d’excellents conducteurs électriques.
- Les règles de Fajans expliquent clairement cette chimie en disant que l’ion Be2+, très petit et très chargé, est capable de polariser (déformer) les nuages d’électrons d’ions chlorure comparativement grands en liaison covalente et donc de donner une structure moléculaire.
- L’analyse HSAB de Pearson-Klopman indique que l’ion béryllium, étant le plus petit des cations métalliques du groupe II est aussi le plus dur. Les sels d’ions béryllium devraient donc présenter une liaison extrême contrôlée par la charge et donner lieu à des matériaux ioniques, mais ce n’est pas le cas.
- L’analyse de la chimiogenèse, ici, dit que les cations du groupe II : Be2+, Mg2+, Ca2+, Sr2+ &Ba2+, constituent une série congénère d’acides de Lewis s-LUMO chargés, que des tendances de comportement linéaire se retrouvent sur cette série.
Ces tendances de comportement linéaire peuvent être attribuées à un comportement « dur-mou », si on le souhaite, cependant, les termes « dur » et « mou » ne peuvent être utilisés que par rapport à la série congénérique en question et les comparaisons « dur-mou » ne peuvent être faites par rapport à d’autres acides de Lewis.
Alors, qu’est-ce qui se passe ?
Le point est qu’aucun paramètre physique n’est corrélé avec la dureté sur l’ensemble des espèces choisies par Pearson. Cela crée des ambiguïtés, comme avec la chimie organique de l’ion fluorure, ici, et la contradiction avec les règles de Fajans, ci-dessus.
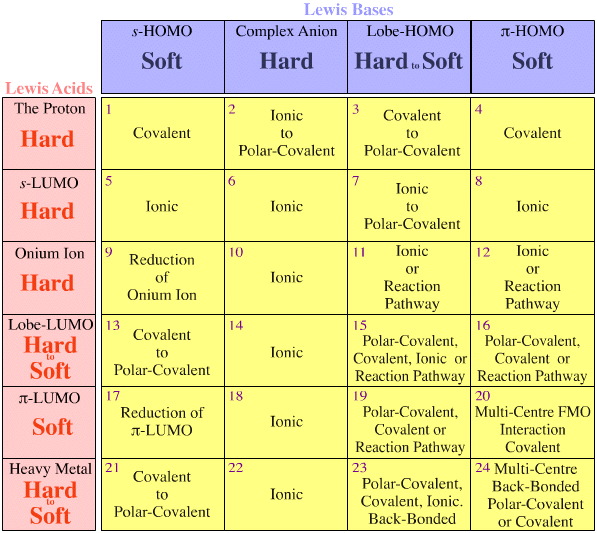
Le modèle de Pearson ne tient pas compte de la géométrie FMO (les formes & phases des orbitales participantes). Par exemple, quelle est la similitude entre les acides durs de Pearson :
H+ + BF3 CO2 Cs+ Cu2+ ?
Ou, quelle est la similarité des bases molles de Pearson:
H R2S : H3C benzène ?
Crucialement pour les chimistes organiques et des groupes principaux, l’analyse HSAB dit peu/rien sur l’important ion carbénium (carbocation) de l’acide de Lewis, H3C+, ou la base de Lewis carbanion, H3C.
Affirmation audacieuse
Le continuum unidimensionnel dur-bordure-mou de l’analyse de Pearson a en fait pour effet d’estomper une grande partie du comportement riche et linéaire (prévisible) qui peut être trouvé dans l’espace chimique de la réaction acide/base de Lewis.
La nouvelle analyse de la chimiogenèse telle que présentée dans ce livre web et soutenue par la chimie des réactions détenue dans la base de données The Chemical Thesaurus évite et explique les pièges de l’approche HSAB tant vantée de Pearson.
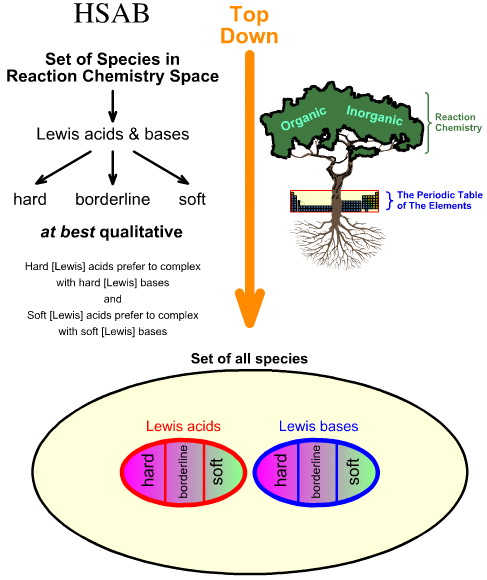
Comparaison de l’analyse HSAB « Top Down » avec l’analyse Chemogenesis « Bottom Up »
L’analyse Hard Soft Acid Base (HSAB) de Pearson est top down.
- En partant de toutes les espèces dans l’espace de la chimie réactionnelle, un certain nombre d’espèces importantes sont identifiées comme des acides et des bases de Lewis.
- Les acides de Lewis et les bases de Lewis sont ensuite classés comme durs, limites ou mous en utilisant l’observation empirique et le principe selon lequel : les acides de Lewis durs préfèrent se complexer avec des bases de Lewis dures et les acides de Lewis mous préfèrent se complexer avec des bases de Lewis molles :
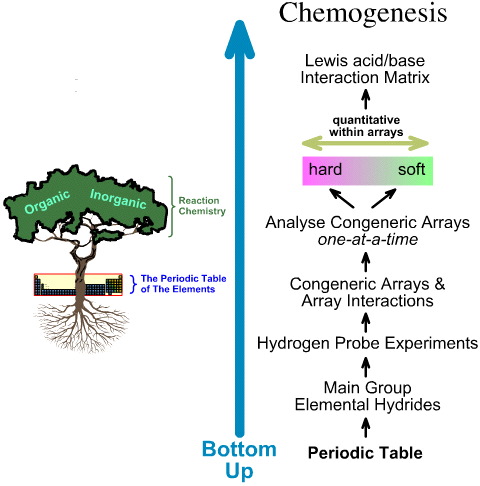
En revanche, l’analyse de la chimiogenèse est ascendante :
- Les hydrures élémentaires du groupe principal sont soumis aux 5 expériences de sonde à hydrogène.
- Les réseaux congénères et les interactions entre réseaux sont étudiés.
- Les tendances linéaires de structure et de réactivité hard-to-soft sont identifiées au sein des réseaux, et il est reconnu qu’un comportement linéaire ne peut être attendu entre les réseaux.
- Les acides de Lewis et les bases de Lewis sont classés par leurs structures électroniques de Lewis et leurs topologies FMO et sont arrangés dans une matrice d’interaction acide/base de Lewis, ici.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman et R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Voir aussi ici.
Autres analyses post-Pearson
Le modèle ECW est un modèle semi-quantitatif qui décrit et prédit la force des interactions acide/base de Lewis. Initialement, le modèle a attribué des paramètres électrostatiques (E) et covalents (C) aux acides et aux bases de Lewis. Il a ensuite été étendu au modèle ECW pour couvrir les réactions qui ont un terme d’énergie constant, W, qui décrit les processus qui précèdent l’interaction acide/base.
Dans l’analyse originale de Drago & Wayland de 1965, une équation à deux termes a été employée de telle sorte que chaque acide de Lewis est caractérisé par des termes EA et CA et chaque base de Lewis par EB et CB où les paramètres E et C se réfèrent aux contributions électrostatiques et covalentes à la force des liaisons que l’interaction acide/base formera. (Cela ressemble à l’analyse de Klopman, ci-dessus.) Ces paramètres ont été obtenus empiriquement en utilisant les enthalpies pour les adduits qui ne forment que des liaisons σ entre l’acide et la base de Lewis et qui n’ont pas de répulsion stérique :
-ΔH = EAEB + CACB
Dans le modèle ECW, un nouveau terme W a été ajouté à l’équation.
-ΔH = EAEB + CACB + W
où le terme W représente une énergie constante pour le clivage d’un acide ou d’une base de Lewis dimérique.
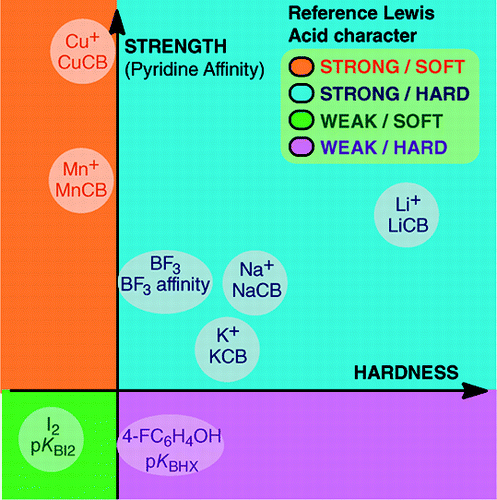
From An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal : J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
L’impossibilité d’établir une échelle universelle de basicité de Lewis n’empêche pas de déterminer le comportement quantitatif des bases de Lewis, grâce à des échelles construites contre des acides de Lewis particuliers : BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, et CH3NH3+. Ces échelles englobent d’importants types de liaisons formées dans un adduit acide-base de Lewis : la liaison dative, les liaisons hydrogène conventionnelles et ioniques, la liaison halogène et les liaisons cation-molécule pour les cations métalliques des groupes 1, 7, 10, 11 et 13. De plus, bien que ces échelles ne soient généralement pas liées entre elles, il existe des relations famille-dépendantes qui permettent de classer, dans un ordre assez général, les bases appartenant à une famille chimique donnée, par exemple, la famille des bases oxygénées. Par conséquent, le scepticisme quant à l’utilité quantitative du concept de Lewis des acides et des bases n’est plus fondé.et:
La formation de produits d’addition acide-base de Lewis couvre une grande variété de processus de formation de liaisons, de la faible liaison de van der Waals dans Ar—BF3 à la forte liaison dative dans H3N-BF3. Le terme « liaison » peut être répréhensible pour les adduits faibles. Ces espèces faiblement liées sont généralement produites dans un faisceau supersonique ou dans une matrice cryogénique. Ici, nous nous intéressons principalement aux complexes qui peuvent être observés dans un mélange à température ambiante de l’acide de Lewis et de la base de Lewis.Dans l’eau, l’ordre des constantes de complexation des ions halogénures avec l’acide Fe3+ est F- > Cl- > Br- > I-, alors qu’avec Hg2+, il est I- > Br- > Cl- >F-. Cette inversion s’explique par le principe de l’acide et de la base dure et molle de Pearson.
La coordination d’une série d’azines aux métallocènes a été corrélée à l’échelle de basicité des liaisons hydrogène des azines.
Le calcul ab initio de la force acide de Lewis des halogénures métalliques covalents dans le vide en utilisant l’anion fluorure comme base de Lewis de référence.
Une valeur de DN de la triéthylamine a été estimée à partir d’une corrélation entre DN et le déplacement chimique RMN du noyau 23Na pour des solutions de sels de sodium dans des solvants basiques. Par la suite, la détermination directe a donné une valeur qui était la moitié de la valeur estimée.
 |
 |
 |
| Lewis & Théories de l’acidité de Brønsted | Hydrures élémentaires du groupe principal |
.