Original Editor – Joanne Garvey and Naomi O’Reilly
Top Contributors – Joanne Garvey, Lucinda hampton, Rachael Lowe, Naomi O’Reilly and Tarina van der Stockt
- Wprowadzenie
- Kanały jonowe
- Typy kanałów
- Podstawowe właściwości kanału jonowego
- Membrana spoczynkowa i potencjał czynnościowy
- Potencjał czynnościowy
- Złącze nerwowo-mięśniowe / Synapsy
- Synapsa
- Przekazywanie synaptyczne
- Przewodnictwo nerwowe
- Aksony nie mielinowane
- Aksony mielinizowane
- Neuroprzekaźniki, receptory i szlaki
Wprowadzenie
Neurofizjologia jest gałęzią fizjologii zajmującą się funkcjami układu nerwowego. ie Badanie właściwości funkcjonalnych neuronów, glejaków i sieci.
- Historycznie został zdominowany przez elektrofizjologii-elektryczne nagrywanie zdarzeń neuronalnych, począwszy od molowych (elektroencefalogram, EEG) do komórkowych (wewnątrzkomórkowe nagrywanie właściwości pojedynczych neuronów).
- Ponieważ neuron jest maszyną elektrochemiczną, niemożliwe jest oddzielenie zdarzeń elektrycznych od procesów biochemicznych i molekularnych, które je wywołują.
- Neurofizjolodzy używają dziś technik z chemii (obrazowanie wapnia), fizyki (funkcjonalny rezonans magnetyczny, fMRI) i biologii molekularnej (mutacje ukierunkowane na miejsce) do badania funkcji mózgu.
Poniżej dowiesz się wszystkiego o
- Kanałach jonowych
- Membranie spoczynkowej i potencjale czynnościowym
- Złączu nerwowo-mięśniowym / synapsach
- Przewodzeniu nerwowym
- Neuroprzekaźnikach, Receptory i szlaki
Kanały jonowe
Kanał jonowy to makrocząsteczka białka, która przecina szerokość błony i pozwala cząsteczkom przechodzić przez nią. Jony poruszają się w kierunku określonym przez gradient elektrochemiczny w poprzek błony.
- Jony mają tendencję do przepływu z obszaru o wysokim stężeniu do obszaru o niskim stężeniu.
- W obecności gradientu napięcia, może nie być przepływu jonów pomimo nierównych stężeń.
- Kanały jonowe mogą być otwarte lub zamknięte.
- Otwarcie jest powodowane przez zmianę napięcia przez błonę lub związanie substancji chemicznej z receptorem.
- Najważniejszą ich rolą jest to, że zapewniają neuronowi pobudliwość elektryczną.
- Znajdują się we wszystkich częściach neuronu i w mniejszym stopniu w komórkach neurogleju.
Typy kanałów
- Kanały bramkowane napięciem
- Aktywowane chemicznie
- Mechaniczne rozciąganie/ciśnienie.
Podstawowe właściwości kanału jonowego
- Składa się on z szeregu podjednostek białkowych, siedzących w poprzek błony, umożliwiając jonom przejście z jednej strony na drugą. (Transmembrane pore)
- Kanał musi być w stanie przejść od stanu otwartego do zamkniętego, i z powrotem.
- Musi być zdolny do otwarcia w odpowiedzi na odpowiednie bodźce.
Niektóre kanały reagują na bodźce chemiczne (szczególnie w synapsie). Kanały te mają specyficzne receptory dla tej substancji chemicznej, co prowadzi do otwarcia kanału.
Membrana spoczynkowa i potencjał czynnościowy
- W stanie spoczynku błona komórkowa neuronu jest dość nieprzepuszczalna dla jonów. Ma to kluczowe znaczenie dla generowania spoczynkowego potencjału błonowego.
- Głównym jonem wewnątrzkomórkowym jest potas (w płynie pozakomórkowym jest to sód).
- Naturalny przepływ jonów poprzez ich gradienty stężeń jest dla K+ do opuszczenia komórki i Na+ do wejścia.
- Ten ruch jonów poza komórkę prowadzi do ujemnego potencjału błonowego – hiperpolaryzacji.
- Odwrotnie jest w przypadku względnego napływu jonów – Hipopolaryzacja.

Błona w stanie spoczynku jest względnie nieprzepuszczalna dla jonów Na+, natomiast pozostaje przepuszczalna dla jonów K+. Więc kiedy błona jest w spoczynku, będzie tendencja do wypływu jonów K+ z komórki, w dół jej gradientu stężenia, pozostawiając za sobą nadmiar ładunku ujemnego. Trwa to tak długo, aż chemiczny gradient stężenia, który wypycha K+ z komórki, znajdzie się dokładnie w punkcie, w którym zostanie zrównoważony przez różnicę potencjałów elektrycznych wygenerowaną przez ten odpływ. (potencjał membranowy) K+ jest wtedy wciągany z powrotem do komórki.
Ten stały stan błony jest nazywany potencjałem równowagi.
Równanie do wyprowadzenia potencjału równowagi jest nazywane równaniem Nernsta.
W rzeczywistości istnieje nieco nieoczekiwany zwiększony ładunek dodatni w aksonach z powodu małej przepuszczalności jonów Na+ błony w stanie spoczynku. Jest to kompensowane przez ATP zależną pompę wymiany Na+/K+. Wypompowuje ona 3 jony Na+ na każde 3 jony K+ wnoszone do komórki. Jednakże, to tylko niewielki wkład do spoczynkowego potencjału membranowego komórki.
Potencjał czynnościowy
Definiowany jako „pojedynczy impuls elektryczny przechodzący w dół aksonu”.
Jest to wszystko albo nic w swoim działaniu. Oznacza to, że gdy zostanie osiągnięta progowa intensywność bodźca, zostanie wygenerowany potencjał czynnościowy.
Informacja w układzie nerwowym jest kodowana i interpretowana przez częstotliwość jodłowania, a nie przez wielkość potencjału czynnościowego.
Progowa intensywność bodźca: Wartość, przy której prąd wewnętrzny netto(określony przez jony Na+) jest właśnie większy od prądu zewnętrznego netto (przenoszonego przez jony K+). Normalnie jest to -55mV (krytyczny próg wypalenia)
AP najłatwiej występuje we wzgórku aksonu, ponieważ tam jest większa gęstość kanałów jonowych Na+. To właśnie z tego powodu jest to miejsce inicjacji AP w neuronie.
Jeżeli próg nie zostanie osiągnięty, potencjał czynnościowy nie zostanie wygenerowany, a transmisja sygnału zostaje zakończona w tym miejscu.
Sekwencja zdarzeń dla wygenerowania potencjału czynnościowego
- Napięcie depolaryzujące aktywuje wrażliwe na napięcie kanały jonowe Na+ w błonie neuronu: Jony Na+ płyną w dół gradientu elektrochemicznego. Membrana ulega dalszej depolaryzacji. Kolejne kanały Na+ otwierają się w pętli dodatniego sprzężenia zwrotnego. Gdy prąd jonów sodowych jest większy niż odpływ jonów K+, następuje szybkie otwarcie wszystkich kanałów Na+. Powoduje to depolaryzację błony w kierunku potencjału równowagi dla Na+ (+55mV). Powstaje pik AP, ale nie udaje się osiągnąć potencjału równowagi dla Na+ z powodu wzrastającego odpływu K+.
- As the Na+ channels become less active the AP falls. Ta inaktywacja jest zależna od napięcia. Podczas fazy opadania prąd K+ jest ważny, ponieważ prowadzi do krótkiego okresu hiperpolaryzacji błony zanim ulegnie dezaktywacji.
- Potencjał błonowy powraca do stanu spoczynku.
Złącze nerwowo-mięśniowe / Synapsy
Synapsa
Synapsa jest połączeniem dwóch neuronów. W układzie nerwowym dominuje synapsa chemiczna, ale synapsy elektryczne występują w mięśniach sercowych i komórkach glejowych.
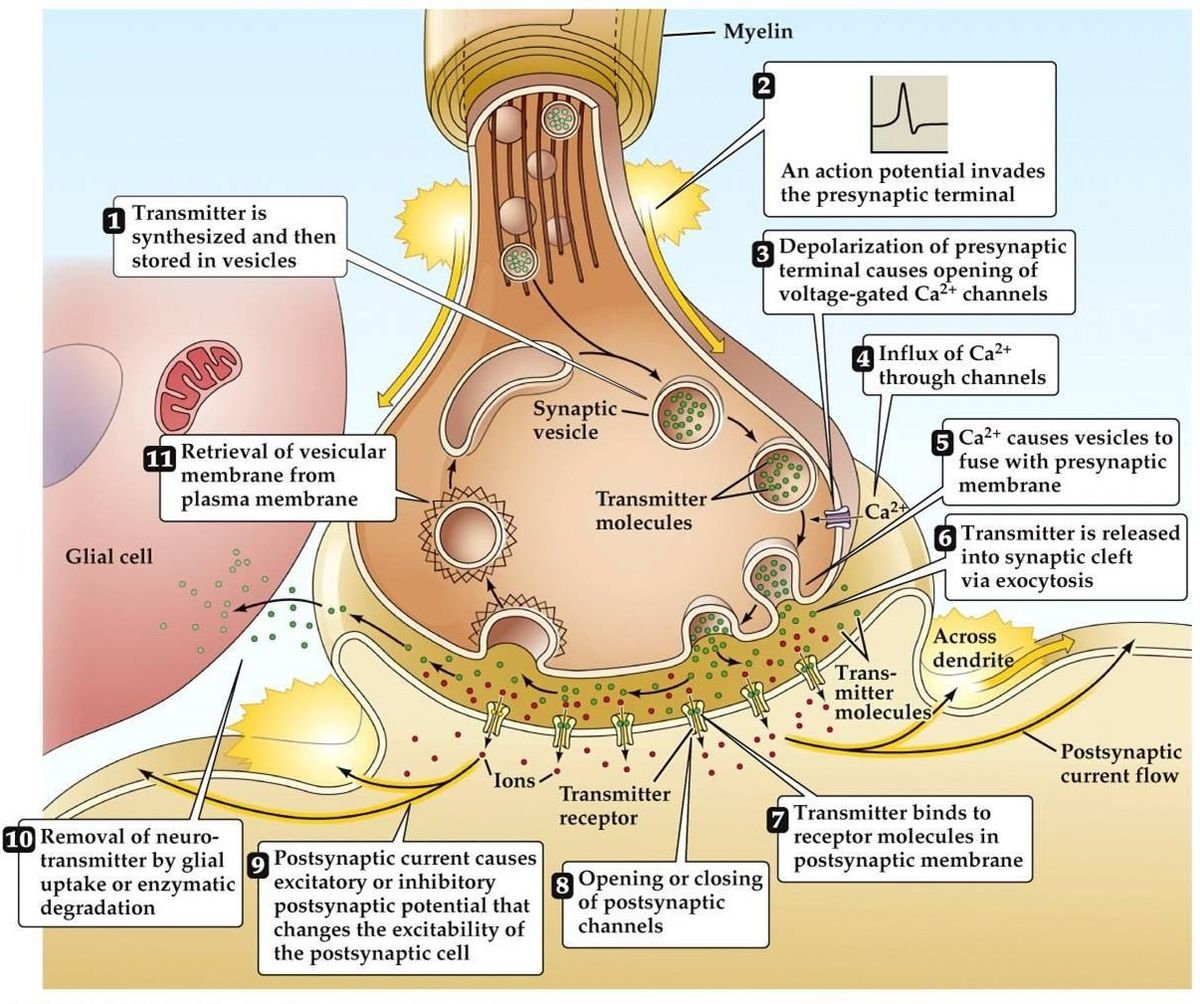
Przekazywanie synaptyczne
- Nadejście potencjału czynnościowego prowadzi do depolaryzacji terminala presynaptycznego. W strefach aktywnych terminala otwierają się zależne od napięcia kanały Ca2+. Prowadzi to do napływu Ca2+.
- Przepływ Ca2+ prowadzi do fosforylacji i zmiany ilości presynaptycznych białek wiążących wapń. To uwalnia cząsteczkę od presynaptycznej sieci aktynowej, a następnie wiąże się z błoną presynaptyczną.
- Fuzja pęcherzyka z błoną prowadzi do powstania małego kanału, który szybko się rozszerza i uwalnia swoją zawartość do szczeliny synaptycznej. Błona pęcherzyka jest utylizowana przez endocytozę.
- Uwolniony neurotransmiter dyfunduje przez szczelinę synaptyczną w celu związania się z receptorem postsynaptycznym.
- Aktywacja receptora postsynaptycznego prowadzi do zmiany potencjału błony postsynaptycznej.
- Istnieją alternatywne teorie, które sugerują, że neuroprzekaźnik jest dostarczany raczej przez cząsteczki lub kanały błonowe niż pęcherzyki.
Przewodnictwo nerwowe
Rozprzestrzenianie się potencjału czynnościowego jest osiągane przez lokalne rozprzestrzenianie się prądu.
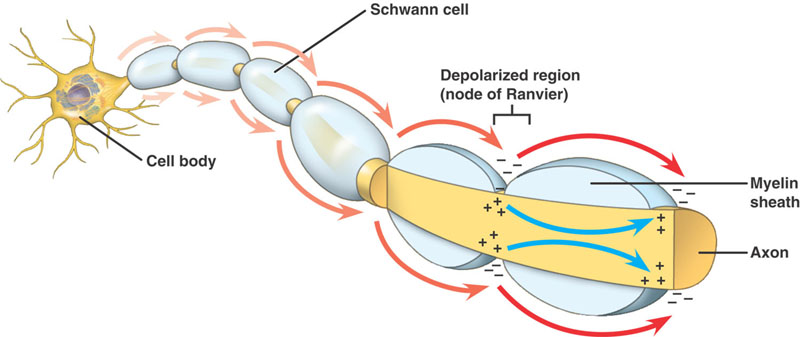
Nerw jest izolowany mieliną, jeśli jego rozmiar jest powyżej pewnej średnicy, z węzłami Ranviera w różnych odstępach wzdłuż jego długości.
Aksony nie mielinowane
Potencjał czynnościowy prowadzi do depolaryzacji błony bezpośrednio przed (i za). Błona jest w stanie refrakcji, więc potencjał czynnościowy jest przewodzony tylko w jednym kierunku. Jest to wykonalne w małych aksonach, ale rozprzestrzenianie się prądu jest powolne.
Aksony mielinizowane
Taka sama sekwencja zdarzeń jak w aksonach nie mielinizowanych. Jest jednak istotna różnica. Postępujący potencjał czynnościowy napotyka na strukturę o wysokiej rezystancji i niskiej pojemności – mielinę owiniętą wokół aksonu. Depolaryzujący prąd płynie wzdłuż aksoplazmy, aż dotrze do niskooporowego węzła Ranviera z dużą ilością kanałów Na+. W tym miejscu generowany jest potencjał czynnościowy. Potencjał czynnościowy jest przewodzony od węzła do węzła. Nazywa się to przewodzeniem solnym.
Zalety mielinizacji
- Pozwala na szybkie przewodzenie potencjału czynnościowego
- Minimalizuje wymagania metaboliczne komórki.
- Zwiększa zdolność upakowania NS, umożliwiając upakowanie większej liczby włókien w jednym nerwie.
Większość nerwów większych niż 1 mikron jest mielinizowana.
Zaburzenia w przewodzeniu są zwykle spowodowane patologiami demielinizacji. Należą do nich zespół Guillana-Barre’a i stwardnienie rozsiane.
Integracja postsynaptyczna:
Każdy neuron centralny otrzymuje wiele setek synaps. Każde z tych wejść jest następnie integrowane w odpowiedź przez ten konkretny neuron. Wiąże się to z przetwarzaniem wszystkich wejść, które docierają w danym momencie. Nazywa się to sumowaniem przestrzennym. Przetwarzanie danych wejściowych w określonym czasie jest nazywane sumowaniem czasowym. W tym miejscu będzie działała mieszanina synaps pobudzających i hamujących.
Potencjały postsynaptyczne pobudzające
- Wiązanie neuroprzekaźnika prowadzi do otwarcia kanałów jonowych.
- Występuje napływ kationów w procesie postsynaptycznym
- Depolaryzacja błony.
- EPSPs depolaryzacje rejestrowane w komórce postsynaptycznej na określony bodziec pobudzający.
- Depolaryzacje związane z EPSP mogą wywołać AP, jeśli w synapsie nastąpi sumowanie.
Inhibicyjne potencjały postsynaptyczne
- Kanały jonowe umożliwiają napływ anionów do komórek postsynaptycznych, gdy są otwarte.
- Hiperpolaryzacja błony następuje w wyniku napływu CL- i odpływu K+
- ważne dla modulowania odpowiedzi neuronów na pobudzające wejście w synapsie.
- Znajdują się w strategicznie ważnych miejscach neuronu, takich jak proksymalny dendryt i soma.
- Mają duży wpływ na drzewo dendrytyczne
- Niektóre neurony zapewniają własny wpływ hamujący poprzez posiadanie kolaterali aksonalnych i własnych interneuronów hamujących. Jest to określane jako hamowanie zwrotne. Np. neurony ruchowe i komórki Renshawa w rdzeniu kręgowym.
Neuroprzekaźniki, receptory i szlaki
Neuroprzekaźnik jest uwalniany w synapsie i współpracuje ze specyficznym białkiem w błonie postsynaptycznej zwanym receptorem. W niektórych synapsach neuroprzekaźnik może również oddziaływać z autoreceptorem presynaptycznym. PSA działa jako regulator ilości uwalnianego przekaźnika.
Receptory są zwykle specyficzne dla danego neuroprzekaźnika. Istnieje kilka typów receptorów. Współuwolnione neuroprzekaźniki mogą regulować wiązanie innego przekaźnika.
Receptory dla specyficznych neuroprzekaźników mogą być albo sprzężone bezpośrednio z kanałami jonowymi, albo z enzymem błonowym, gdzie wiązanie neuroprzekaźnika z receptorem albo otwiera kanał jonowy poprzez wewnątrzkomórkową kaskadę enzymów, albo pośrednio moduluje prawdopodobieństwo otwarcia innych kanałów jonowych w odpowiedzi na zmiany napięcia. (neuromodulacja)
Aktywowany receptor może powrócić do stanu spoczynku dopiero po usunięciu neuroprzekaźnika w procesie hydrolizy enzymatycznej (wychwytu) do presynaptycznego terminala nerwowego lub do pobliskich komórek glejowych.
Desensytyzacja/Down regulation: Zmniejszenie powinowactwa receptora do przekaźnika w krótkim okresie, w dłuższym okresie prowadzi to do zmniejszenia liczby receptorów.
Nadwrażliwość/regulacja w górę: Zwiększone powinowactwo receptora do transmitera w krótkim okresie czasu może prowadzić do zwiększenia liczby kanałów w długim okresie czasu.
Receptory:
- Ionotropowe: N-metylo-D-asparaginian(NMDA)
- Nie NMDA.
- Metabotropowe : Receptory glutaminianowe związane z białkiem G, które odpowiadają poprzez inicjowanie wewnątrzkomórkowych zdarzeń biochemicznych, modulując przekaźnictwo synaptyczne.
Istnieje duża liczba Neurotransmiterów:
- Aminokwasy pobudzające: są to główne pobudzające NT w OUN. Głównym NT w tej grupie jest Glutaminian, który działa na wielu receptorach.
- Inhibitory Amino Acids: Są to główne neuroprzekaźniki hamujące, z których głównym jest GABA, obecny w całym OUN. Glicyna, występująca głównie w rdzeniu kręgowym.
- Monoaminy: Znalezione w małych grupach neuronów w pniu mózgu, rzutujące szeroko do OUN. Znajdują się w autonomicznym NS. Wiążą się z wieloma receptorami.
- Acetylocholina: Szeroko rozpowszechniona w całym układzie nerwowym, w tym w złączu nerwowo-mięśniowym i autonomicznej NS.
- Neuropeptydy: Znalezione w całym NS. Często uwalniane jednocześnie z innymi NT.
Dodatkowo znaleziono ponad 50 neuroaktywnych peptydów, a nowe są odkrywane regularnie. Wiele z nich jest „współwydzielanych” wraz z małomolekularnym transmiterem. Niemniej jednak, w niektórych przypadkach peptyd jest głównym przekaźnikiem w synapsie. β-endorfina jest stosunkowo dobrze znanym przykładem neuroprzekaźnika peptydowego, ponieważ wchodzi ona w wysoce specyficzne interakcje z receptorami opioidowymi w ośrodkowym układzie nerwowym.
Pojedyncze jony (takie jak synaptycznie uwolniony cynk) są również uważane za neuroprzekaźniki przez niektórych, jak również niektóre cząsteczki gazowe, takie jak tlenek azotu (NO), tlenek węgla (CO) i siarkowodór (H2S). Gazy są produkowane w cytoplazmie neuronów i są natychmiast dyfundowane przez błonę komórkową do płynu pozakomórkowego i do pobliskich komórek, aby stymulować produkcję drugich posłańców. Rozpuszczalne neurotransmitery gazowe są trudne do badania, ponieważ działają szybko i są natychmiast rozkładane, istniejąc tylko przez kilka sekund.
Najbardziej rozpowszechnionym transmiterem jest glutaminian, który jest pobudzający w ponad 90% synaps w ludzkim mózgu. Kolejnym najbardziej rozpowszechnionym jest kwas gamma-aminomasłowy, lub GABA, który jest hamujący w ponad 90% synaps, które nie używają glutaminianu. Mimo że inne przekaźniki są wykorzystywane w mniejszej liczbie synaps, mogą być bardzo ważne funkcjonalnie: zdecydowana większość leków psychoaktywnych wywiera swoje działanie poprzez zmianę działania niektórych układów neuroprzekaźników, często działających poprzez przekaźniki inne niż glutaminian czy GABA. Narkotyki uzależniające, takie jak kokaina i amfetamina, oddziałują przede wszystkim na układ dopaminergiczny. Uzależniające leki opiatowe wywierają swoje działanie przede wszystkim jako funkcjonalne analogi peptydów opioidowych, które z kolei regulują poziom dopaminy.