Editură originală – Joanne Garvey și Naomi O’Reilly
Contribuitori principali – Joanne Garvey, Lucinda hampton, Rachael Lowe, Naomi O’Reilly și Tarina van der Stockt
- Introducere
- Canale ionice
- Tipuri de canale
- Proprietăți fundamentale ale unui canal ionic
- Membrana de repaus și potențialul de acțiune
- Potențialul de acțiune
- Joncțiunea neuromusculară / Sinapsele
- Sinapsa
- Transmisia sinaptică
- Conducția nervoasă
- Axoni nemielinizați
- Axoni mielinizați
- Neurotransmițători, receptori și căi
Introducere
Neurofiziologia este ramura fiziologiei care se ocupă cu funcțiile sistemului nervos. Adică studiul proprietăților funcționale ale neuronilor, glia și rețelelor.
- Din punct de vedere istoric, ea a fost dominată de electrofiziologie – înregistrarea electrică a evenimentelor neuronale, de la cea molară (electroencefalograma, EEG) la cea celulară (înregistrarea intracelulară a proprietăților unui singur neuron).
- Deoarece neuronul este o mașină electrochimică, este imposibil să se separe evenimentele electrice de procesele biochimice și moleculare care le determină.
- Neurofiziologii folosesc astăzi tehnici din chimie (imagistica calciului), fizică (imagistica prin rezonanță magnetică funcțională, fMRI) și biologie moleculară (mutații dirijate pe site) pentru a studia funcția creierului.
În cele ce urmează veți afla totul despre
- Canalele ionice
- Membrana de repaus și potențialul de acțiune
- Joncțiunea neuromusculară / sinapsele
- Conducerea nervoasă
- Neurotransmițătorii, Receptori și căi
Canale ionice
Un canal ionic este o macromoleculă proteică care traversează lățimea unei membrane și permite trecerea moleculelor. Ionii se deplasează într-o direcție determinată de gradientul electrochimic de-a lungul membranei.
- Ionii au tendința de a curge dintr-o zonă de concentrație ridicată către o zonă de concentrație scăzută.
- În prezența unui gradient de tensiune, este posibil să nu existe un flux de ioni în ciuda unor concentrații inegale.
- Canalele de ioni pot fi deschise sau închise.
- Deschiderea este provocată de modificarea tensiunii pe membrană sau de legarea unei substanțe chimice la un receptor.
- Rolul cel mai important este că asigură neuronului excitabilitatea electrică.
- Se găsesc în toate părțile neuronului și, într-o măsură mai mică, în celulele neurogliale.
Tipuri de canale
- Canale activate de tensiune
- Activate chimic
- Întindere/presiune mecanică.
Proprietăți fundamentale ale unui canal ionic
- Este alcătuit dintr-un număr de subunități proteice, așezate de-a lungul membranei, permițând ionilor să treacă dintr-o parte în alta. (Porul transmembranar)
- Canalul trebuie să fie capabil să treacă din starea deschisă în starea închisă și invers.
- Trebuie să fie capabil să se deschidă ca răspuns la stimulii corespunzători.
Câteva canale răspund la stimuli chimici (în special la sinapsă). Aceste canale au receptori specifici pentru acea substanță chimică, care duce la deschiderea canalului.
Membrana de repaus și potențialul de acțiune
- În stare de repaus, membrana celulei neuronale este destul de impermeabilă la ioni. Acest lucru este crucial pentru generarea potențialului membranar de repaus.
- Principalul ion intracelular este Potasiul (Este sodiu în lichidul extracelular).
- Fluxul natural al ionilor prin intermediul gradienților lor de concentrație este ca K+ să iasă din celulă și Na+ să intre.
- Această mișcare a ionilor în afara celulei duce la un potențial de membrană negativ – Hiperpolarizare.
- Opusul este valabil pentru un aflux relativ de ioni – Hipopolarizarea.

Membrana în repaus este relativ impermeabilă la ionii Na+, rămânând permeabilă la ionii K+. Astfel, atunci când membrana este în repaus, va exista o tendință de eflux de ioni K+ în afara celulei, pe gradientul de concentrație al acesteia, lăsând în urmă un exces de sarcină negativă. Acest lucru continuă până când gradientul de concentrație chimică care elimină K+ din celulă se află exact în punctul în care este compensat de diferența de potențial electric generată de acest eflux. (potențialul membranar) K+ este apoi atras înapoi în celulă.
Această stare de echilibru a membranei se numește potențial de echilibru.
Ecuația de obținere a potențialului de echilibru se numește ecuația lui Nernst.
Există de fapt o sarcină pozitivă ușor crescută neașteptată în axoni datorită unei mici permeabilități la ionii Na+ a membranei în stare de repaus. Aceasta este compensată de pompa de schimb Na+/K+ dependentă de ATP. I pompează 3 ioni Na+ pentru fiecare 3 ioni K+ aduși în celulă. Cu toate acestea, aceasta are doar o contribuție infimă la potențialul de membrană în stare de repaus al celulei.
Potențialul de acțiune
Definit ca un „impuls electric unic care trece de-a lungul unui axon”.
Este totul sau nimic în acțiunea sa. Aceasta înseamnă că, odată atins pragul de intensitate a stimulului, va fi generat un potențial de acțiune.
Informația în sistemul nervos este codificată și interpretată prin frecvența de tragere, nu prin mărimea potențialului de acțiune.
Intensitatea de prag a stimulului: Valoarea la care curentul net de intrare (determinat de ionii Na+) este puțin mai mare decât curentul net de ieșire (purtat de ionii K+). În mod normal, este de -55mV (pragul critic de ardere)
PAP se produce cel mai ușor la nivelul cocoașei axonului, deoarece aici există o densitate mai mare de canale de ioni Na+. Din acest motiv, acesta este locul de inițiere a PA în neuron.
Dacă pragul nu este atins, potențialul de acțiune nu va fi generat, iar transmiterea semnalului se termină în acel punct.
Secvența evenimentelor pentru ca un potențial de acțiune să fie generat
- Depolarizarea tensiunii activează canalele ionice Na+ sensibile la tensiune din membrana neuronală: Ionii Na+ curg în jos pe gradientul electrochimic. Membrana este depolarizată în continuare. Alte canale Na+ se deschid într-o buclă de reacție pozitivă. Atunci când există un curent mai mare de intrare a ionilor de sodiu în comparație cu efluxul de ioni K+, are loc o deschidere rapidă a tuturor canalelor Na+. Acest lucru depolarizează membrana spre potențialul de echilibru pentru Na+ (+55mV). Se generează un vârf de PA, dar nu reușește să atingă potențialul de echilibru pentru Na+ din cauza efluxului crescând de K+.
- Pe măsură ce canalele de Na+ devin mai puțin active, PA scade. Această inactivare este dependentă de tensiune. În timpul fazei de cădere, curentul de K+ este important deoarece conduce la o scurtă perioadă de hiperpolarizare a membranei înainte de a se dezactiva.
- Potențialul membranar revine la starea de repaus.
Joncțiunea neuromusculară / Sinapsele
Sinapsa
O sinapsă este joncțiunea a doi neuroni. Sinapsa chimică este cea care predomină în sistemul nervos, însă sinapsele electrice se găsesc în mușchiul cardiac și în celulele gliale.
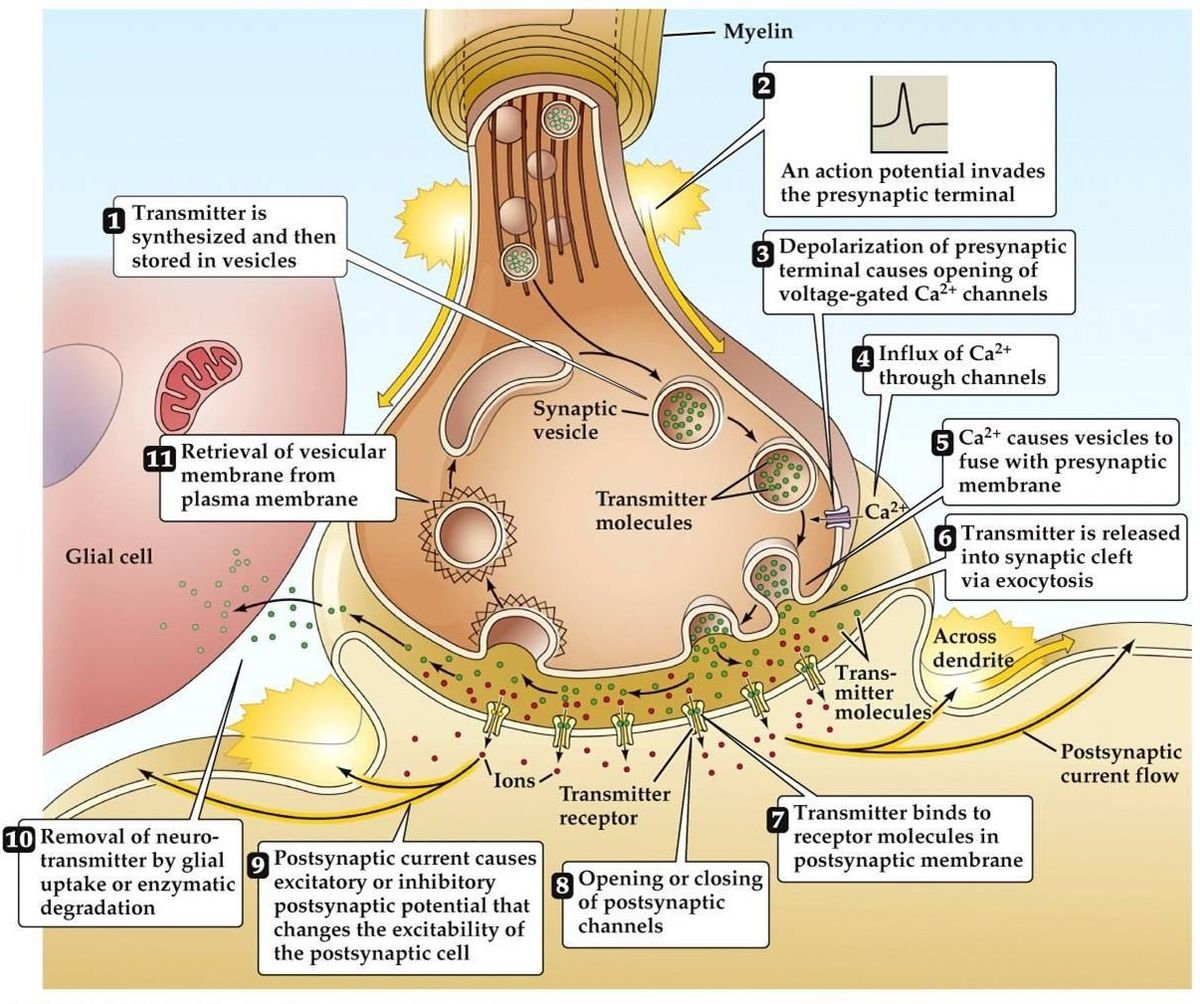
Transmisia sinaptică
- Potențialul de acțiune ajunge, duce la depolarizarea terminalului presinaptic. Canalele Ca2+ dependente de tensiune se deschid în zonele active ale terminalului. Acest lucru duce la influxul de Ca2+.
- Fluxul de Ca2+ duce la fosforilarea și alterarea cantității de proteine presinaptice de legare a calciului. Acest lucru eliberează vezicula din rețeaua de actină presinaptică, Aceasta se leagă apoi de membrana presinaptică.
- Fuziunea veziculei cu membrana duce la formarea unui mic canal, care se extinde rapid și își eliberează conținutul în fanta sinaptică. Membrana veziculei este reciclată prin endocitoză.
- Neurotransmițătorul eliberat difuzează prin fanta sinaptică cu scopul de a se lega de receptorul postsinaptic.
- Activarea receptorului postsinaptic duce la o modificare a potențialului membranar postsinaptic.
- Există teorii alternative care sugerează că neurotransmițătorul este livrat prin intermediul unor molecule sau canale membranare mai degrabă decât prin vezicule.
Conducția nervoasă
Propagarea potențialului de acțiune se realizează prin propagarea locală a curentului.
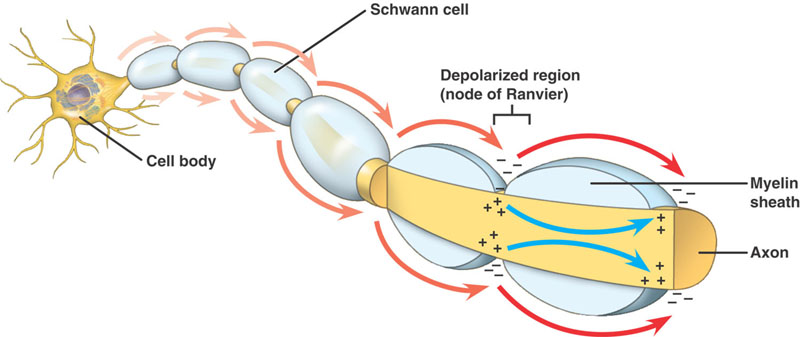
Nervul este izolat cu mielină dacă dimensiunea sa este peste un anumit diametru, cu Nodurile lui Ranvier la diferite intervale de-a lungul lungimii sale.
Axoni nemielinizați
Potențialul de acțiune conduce la depolarizarea membranei aflate imediat în față (și în spate). Membrana se află într-o stare refractară, astfel încât potențialul de acțiune este condus doar într-o singură direcție. Acest lucru este fezabil în axonii mici, dar răspândirea curentului este lentă.
Axoni mielinizați
Aceeași secvență de evenimente ca la axonii nemielinizați. Există totuși o diferență semnificativă. Potențialul de acțiune în progresie întâlnește o structură cu rezistență ridicată și capacitate scăzută – mielina înfășurată în jurul axonului. Curentul de depolarizare trece de-a lungul axoplasmei, până când ajunge la Nodul Ranvier, cu rezistență scăzută, cu o cantitate mare de canale Na+. Potențialul de acțiune este apoi generat în acest loc. Potențialul de acțiune este condus de la un nod la altul. Acest lucru se numește Conducere săritoare.
Avantajele mielinizării
- Permite o conducere rapidă a potențialului de acțiune
- Minimizează solicitările metabolice ale celulei.
- Crește capacitatea de împachetare a NS, permițând înghesuirea mai multor fibre în 1 nerv.
Majoritatea nervilor mai mari de 1 micron sunt mielinizați.
Disturbările în conducere se datorează în mod normal patologiilor de demielinizare. Acestea includ sindromul Guillan Barre și scleroza multiplă.
Integrarea postsinaptică:
Care neuron central primește mai multe sute de sinapse. Fiecare dintre aceste intrări este apoi integrată într-un răspuns de către acel neuron particular. Acest lucru implică procesarea tuturor intrărilor care sosesc la un moment dat. Acest lucru se numește însumare spațială. Prelucrarea intrărilor pe o anumită perioadă de timp se numește însumare temporală. În acest punct va exista un amestec de sinapse excitatoare și inhibitoare care acționează.
Potențiali postsinaptici excitatori
- Legăturarea neurotransmițătorului duce la deschiderea canalelor ionice.
- Se produce un influx de cationi în procesul postsinaptic
- Se produce o dezpolarizare a membranei.
- Depolarizări EPSP înregistrate în celula post-sinaptică la un anumit stimul excitator.
- Depolarizările asociate cu EPSP pot continua să declanșeze PA dacă are loc o însumare la nivelul sinapsei.
Potențiali postsinaptici inhibitori
- Canalele de ioni permit influxul de anioni postsinaptici atunci când sunt deschise.
- Se produc hiperpolarizări ale membranei datorită influxului de CL- și efluxului de K+
- important pentru modularea răspunsului neuronilor la intrarea excitatorie la nivelul sinapsei.
- Se găsește în locuri strategic importante ale neuronului, cum ar fi dendrita proximală și soma.
- Au o mare influență asupra arborelui dendritic
- Câțiva neuroni își asigură propria influență inhibitorie prin faptul că au colaterale axonale și interneuronii inhibitori proprii. Aceasta se numește inhibiție prin feedback. De ex. motoneuronii și celulele Renshaw din măduva spinării.
Neurotransmițători, receptori și căi
Neurotransmițătorul este eliberat la sinapsă și lucrează cu o proteină specifică din membrana postsinaptică numită receptor. În unele sinapse, se poate constata că neurotransmițătorul interacționează și cu un autoreceptor presinaptic. PSA acționează ca un regulator al cantității de transmițător eliberat.
Receptorii sunt, în mod normal, specifici pentru un anumit neurotransmițător. Există mai multe tipuri de receptori. Neurotransmițătorii coeliberați pot regla legarea unui alt transmițător.
Receptorii pentru neurotransmițători specifici pot fi fie cuplați direct la canale ionice, fie la o enzimă de membrană, unde legarea neurotransmițătorului la receptor fie deschide un canal ionic prin intermediul unei cascade enzimatice intracelulare, fie modulează indirect probabilitatea deschiderii altor canale ionice ca răspuns la modificări de tensiune. (neuromodularea)
Receptorul activat poate reveni la starea sa de repaus numai după ce neurotransmițătorul este eliminat prin procesul de hidroliză enzimatică (absorbție) în terminalul nervos presinaptic sau în celulele gliale din apropiere.
Desensibilizare/Down regulation: O scădere a afinității receptorului pentru transmițător pe termen scurt, pe termen lung, acest lucru duce la o scădere a numărului de receptori.
Supersensibilitate/Reglare ascendentă: O afinitate crescută a receptorului pentru emițător pe termen scurt poate duce, pe termen lung, la o creștere a numărului de canale.
Receptorii:
- Ionotropi: N-metil-D-aspartat(NMDA)
- Nu NMDA.
- Metabotropici : Receptorii de glutamat asociați cu proteina G care răspund prin inițierea unor evenimente biochimice intracelulare, modulând transmisia sinaptică.
Există un număr mare de neurotransmițători:
- Aminoacizi excitanți: Aceștia sunt principalii NT excitanți din SNC. Principalul NT din acest grup este glutamatul care acționează la un număr de receptori.
- Aminoacizi inhibitori: Aceștia sunt principalii neurotransmițători inhibitori, dintre care principalul este GABA, prezent în tot SNC. Glicina, care se găsește în principal în măduva spinării.
- Monoaminele: Se găsesc în grupuri mici de neuroni din trunchiul cerebral, care se proiectează pe scară largă în SNC. Se găsesc în NS autonom. Se leagă de o serie de receptori.
- Acetilcolină: Distribuită pe scară largă în tot sistemul nervos, inclusiv în joncțiunea neuromusculară și în NS autonom.
- Neuropeptide: Se găsesc peste tot în NS. Adesea eliberate simultan cu alte NT.
În plus, au fost descoperite peste 50 de peptide neuroactive, iar altele noi sunt descoperite în mod regulat. Multe dintre acestea sunt „coeliberate” împreună cu un transmițător cu moleculă mică. Cu toate acestea, în unele cazuri, o peptidă este transmițătorul principal la o sinapsă. β-endorfina este un exemplu relativ bine cunoscut de neurotransmițător peptidic, deoarece aceasta se angajează în interacțiuni foarte specifice cu receptorii opioizi din sistemul nervos central.
Ionii singuri (cum ar fi zincul eliberat sinaptic) sunt, de asemenea, considerați de unii neurotransmițători, precum și unele molecule gazoase, cum ar fi oxidul nitric (NO), monoxidul de carbon (CO) și hidrogenul sulfurat (H2S). Gazele sunt produse în citoplasma neuronală și sunt imediat difuzate prin membrana celulară în lichidul extracelular și în celulele din apropiere pentru a stimula producția de mesageri secundari. Neurotransmițătorii gazoși solubili sunt dificil de studiat, deoarece acționează rapid și sunt imediat descompuse, existând doar pentru câteva secunde.
Cel mai răspândit emițător este glutamatul, care este excitator la mai bine de 90% din sinapsele din creierul uman. Următorul cel mai răspândit este acidul gama-aminobutiric, sau GABA, care este inhibitor la mai mult de 90% din sinapsele care nu folosesc glutamat. Deși alți transmițători sunt utilizați în mai puține sinapse, aceștia pot fi foarte importanți din punct de vedere funcțional: marea majoritate a drogurilor psihoactive își exercită efectele prin alterarea acțiunilor unor sisteme de neurotransmițători, acționând adesea prin alți transmițători decât glutamatul sau GABA. Drogurile care creează dependență, cum ar fi cocaina și amfetaminele, își exercită efectele în primul rând asupra sistemului dopaminei. Medicamentele opiacee care dau dependență își exercită efectele în primul rând ca analogi funcționali ai peptidelor opioide, care, la rândul lor, reglează nivelurile de dopamină.