Éditeur original – Joanne Garvey et Naomi O’Reilly
Principaux contributeurs – Joanne Garvey, Lucinda hampton, Rachael Lowe, Naomi O’Reilly et Tarina van der Stockt
- Introduction
- Canaux ioniques
- Types de canaux
- Propriétés fondamentales d’un canal ionique
- Membrane au repos et potentiel d’action
- Potentiel d’action
- Jonction neuromusculaire / Synapses
- Synapse
- Transmission synaptique
- Conduction nerveuse
- Axe non myélinisé
- Axiomes myélinisés
- Neurotransmetteurs, récepteurs et voies
Introduction
La neurophysiologie est la branche de la physiologie traitant des fonctions du système nerveux. ie L’étude des propriétés fonctionnelles des neurones, de la glie et des réseaux.
- Historiquement, elle a été dominée par l’électrophysiologie – l’enregistrement électrique des événements neuronaux allant du molaire (l’électroencéphalogramme, EEG) au cellulaire (enregistrement intracellulaire des propriétés des neurones uniques).
- Comme le neurone est une machine électrochimique, il est impossible de séparer les événements électriques des processus biochimiques et moléculaires qui les provoquent.
- Les neurophysiologistes utilisent aujourd’hui des techniques issues de la chimie (imagerie calcique), de la physique (imagerie par résonance magnétique fonctionnelle, IRMf) et de la biologie moléculaire (mutations dirigées vers un site) pour étudier le fonctionnement du cerveau.
Vous apprendrez tout sur
- Canaux ioniques
- Membrane de repos et potentiel d’action
- Jonction neuromusculaire / Synapses
- Conduction nerveuse
- Neurotransmetteurs, Récepteurs et voies
Canaux ioniques
Un canal ionique est une macromolécule protéique qui traverse la largeur d’une membrane et permet le passage de molécules. Les ions se déplacent dans une direction déterminée par le gradient électrochimique à travers la membrane.
- Les ions ont tendance à s’écouler d’une zone de forte concentration vers une zone de faible concentration.
- En présence d’un gradient de tension, il peut n’y avoir aucun flux d’ions malgré des concentrations inégales.
- Les canaux ioniques peuvent être ouverts ou fermés.
- L’ouverture est provoquée par la modification de la tension à travers la membrane, ou la liaison d’une substance chimique à un récepteur.
- Le rôle le plus important est qu’ils assurent l’excitabilité électrique du neurone.
- On les trouve dans toutes les parties du neurone et dans une moindre mesure dans les cellules neurogliales.
Types de canaux
- Voltage Gated
- Activé chimiquement
- Etirement mécanique/pression.
Propriétés fondamentales d’un canal ionique
- Il est constitué d’un certain nombre de sous-unités protéiques, siégeant à travers la membrane, permettant aux ions de passer d’un côté à l’autre. (Pore transmembranaire)
- Le canal doit être capable de passer de l’état ouvert à l’état fermé, et inversement.
- Il doit être capable de s’ouvrir en réponse aux stimuli appropriés.
Certains canaux répondent à un stimulus chimique (notamment au niveau de la synapse). Ces canaux ont des récepteurs spécifiques pour ce produit chimique, ce qui entraîne l’ouverture du canal.
Membrane au repos et potentiel d’action
- À l’état de repos, la membrane des cellules neuronales est assez imperméable aux ions. Ceci est crucial pour la génération du potentiel membranaire de repos.
- Le principal ion intracellulaire est le Potassium (C’est le sodium dans le liquide extracellulaire).
- Le flux naturel des ions par le biais de leurs gradients de concentration est que le K+ quitte la cellule et que le Na+ y entre.
- Ce mouvement des ions hors de la cellule conduit à un potentiel de membrane négatif – Hyperpolarisation.
- L’inverse est vrai pour un afflux relatif d’ions – Hypopolarisation.

La membrane au repos est relativement imperméable aux ions Na+, tout en restant perméable aux ions K+. Ainsi, lorsque la membrane est au repos, il aura tendance à y avoir un efflux d’ions K+ hors de la cellule, le long de son gradient de concentration, laissant derrière lui un excès de charge négative. Ce phénomène se poursuit jusqu’à ce que le gradient de concentration chimique qui chasse le K+ de la cellule soit exactement au point où il est compensé par la différence de potentiel électrique générée par cet efflux. (le potentiel de membrane) Le K+ est alors attiré de nouveau dans la cellule.
Cet état d’équilibre de la membrane est appelé le potentiel d’équilibre.
L’équation permettant de dériver le potentiel d’équilibre est appelée équation de Nernst.
Il y a en fait une charge positive légèrement accrue inattendue dans les axones en raison d’une faible perméabilité aux ions Na+ de la membrane à l’état de repos. Ceci est compensé par la pompe d’échange Na+/K+ dépendante de l’ATP. Cette pompe expulse 3 ions Na+ pour chaque 3 ions K+ introduits dans la cellule. Cependant, elle ne contribue que très peu au potentiel membranaire de repos de la cellule.
Potentiel d’action
Défini comme une « impulsion électrique unique passant le long d’un axone ».
C’est tout ou rien dans son action. Cela signifie qu’une fois le seuil d’intensité du stimulus atteint, un potentiel d’action sera généré.
L’information dans le système nerveux est codée et interprétée par la fréquence des tirs, et non par la taille du potentiel d’action.
Intensité seuil du stimulus : La valeur à laquelle le courant net entrant(déterminé par les ions Na+) est juste supérieur au courant net sortant (porté par les ions K+). Elle est normalement de -55mV (seuil critique d’allumage)
Le PA se produit le plus facilement au niveau de la butée axonale car c’est là que se trouve une plus grande densité de canaux ioniques Na+. C’est pour cette raison que c’est le site d’initiation du PA dans le neurone.
Si le seuil n’est pas atteint, le potentiel d’action ne sera pas généré, et la transmission du signal se termine à ce moment-là.
Séquence d’événements pour qu’un potentiel d’action soit généré
- La tension dépolarisante active les canaux ioniques Na+ sensibles au voltage dans la membrane neuronale : Les ions Na+ s’écoulent le long du gradient électrochimique. La membrane est encore dépolarisée. D’autres canaux Na+ s’ouvrent dans une boucle de rétroaction positive. Lorsqu’il y a un courant entrant d’ions sodium plus important que l’efflux d’ions K+, il y a une ouverture rapide de tous les canaux Na+. Cela dépolarise la membrane vers le potentiel d’équilibre pour Na+ (+55mV). Un pic de PA est généré, mais ne parvient pas à atteindre le potentiel d’équilibre pour Na+ en raison de l’efflux croissant de K+.
- Lorsque les canaux Na+ deviennent moins actifs, le PA chute. Cette inactivation est dépendante du voltage. Pendant la phase de chute, le courant K+ est important car il conduit à une courte période d’hyperpolarisation de la membrane avant de se désactiver.
- Le potentiel membranaire revient à l’état de repos.
Jonction neuromusculaire / Synapses
Synapse
Une synapse est la jonction de deux neurones. La synapse chimique est celle qui prédomine dans le système nerveux, cependant les synapses électriques sont présentes dans le muscle cardiaque et les cellules gliales.
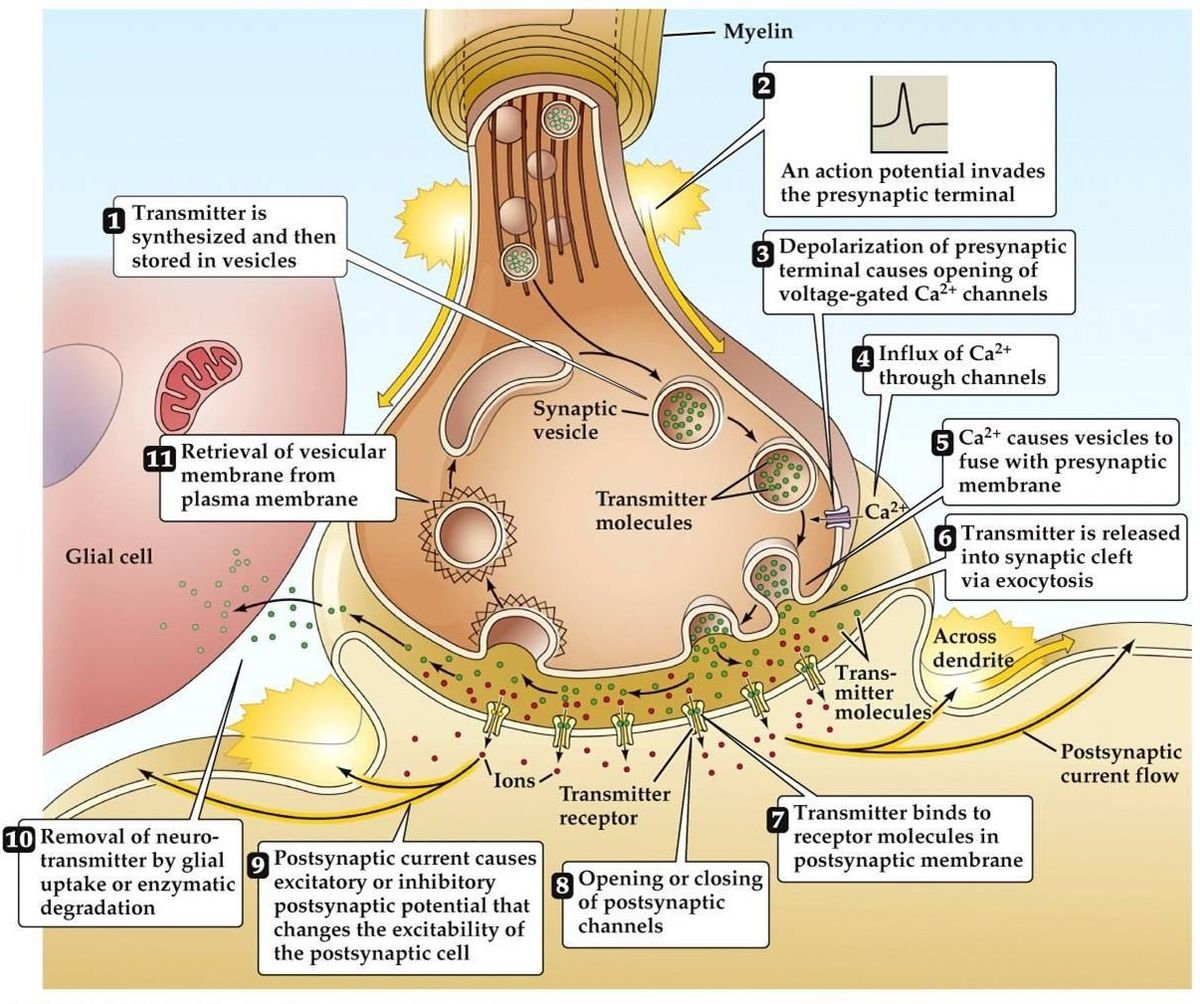
Transmission synaptique
- Le potentiel d’action arrive, entraîne une dépolarisation de la borne présynaptique. Les canaux Ca2+ voltage dépendant s’ouvrent dans les zones actives de la borne. Cela conduit à un influx de Ca2+.
- L’influx de Ca2+ entraîne la phosphorylation et la modification de la quantité de protéines de liaison au calcium présynaptique. Cela libère la vésicule de son réseau d’actine présynaptique, Elle se lie alors à la membrane présynaptique.
- La fusion de la vésicule à la membrane entraîne la formation d’un petit canal, qui s’élargit rapidement et libère son contenu dans la fente synaptique. La membrane de la vésicule est recyclée par endocytose.
- Le neurotransmetteur libéré diffuse dans la fente synaptique dans le but de se lier au récepteur postsynaptique.
- L’activation du récepteur postsynaptique entraîne une modification du potentiel de la membrane postsynaptique.
- Il existe des théories alternatives qui suggèrent que le neurotransmetteur est délivré par des molécules ou des canaux membranaires plutôt que par des vésicules.
Conduction nerveuse
La propagation du potentiel d’action est réalisée par une propagation locale du courant.
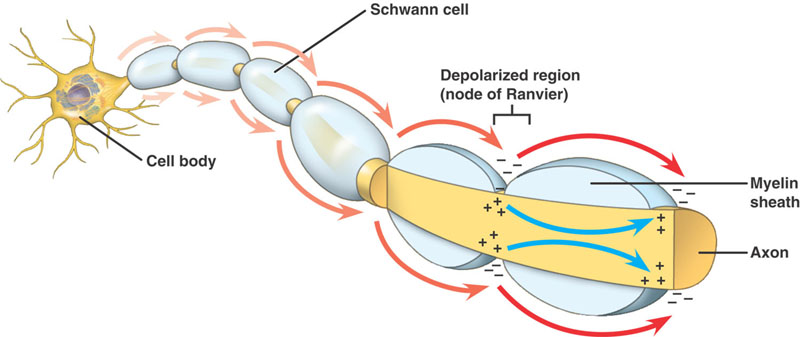
Le nerf est isolé par de la myéline si sa taille est supérieure à un certain diamètre, avec les Nœuds de Ranvier à différents intervalles sur sa longueur.
Axe non myélinisé
Le potentiel d’action entraîne une dépolarisation de la membrane immédiatement devant (et derrière). La membrane est dans un état réfractaire, donc le potentiel d’action n’est conduit que dans 1 direction. Ceci est réalisable dans les petits axones, mais la propagation du courant est lente.
Axiomes myélinisés
Même séquence d’événements que dans les axones non myélinisés. Il existe cependant une différence importante. Le potentiel d’action qui progresse rencontre une structure à haute résistance et à faible capacité – la myéline enroulée autour de l’axone. Le courant de dépolarisation passe le long de l’axoplasme, jusqu’à ce qu’il atteigne le nœud de Ranvier, de faible résistance, avec sa grande quantité de canaux Na+. Le potentiel d’action est alors généré à cet endroit. Le potentiel d’action est conduit de nœud en nœud. C’est ce qu’on appelle la conduction saltatoire.
Avantages de la myélinisation
- Permet une conduction rapide du potentiel d’action
- Minimise les demandes métaboliques de la cellule.
- Augmente la capacité de tassement du SN, permettant d’entasser plus de fibres dans 1 nerf.
La plupart des nerfs de plus d’un micron sont myélinisés.
Les perturbations de la conduction sont normalement dues à des pathologies de démyélinisation. Elles comprennent le syndrome de Guillan Barre et la sclérose en plaques.
Intégration post-synaptique :
Chaque neurone central reçoit plusieurs centaines de synapses. Chacune de ces entrées est ensuite intégrée dans une réponse par ce neurone particulier. Cela implique de traiter toutes les entrées qui arrivent à un moment donné. C’est ce qu’on appelle la sommation spatiale. Le traitement des entrées sur une période de temps donnée est appelé sommation temporelle. Il y aura un mélange de synapses excitatrices et inhibitrices agissant à ce point.
Excitateur Potentiels post-synaptiques
- La liaison du neurotransmetteur entraîne l’ouverture des canaux ioniques.
- Il y a un afflux de cations dans le processus post-synaptique
- La dépolarisation de la membrane se produit.
- Dépolarisations EPSPs enregistrées dans la cellule post-synaptique à un stimulus excitateur particulier.
- Les dépolarisations associées aux EPSP peuvent aller jusqu’à déclencher des PA si une sommation se produit au niveau de la synapse.
Potentiels postsynaptiques inhibiteurs
- Les canaux ioniques permettent l’influx d’anions postsynaptiques lorsqu’ils sont ouverts.
- Des hyperpolarisations de la membrane se produisent en raison de l’influx de CL- et de l’efflux de K+
- important pour moduler la réponse des neurones à l’entrée excitatrice à la synapse.
- On les trouve dans des sites stratégiquement importants du neurone tels que la dendrite proximale et le soma.
- Ils ont une grande influence sur l’arbre dendritique
- Certains neurones fournissent leur propre influence inhibitrice en ayant des collatéraux axonaux et leurs propres interneurones inhibiteurs. On parle alors de rétro-inhibition. Par exemple, les motoneurones et les cellules de Renshaw dans la moelle épinière.
Neurotransmetteurs, récepteurs et voies
Le neurotransmetteur est libéré à la synapse et fonctionne avec une protéine spécifique dans la membrane postsynaptique appelée récepteur. Dans certaines synapses, le neurotransmetteur peut également se trouver en interaction avec un autorécepteur présynaptique. L’APS agit comme un régulateur de la quantité de transmetteur libéré.
Les récepteurs sont normalement spécifiques d’un neurotransmetteur particulier. Il existe plusieurs types de récepteurs. Les neurotransmetteurs co-libérés peuvent réguler la liaison d’un autre transmetteur.
Les récepteurs de neurotransmetteurs spécifiques peuvent être soit couplés directement à des canaux ioniques, soit à une enzyme membranaire où la liaison du neurotransmetteur au récepteur ouvre soit un canal ionique via une cascade d’enzymes intracellulaires, soit moduler indirectement la probabilité d’ouverture d’autres canaux ioniques en réponse à des variations de tension. (neuromodulation)
Le récepteur activé ne peut revenir à son état de repos qu’une fois le neurotransmetteur éliminé par le processus d’hydrolyse enzymatique (absorption) dans la borne nerveuse présynaptique ou dans les cellules gliales voisines.
Désensibilisation/Régulation à la baisse : Diminution de l’affinité du récepteur pour le transmetteur à court terme, à long terme, cela entraîne une diminution du nombre de récepteurs.
Supersensibilité/régulation à la hausse : Une affinité accrue du récepteur pour le transmetteur à court terme peut conduire à une augmentation des canaux à long terme.
Récepteurs :
- Ionotropes : N-méthyl-D-aspartate(NMDA)
- Non NMDA.
- Métabotrope : Récepteurs du glutamate associés aux protéines G qui répondent en initiant des événements biochimiques intracellulaires, modulant la transmission synaptique.
Il existe un grand nombre de neurotransmetteurs :
- Acides aminés excitateurs : ce sont les principaux NT excitateurs du SNC. Le principal NT de ce groupe est le Glutamate qui agit sur un certain nombre de récepteurs.
- Acides aminés inhibiteurs : Ce sont les principaux neurotransmetteurs inhibiteurs, dont le principal est le GABA, présent dans tout le SNC. La glycine, présente principalement dans la moelle épinière.
- Monoamines : Se trouvent dans de petits groupes de neurones dans le tronc cérébral, se projetant largement dans le SNC. Se trouvent dans le SN autonome. Elles se lient à une foule de récepteurs.
- Acétylcholine : Largement distribuée dans tout le système nerveux, y compris la jonction neuromusculaire et le SN autonome.
- Neuropeptides : Se trouvent partout dans le SN. Souvent libérés simultanément avec d’autres NT.
En outre, plus de 50 peptides neuroactifs ont été trouvés, et de nouveaux sont découverts régulièrement. Beaucoup d’entre eux sont « co-livrés » en même temps qu’un transmetteur à petite molécule. Néanmoins, dans certains cas, un peptide est le principal transmetteur au niveau d’une synapse. La β-endorphine est un exemple relativement bien connu de neurotransmetteur peptidique car elle s’engage dans des interactions très spécifiques avec les récepteurs opioïdes du système nerveux central.
Des ions simples (tels que le zinc libéré au niveau synaptique) sont également considérés comme des neurotransmetteurs par certains, ainsi que certaines molécules gazeuses telles que l’oxyde nitrique (NO), le monoxyde de carbone (CO) et le sulfure d’hydrogène (H2S). Les gaz sont produits dans le cytoplasme neural et sont immédiatement diffusés à travers la membrane cellulaire dans le liquide extracellulaire et dans les cellules voisines pour stimuler la production de seconds messagers. Les neurotransmetteurs gazeux solubles sont difficiles à étudier, car ils agissent rapidement et sont immédiatement dégradés, n’existant que quelques secondes.
Le transmetteur le plus répandu est le glutamate, qui est excitateur sur bien plus de 90% des synapses du cerveau humain. Le deuxième plus répandu est l’acide gamma-aminobutyrique, ou GABA, qui est inhibiteur dans plus de 90 % des synapses qui n’utilisent pas le glutamate. Bien que d’autres transmetteurs soient utilisés dans moins de synapses, ils peuvent être très importants sur le plan fonctionnel : la grande majorité des drogues psychoactives exercent leurs effets en modifiant les actions de certains systèmes de neurotransmetteurs, agissant souvent par le biais de transmetteurs autres que le glutamate ou le GABA. Les drogues addictives telles que la cocaïne et les amphétamines exercent leurs effets principalement sur le système de la dopamine. Les drogues opiacées addictives exercent leurs effets principalement en tant qu’analogues fonctionnels des peptides opioïdes, qui, à leur tour, régulent les niveaux de dopamine.