Ursprüngliche Herausgeberin – Joanne Garvey und Naomi O’Reilly
Mitwirkende – Joanne Garvey, Lucinda Hampton, Rachael Lowe, Naomi O’Reilly und Tarina van der Stockt
Einführung
Neurophysiologie ist der Zweig der Physiologie, der sich mit den Funktionen des Nervensystems beschäftigt. D.h. die Untersuchung der funktionellen Eigenschaften von Neuronen, Glia und Netzwerken.
- Historisch gesehen wurde sie von der Elektrophysiologie dominiert – der elektrischen Aufzeichnung neuronaler Ereignisse, die vom molaren (Elektroenzephalogramm, EEG) bis zum zellulären (intrazelluläre Aufzeichnung der Eigenschaften einzelner Neuronen) reicht.
- Da das Neuron eine elektrochemische Maschine ist, ist es unmöglich, elektrische Ereignisse von den biochemischen und molekularen Prozessen zu trennen, die sie hervorbringen.
- Neurophysiologen verwenden heute Techniken aus der Chemie (Kalzium-Imaging), der Physik (funktionelle Magnetresonanztomographie, fMRI) und der Molekularbiologie (ortsgerichtete Mutationen), um die Gehirnfunktion zu untersuchen.
Im Folgenden erfahren Sie alles über
- Ionenkanäle
- Ruhende Membran und Aktionspotential
- Neuromuskuläre Verzweigung / Synapsen
- Nervenleitung
- Neurotransmitter, Rezeptoren und Leitungsbahnen
Ionenkanäle
Ein Ionenkanal ist ein Proteinmakromolekül, das die Breite einer Membran durchquert und Moleküle durchlässt. Die Ionen bewegen sich in eine Richtung, die durch das elektrochemische Gefälle in der Membran bestimmt wird.
- Ionen neigen dazu, von einem Bereich mit hoher Konzentration zu einem Bereich mit niedriger Konzentration zu fließen.
- Beim Vorhandensein eines Spannungsgradienten kann es trotz ungleicher Konzentrationen zu keinem Ionenfluss kommen.
- Ionenkanäle können offen oder geschlossen sein.
- Das Öffnen wird durch eine Änderung der Spannung an der Membran oder durch die Bindung einer chemischen Substanz an einen Rezeptor bewirkt.
- Die wichtigste Rolle ist, dass sie das Neuron mit elektrischer Erregbarkeit versorgen.
- Vorkommen in allen Teilen des Neurons und in geringerem Maße in den Neurogliazellen.
Kanaltypen
- Spannungsgesteuert
- Chemisch aktiviert
- Mechanische Dehnung/Druck.
Grundlegende Eigenschaften eines Ionenkanals
- Er besteht aus einer Reihe von Proteinuntereinheiten, die quer über die Membran sitzen und es Ionen ermöglichen, von einer Seite zur anderen zu gelangen. (Transmembranpore)
- Der Kanal muss in der Lage sein, vom offenen in den geschlossenen Zustand und zurück zu wechseln.
- Der Kanal muss sich als Reaktion auf die entsprechenden Reize öffnen können.
Einige Kanäle reagieren auf chemische Reize (insbesondere an der Synapse). Diese Kanäle haben spezifische Rezeptoren für diese Chemikalie, die zur Kanalöffnung führt.
Ruhemembran und Aktionspotential
- Im Ruhezustand ist die neuronale Zellmembran ziemlich undurchlässig für Ionen. Dies ist entscheidend für die Erzeugung des Ruhemembranpotentials.
- Das wichtigste intrazelluläre Ion ist Kalium (in der extrazellulären Flüssigkeit ist es Natrium).
- Der natürliche Fluss der Ionen über ihre Konzentrationsgradienten besteht darin, dass K+ die Zelle verlässt und Na+ eintritt.
- Diese Bewegung von Ionen aus der Zelle heraus führt zu einem negativen Membranpotential – Hyperpolarisation.
- Das Gegenteil gilt für einen relativen Zustrom von Ionen – Hypopolarisation.

Die ruhende Membran ist relativ undurchlässig für Na+-Ionen, während sie für K+-Ionen durchlässig bleibt. Wenn sich die Membran in Ruhe befindet, kommt es also zu einem Abfluss von K+-Ionen aus der Zelle über den Konzentrationsgradienten, wobei eine überschüssige negative Ladung zurückbleibt. Dies setzt sich so lange fort, bis der chemische Konzentrationsgradient, der das K+ aus der Zelle verdrängt, genau an dem Punkt ist, an dem er durch die elektrische Potenzialdifferenz ausgeglichen wird, die durch diesen Abfluss entsteht (das Membranpotenzial). (das Membranpotential) K+ wird dann wieder in die Zelle gezogen.
Dieser stationäre Zustand der Membran wird als Gleichgewichtspotential bezeichnet.
Die Gleichung zur Ableitung des Gleichgewichtspotentials wird als Nernst-Gleichung bezeichnet.
Es gibt tatsächlich eine leicht unerwartete erhöhte positive Ladung in Axonen aufgrund einer geringen Durchlässigkeit der Membran für Na+-Ionen im Ruhezustand. Dies wird durch die ATP-abhängige Na+/K+-Austauschpumpe ausgeglichen. Sie pumpt 3 Na+-Ionen für je 3 K+-Ionen, die in die Zelle eingebracht werden, aus. Sie trägt aber nur geringfügig zum Ruhemembranpotential der Zelle bei.
Aktionspotential
Definiert als ein „einzelner elektrischer Impuls, der ein Axon entlangläuft“.
Es handelt sich um ein Alles-oder-Nichts-Potential. Das bedeutet, dass ein Aktionspotential entsteht, sobald die Schwellenreizintensität erreicht ist.
Informationen im Nervensystem werden durch die Frequenz des Feuerns kodiert und interpretiert, nicht durch die Größe des Aktionspotentials.
Schwellenwert der Reizintensität: Der Wert, bei dem der Nettoeinwärtsstrom (bestimmt durch Na+-Ionen) gerade größer ist als der Nettoauswärtsstrom (getragen von K+-Ionen). Sie liegt normalerweise bei -55mV (kritische Zündschwelle)
Der AP tritt am ehesten am Axonhügel auf, weil dort eine größere Dichte an Na+-Ionenkanälen vorhanden ist. Aus diesem Grund ist dies der Ort der AP-Initiierung im Neuron.
Wenn der Schwellenwert nicht erreicht wird, wird das Aktionspotential nicht erzeugt und die Signalübertragung wird an diesem Punkt beendet.
Abfolge der Ereignisse für die Erzeugung eines Aktionspotenzials
- Eine ansteigende Spannung aktiviert die spannungsempfindlichen Na+-Ionenkanäle in der neuronalen Membran: Na+-Ionen fließen den elektrochemischen Gradienten hinunter. Die Membran wird weiter depolarisiert. Weitere Na+-Kanäle öffnen sich in einer positiven Rückkopplungsschleife. Wenn der Einstrom von Natrium-Ionen größer ist als der Ausstrom von K+-Ionen, öffnen sich schnell alle Na+-Kanäle. Dies führt zu einer Depolarisation der Membran in Richtung des Gleichgewichtspotenzials für Na+ (+55 mV). Es entsteht eine AP-Spitze, die jedoch das Gleichgewichtspotenzial für Na+ aufgrund des zunehmenden K+-Effluxes nicht erreicht.
- Wenn die Na+-Kanäle weniger aktiv werden, sinkt das AP. Diese Inaktivierung ist spannungsabhängig. Während der abfallenden Phase ist der K+-Strom wichtig, da er zu einer kurzen Periode der Membranhyperpolarisation führt, bevor er deaktiviert wird.
- Das Membranpotential kehrt in den Ruhezustand zurück.
Neuromuskuläre Verbindung / Synapsen
Synapse
Eine Synapse ist die Verbindung zwischen zwei Neuronen. Die chemische Synapse ist die vorherrschende Synapse im Nervensystem, elektrische Synapsen finden sich jedoch in Herzmuskel- und Gliazellen.
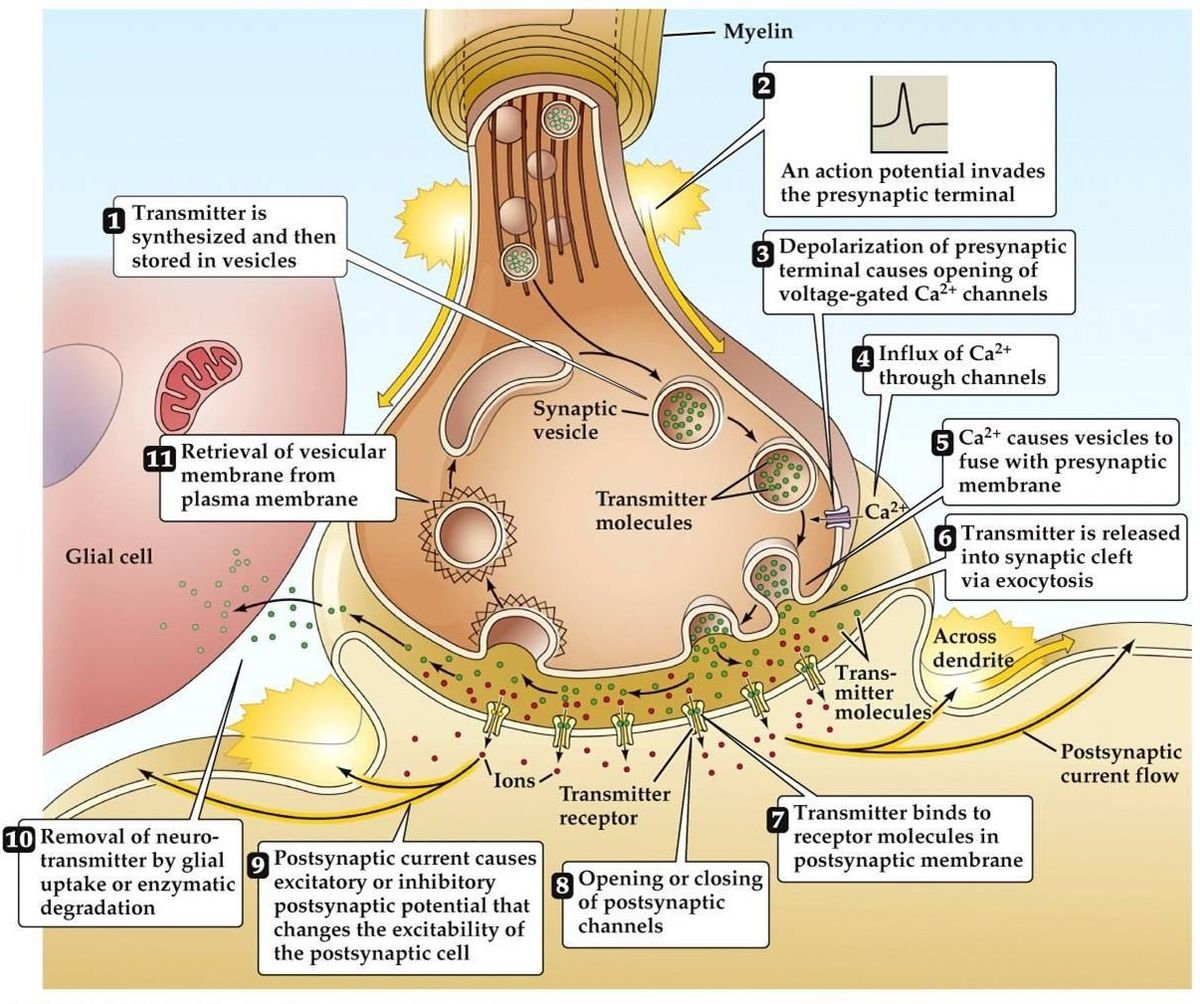
Synaptische Übertragung
- Das Eintreffen des Aktionspotentials führt zu einer Depolarisation des präsynaptischen Terminals. Spannungsabhängige Ca2+-Kanäle öffnen sich in den aktiven Zonen des Terminals. Dies führt zum Einstrom von Ca2+.
- Der Einstrom von Ca2+ führt zur Phosphorylierung und Veränderung der Menge präsynaptischer kalziumbindender Proteine. Dadurch wird das Vesikel von seinem präsynaptischen Aktin-Netzwerk befreit und bindet sich dann an die präsynaptische Membran.
- Die Verschmelzung des Vesikels mit der Membran führt zur Bildung eines kleinen Kanals, der sich schnell ausdehnt und seinen Inhalt in den synaptischen Spalt entlässt. Die Vesikelmembran wird durch Endozytose recycelt.
- Der freigesetzte Neurotransmitter diffundiert durch den synaptischen Spalt mit dem Ziel der Bindung an den postsynaptischen Rezeptor.
- Die Aktivierung des postsynaptischen Rezeptors führt zu einer Veränderung des postsynaptischen Membranpotentials.
- Es gibt alternative Theorien, die davon ausgehen, dass der Neurotransmitter über Moleküle oder Membrankanäle und nicht über Vesikel übertragen wird.
Nervenleitung
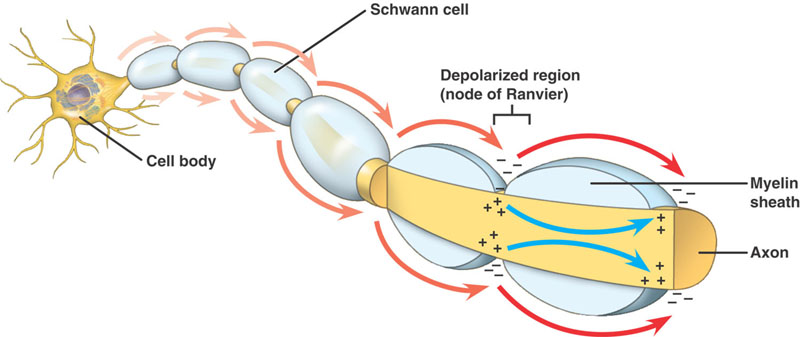
Die Ausbreitung des Aktionspotentials wird durch lokale Stromausbreitung erreicht.
Der Nerv ist ab einem bestimmten Durchmesser mit Myelin isoliert, mit Ranvier-Knoten in verschiedenen Abständen entlang seiner Länge.
Unmyelinisierte Axone
Das Aktionspotential führt zu einer Depolarisation der unmittelbar davor (und dahinter) liegenden Membran. Die Membran befindet sich in einem refraktären Zustand, so dass das Aktionspotenzial nur in eine Richtung geleitet wird. Dies ist bei kleinen Axonen möglich, aber die Stromausbreitung ist langsam.
Myelinisierte Axone
Die gleiche Abfolge von Ereignissen wie bei den nicht-myelinisierten Axonen. Es gibt jedoch einen wesentlichen Unterschied. Das fortschreitende Aktionspotenzial trifft auf eine Struktur mit hohem Widerstand und geringer Kapazität – das Myelin, das das Axon umhüllt. Der depolarisierende Strom fließt entlang des Axoplasmas, bis er den niederohmigen Ranvier-Knoten mit seiner großen Anzahl von Na+-Kanälen erreicht. An dieser Stelle wird dann das Aktionspotenzial erzeugt. Das Aktionspotenzial wird von Knoten zu Knoten weitergeleitet. Dies wird als Saltatorische Leitung bezeichnet.
Vorteile der Myelinisierung
- Ermöglicht eine schnelle Leitung des Aktionspotentials
- Minimiert die metabolischen Anforderungen an die Zelle.
- Erhöht die Packungskapazität des NS, so dass mehr Fasern in einen Nerv gezwängt werden können.
Die meisten Nerven, die größer als 1 Mikrometer sind, sind myelinisiert.
Störungen der Reizleitung sind in der Regel auf Demyelinisierungspathologien zurückzuführen. Dazu gehören das Guillan-Barre-Syndrom und die Multiple Sklerose.
Postsynaptische Integration:
Jedes zentrale Neuron erhält viele Hunderte von Synapsen. Jede dieser Eingaben wird dann von dem jeweiligen Neuron in eine Reaktion integriert. Dazu müssen alle Eingänge, die zu einem bestimmten Zeitpunkt eintreffen, verarbeitet werden. Dies wird als räumliche Summierung bezeichnet. Die Verarbeitung von Eingaben über einen bestimmten Zeitraum hinweg wird als zeitliche Summierung bezeichnet. Es gibt eine Mischung aus erregenden und hemmenden Synapsen, die an diesem Punkt wirken.
Erregende postsynaptische Potenziale
- Die Bindung von Neurotransmittern führt zur Öffnung von Ionenkanälen.
- Einstrom von Kationen im postsynaptischen Prozess
- Eine Depolarisation der Membran findet statt.
- EPSPs Depolarisationen in der postsynaptischen Zelle auf einen bestimmten Erregungsreiz.
- Depolarisationen, die mit EPSPs einhergehen, können APs auslösen, wenn es an der Synapse zu einer Summierung kommt.
Inhibitorische postsynaptische Potenziale
- Ionenkanäle ermöglichen den postsynaptischen Anioneneinstrom, wenn sie geöffnet sind.
- Hyperpolarisationen der Membran entstehen durch den Einstrom von CL- und den Ausstrom von K+
- wichtig für die Modulation der Reaktion des Neurons auf den erregenden Input an der Synapse.
- Findet sich an strategisch wichtigen Stellen des Neurons, wie dem proximalen Dendriten und dem Soma.
- Sie haben einen großen Einfluss auf den Dendritenbaum
- Einige Neuronen üben ihren eigenen hemmenden Einfluss aus, indem sie Axonkollaterale und ihre eigenen hemmenden Interneuronen haben. Dies wird als Rückkopplungshemmung bezeichnet. Z.B. Motorneuronen und Renshaw-Zellen im Rückenmark.
Neurotransmitter, Rezeptoren und Signalwege
Der Neurotransmitter wird an der Synapse freigesetzt und arbeitet mit einem spezifischen Protein in der postsynaptischen Membran, dem Rezeptor. In einigen Synapsen kann der Neurotransmitter auch mit einem präsynaptischen Autorezeptor interagieren. Der PSA wirkt als Regulator für die Menge des freigesetzten Transmitters.
Rezeptoren sind normalerweise spezifisch für einen bestimmten Neurotransmitter. Es gibt verschiedene Arten von Rezeptoren. Gemeinsam freigesetzte Neurotransmitter können die Bindung eines anderen Transmitters regulieren.
Rezeptoren für bestimmte Neurotransmitter können entweder direkt an Ionenkanäle oder an ein Membranenzym gekoppelt sein, wobei die Bindung des Neurotransmitters an den Rezeptor entweder einen Ionenkanal über eine intrazelluläre Enzymkaskade öffnet oder indirekt die Wahrscheinlichkeit der Öffnung anderer Ionenkanäle in Reaktion auf Spannungsänderungen moduliert. (Neuromodulation)
Der aktivierte Rezeptor kann nur in seinen Ruhezustand zurückkehren, wenn der Neurotransmitter durch den Prozess der enzymatischen Hydrolyse (Aufnahme) in die präsynaptische Nervenendigung oder in die nahe gelegenen Gliazellen entfernt wird.
Desensibilisierung/Down-Regulation: Kurzfristige Abnahme der Affinität des Rezeptors für den Transmitter, langfristig führt dies zu einer Abnahme der Anzahl der Rezeptoren.
Supersensitivität/Hochregulation: Eine kurzfristig erhöhte Affinität des Rezeptors für den Transmitter kann langfristig zu einer Zunahme der Kanäle führen.
Rezeptoren:
- Ionotrope: N-Methyl-D-Aspartat(NMDA)
- Nicht NMDA.
- Metabotrop: G-Protein-assoziierte Glutamatrezeptoren, die durch die Initiierung intrazellulärer biochemischer Ereignisse reagieren und die synaptische Übertragung modulieren.
Es gibt eine große Anzahl von Neurotransmittern:
- Exzitatorische Aminosäuren: Dies sind die wichtigsten erregenden NTs im ZNS. Die wichtigste NT in dieser Gruppe ist Glutamat, das an einer Reihe von Rezeptoren wirkt.
- Hemmende Aminosäuren: Dies sind die wichtigsten hemmenden Neurotransmitter, von denen der wichtigste GABA ist, der überall im ZNS vorkommt. Glycin, das hauptsächlich im Rückenmark vorkommt.
- Monoamine: Gefunden in kleinen Gruppen von Neuronen im Hirnstamm, die weit in das ZNS projizieren. Sie kommen im autonomen NS vor. Sie binden an eine Vielzahl von Rezeptoren.
- Acetylcholin: Weit verbreitet im gesamten Nervensystem, einschließlich der neuromuskulären Verbindung und des autonomen NS.
- Neuropeptide: Überall im NS zu finden. Werden oft gleichzeitig mit anderen NTs freigesetzt.
Zusätzlich wurden über 50 neuroaktive Peptide gefunden, und es werden regelmäßig neue entdeckt. Viele von ihnen werden zusammen mit einem niedermolekularen Transmitter „freigesetzt“. In einigen Fällen ist jedoch ein Peptid der primäre Transmitter an einer Synapse. β-Endorphin ist ein relativ bekanntes Beispiel für einen Peptid-Neurotransmitter, da es hochspezifische Interaktionen mit Opioidrezeptoren im zentralen Nervensystem eingeht.
Einzelne Ionen (wie z. B. synaptisch freigesetztes Zink) werden von einigen ebenfalls als Neurotransmitter angesehen, ebenso wie einige gasförmige Moleküle wie Stickstoffmonoxid (NO), Kohlenmonoxid (CO) und Schwefelwasserstoff (H2S). Die Gase werden im neuronalen Zytoplasma produziert und diffundieren sofort durch die Zellmembran in die extrazelluläre Flüssigkeit und in benachbarte Zellen, um die Produktion von Botenstoffen anzuregen. Lösliche Gasneurotransmitter sind schwer zu untersuchen, da sie schnell wirken und sofort abgebaut werden und nur wenige Sekunden lang existieren.
Der am weitesten verbreitete Transmitter ist Glutamat, das an weit über 90 % der Synapsen im menschlichen Gehirn erregend wirkt. Der zweithäufigste Transmitter ist Gamma-Aminobuttersäure (GABA), die in mehr als 90 % der Synapsen, die kein Glutamat verwenden, hemmend wirkt. Obwohl andere Transmitter in weniger Synapsen verwendet werden, können sie funktionell sehr wichtig sein: Die große Mehrheit der psychoaktiven Drogen übt ihre Wirkung aus, indem sie die Aktionen einiger Neurotransmittersysteme verändert, die oft über andere Transmitter als Glutamat oder GABA wirken. Suchtmittel wie Kokain und Amphetamine üben ihre Wirkung vor allem auf das Dopaminsystem aus. Die süchtig machenden Opiate üben ihre Wirkung in erster Linie als funktionelle Analoga von Opioidpeptiden aus, die wiederum den Dopaminspiegel regulieren.