- meta-synthese
- Over
- Onze websites
- Web Boekhoofdstukken
 |
 |
 |
Ralph Pearson introduceerde zijn Hard Soft Acid Base (HSAB) principe in het begin van de jaren zestig, en probeerde daarmee de anorganische en organische reactiechemie te verenigen. De impact van het nieuwe idee was onmiddellijk, maar in de loop der jaren is het HSAB principe eerder terzijde geschoven terwijl andere benaderingen die tegelijkertijd werden ontwikkeld, zoals de frontier moleculaire orbitaal (FMO) theorie en de moleculaire mechanica, tot bloei zijn gekomen.
Deze pagina bespreekt de diepgaande beperkingen van de Pearson benadering en vergelijkt & het HSAB principe met de chemogenese analyse zoals die in dit webboek wordt gepresenteerd.
Note, in dit webboek:
| Lewis zuren zijn ROOD | Lewis basen zijn BLAUW |
- Irving-Williams stabiliteitsreeksen
- Ahrland’s Type A, Type B Analyse
- Railsback’s Geochemische Analyse
- Pearson’s HSAB Principle (The Hard Soft Acid Base Principle)
- Pearson’s HSAB Classificatie Systeem, van hier:
- Jensen’s Review of the HSAB Principle
- Klopman’s FMO-analyse
- Combinatie van Pearson’s en Klopman’s ideeën
- The Ho Paper
- Het HSAB-principe voor organische & Hoofdgroepchemici
- Problemen, problemen, problemen…
- Fajans’ regels
- Dus, wat is er aan de hand?
- Vergelijking van de “Top Down” HSAB Analyse met de “Bottom Up” Chemogenese Analyse
- De HSAB Papers:
- Andere post-Pearson analyse
Irving-Williams stabiliteitsreeksen
De Irving-Williams stabiliteitsreeksen (1953) wezen erop dat voor een gegeven ligand de stabiliteit van dipositieve metaalion complexen toeneemt:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Het was ook bekend dat bepaalde liganden hun meest stabiele complexen vormden met metaalionen zoals Al3+, Ti4+ & Co3+ terwijl andere stabiele complexen vormden met Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analyse
In 1958 classificeerden Ahrland et al. de metaalkationen in als Type A en Type B, waarbij:
Type A metaalkationen omvatten:
- Alkalimetaalkationen: Li+ tot Cs+
- Alkalische aardmetaalkationen: Be2+ t/m Ba2+
- Lichtere overgangsmetaalkationen in hogere oxidatietoestanden: Ti4+, Cr3+, Fe3+, Co3+
- Het proton, H+
Metaalkationen van type B zijn onder andere:
- Zwaardere overgangsmetaalkationen in lagere oxidatietoestanden: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
Liganden, chemische entiteiten die complexen vormen met metaalkationen, werden geclassificeerd als Type A of Type B, afhankelijk van het feit of ze stabielere complexen vormden met metaalkationen van Type A of Type B, vanaf hier:
|
Neiging van ligand tot complex
met metaalkationen van type A |
Neiging van ligand tot complex
met type B-metalen |
|
N >> P > As > Sb > Bi O >> S > Se > Te F >> Cl > Br > I |
N << P > As > Sb > Bi O << S ~ Se ~ Te F < Cl < Br << I |
Vanuit deze analyse, kan een empirische regel worden afgeleid:
Metalen van type A binden (complexeren) zich bij voorkeur aan Liganden van type A
en
Metalen van type B binden (complexeren) zich bij voorkeur aan Liganden van type B
Deze empirische – experimenteel afgeleide – regels vertellen ons dat Metalen van type A meer kans hebben om oxiden te vormen, carbonaten, nitriden en fluoriden, terwijl type B-metalen eerder fosfiden, sulfiden en seliniden vormen.
Railsback’s Geochemische Analyse
De “Type A, Type B”-analyse is van groot economisch belang omdat:
- Sommige metalen worden in de natuur gevonden als Type A metaal + Type A ligand mineralen, zoals carbonaten: MgCO3 en CaCO3 en oxiden: Fe2O3 en TiO2
- Andere worden gevonden als Type B metaal + Type B ligand mineralen, bijvoorbeeld de sulfide-ertsen: PbS, CdS, NiS, enz.
Deze benadering is zeer succesvol ontwikkeld in door Bruce Railsback met zijn uitstekende en zeer aan te bevelen “Earth Scientist’s Periodic Table website”.
Klik op de afbeelding om te vergroten:
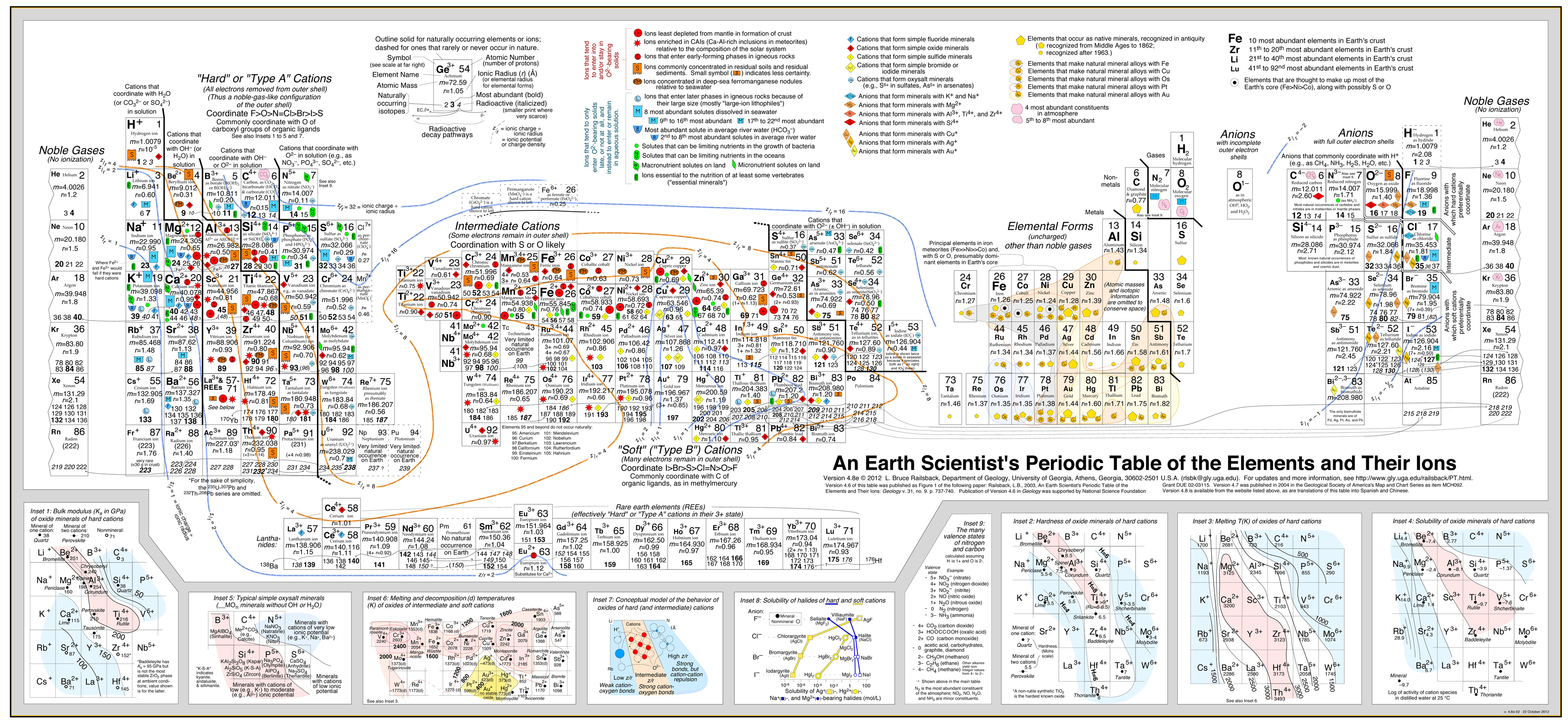
- De Railsback analyse maakt gebruik van contouren van het gedrag gesuperponeerd op het periodiek systeem.
- Zie de paper: A Synthesis of Systematic Mineralogy van Bruce Railsback waarin deze analyse wordt uitgewerkt.
Pearson’s HSAB Principle (The Hard Soft Acid Base Principle)
In de jaren zestig heeft Ralph Pearson de Type A-Type B logica sterk uitgebreid door het differentiële complexatiegedrag van kationen en liganden te verklaren in termen van elektronpaar accepterende Lewiszuren en elektronpaar donerende Lewisbasen:
Lewis zuur + Lewis base → Lewis zuur/base complex
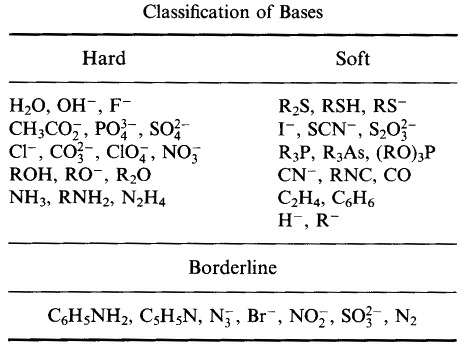
Pearson classificeerde Lewis zuren en Lewis basen als hard, borderline of zacht.
Volgens Pearson’s hard zacht zuur base (HSAB) principe:
Harde zuren binden zich bij voorkeur aan Harde basen
en
Zachte zuren binden zich bij voorkeur aan Zachte basen
Op het eerste gezicht lijkt de HSAB-analyse nogal op het Type A- en Type B-systeem.
Pearson classificeerde echter een zeer breed scala van atomen, ionen, moleculen en moleculaire ionen als hard, borderline of zacht, waarmee hij de analyse van de traditionele metaal/ligand anorganische chemie verplaatste naar – en combineerde met – het rijk van de organische chemie.
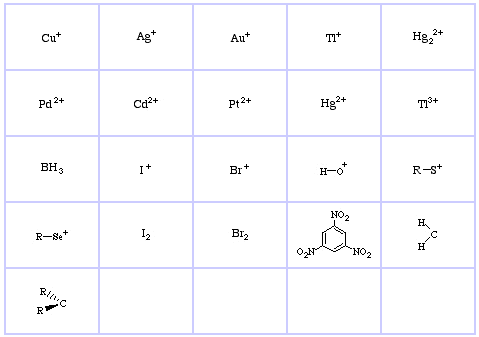
Pearson’s HSAB Classificatie Systeem, van hier:
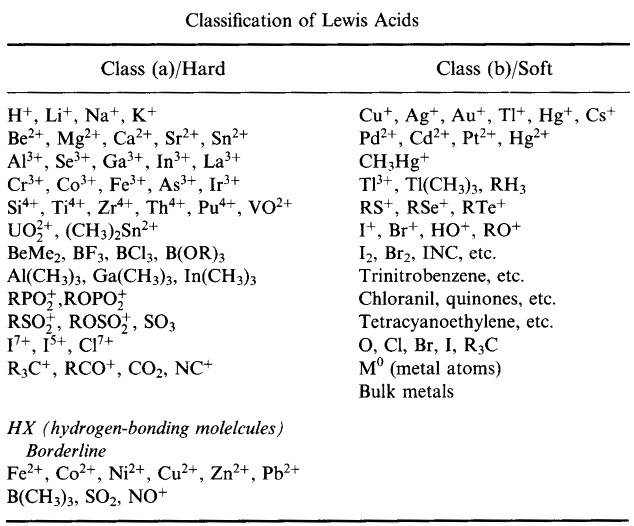
Pearson’s Hard Lewis Acids (van de Chemical Thesaurus), hier, en van de congeneric array database, hier:
Pearson’s Borderline Lewis Acids, hier, en hier:
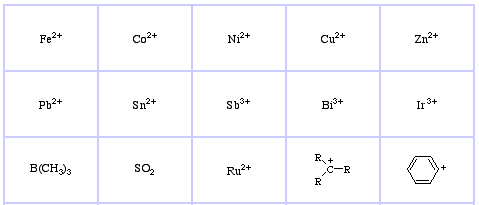
Pearson’s Soft Lewis Acids, hier, en hier:
Pearson’s Hard Lewis Bases (uit The Chemical Thesaurus), hier, en uit de congeneric array database, hier:
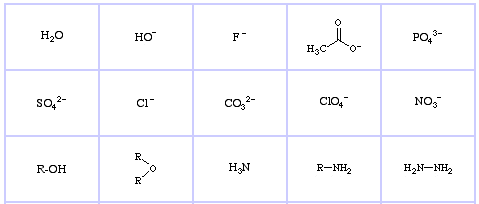
Pearson’s Borderline Lewis Bases, hier, en hier:

Pearson’s Soft Lewis Bases, hier, en hier:
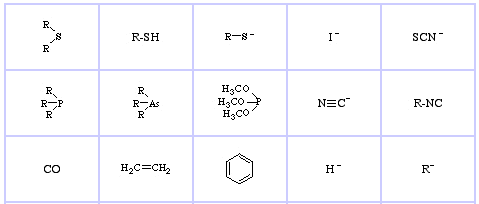
Jensen’s Review of the HSAB Principle
William (Bill) Jensen presenteerde drie papers in het ACS journal Chemistry, vol 47 (1974), Lewis Acid-Base Theory: Deel I maart pp 11-14; Deel II april pp 13-18; Deel III mei pp 14-18. Deel III behandelt Pearsons HSAB-analyse.
De gecombineerde paper – die zowel uitstekend als gedetailleerd is – is beschikbaar op Bill’s webruimte (en een kloon van het bestand kan van deze website worden gedownload).
Klopman’s FMO-analyse
In 1968 probeerde G. Klopman Pearsons HSAB-principe te kwantificeren met behulp van de frontier molecular orbital (FMO) theorie, zoals elders in dit webboek besproken, hier, met deze vergelijking:
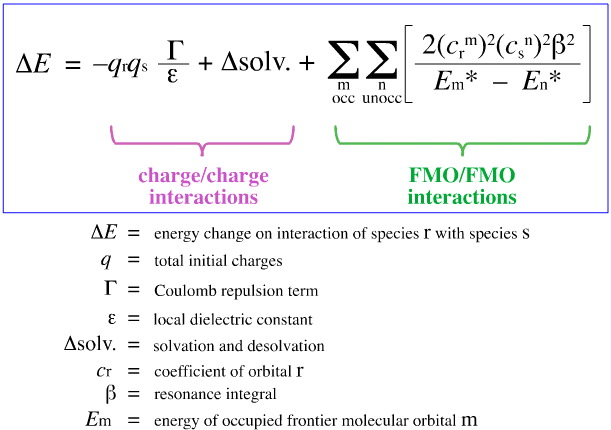
Klopman stelde voor dat:
Harde zuren binden zich aan harde basen om lading-gecontroleerde (ionische) complexen te vormen. Dergelijke interacties worden gedomineerd door de +/ ladingen op de interagerende soorten.
en
Zachte zuren binden zich aan zachte basen om FMO-gecontroleerde complexen te vormen. Deze interacties worden gedomineerd door de energieën van de deelnemende frontier moleculaire orbitalen (FMO), de hoogst bezette moleculaire orbitaal (HOMO) en de laagst niet-bezette moleculaire orbitaal (LUMO).
Lees meer elders in het Chemogenesis webboek, hier, of kijk naar Ian Fleming’s Organic Chemistry and FMO theory hier, waar deze ideeën uitvoerig worden uitgewerkt.
Met behulp van de bovenstaande analyse worden de bijdragende aspecten van lading-gecontroleerde en FMO-gecontroleerde Lewiszuur/base complexatie gescheiden en gekwantificeerd, een cruciale ontwikkeling.
Combinatie van Pearson’s en Klopman’s ideeën
Harde Lewiszuren:
Atoomkernen met kleine ionstraal
Hoge positieve lading
Soorten bevatten geen elektronenparen in hun valentieschillen
Lage elektronenaffiniteit
Waarschijnlijk sterk oplosbaar
Hoge energie LUMOZachte Lewiszuren:
Grote straal
Lage of gedeeltelijke δ+ positieve lading
Elektronenparen in hun valentieschillen
Gemakkelijk te polariseren en te oxideren
LUMO’s met lage energie, maar LUMO-coëfficiënten van grote omvangHarde Lewisbasen:
Kleine, sterk opgeloste, elektronegatieve atoomkernen: 3.0-4.0
Hoge LUMO-coëfficiëntenHarde Lewisbasen:
Kleine, sterk oplosbare, elektronegatieve atoomkernen: 3.0-4.0
0-4.0
Soorten zijn zwak polariseerbaar
Moeilijk te oxideren
Hoge energie HOMOZachte Lewis basen:
Grote atomen met intermediaire elektronegativiteit: 2.5-3.0
Gemakkelijk te polariseren en te oxideren
Lage energie HOMO’s maar grote magnitude HOMO coëfficiëntenGrenssoorten hebben intermediaire eigenschappen.
Er staat een kwalificatie in Klopman’s paper die zegt dat: het niet noodzakelijk is dat soorten alle eigenschappen bezitten.
The Ho Paper
Pearson suggereerde dat hard-naar-zacht trends gevonden konden worden in de groepen 15, 16 en 17 van het periodiek systeem. In 1975 werd het idee uitgebreid door Tse Lok Ho die realistische chemische soorten gebruikte en de term congenerisch (van dezelfde familie) bedacht, waarbij congenerische soorten isoelectronisch zijn (dezelfde buitenste schil Lewis-structuur hebben).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Harde en zachte zuren en basen, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., The Hard Soft Acids Bases (HSAB) Principle and Organic Chemistry Chemistry Reviews 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
Het HSAB-principe voor organische & Hoofdgroepchemici
Voor onze doeleinden hoofdgroep- en organische reactiechemie is de Pearson-benadering het meest succesvol bij het vergelijken van paren van soorten:
- Het natriumion, Na+, is een harder Lewiszuur dan het zilverion, Ag+
- Alkoxide-ionen, RO, zijn hardere Lewisbasen dan thioanionen, RS
- Koper(II)-ion, Cu2+, is een harder Lewiszuur dan het koper(I)-ion, Cu+
- Het stikstofanionuiteinde van het ambidentate cyanide-ion, CN, is een hardere Lewis base dan het zachtere koolstofanionuiteinde, NC
- Het ambidentate enolaation, heeft een hard oxyanion Lewis base centrum terwijl het carbanion centrum een zachtere Lewis base is en meer nucleofiel
Dit type analyse kan zeer nuttig zijn bij het verklaren van reactieselectiviteit.
Bij voorbeeld, β-propiolacton – een reactieve cyclische ester – wordt de ring geopend door nucleofiele Lewisbasen. De aanval kan op twee plaatsen plaatsvinden en nucleofielen vertonen regioselectiviteit:
- Hardere nucleofielen zoals het alkoxide-ion, R-O, vallen de acyl (carbonyl) koolstof aan.
- Zachtere nucleofielen zoals het cyanide-ion, NC, en het thioanion, R-S, vallen de β-alkyl koolstof aan.
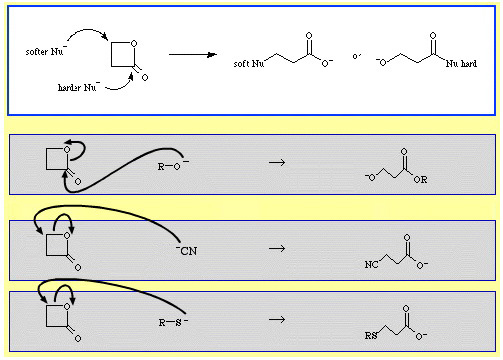
Er zijn een flink aantal voorbeelden van ambidentate selectiviteit in The Chemical Thesaurus reaction chemistry database:
- Eliminatie vs Substitutie met 1,2-Dichloorethaan
- Eliminatie vs Substitutie met 2-Broompropaan
- β-Propiolacton
- Cyanide-ion
- Enolaat-ionen
- Nitriet-ion
- Sulffinaat-ion
- Thiocyanaat-ion
Problemen, problemen, problemen…
Echter, er zijn ernstige problemen met Pearson’s analyse. Hoewel het Pearson-Klopman HSAB model niet helemaal fout is… vereenvoudigt het wel op grove wijze de bekende reactiechemie, zoals Ralph Pearson zelf erkent:
Aan het begin van zijn boek uit 1997, Chemical Hardness, Wiley-VCH, pp 3-4, schrijft Ralph Pearson openhartig:
“Met nomenclatuur is het mogelijk om een eenvoudige, algemene uitspraak te doen:
“Harde zuren coördineren bij voorkeur met harde basen, en zachte zuren coördineren bij voorkeur met zachte basen.”
“Dit is het Principe van Harde en Zachte Zuren en Basen, of het HSAB Principe.
“Merk op dat dit Principe eenvoudigweg een herformulering is van het experimentele bewijsmateriaal dat leidde tot . Het is een verkorte verklaring van een zeer grote hoeveelheid chemische informatie. Als zodanig zou het een wet genoemd kunnen worden. Maar dit etiket lijkt pretentieus gezien het ontbreken van een kwantitatieve definitie van hardheid.
“HSAB is geen theorie, omdat het geen verklaring geeft voor variaties in de sterkte van chemische bindingen. Het woord ‘liever’ in het HSAB-beginsel impliceert een tamelijk bescheiden effect.
“Zachtheid is niet de enige factor die de waarde van ΔH° in de vergelijking bepaalt:
A + :B → A:B
“Er zijn veel voorbeelden van zeer sterke bindingen tussen paren die niet bij elkaar passen, zoals H2, gevormd uit hard H+ en zacht H.
“H2O, OH en O2 zijn allemaal geclassificeerd als harde basen, maar er zijn grote verschillen in hun basissterkte, volgens welk criterium dan ook.”
RP
Dus… (!)
Eén probleem is dat de volledige reeks van harde-grens-zachte interacties en complexaties eenvoudigweg niet in aanmerking wordt genomen bij de Pearson-analyse. Kijk eens hoe leeg de HSAB interactie matrix is:
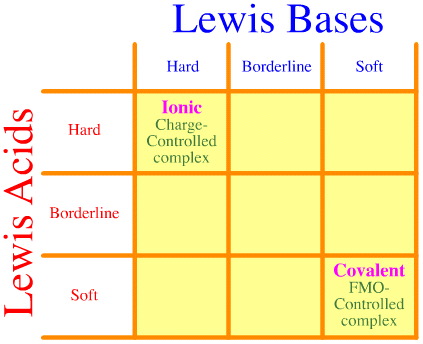
Het Pearson HSAB principe stelt dat “harde zuren bij voorkeur binden aan harde basen en dat zachte zuren bij voorkeur binden aan zachte basen”, wat waar kan zijn, maar het zegt niets over gemengde hard-zachte complexen.
Klopman stelt eenvoudigweg zeer onbehulpzaam dat dergelijke interacties “ongedefinieerd” zijn!
Toch zijn veel van de meest interessante reagentia van de organische en anorganische reactiechemie hard-zachte “gespannen” complexen:
| Natriumhydride |
NaH
|
Na+
|
H
|
| Lithiumaluminiumhydride |
LiAlH4
|
Al3+
|
H
|
| Lead(IV) acetaat |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Methyljodide |
CH3I
|
CH3+
|
I
|
| Methyllithium |
CH3Li
|
Li+
|
CH3
|
| Triethyloxoniumtetrafluoroboraat |
+
|
CH3CH2+
|
:OR2
|
| Ferroceen |
Fe(Cp)2
|
Fe2+
|
|
|
Hard
|
Borderline
|
Soft
|
In vergelijking, de rijkdom van de bekende reactiechemie ontstaat op natuurlijke wijze in de Lewis zuur/base interactie matrix, een centraal principe van de chemogenese analyse (maar we lopen het gevaar op de zaken vooruit te lopen, zie de volgende pagina’s & hier).
Er zijn twee observaties/regels, en beide hebben betrekking op congenerische arrays van iso-elektronische/isoreactieve soorten:
- Congenerische arrays worden altijd gevonden binnen de cellen van de Lewis zuur/base wisselwerkingsmatrix, en niet kruisend over cellen.
- Harde-naar-zachte trends komen voor binnen congenerische arrays, maar ze kruisen nooit tussen arrays.
Fajans’ regels
De Pearson-Klopman HSAB analyse is ook in directe tegenspraak met de welbekende “Fajans’ regels” (ontwikkeld in de jaren 1915-24), ook al lijkt geen enkele andere auteur zich tot nu toe met deze kwestie te hebben beziggehouden.
Ionisch-covalent karakter in binaire materialen van metaal plus niet-metaal kan worden berekend met behulp van de Pauling-vergelijking, hier, maar het verschil in elektronegativiteit onderschat het effect van polarisatie: de mate waarin het ene atoom de elektronenwolk van het andere vervormt of polariseert.
Fajans regels zeggen:
- Een klein positief ion is sterk polariseerbaar, begunstigt covalentie, en voor een gegeven kation neemt het covalente karakter toe naarmate het anion groter wordt.
- Grote negatieve ionen zijn sterk polariseerbaar, begunstigen covalentie, en voor een gegeven anion neemt het covalente karakter toe naarmate het kation kleiner wordt.
- Covalent karakter neemt toe met toenemende ionische lading op beide ionen.
- Polarisatie, en dus covalentie, wordt bevorderd als het positieve ion geen edelgasconfiguratie heeft. Dit is belangrijk voor kationen zoals: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Een voorbeeld:
Beschouw berylliumchloride, BeCl2 in vergelijking met de andere alkalische aarde chloriden: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Cation
|
Ionic
Radius |
Eneg.
|
% Ionisch van
naar Cl- binding |
Bond & Materiaal
Type |
|
Be2+
|
41
|
1.57
|
34
|
Covalent/Moleculair
|
|
Mg2+
|
86
|
1.31
|
42
|
Ionisch zout
|
|
Ca2+
|
114
|
1.00
|
51
|
Ionisch zout
|
|
Sr2+
|
132
|
0.95
|
52
|
Ionisch zout
|
|
Ba2+
|
149
|
0.89
|
54
|
Ionisch zout
|
Ionische straalgegevens van webelementen
Berylliumchloride, BeCl2, is covalent: het watervrije materiaal is oplosbaar in organische oplosmiddelen, het sublimeert (in vacuüm), en het gesmolten materiaal is een slechte geleider van elektriciteit. MgCl2, CaCl2, SrCl2 en BaCl2 zijn ionische materialen en de gesmolten zouten zijn uitstekende elektrische geleiders.
- Fajans regels verklaren deze chemie duidelijk door te zeggen dat het zeer kleine, hoog geladen Be2+ ion in staat is de elektronenwolken van relatief grote chloride-ionen te polariseren (vervormen) tot covalente bindingen en daardoor een molecuulstructuur te geven.
- De HSAB-analyse van Pearson-Klopman stelt dat het berylliumion, het kleinste van de metaalkationen van groep II, ook het hardste is. Beryllium ion zouten zouden daarom extreme lading gecontroleerde binding moeten vertonen en aanleiding moeten geven tot ionische materialen, maar dat doen zij niet.
- De chemogenesis analyse, hier, zegt dat Groep II kationen: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, een congenerische reeks van geladen s-LUMO Lewiszuren vormen, dat lineaire gedragstrends over deze reeks worden gevonden.
Deze lineaire gedragstendensen kunnen worden toegeschreven aan “hard-zacht” gedrag, indien gewenst, maar de termen “hard” en “zacht” kunnen alleen worden gebruikt met betrekking tot de congenerische reeks in kwestie en “hard-zacht” vergelijkingen kunnen niet worden gemaakt met betrekking tot andere Lewiszuren.
Dus, wat is er aan de hand?
Het punt is dat geen enkele fysische parameter correleert met hardheid over de door Pearson gekozen verzameling van soorten. Dit schept dubbelzinnigheden, zoals met de organische chemie van het fluoride-ion, hier, en de tegenspraak met de regels van Fajans, hierboven.
Het Pearson-model houdt geen rekening met de FMO-geometrie (de vormen & fasen van de deelnemende orbitalen). Bijvoorbeeld, hoe vergelijkbaar zijn Pearsons harde zuren:
H+ + BF3 CO2 Cs+ Cu2+ ?
Of, hoe vergelijkbaar zijn Pearsons zachte basen:
H R2S: H3C benzeen ?
Cruciaal voor organische en hoofdgroepchemici is dat de HSAB-analyse weinig/niets zegt over het belangrijke carbeniumion (carbocatie) Lewiszuur, H3C+, of de carbanion Lewisbasis, H3C.
Gedrukte bewering
Het eendimensionale harde-grenslijn-zachte continuüm van Pearsons analyse heeft in feite tot gevolg dat veel van het rijke, lineaire (voorspelbare) gedrag dat kan worden gevonden in de Lewiszuur/base-reactiechemie-ruimte, vervaagt.
De nieuwe chemogenese analyse zoals gepresenteerd in dit webboek en ondersteund door de reactiechemie in The Chemical Thesaurus database vermijdt en verklaart de valkuilen van Pearson’s veel gehypte HSAB benadering.
Vergelijking van de “Top Down” HSAB Analyse met de “Bottom Up” Chemogenese Analyse
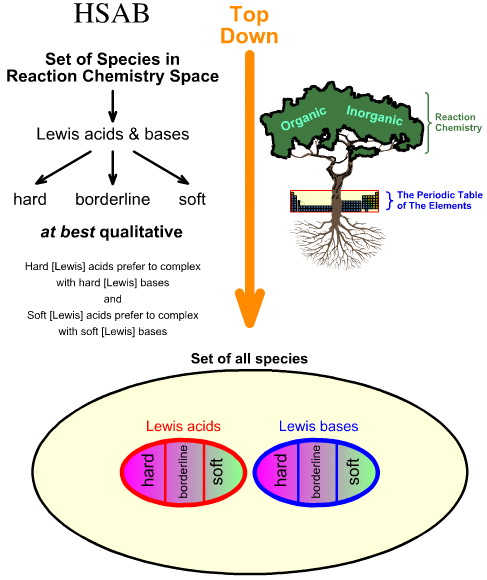
Pearson’s Hard Soft Acid Base (HSAB) analyse is top-down.
- Gaande van alle soorten in de reactie-chemische ruimte, worden een aantal belangrijke soorten geïdentificeerd als Lewiszuren en Lewisbasen.
- Lewiszuren en Lewisbasen worden vervolgens geclassificeerd als hard, borderline of zacht met behulp van empirische observatie en het principe dat: harde Lewiszuren de voorkeur geven aan complexen met harde Lewisbasen en zachte Lewiszuren de voorkeur geven aan complexen met zachte Lewisbasen:
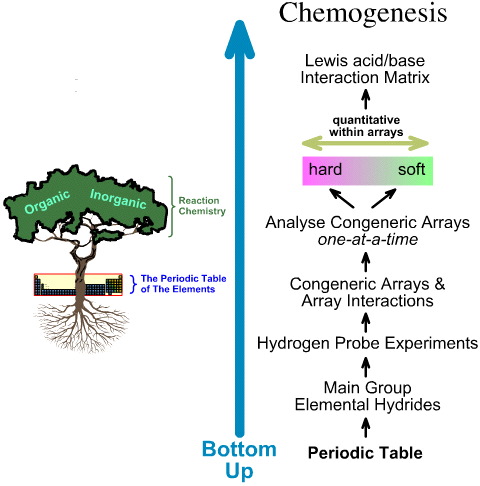
De chemogenese-analyse daarentegen is bottom-up:
- De elementaire hydriden van de hoofdgroep worden onderworpen aan de 5 waterstofprobexperimenten.
- Congenerische arrays en array-interacties worden bestudeerd.
- Lineaire hard-naar-zacht structuur- en reactiviteitstrends worden geïdentificeerd binnen arrays, en erkend wordt dat lineair gedrag tussen arrays niet te verwachten is.
- Lewiszuren en Lewisbasen worden geclassificeerd op basis van hun Lewis-elektronische structuren en FMO-topologieën en worden gerangschikt in een Lewiszuur/base-interactiematrix, hier.
De HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc., 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Zie ook hier.
Andere post-Pearson analyse
Het ECW model is een semi-kwantitatief model dat de sterkte van Lewis zuur/base interacties beschrijft en voorspelt. Aanvankelijk kende het model elektrostatische (E) en covalente (C) parameters toe aan de Lewis zuren en basen. Dit werd later uitgebreid tot het ECW model om reacties te omvatten die een constante energieterm, W, hebben, die processen beschrijft die voorafgaan aan de zuur/base interactie.
In de oorspronkelijke analyse van Drago & Wayland uit 1965, werd een vergelijking met twee termen gebruikt, zodat elk Lewiszuur wordt gekarakteriseerd door EA en CA termen en elke Lewisbas door EB en CB, waarbij de E en C parameters verwijzen naar de elektrostatische en covalente bijdragen aan de sterkte van de bindingen die de zuur/base interactie zal vormen. (Dit is zoals de analyse van Klopman, hierboven.) Deze parameters werden empirisch verkregen door gebruik te maken van enthalpie’s voor adducten die alleen σ-bindingen vormen tussen het Lewis-zuur en de Lewis-base en geen sterische afstoting hebben:
-ΔH = EAEB + CACB
In het ECW-model werd een nieuwe term W aan de vergelijking toegevoegd.
-ΔH = EAEB + CACB + W
waarbij de term W een constante energie vertegenwoordigt voor splitsing van een dimeer van Lewiszuren of Lewisbasen.
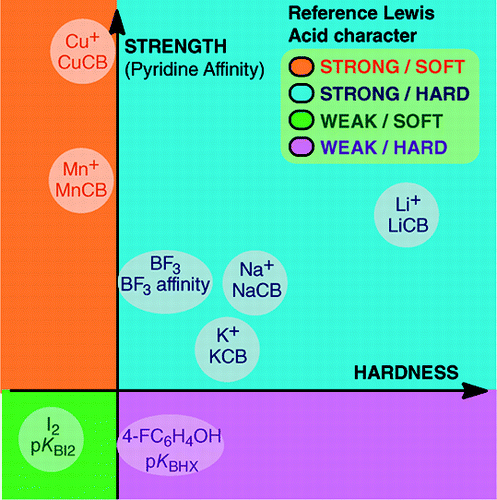
Van An Overview of Lewis Basicity and Affinity Scales door Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
De onmogelijkheid om een universele schaal van Lewisbasiciteit vast te stellen verhindert niet de bepaling van het kwantitatieve gedrag van Lewisbasen, dankzij schalen die geconstrueerd zijn tegen bepaalde Lewiszuren: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, en CH3NH3+. Deze schalen omvatten belangrijke soorten bindingen die in een Lewiszuur-base adduct worden gevormd: de datieve binding, de conventionele en ionische waterstofbruggen, de halogeenbrug en kation-molecuulbruggen voor metaalkationen van de groepen 1, 7, 10, 11, en 13. Hoewel deze schalen in het algemeen geen onderling verband vertonen, bestaan er familie-afhankelijke relaties die het mogelijk maken de basen die tot een bepaalde chemische familie behoren, bijvoorbeeld de familie van de zuurstofbasen, in een tamelijk algemene volgorde te rangschikken. Daarom is de scepsis over de kwantitatieve bruikbaarheid van het Lewis-concept van zuren en basen niet langer gegrond.en:
De vorming van Lewis zuur-base adducten omvat een grote verscheidenheid van bindingsvormende processen, van de zwakke van der Waals binding in Ar—BF3 tot de sterke datieve binding in H3N-BF3. De term “binding” kan bezwaarlijk zijn voor zwakke adducten. Deze zwak gebonden soorten worden in het algemeen geproduceerd in een supersonische straal of een cryogene matrix. Hier zijn wij vooral geïnteresseerd in complexen die kunnen worden waargenomen in een mengsel bij kamertemperatuur van het Lewis-zuur en de Lewis-base.In water is de volgorde van complexatieconstanten van halide-ionen met het zuur Fe3+ F- > Cl- > Br- > I-, terwijl dit met Hg2+ I- > Br- > Cl- >F- is. Deze omkering wordt verklaard door het hard en zacht zuur en base principe van Pearson.
De coördinatie van een reeks azines met metallocenen is gecorreleerd met de waterstof-bond-base-schaal van de azines.
De ab initio berekening van de Lewis zuur sterkte van covalente metaalhalogeniden in vacuo met behulp van het fluoride anion als de referentie Lewis base.
Een DN-waarde van triethylamine werd geschat uit een correlatie tussen DN en de NMR chemische verschuiving van de 23Na-kern voor oplossingen van natriumzouten in basische oplosmiddelen. Later gaf de directe bepaling een waarde die de helft was van de geschatte waarde.
 |
 |
 |
| Lewis & Brønsted Theories of Acidity | Main Group Elemental Hydrides |