- meta-szintézis
- Rólunk
- Weboldalaink
- Web Könyvfejezetek
 |
 |
 |
Ralph Pearson a hatvanas évek elején vezette be a Hard Soft Acid Base (HSAB) elvét, és ezzel megpróbálta egyesíteni a szervetlen és szerves reakciók kémiáját. Az új ötlet hatása azonnali volt, azonban az évek során a HSAB-elv inkább háttérbe szorult, míg más, ugyanebben az időben kifejlesztett megközelítések, mint például a határmolekuláris orbitális (FMO) elmélet és a molekulamechanika, virágzásnak indultak.
Ez az oldal a Pearson-féle megközelítés mélyreható korlátait tárgyalja, és összehasonlítja & szembeállítja a HSAB-elvet a kemogenezis elemzésével, ahogyan az ebben a webkönyvben szerepel.
Figyelem, ebben a webkönyvben:
| Lewis savak VÖRÖS | Lewis bázisok KÉK |
- Irving-Williams stabilitási sorozat
- Ahrland’s Type A, Type B Analysis
- Railsback geokémiai analízise
- Pearson HSAB-elve (The Hard Soft Acid Base Principle)
- Pearson HSAB osztályozási rendszere, innen:
- Jensen’s Review of the HSAB Principle
- Klopman FMO-elemzése
- Pearson és Klopman gondolatainak kombinálása
- A Ho-papír
- A HSAB-elv a szerves & Főcsoportkémikusok
- Probl, problémák, problémák…
- Fajans szabályai
- Tehát, mi folyik itt?
- A “felülről lefelé” történő HSAB-elemzés és az “alulról felfelé” történő kemogenezis elemzés összehasonlítása
- A HSAB Papers:
- Más Pearson utáni elemzések
Irving-Williams stabilitási sorozat
Az Irving-Williams stabilitási sorozat (1953) rámutatott, hogy adott ligandum esetén a dipozitív fémion komplexek stabilitása nő:
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Azt is tudták, hogy bizonyos ligandumok a legstabilabb komplexeiket olyan fémionokkal képezik, mint az Al3+, Ti4+ & Co3+ míg mások Ag+, Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
1958-ban Ahrland et al. A-típusú és B-típusú fémkationokat osztályozott, ahol:
A-típusú fémkationok közé tartoznak:
- az alkálifém kationok: Li+-tól Cs+-ig
- Alkaliföldfém kationok: Be2+-tól Ba2+-ig
- Könnyebb átmeneti fémkationok magasabb oxidációs fokozatokban:
- A proton, H+
A B-típusú fémkationok közé tartoznak:
- Az alacsonyabb oxidációs állapotú nehezebb átmeneti fémkationok: Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
A ligandumokat, a fémkationokkal komplexet alkotó kémiai egységeket A vagy B típusba sorolták attól függően, hogy A típusú fémkationokkal vagy B típusú fémkationokkal alkotnak-e stabilabb komplexeket, innen:
|
A ligand hajlamos komplexet képezni
A típusú fémekkel |
A ligand hajlamos komplexet képezni
A típusú fémekkel |
B típusú fémekkel
|
|
N >> P > As > Sb > Bi O >> S > S > Se > Te F >> Cl > Br > I |
N << P > As > Sb >. Bi O << S ~ Se ~ Te F < Cl < Br << I |
Ebből az elemzésből, levezethető egy empirikus szabály:
A típusú fémek inkább A típusú ligandumokhoz kötődnek (komplexek)
és
A B típusú fémek inkább B típusú ligandumokhoz kötődnek (komplexek)
Ezek az empirikus – kísérletileg levezetett – szabályok azt mondják, hogy az A típusú fémek nagyobb valószínűséggel képeznek oxidokat, karbonátokat, nitrideket és fluoridokat, míg a B-típusú fémek nagyobb valószínűséggel képeznek foszfidokat, szulfidokat és szelinideket.
Railsback geokémiai analízise
A “A típus, B típus” analízisnek nagy gazdasági jelentősége van, mert:
- Egyes fémek a természetben A típusú fém + A típusú ligandum ásványok, például karbonátok formájában fordulnak elő: MgCO3 és CaCO3 és oxidok: Fe2O3 és TiO2
- Míg mások B típusú fém + B típusú ligandum ásványként fordulnak elő, például a szulfidos ércek:
Ezt a megközelítést nagy sikerrel fejlesztette ki Bruce Railsback a kiváló és nagyon ajánlott “Earth Scientist’s Periodic Table website”-jával.
Kattintson a képre a nagyításhoz:
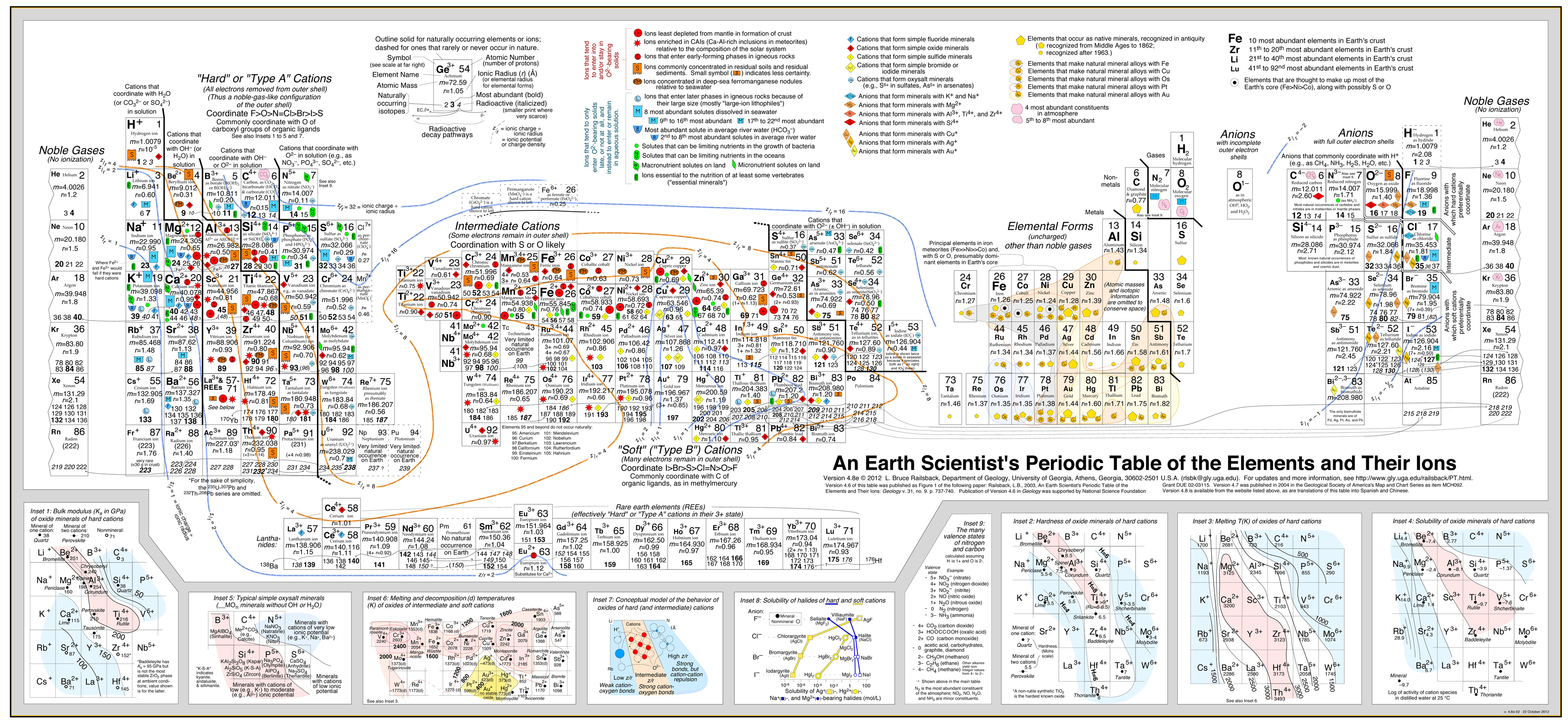
- A Railsback-féle elemzés a periódusos rendszerre helyezett viselkedési kontúrokat használja. .
- Lásd a cikket: A Synthesis of Systematic Mineralogy by Bruce Railsback, amely ezt az elemzést fejleszti.
Pearson HSAB-elve (The Hard Soft Acid Base Principle)
A hatvanas években Ralph Pearson jelentősen kibővítette az A-típusú-B-típusú logikát azzal, hogy a kationok és ligandumok eltérő komplexképzési viselkedését az elektronpárt elfogadó Lewis-savak és az elektronpárt donáló Lewis-bázisok szempontjából magyarázta:
Lewis-sav + Lewis-bázis → Lewis-sav/bázis komplex
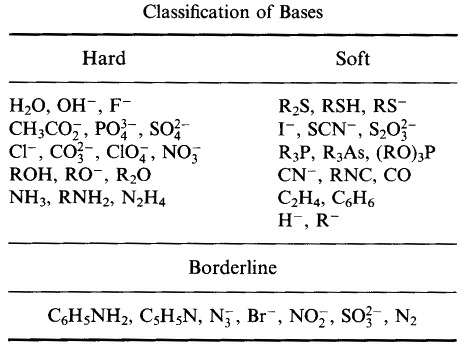
Pearson a Lewis-savakat és Lewis-bázisokat kemény, határeseti vagy lágy csoportba sorolta.
Pearson kemény lágy savas bázis (HSAB) elve szerint:
A kemény savak inkább a kemény bázisokhoz kötődnek
és
A lágy savak inkább a lágy bázisokhoz kötődnek
A HSAB-elemzés első látásra meglehetősen hasonlónak tűnik az A és B típusú rendszerhez.
Pearson azonban az atomok, ionok, molekulák és molekuláris ionok igen széles skáláját osztályozta kemény, határeset vagy lágy csoportba, ezzel az analízist a hagyományos fém/ligandum szervetlen kémiából a szerves kémia területére helyezte át – és ötvözte azzal.
Pearson HSAB osztályozási rendszere, innen:
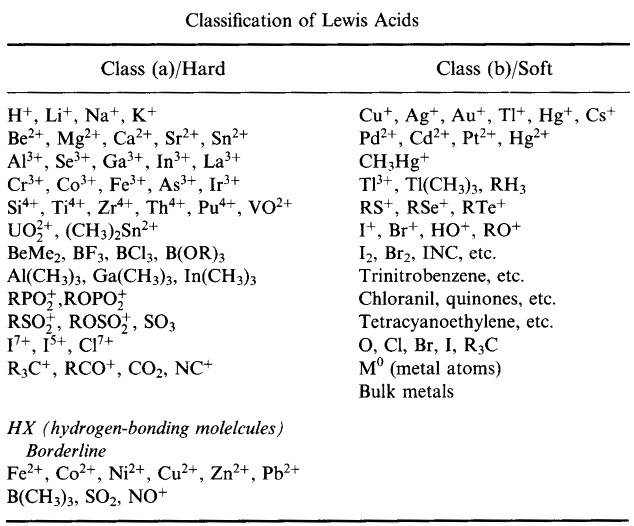
Pearson’s Hard Lewis Acids (a Chemical Thesaurusból), innen, és a congeneric array adatbázisból, innen:
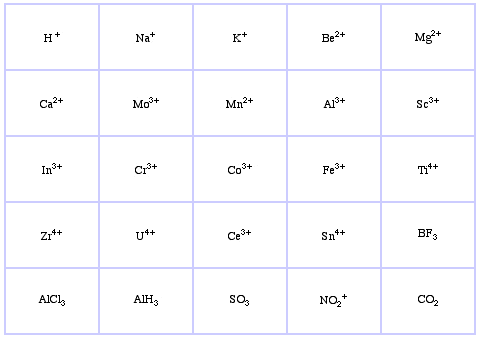
Pearson’s Borderline Lewis Acids, itt, és itt:
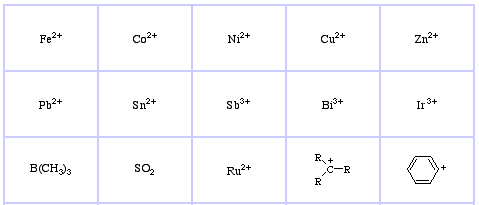
Pearson’s Soft Lewis Acids, itt, és itt:
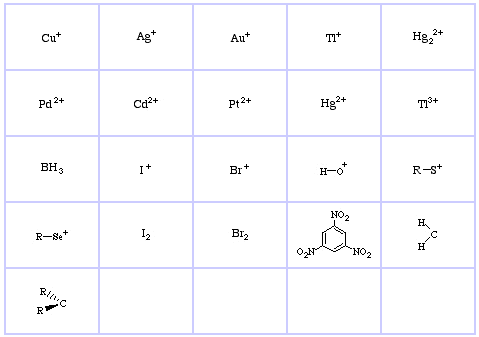
Pearson’s Hard Lewis Bases (a The Chemical Thesaurusból), itt, és a congeneric array adatbázisból, itt:
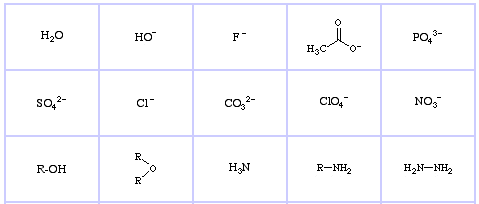
Pearson’s Borderline Lewis Bases, itt, és itt:

Pearson’s Soft Lewis Bases, itt, és itt:
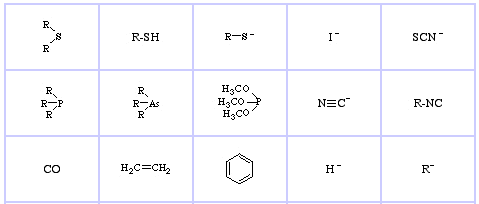
Jensen’s Review of the HSAB Principle
William (Bill) Jensen három tanulmányt mutatott be az ACS folyóirat Chemistry, vol 47 (1974), Lewis Acid-Base Theory: I. rész március 11-14. oldal; II. rész április 13-18. oldal; III. rész május 14-18. oldal. A III. rész Pearson HSAB analízisével foglalkozik.
A kombinált dolgozat – amely egyszerre kiváló és részletes – elérhető Bill webtárhelyén (és a fájl klónja letölthető erről a weboldalról).
Klopman FMO-elemzése
1968-ban G. Klopman megkísérelte számszerűsíteni Pearson HSAB-elvét a határmolekuláris orbitális (FMO) elmélet segítségével, ahogyan azt e webkönyvben máshol, itt, ezzel az egyenlettel tárgyaljuk:
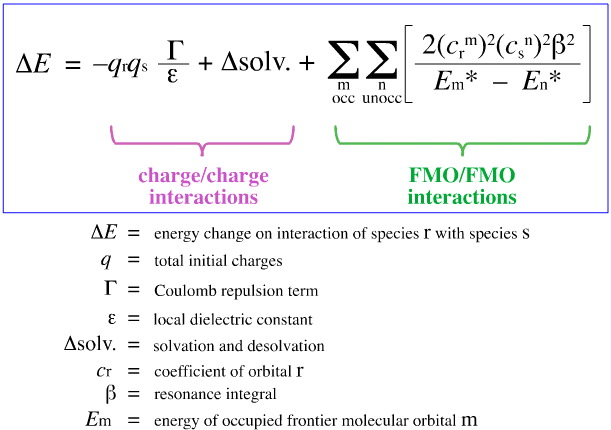
Klopman azt javasolta, hogy:
Kemény savak kemény bázisokhoz kötődve töltésvezérelt (ionos) komplexeket alkotnak. Az ilyen kölcsönhatásokat a kölcsönható fajok +/ töltései dominálják.
és
Lágy savak lágy bázisokhoz kötődve FMO-vezérelt komplexeket adnak. Ezeket a kölcsönhatásokat a résztvevő határmolekuláris orbitálok (FMO), a legmagasabb elfoglalt molekuláris orbitál (HOMO) és a legalacsonyabb nem elfoglalt molekuláris orbitál (LUMO) energiái uralják.
A Chemogenesis webkönyvben máshol, itt olvashat bővebben, vagy nézze meg Ian Fleming Organic Chemistry and FMO theory című könyvét itt, ahol ezeket az elképzeléseket hosszasan kifejti.
A fenti elemzés segítségével a töltésvezérelt és FMO-vezérelt Lewis sav/bázis komplexképzéshez hozzájáruló szempontok elkülönülnek és számszerűsíthetők, ami döntő fontosságú fejlesztés.
Pearson és Klopman gondolatainak kombinálása
Kemény Lewis savak:
Kis ionrádiusú atomközpontok
Nagy pozitív töltés
A fajok nem tartalmaznak elektronpárokat a valenciahéjukban
Alacsony elektronaffinitás
Valószínűleg erősen szolválódnak
Nagy energiájú LUMOLágy Lewis savak:
Nagy sugár
Alacsony vagy részleges δ+ pozitív töltés
Elektronpárok a valenciahéjukban
Könnyen polarizálhatók és oxidálhatók
Alacsony energiájú LUMO-k, de nagy nagyságú LUMO-együtthatókKemény Lewis-bázisok:
Kicsi, erősen szolvatált, elektronegatív atomcentrumok: 3 db.0-4,0
A fajok gyengén polarizálhatók
Nehezen oxidálhatók
Nagy energiájú HOMOLágy Lewis-bázisok:
Nagy, közepes elektronegativitású atomok: 2,5-3,0
Könnyen polarizálhatók és oxidálhatók
Alacsony energiájú HOMO-k, de nagy nagyságú HOMO-együtthatókHatáresetű fajok köztes tulajdonságokkal rendelkeznek.
Klopman dolgozatában van egy minősítés, amely szerint: nem szükséges, hogy a fajok minden tulajdonsággal rendelkezzenek.
A Ho-papír
Pearson felvetette, hogy a periódusos rendszer 15., 16. és 17. csoportjai között kemény-lágy tendenciákat lehet találni. Az elképzelést 1975-ben Tse Lok Ho kiterjesztette, aki reális kémiai fajokat használt, és megalkotta a kongenerikus (ugyanabba a családba tartozó) kifejezést, ahol a kongenerikus fajok izoelektronikusak (azonos külső héj Lewis-szerkezettel rendelkeznek).
 |
|||||
|
Bi
|
Sb
|
As
|
P
|
N
|
Pearson, R.G., Kemény és lágy savak és bázisok, JACS 85, 3533-3539 (1963) |
|
Te
|
Se
|
S
|
O
|
||
|
I
|
Br
|
Cl
|
F
|
||
|
R3Sb:
|
R3As:
|
R3P:
|
R3N:
|
Ho, T.-L., A kemény lágy savak bázisok (HSAB) elve és a szerves kémia Kémiai áttekintések 75, 1-20 (1975) | |
|
H3C-
|
H2N-
|
HO-
|
F-
|
||
|
I-
|
Br-
|
Cl-
|
F-
|
||
|
H3C+
|
(CH3)H2C+
|
(CH3)2HC+
|
(CH3)3C+
|
||
A HSAB-elv a szerves & Főcsoportkémikusok
Céljainkra főcsoport- és szerves reakciókémiában a Pearson-féle megközelítés akkor a legsikeresebb, ha fajpárokat hasonlítunk össze:
- A nátriumion, Na+, keményebb Lewis-sav, mint az ezüstion, Ag+
- Az alkoxidionok, RO, keményebb Lewis-bázisok, mint a tioanionok, RS
- A réz(II)ion, Cu2+, keményebb Lewis-sav, mint a réz(I)ion, Cu+
- Az ambidentát cianidion nitrogén anionjának vége, CN, keményebb Lewis-bázis, mint a lágyabb szén anion vége, NC
- Az ambidentát enolátion, kemény oxianion Lewis-bázis centrummal rendelkezik, míg a karbanion centrum lágyabb Lewis-bázis és nukleofilabb
Ez a fajta elemzés nagyon hasznos lehet a reakciószelektivitás magyarázatában.
Például a β-propiolaktont – egy reaktív ciklikus észtert – nukleofil Lewis-bázisok nyitják gyűrűbe. A támadás két pozícióban történhet, és a nukleofilek regioszelektivitást mutatnak:
- A keményebb nukleofilek, mint az alkoxidion, R-O, az acil (karbonil) szenet támadják.
- A lágyabb nukleofilek, mint a cianidion, NC, és a tioanion, R-S, a β-alkil szenet támadják.
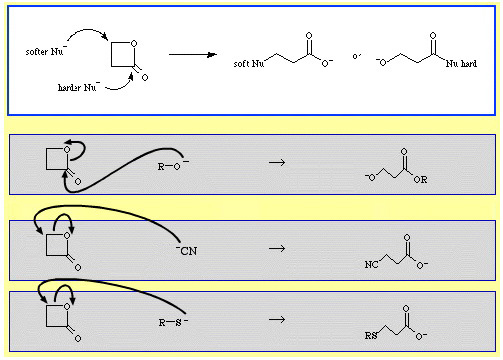
A The Chemical Thesaurus reakciókémiai adatbázisában elég sok példa található az ambidentát szelektivitásra:
- Elimináció vs. szubsztitúció 1,2-Diklóretán
- Elimináció vs. szubsztitúció 2-brom-propánnal
- β-Propiolakton
- Cianidion
- Enolátion
- Nitrition
- Szulfinátion
- Tiocianátion
Probl, problémák, problémák…
A Pearson elemzésével azonban súlyos problémák vannak. Bár a Pearson-Klopman-féle HSAB-modell nem egészen rossz… de durván leegyszerűsíti az ismert reakciók kémiáját, amit maga Ralph Pearson is elismer:
Az 1997-ben megjelent Kémiai keménység, Wiley-VCH, 3-4. oldal című könyvének elején Ralph Pearson őszintén írja:
“A nómenklatúrával lehetséges egy egyszerű, általános kijelentést tenni:
“A kemény savak szívesebben koordinálódnak kemény bázisokkal, a lágy savak pedig szívesebben koordinálnak lágy bázisokkal.”
“Ez a kemény és lágy savak és bázisok elve, vagy a HSAB-elv.
“Vegyük észre, hogy ez az Elv egyszerűen azoknak a kísérleti bizonyítékoknak az újrafogalmazása, amelyek a . Ez egy nagyon nagy mennyiségű kémiai információ sűrített megfogalmazása. Mint ilyen, törvénynek is nevezhető. De ez a címke nagyképűnek tűnik, tekintettel a keménység mennyiségi meghatározásának hiányára.
“A HSAB nem elmélet, mivel nem magyarázza meg a kémiai kötések erősségének változásait. A HSAB-elvben szereplő “inkább” szó meglehetősen szerény hatást feltételez.
“A lágyság nem az egyetlen tényező, amely meghatározza a ΔH° értékét az egyenletben:
A + :B → A:B
“Számos példa van arra, hogy a kemény H+ és lágy H-ból nagyon erős kötések alakulnak ki nem illeszkedő párok között, mint például a H2.
“A H2O, OH és O2 mind kemény bázisnak minősülnek, de báziserősségükben nagy különbségek vannak, bármilyen kritérium szerint.”
RP
Tényleg így… (!)
Az egyik probléma az, hogy a Pearson-elemzéssel egyszerűen nem veszik figyelembe a kemény-határvonal-lágy kölcsönhatások és komplexképződések teljes körét. Nézd meg, milyen üres a HSAB kölcsönhatási mátrixa:
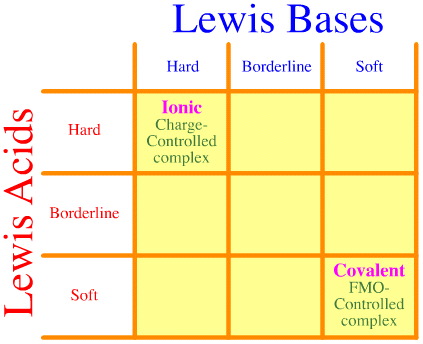
A Pearson-féle HSAB-elv azt állítja, hogy “a kemény savak szívesebben kötődnek kemény bázisokhoz, és a lágy savak szívesebben kötődnek lágy bázisokhoz”, ami igaz lehet, de semmit sem mond a kevert kemény-lágy komplexekről.
Klopman egyszerűen csak azt állítja, nagyon nem segítőkészen, hogy az ilyen kölcsönhatások “meghatározatlanok”!
Mégis a szerves és szervetlen reakciókémiában a legérdekesebb reagensek közül sok a kemény-lágy “feszített” komplex:
| Nátrium-hidrid |
NaH
|
Na+
|
H
|
| Lítium-alumínium-hidrid |
LiAlH4
|
Al3+
|
H
|
| Lead(IV) acetát |
Pb(AcO)4
|
Pb4+
|
AcO
|
| Metil-jodid |
CH3I
|
CH3+
|
I
|
| Metil-lítium |
CH3Li
. |
Li+
|
CH3
|
| Trietiloxónium-tetrafluoroborát |
+
|
CH3CH2+
|
:OR2
|
| Ferrocén |
Fe(Cp)2
|
Fe2+
|
|
|
Kemény
|
Száraz
|
Lágy
|
Összehasonlításképpen, az ismert reakciókémiák gazdagsága természetesen a Lewis-sav/bázis kölcsönhatási mátrixban keletkezik, ami a kemogenezis elemzésének központi tétele (de fennáll a veszélye, hogy elébe megyünk önmagunknak, lásd a következő oldalakat itt & itt).
Két megfigyelés/szabály van, és mindkettő az izoelektronikus/izoreaktív fajok kongenerikus tömbjeire vonatkozik:
- A kongenerikus tömbök mindig a Lewis-sav/bázis kölcsönhatási mátrix celláin belül találhatók, és nem a cellákat keresztezve.
- A kemény-lágy tendenciák a kongenerikus tömbökön belül fordulnak elő, de soha nem keresztezik a tömbök között.
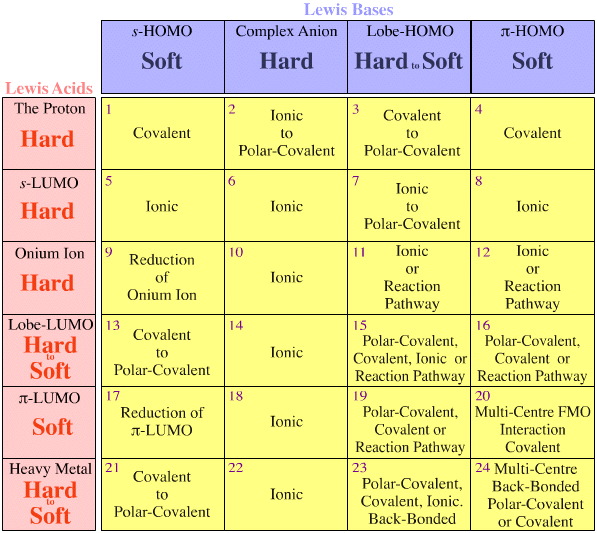
Fajans szabályai
A Pearson-Klopman-féle HSAB-elemzés a jól ismert (1915-24 között kidolgozott) “Fajans-szabályokkal” is szöges ellentétben áll, bár úgy tűnik, hogy más szerző mindeddig nem foglalkozott ezzel a kérdéssel.
A fém plusz nemfém bináris anyagokban az ionos-kovalens jelleg a Pauling-egyenlet segítségével számítható, itt, de az elektronegativitásbeli különbség alábecsüli a polarizáció hatását: azt, hogy az egyik atom milyen mértékben torzítja vagy polarizálja a másik elektronfelhőjét.
Fajans szabályai szerint:
- A kis pozitív ion erősen polarizál, kedvez a kovalenciának, és egy adott kation esetében a kovalens jelleg nő, ahogy az anion nagyobb lesz.
- A nagy negatív ionok erősen polarizálnak, kedveznek a kovalenciának, és egy adott anion esetében a kovalens jelleg nő, ahogy a kation kisebb lesz.
- A kovalens jelleg nő, ha bármelyik ion ion iontöltése növekszik.
- A polarizáció, és így a kovalens jellegnek kedvez, ha a pozitív ion nem nemesgáz-konfigurációjú. Ez olyan kationok esetében fontos, mint pl: Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
Egy példa:
Nézzük a berillium-kloridot, BeCl2-t a többi alkáliföldfém-kloriddal szemben: MgCl2, CaCl2, SrCl2, & BaCl2:
|
Kation
|
Ion
Sugár |
Eneg.
|
% ionos a
Cl-hez |
kötés & Anyag
Típus |
|
Be2+
|
41
|
1.57
|
34
|
Kovalens/Molekuláris
|
|
Mg2+
|
86
|
1.31
|
42
|
Ionikus só
|
|
Ca2+
|
114
|
1.00
|
51
|
Ionikus só
|
|
Sr2+
|
132
|
0.95
|
52
|
Ionikus só
|
|
Ba2+
|
149
|
0.89
|
54
|
Ionsó
|
Ionsugár adatok webelemekből
A berillium-klorid, BeCl2 kovalens: a vízmentes anyag szerves oldószerekben oldódik, szublimál (vákuumban), és az olvadt anyag rossz áramvezető. Az MgCl2, CaCl2, SrCl2 és BaCl2 ionos anyagok, és az olvadt sók kiváló elektromos vezetők.
- Fajans szabályai egyértelműen magyarázzák ezt a kémiát, mondván, hogy a nagyon kicsi, nagy töltésű Be2+ ion képes a viszonylag nagy kloridionok elektronfelhőit kovalens kötésbe polarizálni (eltorzítani), és így molekuláris szerkezetet adni.
- A Pearson-Klopman-féle HSAB-elemzés szerint a berilliumion, mivel a II. csoportba tartozó fémkationok közül a legkisebb, egyben a legkeményebb is. A berilliumion-sóknak tehát extrém töltésvezérelt kötést kellene mutatniuk, és ionos anyagokat kellene eredményezniük, de nem így van.
- A kemogenezis analízis, itt azt mondja, hogy a II. csoport kationjai: Be2+, Mg2+, Ca2+, Sr2+ & Ba2+, a töltött s-LUMO Lewis savak kongenerikus sorozatát alkotják, hogy ezen a sorozaton lineáris viselkedési trendeket találunk.
Ezek a lineáris viselkedési trendek, ha úgy kívánjuk, “kemény-lágy” viselkedésnek tulajdoníthatók, azonban a “kemény” és “lágy” kifejezések csak a szóban forgó kongenerikus sorozatra vonatkozóan használhatók, és a “kemény-lágy” összehasonlítások nem végezhetők más Lewis-savakkal.
Tehát, mi folyik itt?
A lényeg az, hogy egyetlen fizikai paraméter sem korrelál a keménységgel a Pearson által választott fajkészletben. Ez kétértelműségeket okoz, például a fluoridion szerves kémiájával kapcsolatban, itt, és a Fajans-szabályokkal való ellentmondást, fentebb.
A Pearson-modell nem veszi figyelembe az FMO geometriát (a résztvevő orbitálok & fázisainak alakját). Például mennyire hasonlóak a Pearson-féle kemény savak:
H+ + BF3 CO2 CO2 Cs+ Cu2+ ?
Vagy mennyire hasonlóak Pearson lágy bázisai:
H R2S: H3C benzol ?
A szerves és főcsoportos kémikusok számára fontos, hogy a HSAB-elemzés keveset/nem mond semmit a fontos karbéniumion (karbokation) Lewis-savról, H3C+, vagy a karbanion Lewis-bázisról, H3C.
Boldog állítás
A Pearson-elemzés egydimenziós kemény-határvonal-lágy kontinuuma valójában elmosódik a Lewis-sav/bázis reakciókémiában fellelhető gazdag, lineáris (kiszámítható) viselkedés nagy része.
Az ebben a webkönyvben bemutatott és a The Chemical Thesaurus adatbázisban tárolt reakciókémiával alátámasztott új kemogenezis elemzés elkerüli és megmagyarázza Pearson sokat hangoztatott HSAB megközelítésének buktatóit.
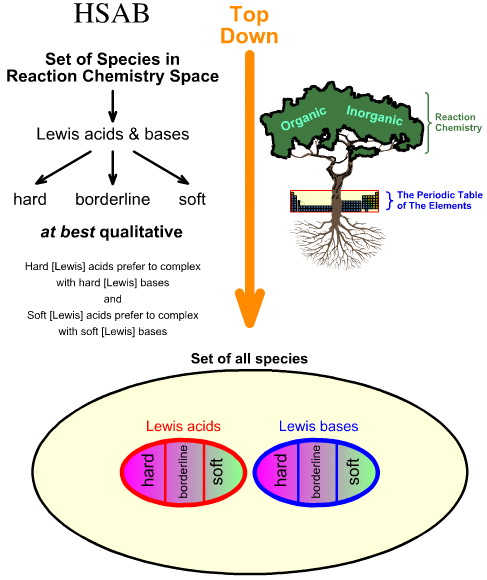
A “felülről lefelé” történő HSAB-elemzés és az “alulról felfelé” történő kemogenezis elemzés összehasonlítása
Pearson kemény-lágy sav-bázis (HSAB) elemzése felülről lefelé történik.
- A reakciókémiai térben lévő összes fajból kiindulva számos fontos faj Lewis-savként és Lewis-bázisként azonosítható.
- A Lewis-savakat és Lewis-bázisokat ezután kemény, határeseti vagy lágy Lewis-bázisokká osztályozzák, empirikus megfigyelés és az alábbi elv alapján: a kemény Lewis-savak inkább kemény Lewis-bázisokkal, a lágy Lewis-savak pedig inkább lágy Lewis-bázisokkal alkotnak komplexet:
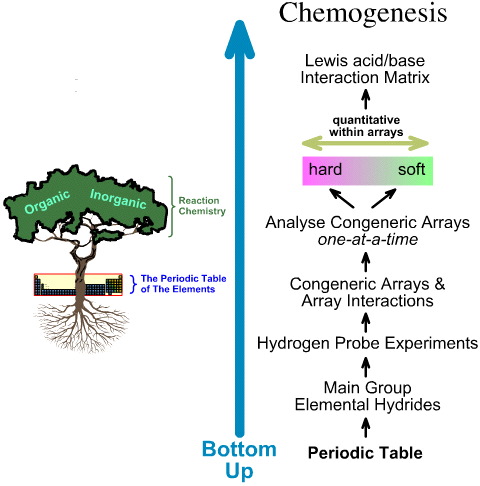
A kemogenetikai elemzés ezzel szemben alulról felfelé halad:
- A főcsoport elemi hidridjeit 5 hidrogénszondás kísérletnek vetik alá.
- Az általános tömböket és a tömbök közötti kölcsönhatásokat vizsgálják.
- Lineáris kemény-lágy szerkezeti és reaktivitási trendeket azonosítanak a tömbökön belül, és felismerik, hogy a tömbök között nem várható lineáris viselkedés.
- A Lewis-savakat és Lewis-bázisokat Lewis elektronszerkezetük és FMO topológiájuk alapján osztályozzák, és Lewis-sav/bázis kölcsönhatási mátrixba rendezik, itt.
A HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman és R.F.Hudson, Theoret. Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968Még itt nézd meg.
Más Pearson utáni elemzések
Az ECW modell egy félkvantitatív modell, amely leírja és megjósolja a Lewis sav-bázis kölcsönhatások erősségét. A modell kezdetben elektrosztatikus (E) és kovalens (C) paramétereket rendelt a Lewis-savakhoz és bázisokhoz. Ezt később kiterjesztették az ECW-modellre, hogy lefedje azokat a reakciókat, amelyeknek van egy állandó energiatermük, a W, amely a sav/bázis kölcsönhatást megelőző folyamatokat írja le.
Drago & Wayland eredeti, 1965-ös elemzésében kéttermes egyenletet alkalmaztak úgy, hogy minden egyes Lewis-savat EA és CA kifejezésekkel, és minden egyes Lewis-bázist EB és CB kifejezésekkel jellemeztek, ahol az E és C paraméterek az elektrosztatikus és kovalens hozzájárulásokra utalnak a sav/bázis kölcsönhatás során kialakuló kötések erősségéhez. (Ez olyan, mint a fenti Klopman-analízis.) Ezeket a paramétereket empirikusan kaptuk olyan adduktok entalpiáinak felhasználásával, amelyek csak σ kötéseket képeznek a Lewis-sav és a Lewis-bázis között, és nincs sztérikus taszítás:
-ΔH = EAEB + CACB
Az ECW-modellben egy új, W terminus került az egyenletbe.
-ΔH = EAEB + CACB + W
ahol a W kifejezés egy dimer Lewis-sav vagy Lewis-bázis hasadásának állandó energiáját jelenti.
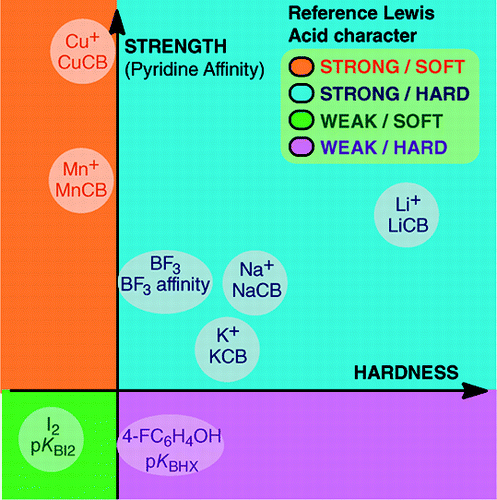
Az An Overview of Lewis Basicity and Affinity Scales című műből: Laurence, Graton & Gal: J. Chem. Educ. 2011, 88, 12, 1651-1657:
Abstract:
A Lewis-bázicitás univerzális skálájának felállításának lehetetlensége nem akadályozza a Lewis-bázisok mennyiségi viselkedésének meghatározását, köszönhetően az egyes Lewis-savakkal szemben felállított skáláknak: BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+ és CH3NH3+. Ezek a skálák felölelik a Lewis-sav-bázis adduktban kialakuló fontos kötéstípusokat: a datív kötést, a hagyományos és ionos hidrogénkötéseket, a halogénkötést és a kation-molekula kötéseket az 1., 7., 10., 11. és 13. csoportba tartozó fémkationok esetében. Továbbá, bár ezek a skálák általában nem kapcsolódnak egymáshoz, léteznek családfüggő kapcsolatok, amelyek lehetővé teszik egy adott kémiai családba, például az oxigénbázisok családjába tartozó bázisok meglehetősen általános sorrendbe állítását. Ezért a savak és bázisok Lewis-féle fogalmának mennyiségi hasznosságával kapcsolatos szkepticizmus már nem megalapozott.és:
A Lewis-féle sav-bázis adduktok kialakulása a kötésképző folyamatok széles skáláját öleli fel, az Ar—BF3 gyenge van der Waals-kötésétől a H3N-BF3 erős datív kötéséig. A “kötés” kifejezés a gyenge adduktok esetében kifogásolható. Ezeket a gyenge kötésű fajokat általában szuperszonikus sugárban vagy kriogén mátrixban állítják elő. Itt elsősorban a Lewis-sav és a Lewis-bázis szobahőmérsékletű keverékében megfigyelhető komplexek érdekelnek bennünket.Vízben a halogenidionok Fe3+ savval való komplexképződési állandóinak sorrendje F- > Cl- > Br- > I-, míg Hg2+ esetén I- > Br- > Cl- >F-. Ez a megfordulás Pearson kemény és lágy sav és bázis elvével magyarázható.
Az azinok egy sorának metallocénekkel való koordinációját korrelálták az azinok hidrogénkötés-bázisossági skálájával.
A kovalens fémhalogenidek Lewis-sav-erősségének ab initio számítása vákuumban a fluorid-aniont mint referencia Lewis-bázist használva.
A trietilamin DN-értékének becslése a DN és a 23Na mag NMR kémiai eltolódása közötti korrelációból nátriumsók bázikus oldószerekben lévő oldataira. Később a közvetlen meghatározás a becsült érték felének megfelelő értéket adott.
 |
 |
 |
| Lewis & Brønsted savasságelméletek | Főcsoportú elemi hidridek |
.