- meta-…合成
- About
- Our Websites
- Web Book Chapters
 |
 |
 |
Ralph Pearsonは1960年代初頭にHSAB(Hard Soft Acid Base)原理を発表した。 無機と有機の反応化学の統一を試みたのである。 しかし、HSAB原理は、同時期に開発されたフロンティア分子軌道(FMO)理論や分子力学などの他のアプローチが繁栄する一方で、長年にわたってむしろ道から外れてきました。
このページでは、Pearsonアプローチの深い限界について述べ、HSAB原理とこのWebブックで提示されている化学発生分析とを&対比させる形で説明しています。
Note, in this web book:
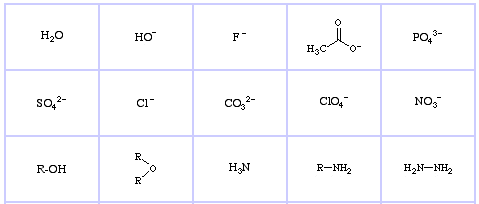
| Lewis acids are RED | Lewis bases are BLUE |
- Irving-Williams Stability Series
- Ahrland’s Type A, Type B Analysis
- レールバックの地球化学分析
- ピアソンのHSAB原理(The Hard Soft Acid Base Principle)
- Jensen’s Review of the HSAB Principle
- Klopman’s FMO Analysis
- PearsonとKlopmanのアイデアの組み合わせ
- Ho論文
- The HSAB Principle for Organic(有機物のHSABの原理)。 & 主成分化学者
- 問題あり。 問題、問題。..
- Fajans’ Rules
- 「トップダウン」HSAB 分析と「ボトムアップ」化学生成分析の比較
- The HSAB Papers:
- その他のPearson解析後
Irving-Williams Stability Series
Arving-Williams stability series(1953)ではある配位子があれば双陽イオン金属錯体の安定度は増加すると指摘されています。
Ba2+ < Sr2+ < Ca2+ < Mg2+ < Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ < Zn2+
Al3+等の金属イオンに対してある配位子によって最も安定な錯体を形成することも知られ、また、金属イオンの安定性は、配位子によって異なることも知られている。 Ti4+ & Co3+、Ag+、Hg2+ & Pt2+
Ahrland’s Type A, Type B Analysis
1958年、Ahrlandら “Type A “と “Type B “が発表され、”Type B “の分析が行われた。 タイプAには、
- アルカリ金属陽イオンが含まれる。 Li+からCs+
- アルカリ土類金属カチオン。 Be2+〜Ba2+
- 高酸化状態の軽元素遷移金属カチオン。 Ti4+, Cr3+, Fe3+, Co3+
- プロトンであるH+
B型金属カチオンは以下の通り:
- 低酸化状態の重遷移金属カチオン。 Cu+, Ag+, Cd2+, Hg+, Ni2+, Pd2+, Pt2+
配位子(金属カチオンと錯体を作る化学物質)は、ここからA型金属カチオンとB型金属カチオンのどちらとより安定な錯体を作るかでA型とB型に分類された。
|
配位子がタイプA金属と錯形成する傾向
|
配位子がタイプA金属と錯形成する傾向
|
配位子がタイプA金属と錯形成する傾向
F > > Cl > Br > I |
N < P > As > Sb > Sb Bi O << S〜Se〜Te F < Cl < Br << I |
この分析から。 という経験則を導き出すことができます。
A型金属はA型配位子と結合(錯形成)することを好み、
そして
B型金属はB型配位子と結合(錯形成)することを好む。この経験則(実験的に得られた法則)からA型金属が酸化物を形成しやすいと言えるでしょう。 炭酸塩、窒化物、フッ化物、B型金属はリン化物、硫化物、セリン化物を形成しやすい。
レールバックの地球化学分析
「タイプA、タイプB」の分析が経済的に重要な理由は:
- 一部の金属は自然界でタイプA金属+タイプA配位子鉱物、例えば炭酸塩として発見される。 MgCO3やCaCO3、酸化物などである。 Fe2O3やTiO2
- 一方、B型金属+B型配位子鉱物として見つかるものもあり、例えば硫化鉱がそうである。
Click image to enlarge:
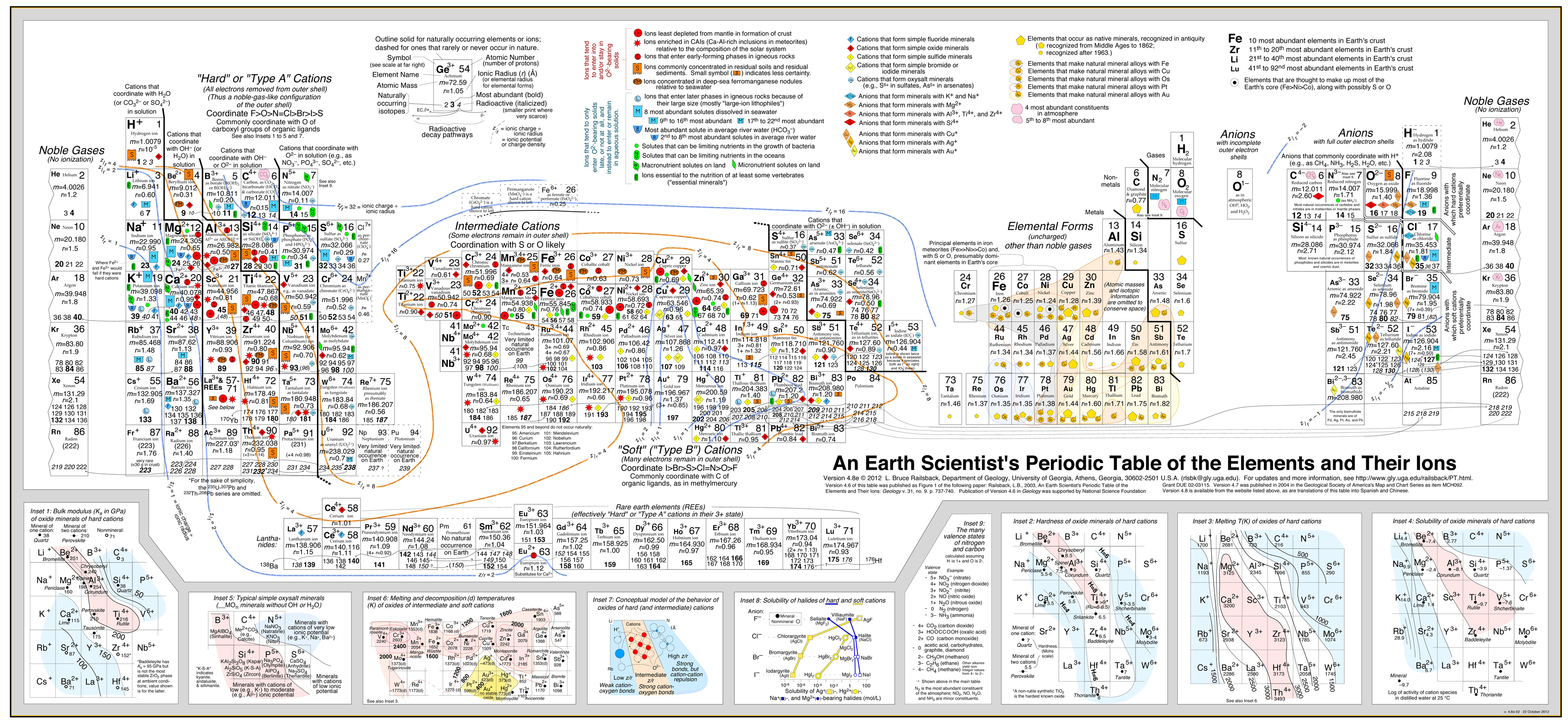
- Railsback analysis uses contours of behaviour superimposed on the periodic table. .
- 論文をご覧ください。 この分析を発展させたBruce Railsback氏の論文:A Synthesis of Systematic Mineralogyをご覧ください。
ピアソンのHSAB原理(The Hard Soft Acid Base Principle)
1960年代、ラルフ・ピアソンは陽イオンとリガンドの錯形成挙動の違いを電子対受容性ルイス酸と電子対供与性ルイス塩基という観点から説明し、タイプA-タイプB論理を大きく拡張しました。
Lewis acid + Lewis base → Lewis acid/base complex
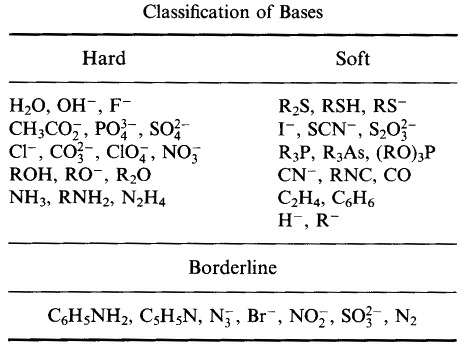
Pearson はルイス酸とルイス塩基をハード、ボーダーライン、ソフトに分類している。
ピアソンのハード・ソフト酸塩基(HSAB)原理による。
Hard acids prefer to bind to Hard bases
and
Soft acids prefer to soft bases
一見、HSAB分析はむしろタイプA、タイプBシステムに近いように思われる。
しかし、ピアソンは非常に幅広い原子、イオン、分子、分子イオンをハード、ボーダーライン、ソフトに分類し、分析を従来の金属/配位子無機化学から有機化学の領域へ、そしてそれと融合させたのです。
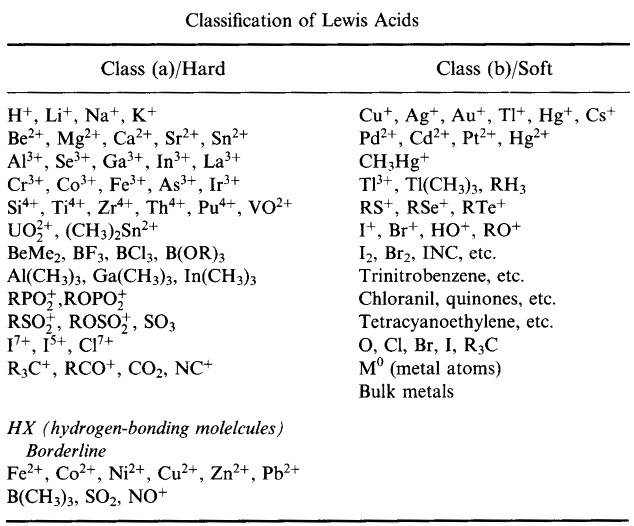
Pearson’s Hard Lewis Acids (from the Chemical Thesaurus), こちら、および congeneric array database, こちらから。
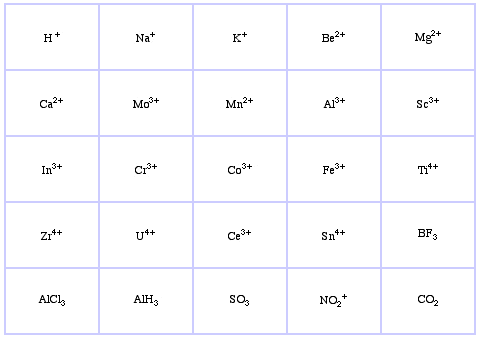
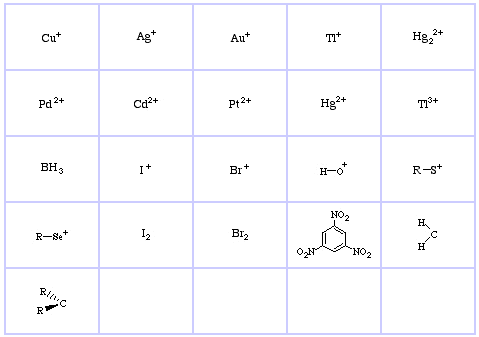
Pearson’s Borderline Lewis Acids, こちら、およびこちら。
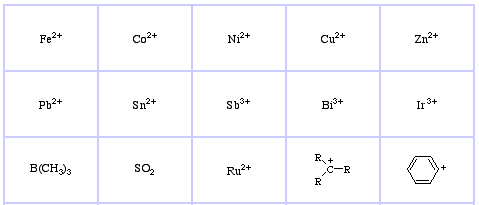
Pearson’s Soft Lewis Acidsはこちら、こちら。
Pearson’s Hard Lewis Bases (from The Chemical Thesaurus)、こちら、congeneric array database、こちらです。
Pearson’s Borderline Lewis Bases, こちら、およびこちら。

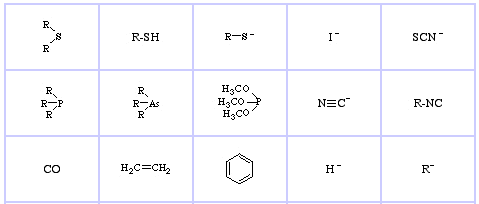
Pearson’s Soft Lewis Basesはこちら、そしてこちら。
Jensen’s Review of the HSAB Principle
William (Bill) Jensen は ACS journal Chemistry, vol 47 (1974), Lewis Acid-Base Theory で三つの論文を発表しています。 Part I March pp 11-14; Part II April pp 13-18; Part III May pp 14-18. Part III は Pearson の HSAB 分析を扱っています。
この複合論文は素晴らしく、かつ詳細で、Bill のウェブスペースで入手できます(また、このウェブサイトからファイルのクローンをダウンロードすることもできます)。Klopman’s FMO Analysis
1968年、G. KlopmanはPearsonのHSAB原理を、このウェブブックの他の場所で議論したように、FMO(frontier molecular orbital) 理論を用いて、ここで、この方程式で定量化しようと試みた:
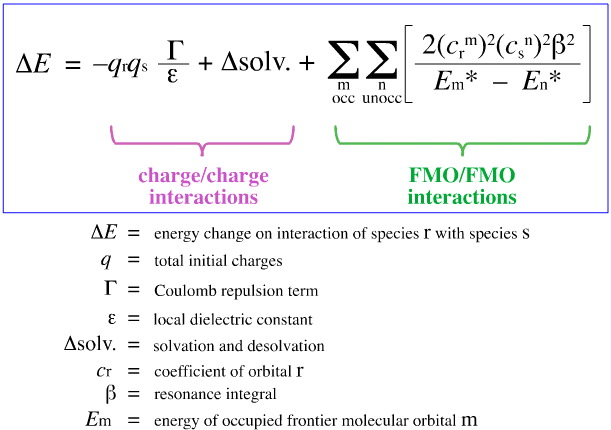
Klopmanは、次のように提案している。
Hard Acids bind to hard bases to give charge-controlled (ionic) complexes.ハード酸はハード塩基と結合し、電荷制御された(イオン)錯体を形成する。
そして
軟酸は軟塩基と結合し、FMO制御の錯体を形成する。 これらの相互作用は参加するフロンティア分子軌道(FMO)、最高被占分子軌道(HOMO)および最低非占分子軌道(LUMO)のエネルギーによって支配される。
Chemogenesis web book の他の部分を読むか、または Ian Fleming の Organic Chemistry and FMO theory を見て、これらの考えを少し詳しく説明しています。
PearsonとKlopmanのアイデアの組み合わせ
ハードルイス酸:
イオン半径の小さな原子中心
高い正電荷
種が価電子殻に電子対を含まない
低い電子親和力
強く溶媒和する可能性
高いエネルギーのLUMOソフトルイス酸。
大きな半径
低いまたは部分的なδ+正電荷
価殻の電子対
分極・酸化しやすい
低エネルギーのLUMO、しかし大きなLUMO係数ハードルイス塩基:
小型で溶媒和の強い、電気陰性な原子中心: 3.,4価の原子中心がある電子陰性な原子中心: 電子陰性な電子中心は、
高エネルギーのLUMOがあり、LUMO係数は大きい。0-4.0
分極しやすい
酸化しにくい
高エネルギーHOMOSoft Lewis base:
大きな原子で電気陰性度が中間のもの: 2.5-3.0
分極、酸化しやすい
低エネルギーHOMOだがHOMO係数は大きいBorderline種は中間特性をもっている。
クロップマンの論文には次のような修飾語がある:種がすべての特性を持つ必要はない。
Ho論文
ピアソンは周期表の15、16、17族にハードからソフトへの傾向が見られることを示唆した。 1975年にTse Lok Hoがこの考えを拡張し、現実的な化学種を用いて、congeneric(同じ族の)、congeneric species are isoelectronc(同じ外殻ルイス構造を持つ)という造語を作りました。
Pearson, R.G., 硬質と軟質の酸と塩基, JACS 85, 3533-3539 (1963)
Ho, T.-L., ハードソフト酸塩基(HSAB)原理と有機化学 Chemistry Reviews 75, 1-20 (1975) The HSAB Principle for Organic(有機物のHSABの原理)。 & 主成分化学者
我々の目的である主成分と有機反応の化学では、種のペアを比較するときにピアソンのアプローチが最も成功します。
- ナトリウムイオン Na+ は銀イオン Ag+
- アルコキシドイオン RO はチオアニオンより硬いルイス塩基である。 RS
- 銅(II)イオンCu2+は銅(I)イオンCu+より硬いルイス酸である
- 両末端シアン化物イオンの窒素アニオン端は、銅(I)イオンより硬い。 CNは炭素アニオンのNC
よりも硬いルイス塩基であり、カルバニオンの中心は軟らかいルイス塩基で求核性が高い
このような分析は、反応の選択性を説明するのに極めて有用である。
例えば、β-プロピオラクトン(反応性環状エステル)は、求核性ルイス塩基によって開環される。 アルコキシドイオン、R-Oのような硬い求核剤はアシル(カルボニル)炭素を攻撃し、9185>
シアン化物イオン、NC、チオアニオン、R-Sなどの軟らかい求核剤はβ-アルキル炭素を攻撃する。
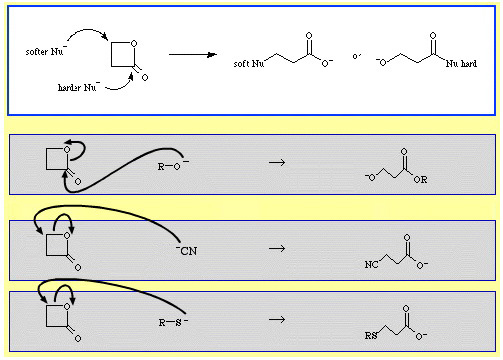
The Chemical Thesaurusの反応化学データベースには、両末端選択性の例がかなり多くあります。
- Elimination vs Substitution with 1,2-ジクロロエタン
- 消去対2-ブロモプロパン
置換
- βプロピオラクトン
- シアン化物イオン
- エノレートイオン
- 亜硝酸イオン
- サルフェートイオン
- チオシアン化物イオン
問題あり。 問題、問題。..
しかし、ピアソンの分析には重大な問題がある。 Pearson-Klopman HSAB モデルは正確には間違っていませんが…既知の反応化学を著しく単純化していることは、Ralph Pearson 自身も認識しています。
Ralph Pearson は、1997 年の著書、Chemical Hardness, Wiley-VCH, pp 3-4 冒頭に、率直に次のように述べています:
「名称付けがあれば、簡単な一般論を述べることは可能である。
「硬い酸は硬い塩基に配位することを好み、柔らかい酸は柔らかい塩基に配位することを好む」
「これは硬軟酸塩基の原理、あるいは HSAB 原理と呼ばれるものである」。
「なお、この原理は、「酸塩基の法則」を導き出した実験的証拠を単に言い直したものです。 非常に多くの化学情報を凝縮して記述したものなのです。 そのため、法則と呼ぶことができるかもしれません。 しかし、硬さの定量的な定義がないことを考えると、このラベルは気取った感じがする。
「HSABは化学結合の強さのばらつきを説明するものではないので、理論とは言えません。 HSAB原理における「好む」という言葉は、むしろ控えめな効果を意味する。
「式:
A + :B → A:B
「硬いH+と柔らかいHからできるH2など、ミスマッチなペア間の非常に強い結合の例がたくさんある。
「H2O、OH、O2はすべて硬塩基に分類されるが、その塩基強度にはどんな基準でも大きな差がある」
RP
確かにそうですね…。 (!)
1 つの問題は、ハード-ボーダーライン-ソフトの相互作用と複合化のフルセットが、単にピアソン分析を使って考慮されていないことです。 HSABの相互作用行列がいかに空白であるかを見てください。
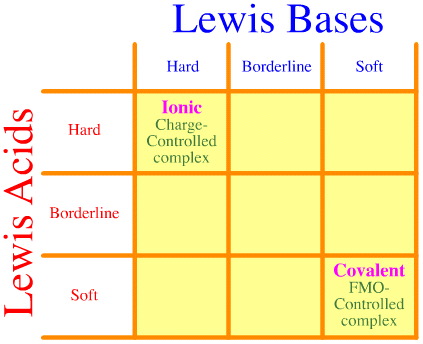
Pearson HSAB 原則では、「硬い酸は硬い塩基に結合することを好み、柔らかい酸は柔らかい塩基に結合することを好む」と述べており、それは正しいかもしれませんが、硬軟混合錯体については何も述べていません。
Klopman では単に、そのような相互作用は「未定義」であるとして非常に不親切です!
しかしながら、有機および無機反応化学における最も興味深い試薬は多くが硬軟「緊張」錯体であります。
水素化ナトリウム 水素化アルミニウムリチウム Lead(IV) acetate ヨウ化メチル リチウムメチル の場合
Triethyloxonium tetrafluoroborate フェロセン
比較してみると。 は、既知の反応化学の豊かさは、化学生成解析の中心的な考え方であるルイス酸/塩基相互作用行列に自然に生じる(ただし、先走る危険性があるので、次のページ&を参照されたい)。
2つの観察/規則があり、どちらも等電子/等反応種の共起配列に関するものである:
- 共起配列は常にルイス酸/塩基相互作用行列のセル内に存在し、セルを横切らない。
- ハードからソフトへのトレンドは、同系統のアレイ内で発生するが、アレイ間で交差することはない。
Fajans’ Rules
Pearson-Klopman HSAB分析は、現在までに他の著者はこの問題を扱っていないようですが、よく知られている「Fajansのルール」(1915年から24年にわたって策定)にも直接反しているのです。
金属+非金属の二元系物質におけるイオン-共有結合性は、ここではポーリング方程式を用いて計算できるが、電気陰性度の差は分極の効果を過小評価する。すなわち、一方の原子が他方の原子の電子雲をどの程度歪めるか、または分極するかということである。
Fajans rules say:
- 小さな正イオンは非常に分極しやすく、共有結合を好み、ある陽イオンに対して、陰イオンが大きくなるにつれて共有結合の性質が強くなる。
- 大きな負イオンは非常に分極しやすく、共有結合を好み、ある陰イオンに対しては、陰イオンが小さくなるにつれて共有結合の性質が強くなる。
- 共有結合の性質は、どちらかのイオンの電荷が大きくなると増加します。
- 分極、そして共有結合は、正イオンが希ガス配置でない場合に有利になります。 これは次のような陽イオンの場合に重要である。 Tl+, Pb2+, Bi3+, Ti3+, V3+, Cr2+, Mn2+, Cu+, Ce3+ & Eu2+.
例:
他のアルカリ土類塩化物と比較して塩化ベリリウム、BeCl2について考えてみましょう。 MgCl2, CaCl2, SrCl2, & BaCl2:
RadiusEneg.X,
CationEneg.X
to Cl- bond
Type1.0
Bound イオン塩
Web要素によるイオン半径データ
塩化ベリリウム、BeCl2は共有:無水物は有機溶剤に溶け、(真空中で)昇華し、溶融物は電気の導体としては不十分である。 MgCl2、CaCl2、SrCl2、BaCl2はイオン性物質で、溶融塩は優れた電気伝導体である。
- Fajans rulesは、非常に小さくて帯電量の多いBe2+イオンが、比較的大きな塩素イオンに対して電子雲の分極(歪曲)をして共有結合にし、分子構造を与えるということでこの化学を明確に説明している。
- ピアソン・クロップマンHSAB分析では、ベリリウムイオンはII族金属カチオンの中で最も小さく、また最も硬いとされています。 したがって、ベリリウムイオン塩は極端に電荷制御された結合を示し、イオン性物質を生じるはずですが、そうではありません。
- ここで、化学生成物分析では、II族陽イオンは。 Be2+, Mg2+, Ca2+, Sr2+ & Ba2+は、荷電s-LUMOルイス酸の共属シリーズを構成し、このシリーズにわたって線形挙動傾向が見られるという。
望むなら、これらの線形挙動の傾向を「ハード-ソフト」挙動とすることができますが、「ハード」および「ソフト」という用語は、問題の共属シリーズに関してのみ使用でき、「ハード-ソフト」比較は他のルイス酸に関して行うことはできません。ポイントは、ピアソンが選んだ化学種のセットで、硬度と相関する物理パラメータがないということです。 このことは、例えばここでのフッ化物イオンの有機化学や、上記のFajansのルールとの矛盾のような曖昧さを生み出します。
PearsonモデルはFMO幾何学(参加軌道の形状&相)を全く考慮していません。 例えば、ピアソンの硬質酸:
H+ + BF3 CO2 Cs+ Cu2+ はどのように似ているのでしょうか?
あるいは、ピアソンの軟塩基はどれくらい似ているかというと、
H R2S: H3C benzene ?
有機化学者や主要なグループ化学者にとって重要なのは、HSAB 分析では、重要なカルベニウム イオン (カルボカチオン) ルイス酸である H3C+ やカルバニオン ルイス塩基である H3C についてほとんど、あるいは何も言えないことです。
Bold Claim
Pearson の分析の一次元ハード-境界線-ソフト連続体は実際にはルイス酸/塩基反応化学空間に見られる豊かで線形な振る舞いの多くをぼかしている効果を持っているのです。
この Web ブックで紹介されている新しい化学生成分析は、The Chemical Thesaurus データベースに保持されている反応化学に裏打ちされており、Pearson の大いに宣伝された HSAB アプローチの落とし穴を回避し説明します。
「トップダウン」HSAB 分析と「ボトムアップ」化学生成分析の比較
Pearson の Hard Soft Acid Base(HSAB)分析はトップダウン型です。
- 反応化学空間のすべての種から出発し、多くの重要な種がルイス酸およびルイス塩基として同定される。
- ルイス酸とルイス塩基は、経験則と次の原理を用いてハード、ボーダーライン、ソフトに分類されます:ハードルイス酸はハードルイス塩基との錯体を好み、ソフトルイス酸はソフトルイス塩基との錯体を好む:
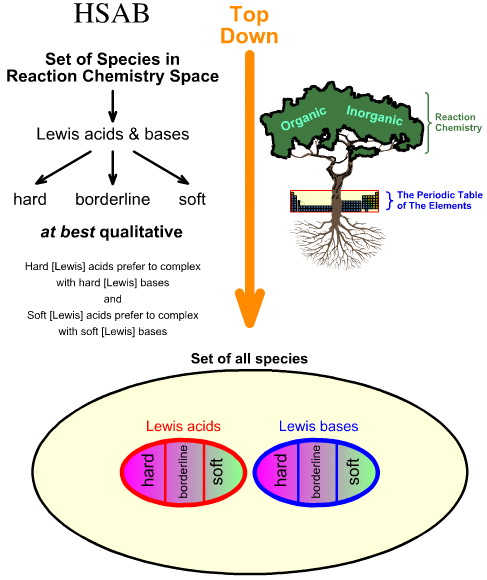
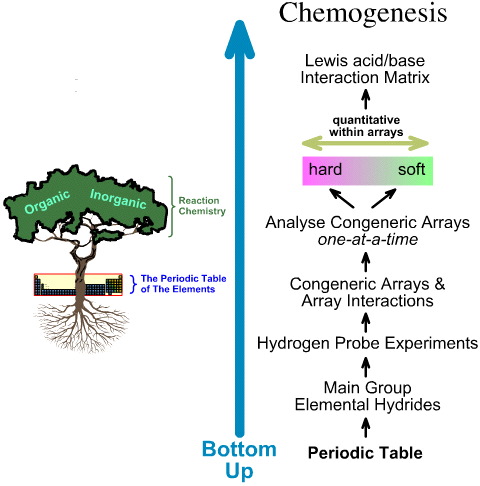
一方、化学発生分析は、ボトムアップ方式で行います:
- 主要グループの元素水素化物には5つの水素プローブに実験が行われる:
- 主要元素水素化物は、1つ目の水素プローブに実験されます。
- 一般的な配列と配列の相互作用を研究する。
- 配列の中で、ハードからソフトへの線形構造および反応性の傾向が確認され、配列の間では線形挙動が期待できないことが認識された。
- Lewis acids and Lewis bases are classified by their Lewis electronic structures and FMO topologies and are arranged into a Lewis acid/base interaction matrix, here.
The HSAB Papers:
R.G.Pearson, J.Am.Chem.Soc, 85, 3533-3543, 1963
R.G.Pearson, Science, 151, 172-177, 1966
R.G.Pearson, Chem. Br., 3, 103-107, 1967
R.G.Pearson, J.Chem.Ed., 45, 581-587, 1968
R.G.Pearson, Chemical Hardness, Wiley-VCH (1997)G.Klopman and R.F.Hudson, Theoret.The World, 1968
R.G.Pearson, J.Chemer, 1967
R.Chemer, 1968
R.G.Pearson, Chemical Hardness, 1968 Chim. Acta, 8, 165, 1967
G.Klopman, J.Am.Chem.Soc., 90, 223-234, 1968こちらもどうぞ
その他のPearson解析後
ECWモデルはルイス酸/塩基相互作用を記述、予測する半定量モデルであり、その強度を予測する。 当初、このモデルはルイス酸と塩基に静電(E)と共有(C)パラメータを割り当てていた。 これは後にECWモデルへと拡張され、酸/塩基相互作用に先行するプロセスを記述する定数エネルギー項Wを持つ反応をカバーするようになった。
Drago & Waylandの1965年の最初の解析では、各ルイス酸をEAとCAの項、各ルイス塩基をEBとCBの項で特徴付ける2項の方程式が採用され、EとCパラメータは、酸/塩基相互作用が形成する結合の強さに対する静電気と共有結合の貢献を意味する。 (これらのパラメータは、ルイス酸とルイス塩基の間にσ結合のみを形成し、立体反発のない付加体のエンタルピーを用いて経験的に得られたものである:
-EAEB + CACB
ECW モデルでは、新しい項 W が式に追加された。
-ΔH = EAEB + CACB + W
ここでW項は二量体のルイス酸またはルイス塩基の開裂のための一定のエネルギーを表す。
An Overview of Lewis Basicity and Affinity Scales by Laurence, Graton & Gal.より引用。 J. Chem. 2011, 88, 12, 1651-1657:
Abstract:
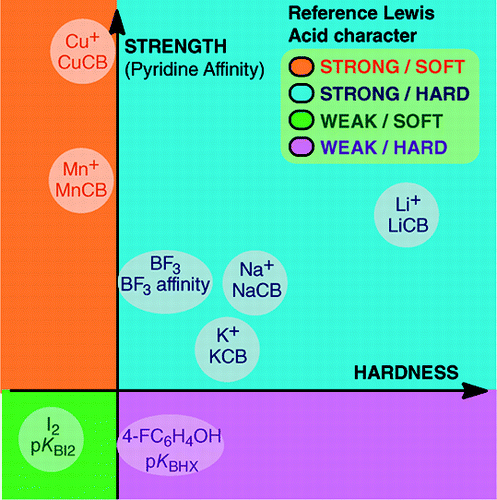
BF3, 4-FC6H4OH, I2, Li+, Na+, K+, Al+, Mn+, CpNi+, CH3NH3+ という特定のルイス酸に対して構築した尺度により、ルイス塩基性の普遍的尺度を確立できないことがルイス塩基の定量的挙動決定の妨げになってはいない。 これらのスケールは、ルイス酸塩基付加物で形成される重要な結合の種類、すなわち、二元的結合、従来の水素結合、イオン性水素結合、ハロゲン結合、1、7、10、11、13族の金属カチオンのカチオン-分子結合を包含している。 また、これらの尺度は一般に相互に関連していないが、ある化学ファミリー、例えば酸素塩基のファミリーに属する塩基を、かなり一般的な順序でランク付けできるファミリー依存の関係が存在する。 したがって、ルイスの酸と塩基の概念の定量的有用性に対する懐疑論はもはや根拠がない。and:
ルイス酸塩基付加体の形成は、Ar-BF3の弱いファンデルワールス結合からH3N-BF3の強い二重結合まで、幅広い結合形成の過程をカバーしている。 弱い付加体の場合、「結合」という用語は好ましくないことがある。 このような弱い結合の種は、一般に超音速ビームや低温マトリックスで生成される。 ここでは、ルイス酸とルイス塩基の室温混合系で観測される錯体に主に注目する。水中では、ハロゲン化物イオンと酸Fe3+との錯形成定数はF- > Cl- > Br- > I-の順であるが、Hg2+ではI- > Br- > Cl- >F- の順である。 この逆転現象は、ピアソンの硬軟酸塩基の原理で説明される。
一連のアジン類のメタロセンへの配位とアジン類の水素結合塩基度スケールとの相関を示した。
真空中での共有結合性金属ハロゲン化物のルイス酸強度をフッ化物アニオンを参照ルイス塩基として第一原理計算で求めた。
塩基性溶媒中のナトリウム塩の溶液について、DNと23Na核のNMR化学シフトの相関からトリエチルアミンのDN値を推定した。 その後、直接測定したところ、推定値の半分の値が得られた。
Lewis & Brønsted Theories of Acidity 主族元素水素化物