Eredeti szerkesztő – Joanne Garvey és Naomi O’Reilly
Top Contributors – Joanne Garvey, Lucinda hampton, Rachael Lowe, Naomi O’Reilly és Tarina van der Stockt
Bevezetés
A neurofiziológia az élettannak az idegrendszer funkcióival foglalkozó ága. Vagyis a neuronok, glia és hálózatok funkcionális tulajdonságainak vizsgálata.
- Történelmileg az elektrofiziológia – a neuronális események elektromos rögzítése a moláris (az elektroenkefalogram, EEG) és a celluláris (az egyes neuronok tulajdonságainak intracelluláris rögzítése) között.
- Mivel a neuron elektrokémiai gépezet, lehetetlen elválasztani az elektromos eseményeket az azokat előidéző biokémiai és molekuláris folyamatoktól.
- A neurofiziológusok ma a kémia (kalcium képalkotás), a fizika (funkcionális mágneses rezonancia képalkotás, fMRI) és a molekuláris biológia (helyhez kötött mutációk) technikáit használják az agyműködés tanulmányozására.
Az alábbiakban mindent megtudhatsz
- Ioncsatornákról
- Nyugalmi membrán és akciós potenciál
- Neuromuszkuláris átmenet / szinapszisok
- Idegvezetés
- Neurotranszmitterek, Receptorok és útvonalak
Ioncsatornák
Az ioncsatorna olyan fehérje makromolekula, amely áthalad a membrán szélességén és átengedi a molekulákat. Az ionok a membránon keresztüli elektrokémiai gradiens által meghatározott irányban mozognak.
- Az ionok hajlamosak a magas koncentrációjú területről az alacsony koncentrációjú területre áramlani.
- Feszültséggradiens jelenlétében előfordulhat, hogy az ionok nem áramlanak az egyenlőtlen koncentrációk ellenére sem.
- Az ioncsatornák lehetnek nyitottak vagy zártak.
- A nyitást a membránon átmenő feszültség megváltoztatása, vagy egy kémiai anyag receptorhoz kötése idézi elő.
- Legfontosabb szerepük, hogy elektromos gerjeszthetőséget biztosítanak az idegsejtnek.
- A neuron minden részében megtalálhatóak, kisebb mértékben a neurogliasejtekben.
A csatornák típusai
- Feszültségvezérelt
- Kémiailag aktivált
- Mechanikai nyúlás/nyomás.
Ioncsatorna alapvető tulajdonságai
- A membránon keresztben ülő fehérje alegységekből áll, amelyek lehetővé teszik az ionok átjutását az egyik oldalról a másikra. (Transzmembrán pórus)
- A csatornának képesnek kell lennie nyitott állapotból zárt állapotba és vissza mozogni.
- A megfelelő ingerek hatására képesnek kell lennie megnyílni.
Néhány csatorna kémiai ingerre reagál (különösen a szinapszisban). Ezek a csatornák specifikus receptorokkal rendelkeznek az adott vegyi anyagra, ami a csatorna megnyílásához vezet.
Nyugalmi membrán és akciós potenciál
- Nyugalmi állapotban a neuronális sejtmembrán meglehetősen átjárhatatlan az ionok számára. Ez döntő fontosságú a nyugalmi membránpotenciál kialakulásához.
- A fő intracelluláris ion a kálium (az extracelluláris folyadékban a nátrium).
- Az ionok természetes áramlása a koncentrációs gradiensük révén az, hogy a K+ elhagyja a sejtet, a Na+ pedig belép.
- Az ionoknak ez a sejtből kifelé irányuló mozgása negatív membránpotenciálhoz – hiperpolarizációhoz – vezet.
- Az ionok relatív beáramlása ennek az ellenkezője – Hipopolarizáció.

A nyugalmi membrán a Na+ ionok számára viszonylag átjárhatatlan, míg a K+ ionok számára átjárható marad. Így amikor a membrán nyugalmi állapotban van, a sejtből a koncentrációs gradiens mentén a K+-ionok kiáramlása tendenciaszerűen megtörténik, és a felesleges negatív töltés marad utána. Ez addig folytatódik, amíg a kémiai koncentrációgradiens, amely a K+ -ionokat a sejtből kiszorítja, pontosan el nem éri azt a pontot, ahol azt az ezen kiáramlás által létrehozott elektromos potenciálkülönbség ellensúlyozza. (a membránpotenciál) Ekkor a K+ visszahúzódik a sejtbe.
A membránnak ezt az állandósult állapotát nevezzük egyensúlyi potenciálnak.
Az egyensúlyi potenciál levezetésére szolgáló egyenletet Nernst-egyenletnek nevezzük.
Az axonokban valójában egy kissé váratlanul megnövekedett pozitív töltés van, ami a nyugalmi állapotban lévő membrán Na+ ionokkal szembeni kis áteresztőképességének köszönhető. Ezt ellensúlyozza az ATP-függő Na+/K+ cserepumpa. A sejtbe bevitt minden egyes 3K+ ionra 3 Na+ iont pumpálok ki. Ez azonban csak kis mértékben járul hozzá a sejt nyugalmi membránpotenciáljához.
Akciós potenciál
Az “axonon végighaladó egyetlen elektromos impulzus”.
A hatásában minden vagy semmi. Ez azt jelenti, hogy a küszöbértékű ingerintenzitás elérésekor akciós potenciál keletkezik.
Az idegrendszerben az információt a tüzelés gyakorisága kódolja és értelmezi, nem pedig az akciós potenciál mérete.
Küszöbértékű ingerintenzitás: Az az érték, amelynél a nettó befelé irányuló áram (Na+ ionok által meghatározott) éppen nagyobb, mint a nettó kifelé irányuló (K+ ionok által hordozott) áram. Ez általában -55mV (kritikus tüzelési küszöb)
Az AP legkönnyebben az axondombon fordul elő, mert itt nagyobb a Na+ ioncsatornák sűrűsége. Ez az oka annak, hogy ez az AP beindulásának helye a neuronban.
Ha a küszöbértéket nem érjük el, az akciós potenciál nem jön létre, és a jel továbbítása ezen a ponton befejeződik.
Az akciós potenciál keletkezésének eseménysorozata
- A depolarizáló feszültség aktiválja a neuronmembránban lévő feszültségérzékeny Na+ ioncsatornákat: A Na+ ionok lefelé áramlanak az elektrokémiai gradiens mentén. A membrán tovább depolarizálódik. További Na+ csatornák nyílnak meg egy pozitív visszacsatolási hurokban. Ha a nátriumionok befelé irányuló áramlása nagyobb a K+ -ionok kiáramlásához képest, az összes Na+ -csatorna gyorsan kinyílik. Ez depolarizálja a membránt a Na+ egyensúlyi potenciál (+55mV) felé. AP tüske keletkezik, de nem éri el az egyensúlyi potenciált a Na+ számára a növekvő K+ kiáramlás miatt.
- Amint a Na+ csatornák egyre kevésbé aktívak, az AP csökken. Ez az inaktiváció feszültségfüggő. A csökkenő fázisban a K+ áram fontos, mivel rövid ideig tartó membránhiperpolarizációhoz vezet, mielőtt deaktiválódik.
- A membránpotenciál visszatér a nyugalmi állapotba.
Neuromuscular Junction / Synapses
Synapse
A szinapszis két neuron kapcsolódási pontja. Az idegrendszerben túlnyomórészt kémiai szinapszisok találhatók, elektromos szinapszisok azonban a szívizom- és a gliasejtekben is előfordulnak.
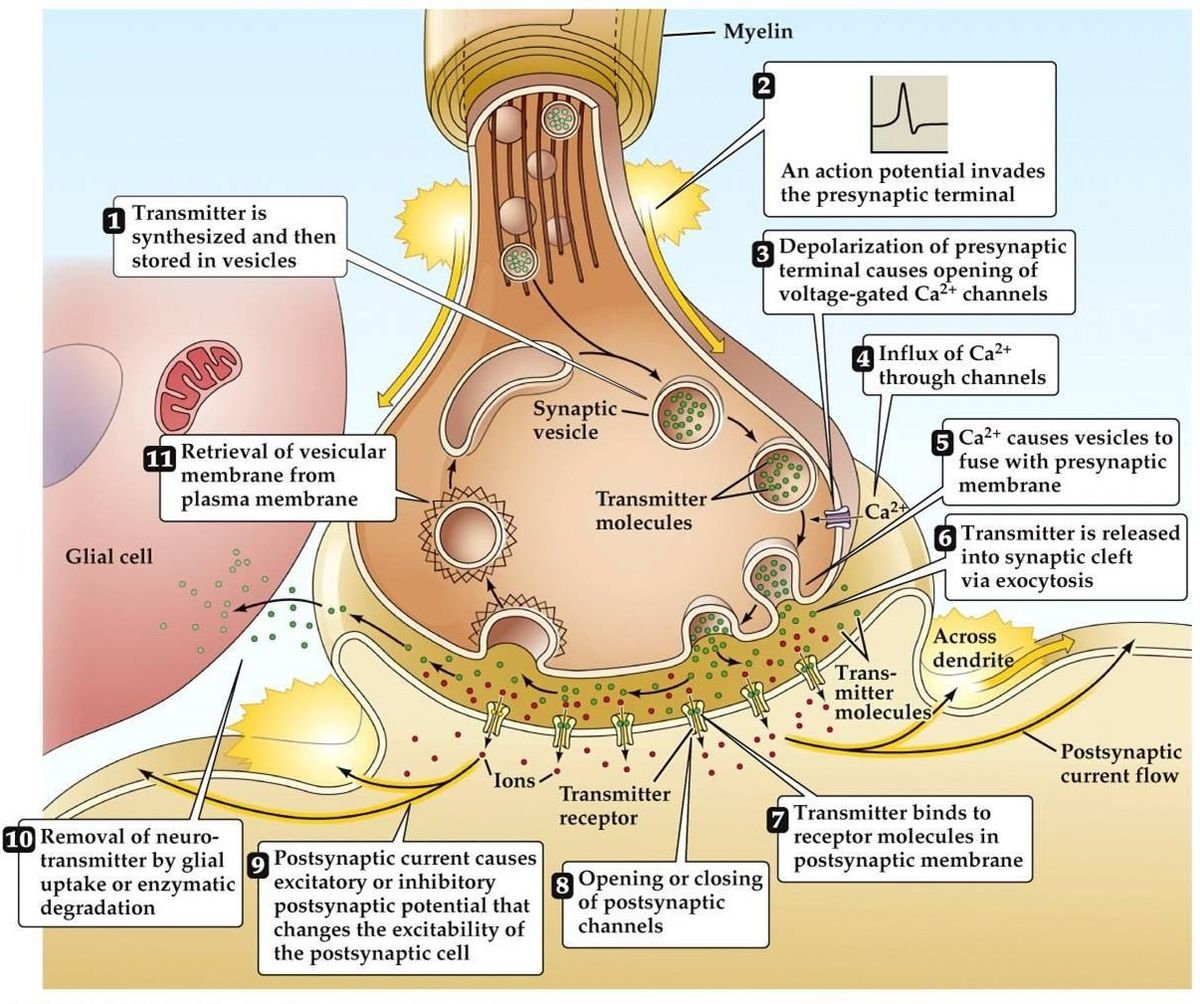
Szinaptikus transzmisszió
- Akciós potenciál érkezik, a preszinaptikus terminál depolarizációjához vezet. A terminál aktív zónáiban feszültségfüggő Ca2+ csatornák nyílnak meg. Ez Ca2+ beáramlásához vezet.
- A Ca2+ beáramlása a preszinaptikus kalciumkötő fehérjék foszforilációjához és mennyiségének megváltozásához vezet. Ez felszabadítja a vezikulát a preszinaptikus aktinhálózatból, Ezután a preszinaptikus membránhoz kötődik.
- A vezikulának a membránnal való összeolvadása egy kis csatorna kialakulásához vezet, amely gyorsan kitágul és tartalmát a szinaptikus hasadékba engedi. A vezikulamembrán endocitózis útján újrahasznosul.
- A felszabaduló neurotranszmitter a szinaptikus hasadékon keresztül diffundál, azzal a céllal, hogy a posztszinaptikus receptorhoz kötődjön.
- A posztszinaptikus receptor aktiválása a posztszinaptikus membránpotenciál változásához vezet.
- Az alternatív elméletek szerint a neurotranszmitter szállítása nem vezikulákon, hanem molekulákon vagy membráncsatornákon keresztül történik.
idegvezetés
Az akciós potenciál terjedése helyi áramterjedéssel valósul meg.
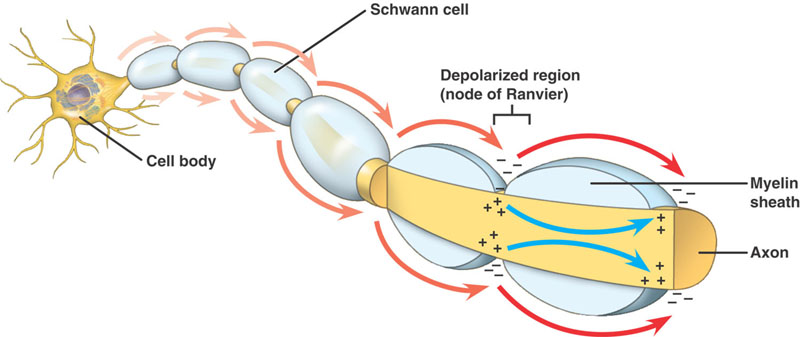
Az ideg myelinnel van szigetelve, ha mérete egy bizonyos átmérő felett van, hosszában különböző időközönként Ranvier-csomópontok találhatók.
A nem mirelinizált axonok
Az akciós potenciál a közvetlenül előtte (és mögötte) lévő membrán depolarizációjához vezet. A membrán refrakter állapotban van, így az akciós potenciál csak 1 irányba vezet. Ez kis axonokban megvalósítható, de az áram terjedése lassú.
Mielinált axonok
Az eseményeknek ugyanaz a sorrendje, mint a nem mielinált axonokban. Van azonban egy jelentős különbség. A haladó akciós potenciál nagy ellenállású, alacsony kapacitású struktúrával – az axon köré tekeredő mielinnel – találkozik. A depolarizáló áram végighalad az axoplazmán, amíg el nem éri az alacsony ellenállású, nagy mennyiségű Na+ csatornát tartalmazó Ranvier-csomópontot. Az akciós potenciál ekkor ezen a helyen keletkezik. Az akciós potenciál csomópontról csomópontra vezet. Ezt nevezzük saltatorikus vezetésnek.
A myelinizáció előnyei
- Lehetővé teszi az akciós potenciál gyors vezetését
- Minimalizálja a sejt anyagcsereigényét.
- Növeli az NS pakolási kapacitását, így több rost zsúfolható 1 idegbe.
A legtöbb 1 mikronnál nagyobb ideg myelinizált.
A vezetési zavarok általában demielinizációs kórképek következményei. Ezek közé tartozik a Guillan Barre-szindróma és a sclerosis multiplex.
Posztszinaptikus integráció:
Minden központi neuron sok száz szinapszist kap. Mindegyik bemenetet azután az adott neuron válaszként integrálja. Ez magában foglalja az összes egyszerre érkező bemenet feldolgozását. Ezt hívják térbeli összegzésnek. A bemenetek meghatározott idő alatt történő feldolgozását időbeli összegzésnek nevezzük. Ezen a ponton gerjesztő és gátló szinapszisok keverednek.
Excitatorikus posztszinaptikus potenciálok
- A neurotranszmitter megkötése ioncsatornák megnyitásához vezet.
- A posztszinaptikus folyamatban kationbeáramlás történik
- A membrán depolarizációja következik be.
- EPSPs a posztszinaptikus sejtben rögzített depolarizáció egy adott gerjesztő ingerre.
- Az EPSP-khez társuló depolarizációk AP-ket válthatnak ki, ha a szinapszisban összegződés történik.
Gátló posztszinaptikus potenciálok
- Az ioncsatornák nyitott állapotban lehetővé teszik a posztszinaptikus anion beáramlást.
- A membrán hiperpolarizációja a CL- beáramlása és a K+ kiáramlása miatt következik be
- fontos a neuronok gerjesztő bemenetre adott válaszának modulálásában a szinapszisban.
- A neuron stratégiailag fontos helyein található, mint például a proximális dendrit és a szoma.
- Nagy hatással vannak a dendritikus fára
- Egyes neuronok saját gátló hatásukat biztosítják azáltal, hogy axon kollaterálisokkal és saját gátló interneuronokkal rendelkeznek. Ezt nevezzük visszacsatolt gátlásnak. Pl. motorneuronok és Renshaw-sejtek a gerincvelőben.
Neurotranszmitterek, receptorok és útvonalak
A neurotranszmitter a szinapszisban szabadul fel, és a posztszinaptikus membránban egy meghatározott fehérjével, a receptorral működik együtt. Egyes szinapszisokban a neurotranszmitter kölcsönhatásba léphet egy preszinaptikus autoreceptorral is. A PSA a felszabaduló transzmitter mennyiségének szabályozójaként működik.
A receptorok általában egy adott neurotranszmitterre specifikusak. A receptoroknak több típusa létezik. A ko-kibocsátott neurotranszmitterek szabályozhatják egy másik transzmitter kötődését.
A specifikus neurotranszmitterek receptorai vagy közvetlenül ioncsatornákhoz, vagy egy membránenzimhez kapcsolódhatnak, ahol a neurotranszmitter receptorhoz való kötődése vagy egy intracelluláris enzimkaszkádon keresztül nyit meg egy ioncsatornát, vagy közvetve modulálja más ioncsatornák megnyílásának valószínűségét a feszültségváltozásra válaszul. (neuromoduláció)
Az aktivált receptor csak akkor tud visszatérni nyugalmi állapotába, ha a neurotranszmitter a preszinaptikus idegvégződésbe vagy a közeli gliasejtekbe történő enzimatikus hidrolízis (felvétel) útján eltávolításra kerül.
Dezzenzibilizáció/alulszabályozás: A receptor transzmitter iránti affinitásának csökkenése rövid távon, hosszú távon ez a receptorok számának csökkenéséhez vezet.
Szuperszenzitivitás/felszabályozás: A receptor transzmitter iránti megnövekedett affinitása rövid távon a csatornák számának növekedéséhez vezethet hosszú távon.
Receptorok:
- Ionotrop: N-metil-D-aszpartát(NMDA)
- Nem NMDA.
- Metabotróp : G-proteinhez kapcsolódó glutamát receptorok, amelyek intracelluláris biokémiai események elindításával reagálnak, modulálva a szinaptikus transzmissziót.
Nagyszámú neurotranszmitter létezik:
- Izgató hatású aminosavak: Ezek a fő izgató hatású NT-k a CNS-ben. A fő NT ebben a csoportban a glutamát, amely számos receptoron hat.
- Gátló aminosavak: Ezek a fő gátló neurotranszmitterek, amelyek közül a legfontosabb a GABA, amely az egész CNS-ben jelen van. A glicin, amely főként a gerincvelőben található.
- Monoaminok: Az agytörzsben található kis neuroncsoportokban találhatók, amelyek széles körben kivetülnek a CNS-be. A vegetatív NS-ben találhatóak. Számos receptorhoz kötődnek.
- Acetilkolin: Széles körben elterjedt az egész idegrendszerben, beleértve a neuromuszkuláris átmenetet és a vegetatív NS-t.
- Neuropeptidek: Az egész NS-ben megtalálhatóak. Gyakran más NT-kkel egyidejűleg szabadulnak fel.
Ezeken kívül több mint 50 neuroaktív peptidet találtak, és rendszeresen fedeznek fel újabbakat. Ezek közül sok “együtt szabadul fel” egy kismolekulájú transzmitterrel együtt. Mindazonáltal néhány esetben egy peptid az elsődleges transzmitter a szinapszisban. A β-endorfin viszonylag jól ismert példa a peptid neurotranszmitterre, mivel igen specifikus kölcsönhatásba lép a központi idegrendszer opioid receptoraival.
Az egyes ionokat (például a szinaptikusan felszabaduló cinket) egyesek szintén neurotranszmittereknek tekintik, akárcsak egyes gáznemű molekulákat, például a nitrogén-oxidot (NO), a szén-monoxidot (CO) és a hidrogén-szulfidot (H2S). A gázok az idegi citoplazmában keletkeznek, és a sejtmembránon keresztül azonnal az extracelluláris folyadékba és a közeli sejtekbe diffundálnak, hogy serkentsék a második hírvivők termelését. Az oldható gázos neurotranszmittereket nehéz tanulmányozni, mivel gyorsan hatnak és azonnal lebomlanak, csak néhány másodpercig léteznek.
A legelterjedtebb transzmitter a glutamát, amely az emberi agyban lévő szinapszisok jóval több mint 90%-ánál gerjesztő hatású. A következő legelterjedtebb a gamma-aminovajsav, vagyis a GABA, amely a glutamátot nem használó szinapszisok több mint 90%-ánál gátló hatású. Bár más transzmittereket kevesebb szinapszisban használnak, funkcionálisan nagyon fontosak lehetnek: a pszichoaktív drogok nagy többsége úgy fejti ki hatását, hogy megváltoztatja bizonyos neurotranszmitterrendszerek működését, gyakran a glutamáttól vagy a GABA-tól eltérő transzmittereken keresztül. Az olyan függőséget okozó drogok, mint a kokain és az amfetaminok elsősorban a dopamin rendszerre fejtik ki hatásukat. Az addiktív ópiát drogok elsősorban az opioid peptidek funkcionális analógjaiként fejtik ki hatásukat, amelyek viszont a dopaminszintet szabályozzák.