原著者 – Joanne Garvey and Naomi O’Reilly
主要執筆者 – Joanne Garvey, Lucinda hampton, Rachael Lowe, Naomi O’Reilly and Tarina van der Stockt
序章
神経生理学は神経系機能を扱う生理学の部門である。 神経細胞、グリア、ネットワークの機能的特性を研究します。
- 歴史的には、電気生理学-大脳皮質(脳波)から細胞(単一ニューロンの特性の細胞内記録)までの神経細胞事象の電気的記録-が主流であった。
- 神経生理学者は今日、化学(カルシウムイメージング)、物理(機能的磁気共鳴画像、fMRI)、および分子生物学(部位特異的突然変異)の技術を使用して、脳機能を研究している。
以下では、
- イオンチャネル
- 静止膜と活動電位
- 神経筋接合部/シナプス
- 神経伝導
- ニューロトランスミッターについてすべて学びます。 受容体と経路
イオンチャネル
イオンチャネルは、膜の幅を越えて分子を通すタンパク質高分子である。 イオンは膜を横切る電気化学的勾配によって決まる方向に移動します。
- イオンは濃度の高い領域から低い領域へ流れる傾向があります。
- 電圧勾配がある場合、濃度が等しくないにもかかわらず、イオンの流れがないことがある。
- イオンチャネルは開いたり閉じたりすることができる。
- 膜の電圧を変化させたり、受容体に化学物質を結合させたりすることで開口します。
- 最も重要な役割は、神経細胞に電気的興奮を与えることである。
- 神経細胞のすべての部分と、より少ない程度ですが神経膠細胞に見られます。
チャネルの種類
- 電圧ゲート
- 化学的に活性化
- 機械的ストレッチ/プレッシャー(Mechanical Stretch/Pressure).
イオンチャネルの基本的な性質
- 膜を挟んで多数のタンパク質サブユニットで構成され、イオンが一方から他方に渡るのを可能にします。 (膜貫通孔)
- チャネルは開いた状態から閉じた状態へ、そして再び戻ることができなければなりません。
- 適切な刺激に反応して開くことができなければならない。
いくつかのチャネルは化学的刺激に反応する(特にシナプスで)。 これらのチャネルはその化学物質に対する特異的な受容体を持っており、それがチャネルを開かせるのです。
静止膜と活動電位
- 静止状態では、神経細胞膜はイオンに対してかなり不浸透性です。 これは安静時膜電位の生成に極めて重要である。
- 細胞内の主要なイオンはカリウムです(細胞外液ではナトリウムです)。
- イオンの濃度勾配による自然な流れは、K+が細胞から出て行き、Na+が入ることである。
- この細胞外へのイオンの移動により、膜電位がマイナスになる(過分極)。
- 逆にイオンが相対的に流入する場合は、低分極になります。

静止膜は、K+イオンには透過性を保ちながら、N+イオンには比較的不透過性です。 そのため、膜が静止しているときは、K+イオンが細胞外に流出する傾向があり、その濃度勾配を下降し、過剰な負電荷を後に残すことになる。 これは、細胞からK+を追い出す化学的濃度勾配が、この流出によって生じる電位差によって相殺されるポイントにちょうど到達するまで続く。 (膜電位)そして、K+は細胞内に引き戻される。
このような膜の定常状態を平衡電位と呼びます。
平衡電位を導き出す方程式をネルンスト方程式といいます。
実は軸索では、静止状態の膜のNa+イオンに対する透過性が小さいため、予想外に正電荷が少し増えているのです。 これはATP依存性のNa+/K+交換ポンプによって相殺される。 私は、3K+イオンが細胞に持ち込まれるごとに、3N+イオンを汲み出します。 しかし、細胞の静止膜電位にはほんのわずかしか寄与していない。
活動電位
「軸索を通過する単一の電気的インパルス」と定義される。
その作用はall or nothingである。 つまり、閾値刺激強度に達すると、活動電位が発生する。
神経系における情報は、活動電位の大きさではなく、発火の頻度によってコード化され、解釈される。
閾値刺激強度(Threshold Stimulus Intensity)。 内向き電流(Na+イオンによって決まる)が外向き電流(K+イオンによって運ばれる)よりちょうど大きくなる値。 通常-55mV(臨界発火閾値)
軸索ヒロックではNa+イオンチャネルが密集しているため、APが最も発生しやすい。 このため、神経細胞ではこの部位がAPの開始部位となるのです。
閾値に達しない場合、活動電位は発生せず、その時点で信号の伝達は終了します。
活動電位が発生するまでの流れ
- 脱色電圧により、神経細胞膜の電圧感受性Na+イオンチャネルが活性化される。 Na+イオンが電気化学的勾配を下降して流れる。 膜はさらに脱分極される。 さらにNa+チャネルが開口し、正のフィードバックループが起こる。 K+イオンの流出に比べ、Na+イオンの内向きの流れが大きい場合、すべてのNa+チャネルが急速に開く。 これにより、膜はNa+の平衡電位(+55mV)に向かって脱分極される。 しかし、K+イオンの流出が増加し、Na+の平衡電位に達することができない。
- Na+チャネルの活性が低下すると、APは低下する。 この不活性化は電圧依存的である。 K+チャネルが不活性化するまでの短い期間、膜の過分極を引き起こすため、電流の減少段階は重要である。
- 膜電位は静止状態に戻る。
神経筋接合部/シナプス
シナプス
シナプスとは2つのニューロンの接合部分である。 神経系では化学的シナプスが主流ですが、電気的シナプスは心筋やグリア細胞でみられます。
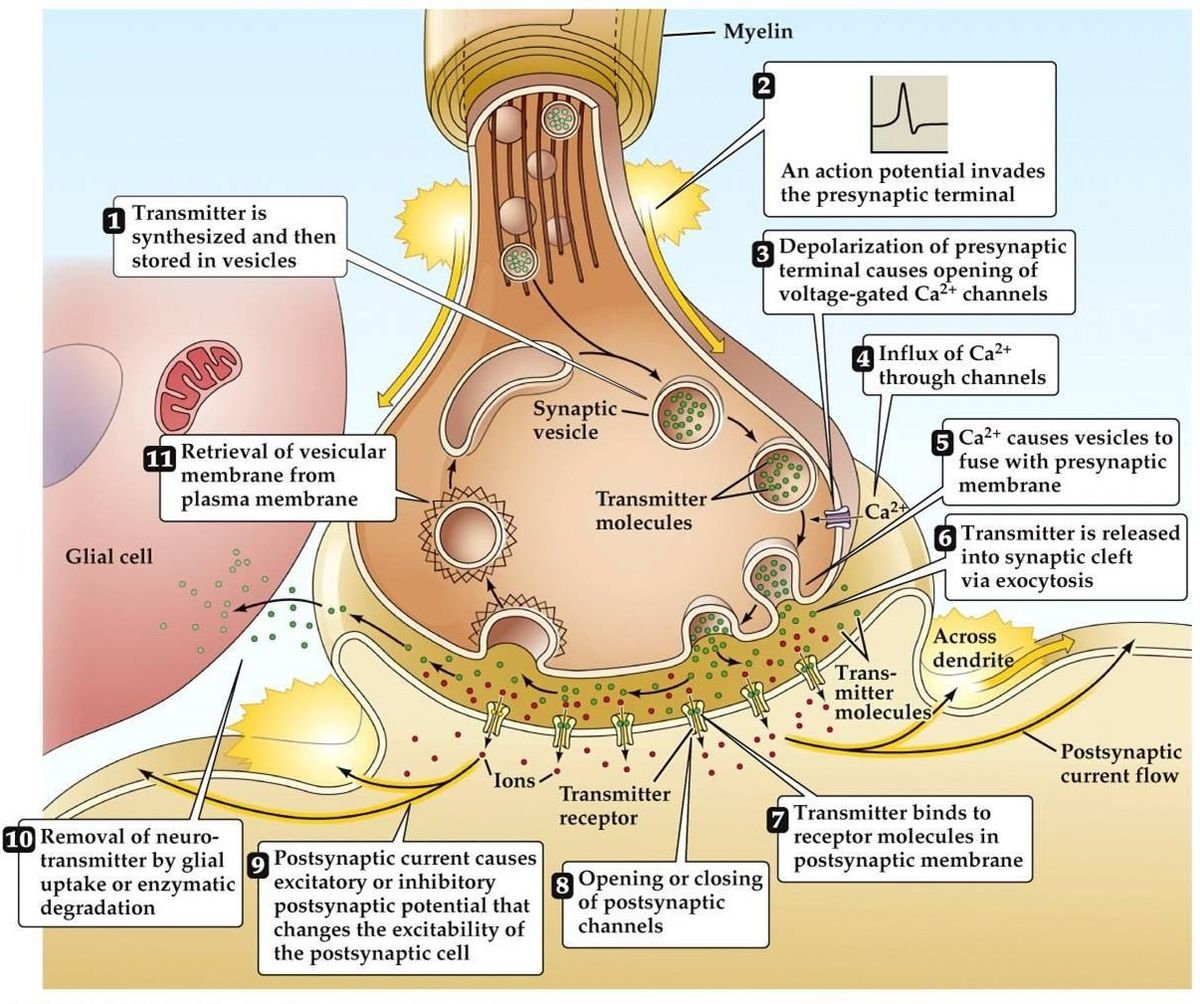
シナプス伝達
- 活動電位の到来により、シナプス前末端が脱分極します。 シナプス前末端の活動領域で電圧依存性Ca2+チャネルが開口する。 これにより、Ca2+が流入する。
- 流入したCa2+はシナプス前細胞のカルシウム結合タンパク質のリン酸化と量的変化をもたらす。 この結果、小胞はシナプス前アクチンネットワークから解放され、シナプス前膜に結合する。
- 小胞が膜に融合すると、小さなチャネルが形成され、そのチャネルが急速に拡張して内容物がシナプス間隙に放出される。 小胞膜はエンドサイトーシスにより再利用される。
- 放出された神経伝達物質は、シナプス後部の受容体に結合することを目的として、シナプス間隙を拡散していく。
- シナプス後膜受容体の活性化により、シナプス後膜電位が変化する。
- 神経伝達物質は小胞ではなく、分子または膜チャネルを介して伝達されるとする代替理論もある。
神経伝導
活動電位の伝播は局所電流拡散により達成される。
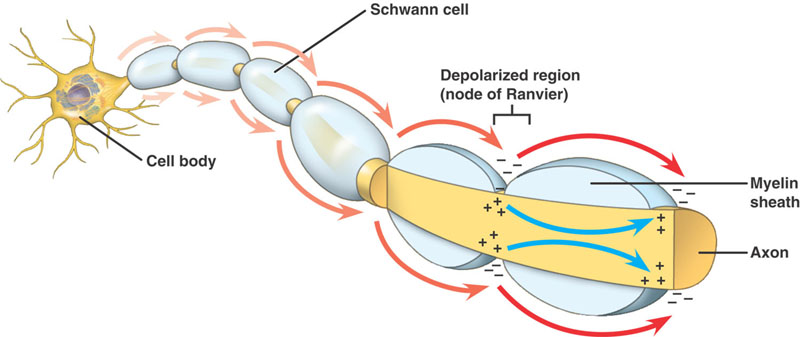
神経は一定以上の直径があるとミエリンで絶縁され、その長さ方向に様々な間隔でランビエの節が存在します。
Unmyelinated Axons
活動電位は、すぐ前(と後ろ)の膜の脱分極につながります。 膜は不応状態なので、活動電位は一方向にしか伝導しません。 小さな軸索では実現可能ですが、電流の広がりは遅くなります。
有髄軸索
無髄軸索と同じ順序で行われる。 しかし、大きな違いがある。 進行中の活動電位は、高抵抗、低キャパシタンスの構造、すなわち軸索を包むミエリンに遭遇する。 脱分極した電流は軸索に沿って進み、低抵抗のNa+チャネルを大量に持つランビエ節に到達します。 そして、この部分で活動電位が発生する。 活動電位は、ノードからノードへと伝導されます。 これを塩基性伝導という。
髄鞘の利点
- 活動電位の迅速な伝導を可能にする
- 細胞への代謝的要求を最小限にすることができる。
- NSの充填能力を高め、1本の神経により多くの線維を詰め込むことができる。
1ミクロン以上のほとんどの神経は有髄である。
伝導の障害は、通常、脱髄の病理によるものである。 Guillan Barre症候群や多発性硬化症などがあります。
シナプス後統合。
各中枢神経細胞は何百ものシナプスを受け取る。 これらの入力はそれぞれ、その特定のニューロンによる反応に統合される。 これには一度に到着するすべての入力を処理することが必要である。 これは空間的総和と呼ばれる。 ある一定期間の入力を処理することは、時間的総和と呼ばれる。 この時点では興奮性シナプスと抑制性シナプスが混在して作用しているであろう。
興奮性 シナプス後電位
- 神経伝達物質の結合により、イオンチャネルが開く。
- シナプス後のプロセスで陽イオンの流入がある
- 膜の脱分極が起こる。
- 特定の興奮刺激に対してシナプス後細胞で記録されたEPSPsの脱分極。
- EPSPに関連する脱分極は、シナプスで和が生じるとAPを誘発することがあります。
- 膜の過分極はCL-の流入とK+の流出によって起こる
- シナプスでの興奮性入力に対するニューロンの反応を調節するために重要である。
- 樹状突起近位部やソーマなど、神経細胞の戦略的に重要な部位に存在する。
- 樹状突起に大きな影響を与える。
- ニューロンによっては、軸索コラテラルとそれ自身の抑制性介在ニューロンを持っていることによって、自身の抑制的影響を提供するものもある。 これはフィードバック抑制と呼ばれる。 例えば、脊髄の運動ニューロンやレンショウ細胞。
神経伝達物質、受容体、経路
神経伝達物質はシナプスで放出されて、シナプス後膜の受容体と呼ばれる特定のタンパク質に作用する。 一部のシナプスでは、神経伝達物質はシナプス前自己受容体と相互作用することも見出される。 自己受容体は、放出される伝達物質の量を調節する働きをする。
受容体は通常、特定の神経伝達物質に対して特異的である。 受容体にはいくつかの種類がある。 共放出された神経伝達物質が別の伝達物質の結合を調節することもある。
特定の神経伝達物質に対する受容体は、イオンチャネルに直接結合しているか、膜酵素に結合しているかのいずれかで、受容体に神経伝達物質が結合すると、細胞内酵素カスケードを介してイオンチャネルが開くか、電圧変化に応答して他のイオンチャネルが開く確率を間接的に調節する。 (神経調節)
活性化された受容体は、神経伝達物質がシナプス前神経末端または近くのグリア細胞への酵素による加水分解(取り込み)のプロセスによって除去されて初めて静止状態に戻ることができます。
脱感作/ダウンレギュレーション(Desensitisation/Down regulation)。 短期的には伝達物質に対する受容体の親和性が低下し、長期的には受容体の数の減少につながること。
超感受性/Up regulation: 短期的にトランスミッターに対する受容体の親和性が高まると、長期的にはチャンネルの増加につながる。
受容体。
- イオノトロピック。 N-methyl-D-aspartate(NMDA)
- 非NMDA.
- メタボトロピック:Gタンパク質と結合したグルタミン酸受容体で、細胞内の生化学的事象を開始することで反応し、シナプス伝達を調節する。
神経伝達物質には多くの種類がある。
- 興奮性アミノ酸:これらはCNSにおける主要な興奮性神経伝達物質である。 このグループの主要な神経伝達物質はグルタミン酸であり、多くの受容体に作用する。
- 抑制性アミノ酸:これらは主要な抑制性神経伝達物質であり、その主なものはGABAで、CNS全体に存在します。 グリシン、主に脊髄に存在する。
- モノアミン類。 脳幹の小さなニューロン群に存在し、CNSに広く投射している。 自律神経系NSに存在する。 多くの受容体に結合する。
- アセチルコリン。 神経筋接合部や自律神経NSなど神経系に広く分布する。
- 神経ペプチド。 NSの至る所に存在する。
さらに、50以上の神経活性ペプチドが発見されており、定期的に新しいものが発見されている。 これらの多くは、低分子の伝達物質と一緒に「同時放出」されます。 しかし、場合によっては、ペプチドがシナプスにおける主要な伝達物質となることもある。 β-エンドルフィンは、中枢神経系のオピオイド受容体と非常に特異的に相互作用するため、ペプチド神経伝達物質の例として比較的よく知られている。
一酸化窒素(NO)、一酸化炭素(CO)、硫化水素(H2S)などの気体分子と同様に、単一イオン(シナプスから放出される亜鉛など)も神経伝達物質と見なされることがある。 これらのガスは神経細胞質で産生され、直ちに細胞膜を通して細胞外液に拡散し、近傍の細胞に拡散してセカンドメッセンジャーの産生を促します。 可溶性ガスの神経伝達物質は、急速に作用し、すぐに分解されて数秒しか存在しないため、研究が困難である。
最も一般的な伝達物質はグルタミン酸で、人間の脳のシナプスの90%以上で興奮性を示す。 次に多いのがγ-アミノ酪酸(GABA)で、グルタミン酸を使わないシナプスの90%以上で抑制的に作用する。 他の伝達物質が使用されるシナプスは少ないが、機能的には非常に重要である可能性がある。精神作用薬の大部分は、いくつかの神経伝達系の作用を変化させることによってその効果を発揮するが、多くの場合、グルタミン酸やGABA以外の伝達物質を通して作用する。 コカインやアンフェタミンなどの依存性薬物は、主にドーパミン系に作用を及ぼす。 アヘン系薬物は、主にオピオイドペプチドの機能性アナログとして作用を発揮し、その結果、ドーパミンのレベルを調節しています。