Indledning
Rekursiv respiratorisk papillomatose (RRP) er en kronisk sygdom forårsaget af humant papillomavirus (HPV), normalt type 6 og 11. Læsionerne ved RRP forekommer hyppigst i larynx (Figur 1), men kan også opstå i munden, trachea, bronkier, lungeparenchyma og esophagus. Den juvenile form af RRP, hvor symptomerne opstår før 12 år, er mere aggressiv end den voksne form, og symptomerne er mere alvorlige. Papillom-recidiv er særlig hurtig hos børn under 3 år, som oplever kortere intervaller mellem kirurgiske indgreb og dermed flere operationer i alt. Sandsynligheden for, at infektionen spreder sig ud over strubehovedet, og forekomsten af tracheostomi for at hjælpe med at holde luftrøret åbent, er også større i denne population (1). Patienter med RRP med juvenilt debut gennemgår i gennemsnit 20 kirurgiske indgreb, hvoraf de fleste finder sted i barndommen (2).
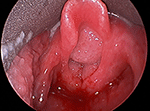
Figur 1. Direkte laryngoskopisk billede af stor voluminøs luftvejspapillomatose, der obstruerer laryngealindgangen.
Den traditionelle kirurgiske metode til kirurgisk ekstirpation involverede klassisk KTP (kaliumtitanylphosphat) eller kuldioxidlaser (3). I betragtning af de potentielt alvorlige bivirkninger ved laserablation, herunder forbrændinger i luftvejene og ardannelse i larynx, er mikrodebridere blevet et stadig mere populært kirurgisk redskab, især blandt otolaryngologer til børn, til voluminøs sygdom (3). Dette håndholdte apparat kan fjerne det syge væv mere præcist, hvilket reducerer skader på det omkringliggende væv (3). I betragtning af den aggressive karakter af juvenil RRP er debrideringer dog stadig hyppige og slider med tiden stadig det underliggende væv betydeligt ned, med høj forekomst af ardannelse. Som sådan er flere medicinske behandlinger blevet undersøgt for at forbedre resultatet af kirurgi ved at forlænge tiden mellem operationerne eller ved at minimere recidiv af RRP-læsioner.
Interferon α
Interferon α, et protein, der produceres af leukocytter som reaktion på forskellige stimuli, herunder virusinfektion, var en af de første potentielle medicinske behandlinger, der blev undersøgt (4). Dets værdi som en adjuverende behandling er kontroversiel. I en stor undersøgelse af 85 børn og 84 voksne afsluttede 58 % af børnene den et år lange behandlingsperiode med intramuskulære interferon α-injektioner tre gange om ugen uden tegn på RRP (5). Hyppigheden af papillomrecidiv faldt hos 74 % af alle behandlede børn (5). I et randomiseret kontrolforsøg med 123 patienter under 21 år blev den nedsatte væksthastighed af papillomer i forsøgsgruppen, der fik intramuskulære interferon α-injektioner, imidlertid ikke opretholdt i løbet af den etårige behandlingsperiode (6). Tilsvarende viste en anden undersøgelse, at 20 år efter afslutningen af behandlingen med interferon α kun 42 % af patienterne viste et langtidsrespons, og alle de patienter, der fik tilbagefald, havde den juvenile form af RRP (7). De fleste undersøgelser, der undersøger interferon α, har også rapporteret om alvorlige bivirkninger, såsom neurologiske lidelser, leukopeni og trombocytopeni (5). Af disse grunde er dets anvendelse af pædiatriske otolaryngologer blevet mindre og anbefales generelt ikke (1). I 2014 modtog kun 4 % af børn med RRP interferon α som adjuverende behandling (1).
Cidofovir
Dette bredspektrede, antivirale lægemiddel, der hæmmer virale DNA-polymeraser, har vist sig at være lovende som en adjuverende intralesional behandling til kirurgi for RRP. Intralesionale cidofovir-injektioner er den mest almindeligt anvendte medicinske behandling af RRP blandt pædiatriske otolaryngologer (1). Alle artikler, der blev offentliggjort mellem 1998 og 2011, og som undersøgte virkningen af intralesional cidofovir, rapporterede mindst ét tilfælde af sygdomsremission (8). Da de fleste af disse undersøgelser imidlertid er ukontrollerede casestudier, er det uklart, om fordelene er forårsaget af Cidofovir eller er en del af sygdommens naturlige forløb. Et randomiseret kontrolforsøg viste, at der ikke var nogen statistisk signifikante forskelle i papillomers sværhedsgrad eller helbredsrelateret livskvalitet mellem en kontrolgruppe, der blev behandlet med kirurgiske indgreb efter behov og intralesionale injektioner af saltvand, og forsøgsgruppen, der blev behandlet med kirurgi og intralesionalt Cidofovir, efter 12 måneders behandling (9). Begge grupper oplevede et signifikant fald i sygdommens sværhedsgrad i løbet af året, hvilket indikerer, at sygdommen kan gå tilbage med tiden af sig selv (9). En anden gennemgang, der kiggede på 27 undersøgelser af Cidofovir-administration, alle offentliggjort før 2011, viste, at den gennemsnitlige komplette remissionsrate med cidofovir var 37 % i pædiatriske undersøgelser (10). Der har også været nogle alvorlige bivirkninger forbundet med cidofovir, idet en gennemgang fandt, at henholdsvis 1,7 og 1 % af 447 RRP-patienter oplevede malign transformation og nefrotoksicitet hos henholdsvis 1,7 og 1 % af 447 RRP-patienter (8). Andre bivirkninger omfatter kutan udslæt, hovedpine og stemmebåndscarring (11). I betragtning af disse potentielle komplikationer og manglen på en accepteret protokol for dosering eller hyppighed af administration er dette lægemiddel ikke en pålidelig adjuvans (4).
Cidofovir er også blevet administreret som en systemisk snarere end lokal behandling til RRP-tilfælde, der er kompliceret af lungesygdom. Fire enkeltstående casestudier har vist, at intravenøs cidofovir førte til remission af sygdommen, hvilket ikke er den normale progression af sygdommen med lungeinvolvering (11). I alle disse undersøgelser blev der anvendt hyperhydrering og probenecid, et urinsyrereducerende middel, for at mindske risikoen for nefrotoksicitet (11). Kun én patient oplevede bivirkninger, delvis alopeci og leukopeni, som følge af en kombinationsbehandling med cidofovir og interferon (12). Doserne af begge lægemidler blev reduceret som reaktion herpå. 18 måneder efter behandlingens afslutning havde patienten kun haft brug for operation for RRP én gang, og hendes lungesygdom havde stabiliseret sig (12).
En ny metode til tilførsel af cidofovir er inhalation. Kun få undersøgelser har undersøgt effektiviteten af denne metode, men den kan være lovende for patienter, der ikke har reageret på andre former for behandling, som en 4 måneder gammel dreng, der på trods af mikrodebrideringer hver anden uge og intralesionale Cidofovir- og intravenøse interferon α-injektioner oplevede forværring af symptomerne (13). I løbet af 6 uger med 40 mg forstøvet Cidofovir dagligt, 12 dage til og 2 dage fra, blev tiden mellem debrideringerne længere (13). Seks måneder senere viste patienten ingen symptomer (13). Sammenfattende kan man sige, at selv om Cidofovir i forskellige administrationsformer fortsat anvendes i vid udstrækning, er behandlingsresultaterne i bedste fald blandede, og dets potentiale for bivirkninger er noget begrænsende.
Photodynamisk terapi
Photodynamisk terapi (PDT) indebærer indføring af et lysfølsomt stof, kaldet en fotosensibilisator, oralt eller ved injektion, i sygt væv og aktivering af stoffet med laserlys for at fremkalde nekrose. En af de store fordele ved PDT er evnen til at ødelægge tumorer uden at påvirke det omgivende væv (4). Casestudier har vist betydeligt langsommere genvækst af papillomer kort efter PDT, administreret som en adjuverende eller selvstændig behandling, og i nogle tilfælde er der ingen sygdom efter flere uger (14, 15). Der har kun været få randomiserede kontrolforsøg til at undersøge virkningen af PDT, men i det seneste forsøg blev det konstateret, at sygdommen kom tilbage efter 3-5 år, sandsynligvis fordi den genererer sin virkning gennem et kortvarigt immunrespons (16). Der bør udføres yderligere forskning for at fastslå dens effektivitet og sikkerhed.
Indol-3-carbinol
Indol-3-carbinol findes i høje koncentrationer i korsblomstrede grøntsager som broccoli og kål og modificerer østrogenmetabolismen for at ændre den cellulære proliferation og DNA-syntese. Det seneste kliniske forsøg viste, at efter indtagelse af indol-3-carbinol to gange dagligt med en dosis på 200 mg for voksne og vægtbestemte doser for børn i gennemsnitligt 50,2 måneder oplevede 70 % af forsøgspersonerne enten et fuldstændigt eller delvist respons (17). Af de pædiatriske patienter oplevede én et fuldstændigt respons, tre et delvist respons og fem slet intet respons (17). Det er uklart, hvorfor voksne patienter reagerede bedre på indol-3-carbinol end pædiatriske patienter. Den mindre aggressive karakter af RRP hos voksne kan være en faktor. I betragtning af de ikke lovende resultater i den pædiatriske population er der ikke blevet forsket meget mere i behandling af RRP med indol-3-carbinol.
Celecoxib
Celecoxib er et antiinflammatorisk lægemiddel, der hæmmer cyclooxygenase-2 (COX-2), et enzym, der fører til inflammation og smerte, og det anvendes almindeligvis til behandling af gigt. In-vitro-undersøgelser har vist, at papillomceller overudtrykker COX-2 som følge af øget signalering af epidermal vækstfaktorreceptor (EGFR), og at denne aktivitet er vigtig for deres vækst (18). En kombinationsbehandling med celecoxib og erlotinib, en EGFR-kinasehæmmer, hjalp med at kontrollere progressiv RRP hos en 58-årig mand a ved at bremse papillomvæksten, hvilket gjorde yderligere kirurgi unødvendig (19). Et igangværende randomiseret kontrolforsøg sponsoreret af Northwell Health har til formål at afgøre, om celecoxib kan nedsætte hastigheden af tilbagefald af papillomer hos både voksne og pædiatriske patienter (4).
Anti-refluxmedicinering
Fældeundersøgelser har vist, at behandling af gastroøsofageal reflukssygdom (GERD) med anti-refluxmedicin hos patienter med RRP med juvenilt debut kan bidrage til at bremse hastigheden af papillomgenvækst (20, 21). I en undersøgelse oplevede patienter, der ikke overholdt GERD-behandlingen, tilbagefald (20). En retrospektiv journalgennemgang viste også, at pædiatriske patienter behandlet for RRP, som ikke blev behandlet for refluks, var betydeligt mere tilbøjelige til at udvikle larynxbaner efter den kirurgiske fjernelse af papillomer (22). Selv om der ikke er entydige beviser for, at GERD forværrer RRP, giver det mening at behandle det for patienter, der har klinisk præsentation af GERD og komplicerede, progressive tilfælde af RRP (23).
Heat Shock Protein
Af de 700 børn med RRP, der blev behandlet af 74 pædiatriske otolaryngologer, som blev spurgt om deres brug af adjuverende behandling, fik 11 patienter HSP-E7, et rekombinant fusionsprotein bestående af heat shock protein 65 (Hsp65) og E7-proteinet fra HPV type 16 (1). HSP-E7 er blevet undersøgt som en behandling af flere sygdomme, der stammer fra HPV, herunder kønsvorter og intraepithelial neoplasi (24). Der er tegn på, at det kan være reaktivt over for flere HPV-stammer end blot HPV 16 (24). I et åbent forsøg med 27 pædiatriske RRP-patienter var medianintervallet mellem operationer efter behandling med HSP-E7 signifikant forlænget sammenlignet med medianen før behandlingen (24). Der var få komplikationer, kun milde til moderate reaktioner på injektionsstedet. Selv om der ikke er nogen igangværende kliniske forsøg til undersøgelse af Hsp-E7’s effektivitet, er det en lovende behandling.
HPV-vaccine
Et par case reports og undersøgelser har dokumenteret brugen af HPV-vaccinen som en adjuverende behandling. Der findes i øjeblikket tre godkendte HPV-vacciner: den bivalente Cervarix-vaccine, den tetravalente Gardasil-vaccine og den ikke-avalente Gardasil 9-vaccine. Den tetravalente vaccine virker mod HPV-6, HPV-11, HPV-16 og HPV-18. En nylig systematisk gennemgang og metaanalyse fandt, at den gennemsnitlige varighed mellem operationer hos 63 unge og voksne RRP-patienter steg betydeligt efter HPV-vaccination, fra 7 til 34 måneder i gennemsnit (25). Undersøgelsen fandt ingen signifikante forskelle efter alder ved RRP-udbruddet (25). Andre casestudier, der ikke er inkluderet i metaanalysen, har også vist Gardasil-effektivitet hos pædiatriske patienter, da det øger tiden mellem operationerne betydeligt eller i nogle tilfælde forårsager fuldstændig remission (26, 27).
Intramuskulær HPV-vaccination kan være mere effektiv end tidligere identificerede, mere almindelige behandlinger som intralesional cidofovir. Et retrospektivt casestudie, der fulgte unge og voksne RRP-patienter i 22 år, viste, at kun to af de 13 patienter, der blev behandlet med kirurgi og Gardasil, fik tilbagefald, mens alle kontrolpatienter, der blev behandlet med kirurgi og Cidofovir, oplevede papillomgenvækst (28). Den gennemsnitlige tid til sygdomsrecidiv var også betydeligt længere hos de behandlede patienter end hos kontrollerne (28).
Et af de mest lovende aspekter af HPV som adjuverende behandling er, at den ikke har nogen alvorlige bivirkninger. Desuden kan forekomsten af juvenil RRP generelt falde med stigende vaccinationsrater, da denne form for sygdommen almindeligvis erhverves, når et barn udsættes for kønsvorter forårsaget af HPV 6- eller 11-virus under fødslen (4).
Mumpsvaccine
Der har været meget få undersøgelser af virkningen af humpevaccinen som adjuverende behandling, selv om den nuværende forskning er lovende. Et casestudie viste, at der blev induceret remission hos ni ud af 11 pædiatriske patienter, der blev behandlet med intralesionale injektioner af vaccinen med 3 til 12 ugers mellemrum sammen med laserkirurgi (29). En retrospektiv undersøgelse, der sammenlignede cidofovir og mæslinger, fåresyge og røde hunde (MMR) vaccinen som adjuverende behandlinger i en pædiatrisk population, viste, at der ikke var nogen signifikante forskelle mellem de børn, der blev behandlet med intralesionale cidofovir- og MMR-injektioner efter debrideringer (30).
Bevacizumab
Bevacizumab er et humant monoklonalt antistof, der binder sig til og forhindrer interaktionen mellem vaskulær endothelial vækstfaktor (VEGF) og receptorer. VEGF-aktivitet har en rolle i RRP-udviklingen, da in vitro-undersøgelser har vist stærk ekspression af VEGF-A i papillomepitel og ekspression af VEGFR-1 og VEGFR-2 messenger RNA’er i underliggende vaskulære endotelceller (31).
De første undersøgelser, der undersøgte bevacizumab som en behandling af RRP, undersøgte fordelen ved intralesionale injektioner som en adjuverende behandling til kirurgi. En undersøgelse af tre patienter mellem 3 og 6 år med svær RRP (dvs. med mindst fire indgreb om året) viste, at alle patienterne oplevede længere tid mellem kirurgisk debridering og pulserende KTP-laserbehandlinger og mindre svær RRP flere uger efter afslutningen af bevacizumab-behandlingen sammenlignet med før (32). De viste også forbedret stemmerelateret livskvalitet (32).
Ud over caserapporter er der også blevet gennemført case-kontrolundersøgelser for at undersøge effekten af bevacizumab som adjuverende behandling. Efter 532 nm KTP-laserbehandling efterfulgt af sublesionale bevacizumab-injektioner i den mere syge stemmeled og saltvandsinjektioner i det andet led havde 16 ud af 20 voksne patienter med bilateral RRP i stemmeleddet færre papillomer i det behandlede led, som det blev fastslået ved endoskopisk billeddannelse (33). Tre af de 20 patienter havde ingen sygdom i begge folder, og ingen af patienterne oplevede komplikationer som følge af behandlingen (33).
Baseret på disse lovende resultater blev der gennemført en større undersøgelse af bevacizumabs effektivitet i en pædiatrisk population. Hos 10 børn mellem 18 måneder og 18 år med progressiv, ikke-reponsiv RRP øgede tre intralesionale bevacizumab-injektioner på 2,5 mg/ml med 2-3 ugers mellemrum sammen med laserbehandling den mediane tid mellem kirurgiske indgreb, mindskede det mediane antal indgreb pr. år og forbedrede den stemmerelaterede livskvalitet (3). En af begrænsningerne i undersøgelsen er, at doseringen er et skøn baseret på doser inden for pædiatrisk oftalmologi. Den mængde, der blev injiceret i paillomer, var heller ikke den samme for alle patienter, da den varierede afhængigt af sygdommens sværhedsgrad.
I nogle undersøgelser har man forsøgt at bestemme de optimale doser. I en anden undersøgelse, hvor man undersøgte ni pædiatriske patienter med RRP med juvenil debut, fandt man også, at efter en serie på fem subepitheliale injektioner, der blev givet med 4-6 ugers mellemrum, med en gennemsnitlig dosis på 14,25 mg, sammen med KTP-laserablation, oplevede alle ni patienter (med en medianalder på 8 år) et øget tidsinterval mellem injektionerne (34). Disse resultater indikerer, at viste, at viste, at højdosis bevacizumabbehandling ikke har nogen komplikationer og kan være meget effektiv.
Efter beviser, der viste effektiviteten af intralesionalt bevacizumab, vendte forskningen sig mod systemisk bevacizumab, der er en særlig lovende behandling for patienter med komplekse diagnoser. Den første rapport om intravenøs administration viste, at med en median på 6 kure i doser på 5, 10 og 15 mg/kg viste alle behandlede patienter med progressiv RRP papillomregression hos alle behandlede patienter med progressiv RRP (35). Patienterne omfattede fire tilfælde af RRP med voksen debut og et tilfælde med juvenilt debut. De fem patienter gennemgik tilsammen 18 kirurgiske indgreb året før bevacizumab, men kun det voksne tilfælde krævede operation efter behandlingen på grund af en malign transformation det følgende år (35).
Andre enkeltstående caserapporter har bekræftet effektiviteten af systemisk bevacizumab uden at finde komplikationer, selv om de fleste af disse er hos voksne patienter. Hos en 42-årig mand med alvorlig tracheal RRP hjalp en lav dosis på 5 mg/kg, øget til 10 mg/kg bevacizumab over tid, med at opnå sygdomsregression 3 måneder efter behandlingsophør (36). En 12-måneders opfølgning viste, at patienten fortsat var sygdomsfri. Seks behandlinger med systemisk bevacizumabbehandling på 5 mg/kg hver 2. uge til en 87-årig patient, som ikke havde reageret på intralesionalt cidofovir, en endobronchial stent eller HPV-vaccination, bidrog også til at opnå et betydeligt fald i lobens masse og en patenteret bronkus (37). Efter to kure med 10 mg/kg intravenøse injektioner hver 2. uge viste en 63-årig med svær RRP mindre lungeinvolvering og ingen tegn på tracheal obstruktion (37).
Den eneste offentliggjorte case report hos børn er om en 12-årig kvinde med progressiv laryngotracheal papillomatose og lungeinvolvering, som efter 3 måneders iværksættelse af systemisk bevacizumab-behandling viste et delvist respons i larynx og et næsten fuldstændigt respons i trachea (38). Efter 5 måneder viste patienten ikke længere lungeinvolvering. Disse resultater er endnu mere imponerende i betragtning af, at patienten i løbet af en 10-årig periode var blevet sat i behandling med Gardasil, interferon, celecoxib, anti-refluxmedicin, zithromycin og propranolol og ikke havde reageret på nogen af disse (38).
Systemisk bevacizumabs potentiale som behandling af de mest aggressive former for RRP sammenfattes bedst af resultaterne af en elektronisk undersøgelse af RRP Task Force of the American Society of Pediatric Otolaryngology, American Broncho-Esophagological Association, og læger, der har behandlet RRP med systemisk bevacizumab (39). De 11 udfyldte spørgeskemaer fra ni medicinske centre viste, at de fleste af de patienter, der blev behandlet med bevacizumab, havde en langvarig historie med RRP i ungdomsstadiet og ikke havde vist vedvarende respons på cidofovir, interferon og celecoxib. Lægerne gav behandling i intervallet 5-10 mg/kg pr. dosis. Syv af de otte behandlede patienter havde et delvist respons og én viste et komplet respons på behandlingen (39). Alle patienterne oplevede øget tid mellem operationerne, nu i størrelsesordenen måneder. Hos tre af de fire patienter med lungeinvolvering viste tre af dem forbedring eller opløsning af lungepapillomerne, og én viste stabilisering af sygdommen. Kun to patienter oplevede mindre komplikationer, hæmoptyse og proteinuri.
For at fastslå den kausale effekt af bevacizumab, bestemme passende doser og identificere eventuelle komplikationer, skal der gennemføres randomiserede kontrolforsøg og større case-kontrolundersøgelser. Desuden skal der udarbejdes protokoller til at definere behandlingsvarigheden, samtidig med at der kontrolleres for eventuelle potentielle rebound-effekter.
Konklusioner
Selv om der endnu ikke er fundet en optimal, universelt effektiv medicinsk adjuverende behandling for RRP, giver lovende resultater fra RRP-vaccination som en terapeutisk tilgang sammen med brugen af systemisk bevacizumab håb om bedre resultater for disse børn i de kommende år. Optimale protokoller til behandling bør udvikles i den nærmeste fremtid.
Forfatterbidrag
Alle forfattere på listen har ydet et væsentligt, direkte og intellektuelt bidrag til arbejdet og har godkendt det til offentliggørelse.
Interessekonflikter
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Den behandlende redaktør erklærede et tidligere samforfatterskab med en af forfatterne DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. American Society of Pediatric Otolaryngology members’ experience with recurrent respiratory papillomatosis and the use of adjuvant therapy. Arch Otolaryngol Head Neck Surg. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Etiopatogenese af recidiverende laryngeal papillomatose og moderne behandlingsstrategier. Acta Med Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Anvendelse af adjuverende intralesionalt bevacizumab ved aggressiv respiratorisk papillomatose hos børn. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Morandi M, Dall’Olio D. Recurrent respiratorisk papillomatose: nuværende og fremtidige perspektiver. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferon alfa-2b som adjuverende behandling af tilbagevendende respiratorisk papillomatose i Cuba: nationalt program (rapport for 1994-1999). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Price KN. Behandling af tilbagevendende respiratorisk papillomatose med human leukocytinterferon. New Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Use of interferon-alpha in recurrent respiratorisk papillomatose: 20-year follow-up. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza K, Klimza H, Wierzbicka M. Outcomes of bevacizumab and cidofovir treatment in HPV-associated recurrent respiratory papillomatosis-review of the literature. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Cidofovirs effektivitet ved recidiverende respiratorisk papillomatose: en randomiseret, dobbeltblind, placebokontrolleret undersøgelse. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Intralesional cidofovir til recidiverende respiratorisk papillomatose: systematisk gennemgang af effekt og sikkerhed. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Bivirkninger af cidofovir ved behandling af recidiverende respiratorisk papillomatose. Eur Arch Otorhinolaryngol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Vellykket behandling af juvenil laryngeal papillomatose-relateret multicystisk lungesygdom med cidofovir: case report and review of the literature. Chest. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Inhaleret cidofovir som en adjuverende behandling af tilbagevendende respiratorisk papillomatose. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Kliniske virkninger af fotodynamisk terapi på tilbagevendende laryngeale papillomer. Arch Otolaryngol Head Neck Surg. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Behandling af laryngeal papillomatose med fotodynamisk laserterapi. Laryngorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Fotodynamisk terapi for tilbagevendende respiratorisk papillomatose. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indol-3-carbinol til recidiverende respiratorisk papillomatose: langtidsresultater. J Voice. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. Epidermal vækstfaktor-induceret cyclooxygenase 2-ekspression formidles gennem phosphatidylinositol-3 kinase, ikke mitogen-aktiveret protein/ekstracellulært signalreguleret kinase kinase, i tilbagevendende respiratoriske papillomer. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Regression af tilbagevendende respiratorisk papillomatose med celecoxib- og erlotinib-kombinationsbehandling. Chest. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Ekstraøsofageal sure refluks og tilbagevendende respiratorisk papillom hos børn. Int. J. Pediatr. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Recurrent respiratorisk papillomatose associeret med gastroøsofageal reflukssygdom hos børn. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s00404050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Laryngopharyngeal refluks og laryngeal webdannelse hos patienter med pædiatriske tilbagevendende respiratoriske papillomer. Laryngoscope. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. Sammenslutningen mellem gastroøsofageal reflukssygdom og tilbagevendende respiratorisk papillomatose: en systematisk gennemgang. Laryngoscope. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. HspE7-behandling af pædiatrisk recidiverende respiratorisk papillomatose: endelige resultater af et åbent forsøg. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Terapeutisk anvendelse af human papillomavirusvaccine på recidiverende respiratorisk papillomatose: en systematisk gennemgang og metaanalyse. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Recidiverende laryngeal papillomatose: vellykket behandling med human papillomavirusvaccination. Arch Dis Child. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Juvenil laryngeal papillomatose-immunisering med den polyvalente vaccine gardasil. Laryngorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. HPV-vaccination som forebyggende tilgang til tilbagevendende respiratorisk papillomatose – en 22-årig retrospektiv klinisk analyse. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. Kan fåmfevaccine fremkalde remission ved tilbagevendende respiratorisk papillom? Arch Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/archotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Sammenligning af cidofovir og vaccinen mod mæslinger, fåresyge og røde hunde ved behandling af tilbagevendende respiratorisk papillomatose. Ear Nose Throat J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Rolle af vaskulær endothelial vækstfaktor-a i tilbagevendende respiratorisk papillomatose. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Anvendelse af 532-Nm pulseret kaliumtitanylphosphatlaser og adjuverende intralesionalt bevacizumab til aggressiv respiratorisk papillomatose hos børn: første erfaring. Arch Otolaryngol Head Neck Surg. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, Lopez-Guerra G, Burns JA, Friedman AD, et al. Lokal injektion af bevacizumab (Avastin) og angiolytisk KTP-laserbehandling af tilbagevendende respiratorisk papillomatose i stemmfolderne: en prospektiv undersøgelse. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. Højdosis sublesional bevacizumab (Avastin) til pædiatrisk recidiverende respiratorisk papillomatose. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Hurtigt respons på systemisk bevacizumab-behandling ved recidiverende respiratorisk papillomatose. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernandez-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Recidiverende respiratorisk papillomatose og behandling med bevacizumab. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Systemisk bevacizumab for tilbagevendende respiratorisk papillomatose: erfaring fra et enkelt center med to tilfælde. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Bevacizumab kemoterapi til behandling af lungepapillomatose og laryngotracheal papillomatose hos et barn. Laryngoscope. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Best SR, Mohr M, Zur KB. Systemisk bevacizumab ved tilbagevendende respiratorisk papillomatose: en national undersøgelse. Laryngoscope. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar