Introduzione
La papillomatosi respiratoria ricorrente (RRP) è una malattia cronica causata dal papillomavirus umano (HPV), solitamente i tipi 6 e 11. Le lesioni della RRP appaiono più frequentemente nella laringe (Figura 1), ma possono anche emergere in bocca, trachea, bronchi, parenchima polmonare ed esofago. La forma giovanile di RRP, in cui i sintomi si presentano prima dei 12 anni, è più aggressiva della forma adulta e i sintomi sono più gravi. La recidiva del papilloma è particolarmente rapida nei bambini sotto i 3 anni, che sperimentano intervalli più brevi tra gli interventi chirurgici e quindi più interventi in generale. La probabilità che l’infezione si diffonda oltre la laringe e l’incidenza di una tracheostomia, per aiutare a mantenere la trachea aperta, sono anche maggiori in questa popolazione (1). I pazienti con RRP ad insorgenza giovanile subiscono in media 20 interventi chirurgici, la maggior parte dei quali nell’infanzia (2).
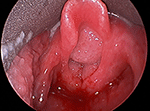
Figura 1. Immagine laringoscopica diretta di una grande papillomatosi voluminosa delle vie aeree che ostruisce l’ingresso laringeo.
Il metodo chirurgico tradizionale per l’estirpazione chirurgica coinvolgeva classicamente il KTP (fosfato di titanile di potassio) o il laser al biossido di carbonio (3). Dati gli effetti collaterali potenzialmente gravi dell’ablazione laser, comprese le ustioni del tratto respiratorio e le cicatrici laringee, i microdebrider sono diventati uno strumento chirurgico sempre più popolare, in particolare tra gli otorinolaringoiatri pediatrici, per la malattia voluminosa (3). Questo dispositivo portatile può rimuovere il tessuto malato in modo più preciso, riducendo i danni ai tessuti circostanti (3). Tuttavia, data la natura aggressiva della RRP giovanile, gli sbrigliamenti sono ancora frequenti e, nel tempo, consumano in modo significativo il tessuto sottostante, con un’alta incidenza di formazione di cicatrici. Come tale, diverse terapie mediche sono state studiate per migliorare il risultato della chirurgia, aumentando la durata del tempo tra le operazioni, o minimizzando la recidiva delle lesioni RRP.
Interferone α
L’interferone α, una proteina prodotta dai leucociti in reazione a diversi stimoli, compresa l’infezione virale, è stato uno dei primi potenziali trattamenti medici studiati (4). Il suo valore come trattamento adiuvante è controverso. In un ampio studio su 85 bambini e 84 adulti, il 58% dei bambini ha concluso il periodo di trattamento di un anno con iniezioni intramuscolari di interferone α tre volte alla settimana senza evidenza di RRP (5). La frequenza della recidiva del papilloma è diminuita nel 74% di tutti i bambini trattati (5). In uno studio di controllo randomizzato su 123 pazienti sotto i 21 anni, tuttavia, il tasso di crescita rallentato dei papillomi nel gruppo sperimentale che ha ricevuto iniezioni intramuscolari di interferone α non è stato sostenuto nel corso del trattamento di un anno (6). Allo stesso modo un altro studio ha trovato che, 20 anni dopo la conclusione del trattamento con interferone α, solo il 42% dei pazienti ha indicato una risposta a lungo termine, e tutti quelli che sono ricaduti avevano la forma giovanile di RRP (7). La maggior parte degli studi sull’interferone α ha anche riportato gravi effetti collaterali, come disturbi neurologici, leucopenia e trombocitopenia (5). Per queste ragioni, il suo uso da parte degli otorinolaringoiatri pediatrici è diminuito e non è generalmente raccomandato (1). Nel 2014, solo il 4% dei bambini con RRP ha ricevuto interferone α come terapia adiuvante (1).
Cidofovir
Questo farmaco antivirale ad ampio spettro che inibisce le polimerasi del DNA virale ha dimostrato di essere promettente come terapia intralesionale adiuvante alla chirurgia per la RRP. Le iniezioni intralesionali di cidofovir sono il trattamento medico più comunemente somministrato per la RRP tra gli otorinolaringoiatri pediatrici (1). Tutti gli articoli pubblicati tra il 1998 e il 2011 che hanno studiato l’efficacia del cidofovir intralesionale hanno riportato almeno un caso di remissione della malattia (8). Tuttavia, poiché la maggior parte di questi studi sono casi di studio non controllati, non è chiaro se i benefici siano causati dal Cidofovir o siano parte del corso naturale della malattia. Uno studio di controllo randomizzato ha trovato che non c’erano differenze statisticamente significative nella gravità del papilloma o nella qualità della vita correlata alla salute tra un gruppo di controllo, trattato con interventi chirurgici secondo necessità e iniezioni intralesionali di soluzione salina, e il gruppo sperimentale, trattato con chirurgia e Cidofovir intralesionale, dopo 12 mesi di trattamento (9). Entrambi i gruppi hanno sperimentato una diminuzione significativa della gravità della malattia nel corso dell’anno, indicando che la malattia può regredire nel tempo da sola (9). Un’altra revisione che ha esaminato 27 studi sulla somministrazione di Cidofovir, tutti pubblicati prima del 2011, ha trovato che il tasso medio di remissione completa con il cidofovir era del 37% negli studi pediatrici (10). Ci sono stati anche alcuni gravi effetti collaterali associati al cidofovir, dato che una revisione ha trovato che l’1,7 e l’1% di 447 pazienti con RRP hanno sperimentato rispettivamente trasformazione maligna e nefrotossicità (8). Altri effetti collaterali includono rash cutaneo, mal di testa e cicatrici delle corde vocali (11). Date queste potenziali complicazioni e la mancanza di un protocollo accettato per il dosaggio o la frequenza di somministrazione, questo farmaco non è un adiuvante affidabile (4).
Cidofovir è stato anche somministrato come trattamento sistemico piuttosto che locale per i casi di RRP che sono complicati dalla malattia polmonare. Quattro studi su singoli casi hanno dimostrato che il cidofovir per via endovenosa ha portato alla remissione della malattia, che non è la normale progressione della malattia con coinvolgimento polmonare (11). Tutti questi studi hanno impiegato iperidratazione e probenecid, un riduttore di acido urico, per ridurre le possibilità di nefrotossicità (11). Solo un paziente ha sperimentato effetti collaterali, alopecia parziale e leucopenia, da una terapia combinata di cidofovir e interferone (12). Le dosi di entrambi i farmaci sono state ridotte in risposta. Diciotto mesi dopo la fine del trattamento, la paziente aveva richiesto un solo intervento chirurgico per la RRP e la sua malattia polmonare si era stabilizzata (12).
Un nuovo metodo di somministrazione del Cidofovir è l’inalazione. Pochi studi hanno indagato l’efficacia di questo metodo, ma può essere promettente per i pazienti che non hanno risposto ad altre forme di trattamento, come un bambino di 4 mesi che, nonostante i microdebridimenti bisettimanali e le iniezioni intralesionali di Cidofovir e interferone α per via endovenosa, ha avuto un peggioramento dei sintomi (13). Entro 6 settimane di 40 mg di Cidofovir nebulizzato al giorno, 12 giorni sì e 2 no, il tempo tra gli sbrigliamenti è aumentato (13). Sei mesi dopo, il paziente non ha mostrato alcun sintomo (13). Per riassumere, anche se il Cidofovir in varie forme di somministrazione rimane ampiamente utilizzato, i suoi risultati di trattamento nel migliore dei casi sono misti, e il suo potenziale di effetti collaterali sono in qualche modo limitanti.
Terapia fotodinamica
La terapia fotodinamica (PDT) comporta l’introduzione di una sostanza sensibile alla luce, chiamata fotosensibilizzante, per via orale o per iniezione, nel tessuto malato e l’attivazione della sostanza con luce laser per indurre la necrosi. Uno dei principali vantaggi della PDT è la capacità di distruggere i tumori senza colpire il tessuto circostante (4). Studi di casi hanno dimostrato tassi significativamente più bassi di ricrescita del papilloma subito dopo la PDT, somministrata come terapia adiuvante o autonoma, e in alcuni casi, l’assenza di malattia dopo diverse settimane (14, 15). Ci sono stati solo pochi studi di controllo randomizzati per indagare l’impatto della PDT, ma il più recente ha trovato che la malattia si ripresenta dopo 3-5 anni, probabilmente perché genera il suo impatto attraverso una risposta immunitaria a breve termine (16). Ulteriori ricerche dovrebbero essere condotte per accertare la sua efficacia e sicurezza.
Indolo-3-Carbinolo
Trovato in alte concentrazioni nelle verdure crucifere come broccoli e cavoli, l’indolo-3-carbinolo modifica il metabolismo degli estrogeni per alterare la proliferazione cellulare e la sintesi del DNA. Il più recente studio clinico ha rilevato che, dopo aver assunto l’indolo-3-carbinolo due volte al giorno, con una dose di 200 mg per gli adulti e dosi determinate in base al peso per i bambini, per una media di 50,2 mesi, il 70% dei soggetti ha avuto una risposta completa o parziale (17). Dei pazienti pediatrici, uno ha avuto una risposta completa, tre una risposta parziale e cinque nessuna risposta (17). Non è chiaro perché i pazienti adulti abbiano risposto meglio all’indolo-3-carbinolo rispetto ai pazienti pediatrici. La natura meno aggressiva della RRP adulta può essere un fattore. Dati i risultati poco promettenti nella popolazione pediatrica, non ci sono state molte altre ricerche sul trattamento della RRP ad esordio giovanile con l’indolo-3-carbinolo.
Celecoxib
Celecoxib è un farmaco antinfiammatorio che inibisce la cicloossigenasi-2 (COX-2), un enzima che porta all’infiammazione e al dolore, ed è comunemente usato per trattare l’artrite. Studi in vitro hanno dimostrato che le cellule di papilloma sovraesprimono la COX-2 come risultato di una segnalazione potenziata del recettore del fattore di crescita epidermico (EGFR), e che questa attività è importante per la loro crescita (18). Una terapia combinata di celecoxib ed erlotinib, un inibitore della chinasi EGFR, ha aiutato a controllare la RRP progressiva in un uomo di 58 anni rallentando la crescita del papilloma, rendendo inutile un ulteriore intervento chirurgico (19). Uno studio di controllo randomizzato in corso, sponsorizzato dal Northwell Health, mira a determinare se il celecoxib può diminuire il tasso di ricaduta dei papillomi in pazienti adulti e pediatrici (4).
medicinali antireflusso
Studi di casi hanno dimostrato che il trattamento della malattia da reflusso gastroesofageo (GERD) con farmaci antireflusso in pazienti con RRP a esordio giovanile può aiutare a rallentare il tasso di ricrescita del papilloma (20, 21). In uno studio, i pazienti che non sono riusciti a rispettare il trattamento GERD hanno sperimentato una recidiva (20). Una revisione retrospettiva della cartella clinica ha anche mostrato che i pazienti pediatrici trattati per la RRP che non erano stati trattati per il reflusso avevano una probabilità significativamente maggiore di sviluppare ragnatele laringee dopo la rimozione chirurgica dei papillomi (22). Mentre c’è una prova inconcludente che la GERD aggrava la RRP, la sua gestione ha senso per i pazienti che hanno una presentazione clinica di GERD e casi complicati e progressivi di RRP (23).
Proteina da shock termico
Tra i 700 bambini con RRP gestiti da 74 otorinolaringoiatri pediatrici, che sono stati intervistati sul loro uso del trattamento adiuvante, 11 pazienti hanno ricevuto HSP-E7, una proteina di fusione ricombinante composta da proteina da shock termico 65 (Hsp65) e la proteina E7 di HPV tipo 16 (1). HSP-E7 è stata studiata come trattamento in diverse malattie che derivano da HPV, tra cui verruche genitali e neoplasia intraepiteliale (24). L’evidenza suggerisce che può essere reattivo contro più ceppi di HPV che solo HPV 16 (24). In uno studio in aperto su 27 pazienti pediatrici con RRP, l’intervallo mediano tra gli interventi chirurgici dopo il trattamento con HSP-E7 è stato significativamente prolungato rispetto alla mediana pre-trattamento (24). Ci sono state poche complicazioni, solo reazioni al sito di iniezione da lievi a moderate. Mentre non ci sono studi clinici in corso per indagare l’efficacia di Hsp-E7, è un trattamento promettente.
Vaccino HPV
Alcuni casi e studi hanno documentato l’uso del vaccino HPV come terapia adiuvante. Ci sono attualmente tre vaccini HPV approvati: il bivalente Cervarix, il tetravalente Gardasil e il nonavalente Gardasil 9. Il vaccino tetravalente agisce contro HPV-6, HPV-11, HPV-16, HPV-18. Una recente revisione sistematica e meta-analisi ha trovato che la durata media tra gli interventi in 63 pazienti giovani e adulti RRP è aumentata significativamente dopo la vaccinazione HPV, da 7 a 34 mesi in media (25). Lo studio non ha trovato differenze significative in base all’età di insorgenza della RRP (25). Altri studi di casi non inclusi nella meta-analisi hanno anche dimostrato l’efficacia del Gardasil nei pazienti pediatrici, in quanto aumenta significativamente il tempo tra gli interventi chirurgici o, in alcuni casi, provoca una remissione completa (26, 27).
La vaccinazione intramuscolare HPV potrebbe essere più efficace dei trattamenti precedentemente identificati e più comuni come il cidofovir intralesionale. Uno studio retrospettivo che ha seguito pazienti giovani e adulti con RRP per 22 anni ha scoperto che solo due dei 13 pazienti trattati con chirurgia e Gardasil hanno avuto una ricaduta, mentre tutti i pazienti di controllo, trattati con chirurgia e Cidofovir, hanno avuto una ricrescita del papilloma (28). La durata media della ricaduta della malattia era anche significativamente più lunga nei pazienti trattati rispetto ai controlli (28).
Uno degli aspetti più promettenti dell’HPV come terapia adiuvante è che non ha effetti collaterali gravi. Inoltre, con l’aumento dei tassi di vaccinazione, l’incidenza della RRP giovanile può diminuire complessivamente, poiché questa forma della malattia è comunemente acquisita quando un bambino è esposto alle verruche genitali causate dal virus HPV 6 o 11 durante il parto (4).
Vaccino per la parotite
Ci sono stati pochissimi studi sull’efficacia del vaccino per la parotite come terapia adiuvante, sebbene la ricerca attuale sia promettente. Uno studio di casi ha trovato che la remissione è stata indotta in nove degli 11 pazienti pediatrici trattati con iniezioni intralesionali del vaccino a intervalli di 3-12 settimane insieme alla chirurgia laser (29). Uno studio retrospettivo che ha confrontato il Cidofovir e il vaccino contro morbillo, parotite e rosolia (MMR) come terapie adiuvanti in una popolazione pediatrica ha scoperto che non c’erano differenze significative tra i bambini trattati con cidofovir intralesionale e iniezioni di MMR dopo gli sbrigliamenti (30).
Bevacizumab
Bevacizumab è un anticorpo monoclonale umano che si lega e previene l’interazione del fattore di crescita endoteliale vascolare (VEGF) con i recettori. L’attività del VEGF ha un ruolo nello sviluppo della RRP, poiché studi in vitro hanno mostrato una forte espressione del VEGF-A nell’epitelio del papilloma e l’espressione degli RNA messaggeri VEGFR-1 e VEGFR-2 nelle cellule endoteliali vascolari sottostanti (31).
I primi studi che hanno esaminato il bevacizumab come trattamento della RRP hanno studiato il beneficio delle iniezioni intralesionali come terapia adiuvante alla chirurgia. Uno studio su tre pazienti di età compresa tra i 3 e i 6 anni con RRP grave (cioè con almeno quattro procedure all’anno) ha rilevato che tutti i pazienti hanno sperimentato un aumento del tempo tra lo sbrigliamento chirurgico e i trattamenti laser KTP pulsato e una RRP meno grave diverse settimane dopo la fine del trattamento con bevacizumab rispetto a prima (32). Hanno anche mostrato una migliore qualità di vita legata alla voce (32).
Oltre ai case report, sono stati condotti anche studi caso-controllo per indagare l’efficacia del bevacizumab come terapia adiuvante. Dopo il trattamento laser KTP 532 nm seguito da iniezioni sublesionali di bevacizumab nella piega vocale più malata e iniezioni saline nell’altra piega, 16 dei 20 pazienti adulti con RRP bilaterale della piega vocale avevano meno papillomi nella piega trattata, come determinato dall’imaging endoscopico (33). Tre dei 20 pazienti non avevano malattia in entrambe le pieghe, e nessuno dei pazienti ha avuto complicazioni dal trattamento (33).
Sulla base di questi risultati promettenti, è stato condotto uno studio più ampio sull’efficacia del bevacizumab in una popolazione pediatrica. In 10 bambini tra i 18 mesi e i 18 anni con RRP progressiva e non responsiva, tre iniezioni intralesionali di bevacizumab di 2,5 mg/ml a distanza di 2-3 settimane, insieme alla terapia laser, hanno aumentato la durata mediana del tempo tra le procedure chirurgiche, diminuito il numero mediano di procedure per anno e migliorato la qualità della vita legata alla voce (3). Una delle limitazioni dello studio è che il dosaggio è una stima basata sulle dosi in oftalmologia pediatrica. Anche la quantità iniettata nei paillomi non era la stessa per ogni paziente, poiché variava in base alla gravità della malattia.
Alcuni studi hanno cercato di determinare i dosaggi ottimali. Un altro studio che ha esaminato nove pazienti pediatrici con RRP a insorgenza giovanile ha anche trovato che, dopo una serie di cinque iniezioni subepiteliali somministrate a intervalli di 4-6 settimane, con una dose media di 14,25 mg, insieme all’ablazione laser KTP, tutti i nove pazienti (con un’età mediana di 8 anni) hanno sperimentato un intervallo di tempo maggiore tra le iniezioni (34). Questi risultati indicano che hanno mostrato che il trattamento con bevacizumab ad alte dosi non ha complicazioni e può essere altamente efficace.
Seguendo le prove che hanno mostrato l’efficacia del bevacizumab intralesionale, la ricerca si è rivolta ad affrontare bevacizumab sistemico, che è un trattamento particolarmente promettente per i pazienti con diagnosi complesse. Il primo rapporto sulla somministrazione endovenosa ha mostrato che, con una mediana di 6 corsi in dosi di 5, 10, 15 mg/kg, tutti i pazienti trattati con RRP progressiva hanno mostrato la regressione del papilloma (35). I pazienti comprendevano quattro casi di RRP a insorgenza adulta e uno a insorgenza giovanile. I cinque pazienti collettivamente sono stati sottoposti a 18 interventi chirurgici l’anno prima del bevacizumab, ma solo il caso dell’adulto ha richiesto un intervento chirurgico dopo il trattamento a causa di una trasformazione maligna l’anno successivo (35).
Altri casi singoli hanno confermato l’efficacia del bevacizumab sistemico senza trovare complicazioni, anche se la maggior parte di questi sono in pazienti adulti. In un uomo di 42 anni con grave RRP tracheale, una bassa dose di 5 mg/kg, aumentata a 10 mg/kg di bevacizumab nel tempo, ha contribuito a raggiungere la regressione della malattia 3 mesi dopo la cessazione del trattamento (36). Un follow-up di 12 mesi ha rivelato che il paziente è rimasto libero da malattia. Sei cicli di trattamento sistemico con bevacizumab di 5 mg/kg ogni 2 settimane per un paziente di 87 anni che non aveva risposto al cidofovir intralesionale, a uno stent endobronchiale o alla vaccinazione HPV, hanno anche aiutato a ottenere una diminuzione significativa della massa del lobo e un bronco brevettato (37). Dopo due cicli di iniezioni endovenose da 10 mg/kg ogni 2 settimane, un 63enne con RRP grave ha mostrato meno coinvolgimento polmonare e nessuna evidenza di ostruzione tracheale (37).
L’unico caso pubblicato nei bambini è quello di una femmina di 12 anni con papillomatosi laringotracheale progressiva e coinvolgimento polmonare che, dopo 3 mesi dall’inizio del trattamento sistemico con bevacizumab, ha mostrato una risposta parziale nella laringe e una risposta quasi completa nella trachea (38). Dopo 5 mesi, il paziente non ha più mostrato coinvolgimento polmonare. Questi risultati sono ancora più impressionanti se si considera che, nell’arco di 10 anni, il paziente era stato avviato a Gardasil, interferone, celecoxib, farmaci antireflusso, zitromicina e propranololo, e non ha risposto a nessuno (38).
Il potenziale del bevacizumab sistemico come trattamento per le forme più aggressive di RRP è meglio riassunto dai risultati di un sondaggio elettronico della task force RRP dell’American Society of Pediatric Otolaryngology, American Broncho-Esophagological Association, e dei medici che hanno trattato RRP con bevacizumab sistemico (39). Le 11 indagini completate ottenute da nove centri medici hanno mostrato che la maggior parte dei pazienti trattati con bevacizumab aveva una lunga storia di RRP ad insorgenza giovanile e non aveva mostrato risposte sostenute al cidofovir, all’interferone e al celecoxib. I medici hanno somministrato il trattamento nell’intervallo di 5-10 mg/kg per dose. Sette degli otto pazienti trattati hanno avuto una risposta parziale e uno ha mostrato una risposta completa al trattamento (39). Tutti i pazienti hanno sperimentato un aumento del tempo tra gli interventi chirurgici, ora dell’ordine di mesi. In tre dei quattro pazienti con coinvolgimento polmonare, tre hanno mostrato il miglioramento o la risoluzione del papilloma polmonare e uno ha mostrato la stabilizzazione della malattia. Solo due pazienti hanno sperimentato complicazioni minori, emottisi e proteinuria.
Per accertare l’effetto causale del bevacizumab, determinare le dosi appropriate e identificare qualsiasi potenziale complicazione, devono essere condotti studi di controllo randomizzati e studi di controllo su casi più grandi. Inoltre, devono essere elaborati protocolli per definire la durata del trattamento, controllando qualsiasi potenziale effetto di rimbalzo.
Conclusioni
Anche se non è stata ancora trovata una terapia medica adiuvante ottimale e universalmente efficace per la RRP, i risultati promettenti della vaccinazione RRP come approccio terapeutico insieme all’uso del bevacizumab sistemico offrono la speranza di migliorare i risultati per questi bambini nei prossimi anni. I protocolli ottimali per il trattamento dovrebbero essere sviluppati nel prossimo futuro.
Contributi degli autori
Tutti gli autori elencati hanno dato un contributo sostanziale, diretto e intellettuale al lavoro, e lo hanno approvato per la pubblicazione.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Il curatore ha dichiarato una coautorità passata con uno degli autori DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. American Society of Pediatric Otolaryngology members’ experience with recurrent respiratory papillomatosis and the use of adjuvant therapy. Arch Otolaryngol Head Neck Surg. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Eziopatogenesi della papillomatosi laringea ricorrente e strategie di trattamento contemporanee. Acta Med Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Uso di bevacizumab intralesionale adiuvante per la papillomatosi respiratoria aggressiva nei bambini. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Dall’Olio D. Papillomatosi respiratoria ricorrente: prospettive attuali e future. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferone alfa-2b come trattamento adiuvante della papillomatosi respiratoria ricorrente a Cuba: programma nazionale (1994-1999 Report). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Price KN. Trattamento della papillomatosi respiratoria ricorrente con interferone leucocitario umano. New Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Uso di interferone alfa nella papillomatosi respiratoria ricorrente: 20 anni di follow-up. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza H, Wierzbicka M. Outcomes of bevacizumab and cidofovir treatment in HPV-associated recurrent respiratory papillomatosis-review of the literature. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Efficacia del Cidofovir nella papillomatosi respiratoria ricorrente: uno studio randomizzato, in doppio cieco, controllato con placebo. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Cidofovir intralesionale per la papillomatosi respiratoria ricorrente: revisione sistematica di efficacia e sicurezza. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Effetti collaterali del cidofovir nel trattamento della papillomatosi respiratoria ricorrente. Eur Arch Otorhinolaryngol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Trattamento di successo della malattia polmonare multicistica giovanile legata alla papillomatosi laringea con cidofovir: case report e revisione della letteratura. Chest. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Cidofovir inalato come terapia adiuvante per la papillomatosi respiratoria ricorrente. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Effetti clinici della terapia fotodinamica sui papillomi laringei ricorrenti. Arch Otolaryngol Head Neck Surg. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Trattamento della papillomatosi laringea con la terapia laser fotodinamica. Laryngorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Terapia fotodinamica per la papillomatosi respiratoria ricorrente. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indolo-3-carbinolo per la papillomatosi respiratoria ricorrente: risultati a lungo termine. J Voice. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. L’espressione della cicloossigenasi-2 indotta dal fattore di crescita epidermico è mediata dalla fosfatidilinositolo-3 chinasi, non dalla proteina attivata da mitogeno/chinasi regolata dal segnale extracellulare, nei papillomi respiratori ricorrenti. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Regressione della papillomatosi respiratoria ricorrente con la terapia combinata di celecoxib ed erlotinib. Chest. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Reflusso acido extraesofageo e papilloma respiratorio ricorrente nei bambini. Int. J. Pediatr. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Papillomatosi respiratoria ricorrente associata a malattia da reflusso gastroesofageo nei bambini. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s004050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Reflusso laringofaringeo e formazione di web laringeo in pazienti con papillomi respiratori ricorrenti pediatrici. Laryngoscope. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. L’associazione tra la malattia da reflusso gastroesofageo e la papillomatosi respiratoria ricorrente: una revisione sistematica. Laryngoscope. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. HspE7 trattamento della papillomatosi respiratoria ricorrente pediatrica: risultati finali di uno studio open-label. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Uso terapeutico del vaccino del papillomavirus umano sulla papillomatosi respiratoria ricorrente: una revisione sistematica e meta-analisi. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Papillomatosi laringea ricorrente: trattamento di successo con vaccinazione contro il papillomavirus umano. Arch Dis Child. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Papillomatosi laringea giovanile-immunizzazione con il vaccino polivalente gardasil. Laryngorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. La vaccinazione HPV come approccio preventivo per la papillomatosi respiratoria ricorrente – un’analisi clinica retrospettiva di 22 anni. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. Può il vaccino contro gli orecchioni indurre la remissione nel papilloma respiratorio ricorrente? Arch Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/archotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Confronto tra cidofovir e il vaccino contro morbillo, parotite e rosolia nel trattamento della papillomatosi respiratoria ricorrente. Ear Nose Throat J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Ruolo del fattore di crescita endoteliale vascolare-a nella papillomatosi respiratoria ricorrente. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Uso di 532-Nm laser pulsato al titanil fosfato di potassio e bevacizumab intralesionale adiuvante per la papillomatosi respiratoria aggressiva nei bambini: esperienza iniziale. Arch Otolaryngol Head Neck Surg. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, Lopez-Guerra G, Burns JA, Friedman AD, et al. Iniezione locale di bevacizumab (Avastin) e trattamento laser KTP angiolitico della papillomatosi respiratoria ricorrente delle pieghe vocali: uno studio prospettico. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. Bevacizumab sublesionale ad alta dose (Avastin) per papillomatosi respiratoria ricorrente pediatrica. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Risposta rapida alla terapia sistemica bevacizumab nella papillomatosi respiratoria ricorrente. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernandez-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Papillomatosi respiratoria ricorrente e trattamento bevacizumab. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Bevacizumab sistemico per la papillomatosi respiratoria ricorrente: un’esperienza di un singolo centro di due casi. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Chemioterapia Bevacizumab per la gestione della papillomatosi polmonare e laringotracheale in un bambino. Laryngoscope. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Migliore SR, Mohr M, Zur KB. Bevacizumab sistemico per la papillomatosi respiratoria ricorrente: un sondaggio nazionale. Laryngoscope. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar