Wprowadzenie
Recurrent respiratory papillomatosis (RRP) jest przewlekłą chorobą wywoływaną przez wirus brodawczaka ludzkiego (HPV), zwykle typu 6 i 11. Zmiany w RRP najczęściej pojawiają się w krtani (ryc. 1), ale mogą również występować w jamie ustnej, tchawicy, oskrzelach, miąższu płuc i przełyku. Młodzieńcza postać RRP, w której objawy pojawiają się przed 12 rokiem życia, jest bardziej agresywna niż postać dorosła, a objawy są bardziej nasilone. Nawroty brodawczaka są szczególnie szybkie u dzieci poniżej 3 roku życia, u których odstępy między kolejnymi zabiegami chirurgicznymi są krótsze, a co za tym idzie, liczba zabiegów chirurgicznych jest większa. Prawdopodobieństwo rozprzestrzenienia się infekcji poza krtań i konieczność wykonania tracheostomii, aby utrzymać tchawicę otwartą, są również większe w tej populacji (1). Pacjenci z RRP o początku młodzieńczym są poddawani średnio 20 interwencjom chirurgicznym, z czego większość w dzieciństwie (2).
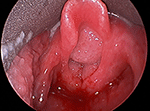
Rysunek 1. Bezpośredni obraz laryngoskopowy brodawczaka dróg oddechowych o dużych rozmiarach, blokującego wlot do krtani.
Tradycyjna metoda chirurgicznej ekstyrpacji klasycznie obejmowała zastosowanie lasera KTP (potassium titanyl phosphate) lub lasera dwutlenku węgla (3). Biorąc pod uwagę potencjalnie poważne skutki uboczne ablacji laserowej, w tym oparzenia dróg oddechowych i blizny na krtani, mikrodrążarki stały się coraz bardziej popularnym narzędziem chirurgicznym, szczególnie wśród otolaryngologów dziecięcych, w przypadku dużych rozmiarów choroby (3). To ręczne urządzenie pozwala na bardziej precyzyjne usunięcie chorej tkanki, zmniejszając uszkodzenie otaczających tkanek (3). Jednakże, biorąc pod uwagę agresywny charakter młodzieńczego RRP, zabiegi debridementu są nadal częste, a z czasem dochodzi do znacznego zużycia tkanki podskórnej, z dużą częstością tworzenia się blizn. W związku z tym badano kilka terapii medycznych mających na celu poprawę wyników leczenia chirurgicznego, poprzez wydłużenie czasu pomiędzy operacjami lub zminimalizowanie nawrotów zmian RRP.
Interferon α
Interferon α, białko produkowane przez leukocyty w reakcji na różne bodźce, w tym infekcje wirusowe, był jednym z pierwszych badanych potencjalnych terapii medycznych (4). Jego wartość jako leczenia adiuwantowego jest kontrowersyjna. W dużym badaniu obejmującym 85 dzieci i 84 dorosłych, 58% dzieci zakończyło roczny okres leczenia domięśniowymi wstrzyknięciami interferonu α trzy razy w tygodniu bez dowodów na wystąpienie RRP (5). Częstość nawrotów brodawczaka zmniejszyła się u 74% wszystkich leczonych dzieci (5). Jednak w randomizowanym badaniu kontrolnym 123 pacjentów poniżej 21 roku życia, spowolnienie wzrostu brodawczaków w grupie eksperymentalnej, która otrzymała domięśniowe zastrzyki interferonu α, nie utrzymało się w ciągu rocznego leczenia (6). Podobnie w innym badaniu stwierdzono, że 20 lat po zakończeniu leczenia interferonem α tylko 42% pacjentów wykazało długotrwałą odpowiedź, a wszyscy ci, u których doszło do nawrotu choroby, mieli postać RRP o początku młodzieńczym (7). W większości badań nad interferonem α odnotowano również poważne działania niepożądane, takie jak zaburzenia neurologiczne, leukopenia i trombocytopenia (5). Z tych powodów jego stosowanie przez otolaryngologów dziecięcych zmniejszyło się i generalnie nie jest zalecane (1). W 2014 roku tylko 4% dzieci z RRP otrzymało interferon α jako terapię adiuwantową (1).
Cidofovir
Ten lek przeciwwirusowy o szerokim spektrum działania, hamujący wirusowe polimerazy DNA, okazał się obiecujący jako adiuwantowa terapia śródskórna do leczenia chirurgicznego RRP. Śródskórne iniekcje cydofowiru są najczęściej stosowanym leczeniem farmakologicznym RRP wśród otolaryngologów dziecięcych (1). We wszystkich pracach opublikowanych w latach 1998-2011, w których badano skuteczność śródskórnych iniekcji cydofowiru, odnotowano co najmniej jeden przypadek remisji choroby (8). Jednakże, ponieważ większość z tych badań to niekontrolowane studia przypadków, nie jest jasne, czy korzyści są spowodowane przez cydofovir, czy są częścią naturalnego przebiegu choroby. W randomizowanym badaniu kontrolnym stwierdzono, że nie było statystycznie istotnych różnic w nasileniu brodawczaka lub jakości życia związanej ze zdrowiem pomiędzy grupą kontrolną, leczoną interwencjami chirurgicznymi w razie potrzeby i dożylnymi wstrzyknięciami soli fizjologicznej, a grupą eksperymentalną, leczoną chirurgicznie i dożylnie Cidofovirem, po 12 miesiącach leczenia (9). Obie grupy doświadczyły znaczącego zmniejszenia nasilenia choroby w ciągu roku, co wskazuje, że choroba może ustąpić z czasem samoistnie (9). W innym przeglądzie, w którym przeanalizowano 27 badań dotyczących podawania cydofowiru, wszystkie opublikowane przed 2011 rokiem, stwierdzono, że średni wskaźnik całkowitej remisji po podaniu cydofowiru wynosił 37% w badaniach pediatrycznych (10). Odnotowano również poważne działania niepożądane związane ze stosowaniem cydofowiru. W jednym z przeglądów stwierdzono, że u 1,7 i 1% z 447 pacjentów z RRP doszło odpowiednio do transformacji złośliwej i nefrotoksyczności (8). Inne działania niepożądane obejmują wysypkę skórną, ból głowy i bliznowacenie strun głosowych (11). Biorąc pod uwagę te potencjalne powikłania oraz brak akceptowanego protokołu dawkowania i częstości podawania, lek ten nie jest wiarygodnym adiuwantem (4).
Cydofowir był również podawany raczej jako leczenie systemowe niż miejscowe w przypadkach RRP powikłanych chorobą płuc. Cztery pojedyncze przypadki wykazały, że dożylne podawanie cydofowiru doprowadziło do remisji choroby, co nie jest normalnym postępem choroby z zajęciem płuc (11). We wszystkich tych badaniach stosowano hiperhydratację i probenecyd, reduktor kwasu moczowego, w celu zmniejszenia szans na wystąpienie nefrotoksyczności (11). Tylko u jednego pacjenta wystąpiły działania niepożądane, częściowe wyłysienie i leukopenia, po zastosowaniu terapii skojarzonej cydofowiru i interferonu (12). W odpowiedzi zredukowano dawki obu leków. Osiemnaście miesięcy po zakończeniu leczenia pacjentka tylko raz wymagała operacji z powodu RRP, a jej choroba płuc ustabilizowała się (12).
Nową metodą podawania cydofowiru jest inhalacja. Niewiele badań dotyczyło skuteczności tej metody, ale może być ona obiecująca dla pacjentów, którzy nie zareagowali na inne formy leczenia, tak jak 4-miesięczny chłopiec, u którego pomimo wykonywanych co dwa tygodnie mikronakłuć, podawania dożylnie Cidofoviru i dożylnych zastrzyków z interferonu α, doszło do pogorszenia objawów (13). W ciągu 6 tygodni stosowania 40 mg nebulizowanego cydofowiru dziennie, 12 dni na dobę i 2 dni przerwy, czas pomiędzy kolejnymi zabiegami usuwania zmian zwiększył się (13). Sześć miesięcy później u pacjenta nie wystąpiły żadne objawy (13). Podsumowując, chociaż Cidofovir w różnych formach podawania pozostaje szeroko stosowany, jego wyniki leczenia w najlepszym przypadku są mieszane, a jego potencjał działań niepożądanych jest nieco ograniczający.
Terapia fotodynamiczna
Terapia fotodynamiczna (PDT) polega na wprowadzeniu substancji światłoczułej, zwanej fotouczulaczem, doustnie lub przez wstrzyknięcie, do chorej tkanki i aktywacji substancji światłem laserowym w celu wywołania martwicy. Jedną z głównych zalet PDT jest zdolność do niszczenia guzów bez wpływu na otaczającą tkankę (4). Badania przypadków wykazały znacznie wolniejsze tempo odrastania brodawczaka wkrótce po PDT, podawanej jako terapia adiuwantowa lub samodzielna, a w niektórych przypadkach brak choroby po kilku tygodniach (14, 15). Przeprowadzono tylko kilka randomizowanych badań kontrolnych, aby zbadać wpływ PDT, ale w najnowszym stwierdzono, że choroba nawraca po 3-5 latach, prawdopodobnie dlatego, że generuje ona swój wpływ poprzez krótkotrwałą odpowiedź immunologiczną (16). Dalsze badania powinny być prowadzone w celu ustalenia jego skuteczności i bezpieczeństwa.
Indole-3-Carbinol
Znaleziony w wysokich stężeniach w warzywach krzyżowych, takich jak brokuły i kapusta, indol-3-carbinol modyfikuje metabolizm estrogenów, aby zmienić proliferację komórek i syntezę DNA. Najnowsze badanie kliniczne wykazało, że po przyjmowaniu indolo-3-karbinolu dwa razy dziennie, w dawce 200 mg dla dorosłych i w dawkach zależnych od wagi dla dzieci, przez średnio 50,2 miesiąca, u 70% badanych wystąpiła całkowita lub częściowa odpowiedź (17). Spośród pacjentów pediatrycznych, jeden doświadczył całkowitej odpowiedzi, trzech częściowej odpowiedzi, a pięciu w ogóle nie doświadczyło odpowiedzi (17). Nie jest jasne, dlaczego dorośli pacjenci lepiej reagowali na indol-3-karbinol niż pacjenci pediatryczni. Czynnikiem może być mniej agresywny charakter RRP u dorosłych. Biorąc pod uwagę mało obiecujące wyniki w populacji dziecięcej, nie przeprowadzono większej liczby badań nad leczeniem RRP o początku młodzieńczym za pomocą indolo-3-karbinolu.
Celecoxib
Celecoxib jest lekiem przeciwzapalnym hamującym cyklooksygenazę-2 (COX-2), enzym prowadzący do stanu zapalnego i bólu, i jest powszechnie stosowany w leczeniu zapalenia stawów. W badaniach in vitro wykazano, że komórki brodawczaka wykazują nadekspresję COX-2 w wyniku zwiększonej sygnalizacji receptora naskórkowego czynnika wzrostu (EGFR) i że ta aktywność jest ważna dla ich wzrostu (18). Terapia skojarzona celekoksybem i erlotynibem, inhibitorem kinazy EGFR, pomogła kontrolować postępujący RRP u 58-letniego mężczyzny poprzez spowolnienie wzrostu brodawczaka, dzięki czemu dalsze zabiegi chirurgiczne stały się zbędne (19). Trwające randomizowane badanie kontrolne sponsorowane przez Northwell Health ma na celu ustalenie, czy celekoksyb może zmniejszyć odsetek nawrotów brodawczaków zarówno u dorosłych, jak i u dzieci (4).
Leki antyrefluksowe
Badania przypadków wykazały, że leczenie choroby refluksowej przełyku (GERD) lekami antyrefluksowymi u pacjentów z RRP o młodzieńczym początku może pomóc spowolnić tempo odrastania brodawczaków (20, 21). W jednym z badań u pacjentów, którzy nie stosowali się do leczenia GERD, doszło do nawrotu choroby (20). Retrospektywny przegląd wykresów wykazał również, że pacjenci pediatryczni leczeni z powodu RRP, którzy nie byli leczeni z powodu refluksu, byli znacząco bardziej narażeni na wystąpienie wstęg krtaniowych po chirurgicznym usunięciu brodawczaków (22). Chociaż nie ma jednoznacznych dowodów na to, że refluks żołądkowo-przełykowy nasila RRP, jego leczenie ma sens w przypadku pacjentów z klinicznymi objawami GERD i powikłanymi, postępującymi przypadkami RRP (23).
Białko szoku cieplnego
Wśród 700 dzieci z RRP leczonych przez 74 otolaryngologów dziecięcych, którzy byli ankietowani na temat stosowania przez nich leczenia adiuwantowego, 11 pacjentów otrzymało HSP-E7, rekombinowane białko fuzyjne składające się z białka szoku cieplnego 65 (Hsp65) i białka E7 wirusa HPV typu 16 (1). HSP-E7 było badane jako lek w leczeniu kilku chorób, które wywodzą się z HPV, w tym brodawek płciowych i śródnabłonkowej neoplazji (24). Dowody sugerują, że może on być reaktywny przeciwko większej liczbie szczepów HPV niż tylko HPV 16 (24). W otwartym badaniu 27 pacjentów pediatrycznych z RRP, mediana odstępów między operacjami po leczeniu HSP-E7 była znacząco wydłużona w porównaniu z medianą przed leczeniem (24). Wystąpiło niewiele powikłań, jedynie łagodne do umiarkowanych reakcje w miejscu wstrzyknięcia. Chociaż nie ma trwających badań klinicznych badających skuteczność Hsp-E7, jest to obiecująca metoda leczenia.
Szczepionka przeciwko HPV
Kilka opisów przypadków i badań udokumentowało zastosowanie szczepionki przeciwko HPV jako terapii adiuwantowej. Obecnie dostępne są trzy zatwierdzone szczepionki przeciwko HPV: dwuwalentna Cervarix, tetrawalentna Gardasil i niewalentna Gardasil 9. Szczepionka tetrawalentna działa na HPV-6, HPV-11, HPV-16, HPV-18. W niedawnym przeglądzie systematycznym i metaanalizie stwierdzono, że średni czas między operacjami u 63 młodocianych i dorosłych pacjentów z RRP znacznie się wydłużył po szczepieniu HPV, średnio od 7 do 34 miesięcy (25). W badaniu nie stwierdzono istotnych różnic w zależności od wieku wystąpienia RRP (25). Inne opisy przypadków, nieuwzględnione w metaanalizie, również wykazały skuteczność szczepionki Gardasil u pacjentów pediatrycznych, ponieważ znacznie wydłuża ona czas między kolejnymi operacjami, a w niektórych przypadkach powoduje całkowitą remisję (26, 27).
Wewnątrzmięśniowa szczepionka przeciwko HPV może być bardziej skuteczna niż wcześniej zidentyfikowane, bardziej powszechne metody leczenia, takie jak cydofowir podawany śródskórnie. W retrospektywnej analizie przypadków, w której śledzono losy pacjentów z RRP o początku młodzieńczym i dorosłym przez 22 lata, stwierdzono, że tylko u dwóch z 13 pacjentów leczonych chirurgicznie i Gardasilem doszło do nawrotu choroby, podczas gdy u wszystkich pacjentów z grupy kontrolnej, leczonych chirurgicznie i cydofowirem, doszło do odrostu brodawczaka (28). Średnia długość czasu do nawrotu choroby była również znacznie dłuższa u leczonych pacjentek niż w grupie kontrolnej (28).
Jednym z najbardziej obiecujących aspektów HPV jako terapii adiuwantowej jest to, że nie ma ona żadnych poważnych skutków ubocznych. Dodatkowo, wraz ze wzrostem liczby szczepień, częstość występowania młodzieńczego RRP może się ogólnie zmniejszyć, ponieważ ta postać choroby jest powszechnie nabywana, gdy dziecko jest narażone na brodawki płciowe wywołane wirusem HPV 6 lub 11 podczas porodu (4).
Szczepionka przeciwko śwince
Było bardzo niewiele badań dotyczących skuteczności szczepionki przeciwko śwince jako terapii adiuwantowej, chociaż obecne badania są obiecujące. Studium przypadku wykazało, że remisja została wywołana u dziewięciu z 11 pacjentów pediatrycznych leczonych śródskórnymi wstrzyknięciami szczepionki w odstępach 3- do 12-tygodniowych wraz z chirurgią laserową (29). W retrospektywnym badaniu porównującym cydofowir i szczepionkę przeciwko odrze, śwince i różyczce (MMR) jako terapie adiuwantowe w populacji dziecięcej stwierdzono, że nie było istotnych różnic między dziećmi leczonymi śródskórnymi wstrzyknięciami cydofowiru i MMR po zabiegach chirurgicznych (30).
Bevacizumab
Bevacizumab jest ludzkim przeciwciałem monoklonalnym, które wiąże się z receptorami i zapobiega interakcji czynnika wzrostu śródbłonka naczyniowego (VEGF) z receptorami. Aktywność VEGF odgrywa rolę w rozwoju RRP, ponieważ badania in vitro wykazały silną ekspresję VEGF-A w nabłonku brodawczaka oraz ekspresję VEGFR-1 i VEGFR-2 messenger RNA w leżących u jego podłoża komórkach śródbłonka naczyniowego (31).
Pierwsze badania uwzględniające bevacizumab w leczeniu RRP dotyczyły korzyści płynących z podawania go doszklistkowo jako terapii adiuwantowej do zabiegu chirurgicznego. W badaniu przeprowadzonym na trzech pacjentach w wieku od 3 do 6 lat z ciężkim RRP (tj. z co najmniej czterema zabiegami w ciągu roku) stwierdzono, że wszyscy pacjenci doświadczyli wydłużenia czasu pomiędzy chirurgicznym usunięciem guza a zabiegami pulsacyjnym laserem KTP oraz mniejszego nasilenia RRP kilka tygodni po zakończeniu leczenia bevacizumabem w porównaniu z okresem wcześniejszym (32). Wykazali oni również poprawę jakości życia związanej z głosem (32).
Oprócz opisów przypadków przeprowadzono również badania kontrolne w celu zbadania skuteczności bevacizumabu jako terapii adiuwantowej. Po leczeniu laserem 532 nm KTP, a następnie podolnych wstrzyknięciach bevacizumabu w bardziej chory fałd głosowy i wstrzyknięciach soli fizjologicznej w drugi fałd, u 16 z 20 dorosłych pacjentów z obustronnym RRP fałdu głosowego odnotowano mniejszą liczbę brodawczaków w leczonym fałdzie, co stwierdzono na podstawie obrazowania endoskopowego (33). Trzech z 20 pacjentów nie miało choroby w żadnym z fałdów, a u żadnego z pacjentów nie wystąpiły powikłania związane z leczeniem (33).
W oparciu o te obiecujące wyniki przeprowadzono większe badanie dotyczące skuteczności bevacizumabu w populacji dziecięcej. U 10 dzieci w wieku od 18 miesięcy do 18 lat z postępującym, niereagującym na leczenie RRP, trzy śródskórne iniekcje bevacizumabu o mocy 2,5 mg/ml w odstępie 2-3 tygodni, wraz z laseroterapią, wydłużyły medianę czasu między zabiegami chirurgicznymi, zmniejszyły medianę liczby zabiegów w ciągu roku i poprawiły jakość życia związaną z głosem (3). Jednym z ograniczeń badania jest to, że dawkowanie jest szacunkowe, oparte na dawkach stosowanych w okulistyce dziecięcej. Ilość leku wstrzykiwanego do mięśniaków nie była również taka sama dla każdego pacjenta, ponieważ różniła się w zależności od stopnia zaawansowania choroby.
W niektórych badaniach próbowano określić optymalne dawki. W innym badaniu, dotyczącym dziewięciu pacjentów pediatrycznych z RRP o początku młodzieńczym, stwierdzono, że po serii pięciu wstrzyknięć podnabłonkowych, podawanych w odstępach 4-6 tygodni, ze średnią dawką 14,25 mg, wraz z ablacją laserową KTP, u wszystkich dziewięciu pacjentów (z medianą wieku 8 lat) zaobserwowano wydłużenie odstępów czasowych między wstrzyknięciami (34). Wyniki te wskazują, że leczenie wysokimi dawkami bevacizumabu nie wiąże się z żadnymi powikłaniami i może być wysoce skuteczne.
Po dowodach, które wykazały skuteczność bevacizumabu podawanego śródskórnie, badania zwróciły się w kierunku bevacizumabu podawanego ogólnoustrojowo, który jest szczególnie obiecującym leczeniem dla pacjentów ze złożonymi rozpoznaniami. Pierwsze doniesienie o podawaniu dożylnym wykazało, że po medianie 6 kursów w dawkach 5, 10, 15 mg/kg u wszystkich leczonych pacjentów z postępującym RRP doszło do regresji brodawczaka (35). Wśród pacjentów były cztery przypadki RRP o początku dorosłym i jeden o początku młodzieńczym. Pięciu pacjentów łącznie przeszło 18 interwencji chirurgicznych w roku poprzedzającym podanie bevacizumabu, ale tylko przypadek osoby dorosłej wymagał operacji po leczeniu z powodu złośliwej transformacji w następnym roku (35).
Inne pojedyncze opisy przypadków potwierdziły skuteczność ogólnoustrojowego bevacizumabu bez stwierdzenia powikłań, chociaż większość z nich dotyczyła pacjentów dorosłych. U 42-letniego mężczyzny z ciężkim RRP tchawicy, niska dawka 5 mg/kg, zwiększona z czasem do 10 mg/kg bevacizumabu, pomogła osiągnąć regresję choroby 3 miesiące po zaprzestaniu leczenia (36). W 12-miesięcznej obserwacji stwierdzono, że chory pozostaje wolny od choroby. Sześć kursów systemowego leczenia bevacizumabem w dawce 5 mg/kg co 2 tygodnie u 87-letniego pacjenta, u którego nie uzyskano odpowiedzi na cydofowir podawany dożylnie, stent wewnątrzoskrzelowy ani szczepienie przeciwko HPV, również pomogło uzyskać znaczne zmniejszenie masy płata i drożny oskrzelik (37). Po dwóch kursach wstrzyknięć dożylnych 10 mg/kg co 2 tygodnie u 63-letniego chorego z ciężkim RRP stwierdzono mniejsze zajęcie płuc i brak cech niedrożności tchawicy (37).
Jedyny opublikowany opis przypadku u dzieci dotyczy 12-letniej dziewczynki z postępującą brodawczakowatością krtani i zajęciem płuc, u której po 3 miesiącach od rozpoczęcia systemowego leczenia bevacizumabem stwierdzono częściową odpowiedź w krtani i prawie całkowitą odpowiedź w tchawicy (38). Po 5 miesiącach chory ten nie wykazywał już zajęcia płuc. Wyniki te są tym bardziej imponujące, że w ciągu 10 lat pacjentka przyjmowała Gardasil, interferon, celekoksyb, leki przeciwrefluksowe, zytromycynę i propranolol, i na żadne z nich nie odpowiedziała (38).
Potencjał systemowego bevacizumabu jako leczenia najbardziej agresywnych postaci RRP najlepiej podsumowują wyniki elektronicznej ankiety RRP Task Force Amerykańskiego Towarzystwa Otolaryngologii Dziecięcej, Amerykańskiego Stowarzyszenia Broncho-Esophagologicznego oraz lekarzy, którzy leczyli RRP systemowym bevacizumabem (39). Z 11 wypełnionych ankiet uzyskanych z dziewięciu ośrodków medycznych wynika, że większość pacjentów leczonych bevacizumabem miała długą historię RRP o początku młodzieńczym i nie wykazała trwałej odpowiedzi na cydofowir, interferon i celekoksyb. Lekarze podawali leczenie w zakresie 5-10 mg/kg na dawkę. Siedmiu z ośmiu leczonych pacjentów uzyskało częściową odpowiedź, a jeden wykazał całkowitą odpowiedź na leczenie (39). Wszyscy pacjenci doświadczyli wydłużenia czasu pomiędzy operacjami, obecnie rzędu miesięcy. U trzech z czterech pacjentów z zajęciem płuc, trzech wykazało poprawę lub ustąpienie brodawczaka płucnego, a jeden wykazał stabilizację choroby. Tylko u dwóch pacjentów wystąpiły niewielkie powikłania, krwioplucie i białkomocz.
Aby ustalić przyczynowy efekt bevacizumabu, określić odpowiednie dawki i zidentyfikować wszelkie potencjalne powikłania, należy przeprowadzić randomizowane badania kontrolne i większe badania kontrolne przypadków. Ponadto należy opracować protokoły określające czas trwania leczenia, kontrolując jednocześnie ewentualne efekty z odbicia.
Wnioski
Chociaż nie znaleziono jeszcze optymalnej, uniwersalnie skutecznej medycznej terapii adiuwantowej RRP, obiecujące wyniki szczepień przeciwko RRP jako podejścia terapeutycznego wraz z zastosowaniem systemowego bevacizumabu dają nadzieję na poprawę wyników leczenia tych dzieci w najbliższych latach. Optymalne protokoły leczenia powinny zostać opracowane w najbliższej przyszłości.
Wkład autorów
Wszyscy wymienieni autorzy wnieśli istotny, bezpośredni i intelektualny wkład w powstanie tej pracy oraz zatwierdzili ją do publikacji.
Oświadczenie o konflikcie interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Redaktor prowadzący zadeklarował współautorstwo w przeszłości z jednym z autorów DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. American Society of Pediatric Otolaryngology members’ experience with recurrent respiratory papillomatosis and the use of adjuvant therapy. Arch Otolaryngol Head Neck Surg. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Etiopatogeneza nawracających brodawczaków krtani i współczesne strategie leczenia. Acta Med Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Use of adjuvant intralesional bevacizumab for aggressive respiratory papillomatosis in children. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Dall’Olio D. Nawracająca brodawczakowatość układu oddechowego: obecne i przyszłe perspektywy. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferon alfa-2b jako leczenie adiuwantowe nawracającej brodawczakowatości układu oddechowego na Kubie: program krajowy (Raport 1994-1999). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Price KN. Treatment of recurrent respiratory papillomatosis with human leukocyte interferon. New Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Zastosowanie interferonu alfa w nawracającej brodawczakowatości dróg oddechowych: 20-letnia obserwacja. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza H, Wierzbicka M. Outcomes of bevacizumab and cidofovir treatment in HPV-associated recurrent respiratory papillomatosis-review of the literature. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Skuteczność cydofowiru w nawracającej brodawczakowatości dróg oddechowych: randomizowane, podwójnie zaślepione, kontrolowane placebo badanie. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Intralesional cidofovir for recurrent respiratory papillomatosis: systematyczny przegląd skuteczności i bezpieczeństwa. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Działania niepożądane cydofowiru w leczeniu nawracającej brodawczakowatości dróg oddechowych. Eur Arch Otorhinolaryngol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Successful treatment of juvenile laryngeal papillomatosis-related multicystic lung disease with cidofovir: case report and review of the literature. Chest. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Inhaled cidofovir as an adjuvant therapy for recurrent respiratory papillomatosis. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Clinical effects of photodynamic therapy on recurrent laryngeal papillomas. Arch Otolaryngol Head Neck Surg. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Treatment of laryngeal papillomatosis with photodynamic laser therapy. Laryngorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Photodynamic therapy for recurrent respiratory papillomatosis. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indol-3-karbinol dla nawracających brodawczaków układu oddechowego: wyniki długoterminowe. J Voice. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. Epidermal growth factor-induced cyclooxygenase-2 expression is mediated through phosphatidylinositol-3 kinase, not mitogen-activated protein/extracellular signal-regulated kinase kinase, in recurrent respiratory papillomas. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Regression of recurrent respiratory papillomatosis with celecoxib and erlotinib combination therapy. Chest. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Extraesophageal acid reflux and recurrent respiratory papilloma in children. Int. J. Pediatr. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Recurrent respiratory papillomatosis associated with gastroesophageal reflux disease in children. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s004050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Laryngopharyngeal reflux and laryngeal web formation in patients with pediatric recurrent respiratory papillomas. Laryngoskop. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. The Association between gastroesophageal reflux disease and recurrent respiratory papillomatosis: a systematic review. Laryngoskop. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. HspE7 treatment of pediatric recurrent respiratory papillomatosis: final results of an open-label trial. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Therapeutic use of the human papillomavirus vaccine on recurrent respiratory papillomatosis: a systematic review and meta-analysis. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Recurrent laryngeal papillomatosis: successful treatment with human papillomavirus vaccination. Arch Dis Child. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Juvenile laryngeal papillomatosis-immunisation with the polyvalent vaccine gardasil. Laryngorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. HPV vaccination as preventive approach for recurrent respiratory papillomatosis-a 22-year retrospective clinical analysis. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. Czy szczepionka przeciwko śwince może wywołać remisję w nawracającym brodawczaku układu oddechowego? Arch Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/archotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Porównanie cidofoviru i szczepionki przeciwko odrze, śwince i różyczce w leczeniu nawracającej brodawczakowatości układu oddechowego. Ear Nose Throat J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Role of vascular endothelial growth factor-a in recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Use of 532-Nm pulsed potassium titanyl phosphate laser and adjuvant intralesional bevacizumab for aggressive respiratory papillomatosis in children: initial experience. Arch Otolaryngol Head Neck Surg. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, Lopez-Guerra G, Burns JA, Friedman AD, et al. Local injection of bevacizumab (Avastin) and angiolytic KTP laser treatment of recurrent respiratory papillomatosis of the vocal folds: a prospective study. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. High-dose sublesional bevacizumab (Avastin) for pediatric recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Rapid response to systemic bevacizumab therapy in recurrent respiratory papillomatosis. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernandez-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Nawracająca brodawczakowatość układu oddechowego i leczenie bevacizumabem. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Systemic bevacizumab for recurrent respiratory papillomatosis: a single center experience of two cases. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Chemioterapia bevacizumabem w leczeniu brodawczaków płucnych i krtaniowo-tchawiczych u dziecka. Laryngoskop. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Best SR, Mohr M, Zur KB. Systemowy bevacizumab dla nawracających brodawczaków układu oddechowego: badanie krajowe. Laryngoskop. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar
.