Caso
Un uomo di 63 anni con ipertensione, diabete e un cancro ai polmoni a cellule squamose recentemente diagnosticato si presenta con dolore addominale diffuso e confusione di due giorni. Pesa 105 kg, la sua pressione sanguigna è 105/65 mm/Hg, la frequenza cardiaca è 105 battiti al minuto e la temperatura è 99,0 gradi Fahrenheit. La sua respirazione è di 18 respiri al minuto, la saturazione dell’ossigeno è del 95% con aria ambiente e l’ortostatismo è positivo. All’esame fisico si notano membrane mucose secche con diminuzione del turgore della pelle. La valutazione di laboratorio rivela un livello di calcio di 15,5 mg/dL, un livello di creatinina di 1,2 mg/dL, un livello di albumina di 4,3 g/dL e un livello di fosforo di 2,9 mg/dL.
Qual è il miglior trattamento di questa condizione? Anche se il 99% del calcio del corpo è immagazzinato nelle ossa, il 50% del calcio sierico è in forma ionizzata attiva, il 40% è legato all’albumina e il 10% è complessato con anioni.1 È importante ricordare queste percentuali quando si valuta il calcio sierico di un paziente; il calcio sierico elevato può essere convalidato utilizzando una formula di correzione (calcio corretto=calcio totale misurato + ) o misurando direttamente il calcio ionizzato, che è la forma fisiologicamente attiva.
L’ipercalcemia da neoplasia è la causa più comune di ipercalcemia nel paziente ricoverato. Dal 20 al 30% dei pazienti con cancro svilupperanno ipercalcemia ad un certo punto del corso della loro malattia.2 In generale, questo fa presagire una cattiva prognosi con una sopravvivenza mediana di tre o quattro mesi.3
Quattro meccanismi generali sono coinvolti nella patogenesi dell’ipercalcemia maligna; questi meccanismi costituiscono la base delle strategie di trattamento disponibili:
- I tumori osteolitici, come il mieloma multiplo, possono agire direttamente sull’osso, portando all’attivazione degli osteoclasti e al rilascio di calcio;
- I mediatori umorali elaborati dalle cellule maligne, come il peptide legato all’ormone paratiroideo (PTH-RP), possono provocare l’attivazione degli osteoclasti e diminuire l’eliminazione renale del calcio, causando l’ipercalcemia umorale della malattia;
- Alcuni tumori maligni (più comunemente i linfomi) possono sintetizzare direttamente la 1,25 (OH)2 vitamina D, portando ad un aumento dell’assorbimento luminoso di calcio e fosforo dal tratto gastrointestinale; e
- la produzione diretta di ormone paratiroideo (PTH) da parte delle cellule maligne è rara, ma è stata riportata.2
Altri fattori, tra cui la ridotta mobilità, potrebbero portare ad un ulteriore riassorbimento osseo e ad un peggioramento dello stato ipercalcemico.
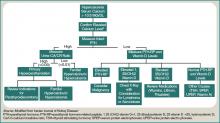
Un paziente con ipercalcemia deve avere un workup sistematico, con la conoscenza di altre cause di ipercalcemia che potrebbero essere presenti, indipendentemente dalla malignità. Gli esempi includono l’iperparatiroidismo primario, l’effetto dei farmaci e le eziologie genetiche. Anche se un’ulteriore discussione va oltre lo scopo di questo articolo, un ampio approccio diagnostico è rappresentato nella Figura 1 (a destra).
La gestione efficace dell’ipercalcemia richiede la considerazione sia della situazione clinica immediata del paziente, sia di quella a lungo termine, alla luce della prognosi del paziente. L’obiettivo primario nella gestione acuta dell’ipercalcemia è quello di normalizzare i valori sierici e diminuire i sintomi. Tuttavia, questo deve essere fatto con la consapevolezza che lo squilibrio metabolico è stato generato da una neoplasia sottostante. L’obiettivo principale della terapia clinica dovrebbe essere rivolto a questo.
 clicca per la versione grande
clicca per la versione grande
Un’immagine generata dal computer di osteoclasti multinucleati che incidono l’osso trabecolare in un processo chiamato riassorbimento osseo. I bifosfonati inibiscono questo processo nell’ipercalcemia indotta dalla malignità.
Rassegna dei dati
Fluidi intravenosi (IV). L’idratazione endovenosa con soluzione salina isotonica rappresenta l’intervento più immediato e critico nella gestione acuta dell’ipercalcemia maligna. Questa condizione ha molteplici effetti potenzialmente deleteri sul rene, tra cui la vasocostrizione, l’inibizione dell’assorbimento del sale a livello distale e l’antagonismo dell’ormone antidiuretico (ADH), che porta alla perdita sia di sale che di acqua. La diminuzione del volume intravascolare potenzia quindi l’aumento del riassorbimento di sodio a livello prossimale nel rene.
La soluzione salina isotonica ripristina la deplezione di volume che si verifica invariabilmente nell’impostazione del deperimento urinario del sale provocato dall’ipercalcemia. Il ripristino del volume intravascolare si traduce in un aumento della velocità di filtrazione glomerulare e, quindi, un aumento della filtrazione del calcio. Inoltre, il riassorbimento tubulare prossimale di sodio e calcio diminuisce con l’aumento della velocità di filtrazione glomerulare. Inoltre, un aumento della presentazione di sodio e acqua ai siti tubulari renali distali provoca un’ulteriore calciuresi.
Si stima che con l’idratazione salina, la concentrazione di calcio dovrebbe diminuire, almeno del grado in cui la disidratazione l’ha aumentata, in genere nell’intervallo da 1,6 mg a 2,4 mg per decilitro.4 L’idratazione da sola, tuttavia, raramente porta alla normalizzazione della concentrazione di calcio nel siero in pazienti con grave ipercalcemia.
Il tasso di infusione si basa sulla gravità dell’ipercalcemia, sull’età e sulle comorbidità del paziente, con particolare attenzione alla malattia cardiaca o renale. Un approccio standard per la maggior parte dei pazienti senza edema e senza insufficienza cardiaca o renale è quello di iniziare un’infusione salina a una velocità iniziale tra 200 mL/h e 300 mL/h. L’obiettivo è di mantenere la produzione di urina a 100 mL/h a 150 mL/h.
Furosemide. Dopo la somministrazione di liquidi per via endovenosa per ristabilire uno stato euvolemico, la furosemide è stata storicamente utilizzata perché ha un effetto calcinurico con diuresi forzata. È anche utile per gestire e prevenire il sovraccarico di liquidi che si verifica con l’idratazione salina. Tuttavia, i dati non supportano il suo uso di routine per abbassare i livelli di calcio nei pazienti ipercalcemici.
La maggior parte degli articoli che studiano l’uso della furosemide sono stati pubblicati negli anni ’70 e ’80, e coinvolgono una varietà di dosi e programmi di somministrazione che vanno da 40 mg per via orale al giorno a 100 mg IV ogni ora con miglioramento variabile nei livelli di calcio nel siero e gli effetti che erano di breve durata. Anche se alcuni studi hanno dimostrato che queste alte dosi (2.400 mg/24 ore) di furosemide possono diminuire i livelli di calcio, sono stati riscontrati gravi alterazioni metaboliche in altri elettroliti. Questo approccio richiedeva un monitoraggio frequente e invasivo per prevenire tali alterazioni.5 L’applicazione clinica di questi studi ha portato alla pubblicazione di raccomandazioni che sono variabili come le dosi utilizzate negli studi iniziali più di 30 anni fa.
Questo include la considerazione che, alla luce della disponibilità e dell’efficacia dei bifosfonati, la furosemide potrebbe non essere più clinicamente utile in questo sforzo.6 L’attuale ruolo della furosemide nella gestione dei pazienti ipercalcemici rimane su una base di necessità per la gestione degli stati di sovraccarico di liquidi causati da una rianimazione aggressiva con fluidi per via endovenosa.
 clicca per la versione grande
clicca per la versione grande
Figura 1: Approccio diagnostico all’ipercalcemia.
Bisfosfonati. I bisfosfonati sono diventati disponibili per la gestione dell’ipercalcemia all’inizio degli anni ’90 e hanno cambiato radicalmente l’intervento acuto e migliorato il decorso clinico a lungo termine dei pazienti con ipercalcemia maligna. Sebbene siano stati sviluppati per la prima volta nel XIX secolo con applicazioni industriali, è stato solo negli anni ’60 che il loro ruolo nel metabolismo osseo è stato apprezzato.
Mentre il loro complesso meccanismo d’azione rimane oggetto di indagini in corso, è noto che i bifosfonati sono diretti alle ossa, dove inibiscono un enzima nella via dell’HMG-CoA reduttasi e promuovono la morte cellulare apoptotica degli osteoclasti.7 Bloccando il riassorbimento osseo mediato dagli osteoclasti, i bifosfonati sono efficaci nel trattamento dell’ipercalcemia che si verifica con una varietà di processi patologici che assorbono le ossa, inclusa l’ipercalcemia maligna. Come composti relativamente non tossici in grado di conferire una profonda e sostenuta diminuzione del calcio sierico, questi agenti sono diventati preferiti nella gestione dell’ipercalcemia acuta e cronica di malignità.
Ci sono cinque bifosfonati parenterali disponibili per il trattamento dell’ipercalcemia maligna: pamidronato, acido zoledronico, ibandronato, etidronato e clodronato. L’etidronato e il clodronato sono agenti di prima generazione, che sono meno potenti e hanno più effetti collaterali di altri agenti e non sono così comunemente usati. L’ibandronato è un agente utile con una lunga emivita che ha dimostrato di essere efficace quanto il pamidronato, sebbene non sia stato studiato in modo così approfondito come gli altri agenti.
Il pamidronato è stato studiato a fondo in molteplici studi osservazionali e randomizzati e ha dimostrato di essere altamente efficace e minimamente tossico nel trattamento dell’ipercalcemia dovuta a cause multiple, compresa l’ipercalcemia maligna.8,9 L’effetto massimo di riduzione del calcio si verifica ad una dose di 90 mg, e la dose viene spesso titolata in base al calcio sierico misurato. Viene infuso da due a quattro ore, provoca un abbassamento del calcio sierico entro uno o due giorni e ha un effetto sostenuto che dura fino a due settimane o più.
Come il più potente e più facilmente somministrabile bifosfonato, l’acido zoledronico è considerato da molti l’agente di scelta nel trattamento dell’ipercalcemia maligna. Può essere somministrato come una dose di 4 mg-8 mg per via endovenosa in 15 minuti (rispetto alle due ore del pamidronato). Due studi di fase III che comprendono 275 pazienti hanno dimostrato l’efficacia superiore dell’acido zoledronico rispetto al pamidronato, con l’88% dei pazienti che hanno ottenuto una normalizzazione del calcio sierico (rispetto al 70% dei pazienti che hanno ricevuto una dose di 90 mg di pamidronato).10
Anche se questi agenti sono relativamente non tossici, ciascuno può provocare una lieve, transitoria malattia simil-floreale nei riceventi. Raramente è stata notata una disfunzione renale. Questi agenti devono essere dosati per via renale e usati con cautela nei pazienti con insufficienza renale avanzata (creatinina sierica >2.5). L’osteonecrosi della mascella è stata osservata in meno del 2% dei pazienti che ricevono bifosfonati per via endovenosa. Di conseguenza, si raccomanda che i pazienti si sottopongano a valutazione dentale prima di ricevere l’agente (se possibile) ed evitino procedure dentali invasive nel periodo in cui ricevono l’agente.11
 clicca per la versione grande
clicca per la versione grande
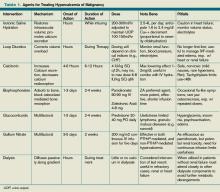
Tabella 1. Agenti per il trattamento dell’ipercalcemia maligna
Altri interventi terapeutici. I bifosfonati rappresentano gli agenti farmaceutici meglio studiati e più efficaci disponibili per trattare l’ipercalcemia. Allontanarsi da questi agenti dovrebbe essere considerato solo quando sono controindicati, in circostanze gravi, o dopo che il paziente non ha risposto.
La calcitonina ha avuto a lungo l’approvazione della FDA per il trattamento dell’ipercalcemia negli adulti. È stato dimostrato in piccoli studi non randomizzati degli anni ’70 e ’80 di diminuire rapidamente (entro due ore) i livelli di calcio nei pazienti ipercalcemici.12,13,14 Tuttavia, queste riduzioni sono piccole (<10%) e transitorie (di solito persistono fino a 72-96 ore) a causa della tachifilassi nota con questo farmaco. Ciononostante, la calcitonina può essere usata come ponte adiuvante per abbassare i livelli di calcio nei pazienti gravemente ipercalcemici per i primi giorni prima che altri agenti comincino a fare effetto.
I glucocorticoidi sono stati usati per trattare l’ipercalcemia fin dagli anni ’50. Prednisone, desametasone e metilprednisolone hanno tutti indicazioni FDA per l’ipercalcemia, ma i dati sono carenti e contraddittori. Un piccolo (n=28) studio controllato randomizzato (RCT) condotto nel 1984 non ha mostrato un’efficacia aggiuntiva dei glucocorticoidi con fluidi IV rispetto ai soli fluidi IV.15 Un altro piccolo (n=30) RCT condotto nel 1992 su donne con cancro al seno metastatico ha mostrato un miglioramento significativo nei pazienti trattati con prednisolone, fluidi IV e furosemide rispetto a fluidi IV e furosemide.16 Altri studi non randomizzati hanno mostrato una risposta imprevedibile nel migliore dei casi.17 Nonostante ciò, è probabile che i glucocorticoidi mantengano un ruolo limitato per il trattamento in casi specifici, tra cui l’ipercalcemia indotta da linfomi che elevano i livelli di 1,25(OH)2 vitamina D (poiché questa interagisce con un recettore regolato dagli steroidi), o mielomi multipli in cui hanno un potenziale impatto sulla progressione della malattia.
Il nitrato di gallio, un sale anidro di un metallo pesante, ha dimostrato in diversi studi randomizzati di essere un agente terapeutico efficace per abbassare i livelli di calcio nei pazienti ipercalcemici.18,19 Inoltre, uno studio in doppio cieco su 64 pazienti con ipercalcemia maligna ha dimostrato che il nitrato di gallio è efficace almeno quanto il pamidronato per il controllo acuto dell’ipercalcemia correlata al cancro.20 Tuttavia, la necessità di un’infusione continua per un periodo di cinque giorni ha limitato l’applicazione di questo agente.
L’emodialisi con un dialisato privo di calcio ha dimostrato in piccoli studi non randomizzati di essere un metodo temporaneamente efficace per ridurre i livelli di calcio nel siero.21,22 Tuttavia, questa modalità di trattamento sarebbe meglio riservata ai pazienti con ipercalcemia grave, nei quali non è consigliabile una replezione di volume intravascolare aggressiva e i bifosfonati (ad esempio, quelli con insufficienza cardiaca o renale significativa) e che hanno un’eziologia sottostante che probabilmente risponderà ad altri trattamenti. Inoltre, dovrebbe essere presa in considerazione l’opportunità di tali procedure invasive di temporizzazione in pazienti con cancro metastatico.
Torna al caso
Questo paziente aveva un livello di calcio ionizzato di 1,9 mmol/L (normale 1,1-1,4 mmol/L). È stato iniziato con un’idratazione endovenosa aggressiva con soluzione salina normale e acido zoledronico. I suoi farmaci a casa sono stati rivisti ed è stato confermato che non stava assumendo farmaci controindicati come i tiazidi o l’integrazione di calcio/vitamina D.
L’ulteriore analisi per l’eziologia della sua ipercalcemia ha rivelato un PTH intatto adeguatamente soppresso e livelli normali di 25 (OH) vitamina D e 1,25 (OH)2 vitamina D. Il suo PTH-RP intatto era elevato a 10pmol/L, e coerente con l’ipercalcemia di malignità.
Sono state richieste consulenze di oncologia e cure palliative per aiutare a coordinare il trattamento del sottostante cancro ai polmoni del paziente; sono stati fatti piani per la chemioterapia sistemica. I suoi sintomi sono lentamente migliorati e 72 ore dopo il ricovero, il suo calcio sierico si era normalizzato. È stato dimesso con un piano per iniziare la chemioterapia e continuare il follow-up con l’oncologia.
Bottom Line
La gestione acuta dell’ipercalcemia di malignità si concentra sull’abbassamento del calcio sierico attraverso una varietà di agenti farmacologici. Tuttavia, questioni a lungo termine come il trattamento del tumore maligno sottostante e le discussioni sugli obiettivi di cura in questa popolazione di pazienti ad alta mortalità sono fondamentali. TH
Il dottor Hartley e il dottor Repaskey sono istruttori clinici di medicina interna presso l’Università del Michigan Health System. Il Dr. Rohde è un assistente clinico di medicina interna presso UMHS.
- Assadi F. Ipercalcemia: un approccio basato sull’evidenza ai casi clinici. Iran J Kidney Dis. 2009;3:(2):71-79.
- Stewart A. Ipercalcemia associata al cancro. N Engl J Med. 2005;542(4):373-379.
- Seccareccia D. Cancer-related hypercalcemia. Can Fam Physician. 2010;56:(3):244-246.
- Bilezikian JP. Gestione di ipercalcemia acuta. N Engl J Med. 1992; 326(18):1196-1203.
- Suki WN, Yium JJ, VonMinden M, et al. Trattamento acuto di ipercalcemia con furosemide. N Engl J Med. 1970;283:836-840.
- LeGrand SB, Leskuski D, Zama I. Narrative review: furosemide per ipercalcemia: una pratica non provata ma comune. Ann Intern Med. 2008;149:259-263.
- Drake MT, Bart LC, Khosla S. Bisfosfonati: meccanismo di azione e ruolo nella pratica clinica. Mayo Clinic Proc. 2008;83(9):1032-1045.
- Nussbaum SR, Younger J, Vandepol CJ, et al. Terapia endovenosa a dose singola con pamidronato per il trattamento dell’ipercalcemia da neoplasia: confronto tra dosaggi da 30, 60 e 90 mg. Am J Med. 1993; 95(3):297-304.
- Gucalp R, Ritch P, Riernik PH, et al. Studio comparativo di pamidronato disodico ed etidronato disodico nel trattamento dell’ipercalcemia legata al cancro. J Clin Oncol. 1992;10(1):134-142.
- Major P, Lortholary A, Hon J, et al. L’acido zoledronico è superiore al pamidronato nel trattamento dell’ipercalcemia di malignità: un’analisi condivisa di due studi clinici randomizzati e controllati. J Clin Oncol. 2001;19(2): 558-567.
- Tanvetyanon T. Gestione degli effetti avversi associati ai bifosfonati intravenosi. Ann Oncol. 2006;17(6):897-907.
- Wisneski LA, Croom WP, Silva OL, et al. Salmon calcitonin in hypercalcemia. Clin Pharmacol Ther. 1978; 24:219-222.
- Binstock ML, Mundy GR. Effetto di calcitonina e glucocorticoidi in combinazione sull’ipercalcemia di malignità. Ann Intern Med. 1980;93(2):269-272.
- Nilsson O, Almqvist S, Karlberg BE. La calcitonina di salmone nel trattamento acuto dell’ipercalcemia moderata e grave nell’uomo. Acta Med Scand. 1978;204(4): 249-252.
- Percival RC, Yates AJ, Gray RE, et al. Ruolo dei glucocorticoidi nella gestione dell’ipercalcemia maligna. Br Med J. 1984;289(6440):287.
- Kristensen B, Ejlertsen B, Holmegaard SN, et al. Prednisolone nel trattamento della grave ipercalcemia maligna nel cancro al seno metastatico: uno studio randomizzato. J Intern Med. 1992;232(3):237-245.
- Thalassinos NC, Joplin GF. Fallimento della terapia corticosteroidea per correggere l’ipercalcemia della malattia maligna. Lancet. 1970;2(7672):537-538.
- Warrell RP Jr, Murphy WK, Schulman P, et al. Uno studio randomizzato in doppio cieco di nitrato di gallio rispetto all’etidronato per il controllo acuto dell’ipercalcemia legata al cancro. J Clin Oncol. 1991;9(8):1467-1475.
- Warrell RP Jr, Israel R, Frisone M, et al. Nitrato di gallio per il trattamento acuto dell’ipercalcemia correlata al cancro: un confronto randomizzato, in doppio cieco con la calcitonina. Ann Intern Med. 1988;108:669-674.
- Cvitkovic F, Armand JP, Tubiana-Hulin M, et al. Randomized, double-blind, phase II trial of gallium nitrate compared with pamidronate for acute control of cancer-related hypercalcemia. Cancer J. 2006;12 (1):47-53.
- Cardella CJ, Birkin BL, Rapoport A. Ruolo della dialisi nel trattamento della ipercalcemia grave: rapporto di due casi trattati con successo con emodialisi e revisione della letteratura. Clin Nephrol. 1979; 12(6):285-290.
- Koo WS, Jeon DS, Ahn SJ, et al. Calcium-free emodialisi per la gestione della ipercalcemia. Nephron. 1996;72(3):424-428.