Cas
Un homme de 63 ans souffrant d’hypertension, de diabète et d’un cancer du poumon à cellules squameuses récemment diagnostiqué se présente avec des douleurs abdominales diffuses et une confusion d’une durée de deux jours. Il pèse 105 kg, sa tension artérielle est de 105/65 mm/Hg, sa fréquence cardiaque est de 105 battements par minute et sa température est de 99,0 degrés Fahrenheit. Sa respiration est de 18 respirations par minute, sa saturation en oxygène est de 95 % à l’air ambiant et son orthostatisme est positif. L’examen physique révèle une sécheresse des muqueuses et une diminution du turgescence de la peau. L’évaluation de laboratoire révèle un taux de calcium de 15,5 mg/dL, un taux de créatinine de 1,2 mg/dL, un taux d’albumine de 4,3 g/dL et un taux de phosphore de 2,9 mg/dL.
Quel est le meilleur traitement de cette affection ?
Overview
L’homéostasie du calcium implique des interactions complexes entre le rein, le tractus gastro-intestinal (GI) et le système squelettique via des influences hormonales. Bien que 99% du calcium de l’organisme soit stocké dans les os, 50% du calcium sérique est sous forme ionisée active, 40% est lié à l’albumine et 10% est complexé avec des anions1. Il est important de se rappeler ces pourcentages lors de l’évaluation du calcium sérique d’un patient ; un taux élevé de calcium sérique peut être validé soit en utilisant une formule de correction (calcium corrigé=calcium total mesuré + ), soit en mesurant directement le calcium ionisé, qui est la forme physiologiquement active.
L’hypercalcémie d’origine maligne est la cause la plus fréquente d’hypercalcémie chez le patient hospitalisé. Vingt à 30 % des patients atteints de cancer développeront une hypercalcémie à un moment donné de l’évolution de leur maladie.2 Dans l’ensemble, cela laisse présager un mauvais pronostic avec une survie médiane de trois à quatre mois3.
Quatre mécanismes généraux sont impliqués dans la pathogenèse de l’hypercalcémie maligne ; ces mécanismes constituent la base des stratégies de traitement disponibles :
- Les tumeurs ostéolytiques, telles que le myélome multiple, peuvent agir directement sur l’os, entraînant l’activation des ostéoclastes et la libération de calcium;
- Les médiateurs humoraux élaborés par les cellules malignes, tels que le peptide lié à l’hormone parathyroïdienne (PTH-RP), peuvent effectuer l’activation des ostéoclastes et diminuer l’élimination rénale du calcium, provoquant une hypercalcémie humorale de malignité ;
- Certaines tumeurs malignes (le plus souvent des lymphomes) peuvent synthétiser directement la 1,25 (OH)2 vitamine D, entraînant une augmentation de l’absorption luminale du calcium et du phosphore à partir du tractus gastro-intestinal ; et
- La production directe de l’hormone parathyroïdienne (PTH) par les cellules malignes est rare, mais a été rapportée.2
D’autres facteurs, notamment une mobilité réduite, pourraient entraîner une résorption osseuse supplémentaire et une aggravation de l’état hypercalcémique.
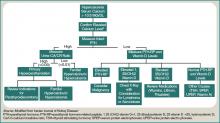
Un patient présentant une hypercalcémie doit faire l’objet d’un bilan systématique, en connaissant les autres causes d’hypercalcémie qui pourraient être présentes, indépendamment de la malignité. Les exemples incluent l’hyperparathyroïdie primaire, l’effet des médicaments et les étiologies génétiques. Bien qu’une discussion plus approfondie dépasse le cadre de cet article, une approche diagnostique générale est représentée dans la figure 1 (à droite).
La prise en charge efficace de l’hypercalcémie exige de prendre en compte à la fois la situation clinique immédiate du patient et celle à plus long terme, à la lumière du pronostic du patient. L’objectif principal de la prise en charge aiguë de l’hypercalcémie est de normaliser les valeurs sériques et de réduire les symptômes. Cependant, cela doit être fait en tenant compte du fait que le dérèglement métabolique a été généré par une tumeur maligne sous-jacente. C’est sur ce point que doit se concentrer la thérapeutique clinique.
 click for large version
click for large version
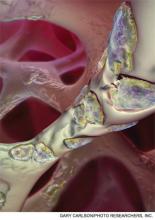
A computer-generated image of multinucleated osteoclasts etching away the trabecular bone in a process called bone resorption. Les bisphosphonates inhibent ce processus dans l’hypercalcémie induite par une tumeur maligne.
Revue des données
Liquides intraveineux (IV). L’hydratation IV avec du sérum salé isotonique représente l’intervention la plus immédiate et la plus critique dans la prise en charge aiguë de l’hypercalcémie maligne. Cette affection a de multiples effets potentiellement délétères sur le rein, notamment une vasoconstriction, une inhibition de l’absorption du sel au niveau distal et un antagonisme de l’hormone antidiurétique (ADH), ce qui entraîne une perte de sel et d’eau. La diminution du volume intravasculaire potentialise alors la réabsorption accrue de sodium au niveau proximal dans le rein.
La solution saline isotonique rétablit la déplétion volumique qui se produit invariablement dans le cadre d’une perte de sel urinaire provoquée par l’hypercalcémie. La restauration du volume intravasculaire entraîne une augmentation du taux de filtration glomérulaire et, par conséquent, une augmentation de la filtration du calcium. De plus, la réabsorption du sodium et du calcium par les tubules proximaux diminue lorsque le taux de filtration glomérulaire augmente. De plus, une augmentation de la présentation de sodium et d’eau aux sites tubulaires rénaux distaux provoque une nouvelle calciurèse.
On estime qu’avec une hydratation saline, la concentration de calcium devrait diminuer, au moins du degré auquel la déshydratation l’a augmentée, typiquement dans la fourchette de 1,6 mg à 2,4 mg par décilitre4. Cependant, l’hydratation seule conduit rarement à la normalisation de la concentration de calcium sérique chez les patients présentant une hypercalcémie grave.
Le débit de perfusion est basé sur la gravité de l’hypercalcémie, ainsi que sur l’âge et les comorbidités du patient, avec une attention particulière pour les maladies cardiaques ou rénales. Une approche standard pour la plupart des patients sans œdème et sans insuffisance cardiaque ou rénale consiste à commencer une perfusion de solution saline à un débit initial compris entre 200 ml/h et 300 ml/h. L’objectif est de maintenir le débit urinaire à un niveau constant. L’objectif est de maintenir le débit urinaire à 100 mL/h à 150 mL/h.
Furosémide. Après l’administration de fluides intraveineux pour rétablir un état euvolémique, le furosémide est historiquement utilisé car il a un effet calcinurique avec une diurèse forcée. Il est également utile pour gérer et prévenir la surcharge liquidienne qui se produit avec l’hydratation saline. Cependant, les données ne soutiennent pas son utilisation systématique pour abaisser les taux de calcium chez les patients hypercalcémiques.
La majorité des articles étudiant l’utilisation du furosémide ont été publiés dans les années 1970 et 1980, et ils impliquent une variété de doses et de schémas d’administration allant de 40 mg par jour par voie orale à 100 mg IV toutes les heures avec une amélioration variable des taux de calcium sérique et des effets de courte durée. Bien que certaines études aient montré que ces doses élevées (2 400 mg/24 heures) de furosémide peuvent diminuer les taux de calcium, elles ont entraîné de graves dérèglements métaboliques des autres électrolytes. Cette approche a nécessité une surveillance fréquente et invasive pour prévenir de tels dérèglements.5 L’application clinique de ces études a conduit à des recommandations publiées qui sont aussi variables que les doses utilisées dans les études initiales il y a plus de 30 ans.
Cela inclut la considération que, à la lumière de la disponibilité et de l’efficacité des bisphosphonates, le furosémide pourrait ne plus être cliniquement utile dans cette entreprise.6 Le rôle actuel du furosémide dans la prise en charge chez les patients hypercalcémiques reste en fonction des besoins pour la gestion des états de surcharge liquidienne provoqués par une réanimation liquidienne IV agressive.
 click for large version
click for large version
Figure 1 : Approche diagnostique de l’hypercalcémie.
Bisphosphonates. Les bisphosphonates sont devenus disponibles pour la gestion de l’hypercalcémie au début des années 1990 et ont considérablement changé l’intervention aiguë et amélioré l’évolution clinique à long terme des patients atteints d’hypercalcémie maligne. Bien qu’ils aient été développés pour la première fois au 19ème siècle avec des applications industrielles, ce n’est que dans les années 1960 que leur rôle dans le métabolisme osseux a été apprécié.
Bien que leur mécanisme d’action complexe reste un sujet d’investigations en cours, on sait que les bisphosphonates sont dirigés vers les os, où ils inhibent une enzyme de la voie de l’HMG-CoA réductase et favorisent la mort cellulaire apoptotique des ostéoclastes7. En bloquant la résorption osseuse médiée par les ostéoclastes, les bisphosphonates sont efficaces pour traiter l’hypercalcémie qui survient dans le cadre de divers processus pathologiques provoquant une résorption osseuse, y compris l’hypercalcémie maligne. En tant que composés relativement non toxiques capables de conférer une diminution profonde et soutenue du calcium sérique, ces agents sont devenus préférés dans la prise en charge de l’hypercalcémie aiguë et chronique d’origine maligne.
Il existe cinq bisphosphonates parentéraux disponibles pour le traitement de l’hypercalcémie maligne : pamidronate, acide zolédronique, ibandronate, étidronate et clodronate. L’étidronate et le clodronate sont des agents de première génération, qui sont moins puissants et ont plus d’effets secondaires que les autres agents et ne sont pas aussi couramment utilisés. L’ibandronate est un agent utile avec une longue demi-vie qui s’est avéré aussi efficace que le pamidronate, bien qu’il n’ait pas fait l’objet d’études aussi approfondies que les autres agents.
Le pamidronate a fait l’objet d’études approfondies dans le cadre de multiples essais d’observation et randomisés, et s’est avéré très efficace et peu toxique dans le traitement de l’hypercalcémie due à de multiples causes, y compris l’hypercalcémie maligne.8,9 L’effet hypocalcémiant maximal se produit à une dose de 90 mg, et la dose est souvent ajustée en fonction du taux de calcium sérique mesuré. L’acide zolédronique est perfusé sur une période de deux à quatre heures, il entraîne une baisse de la calcémie en un ou deux jours et son effet se maintient jusqu’à deux semaines ou plus.
En tant que bisphosphonate le plus puissant et le plus facile à administrer, l’acide zolédronique est considéré par beaucoup comme l’agent de choix dans le traitement de l’hypercalcémie maligne. Il peut être administré par voie intraveineuse à raison de 4 à 8 mg en 15 minutes (contre deux heures pour le pamidronate). Deux essais de phase III portant sur 275 patients ont démontré l’efficacité supérieure de l’acide zolédronique par rapport au pamidronate, 88 % des patients parvenant à normaliser leur calcémie (contre 70 % des patients recevant une dose de 90 mg de pamidronate).10
Même si ces agents sont relativement non toxiques, chacun d’eux peut provoquer une maladie légère et transitoire de type flulique chez les receveurs. Un dysfonctionnement rénal a été noté dans de rares cas. Ces agents doivent être dosés par voie rénale et utilisés avec prudence chez les patients présentant une insuffisance rénale avancée (créatinine sérique >2,5). Une ostéonécrose de la mâchoire a été observée chez moins de 2 % des patients recevant des bisphosphonates par voie IV. Par conséquent, il est recommandé que les patients subissent une évaluation dentaire avant de recevoir l’agent (si possible) et qu’ils évitent les procédures dentaires invasives autour du moment où ils reçoivent l’agent.11
 click for large version
click for large version
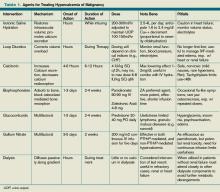
Tableau 1. Agents de traitement de l’hypercalcémie des tumeurs malignes
Autres interventions thérapeutiques. Les bisphosphonates représentent les agents pharmaceutiques les mieux étudiés et les plus efficaces disponibles pour traiter l’hypercalcémie. S’écarter de ces agents ne doit être envisagé que lorsqu’ils sont contre-indiqués, dans des circonstances graves ou après que le patient n’ait pas répondu.
La calcitonine est depuis longtemps approuvée par la FDA pour le traitement de l’hypercalcémie chez les adultes. Il a été démontré dans de petites études non randomisées des années 1970 et 1980 qu’elle diminuait rapidement (dans les deux heures) les taux de calcium chez les patients hypercalcémiques.12,13,14 Cependant, ces réductions sont faibles (<10%) et transitoires (persistant généralement jusqu’à 72 à 96 heures) en raison de la tachyphylaxie observée avec ce médicament. Néanmoins, la calcitonine peut être utilisée comme un pont adjuvant pour abaisser les taux de calcium chez les patients gravement hypercalcémiques pendant les premiers jours avant que les autres agents ne commencent à faire effet.
Les glucocorticoïdes sont utilisés pour traiter l’hypercalcémie depuis les années 1950. La prednisone, la dexaméthasone et la méthylprednisolone ont toutes des indications de la FDA pour l’hypercalcémie, mais les données manquent et sont contradictoires. Un petit essai contrôlé randomisé (ECR) (n=28) réalisé en 1984 n’a pas montré d’efficacité supplémentaire des glucocorticoïdes associés aux solutés IV par rapport aux solutés IV seuls.15 Un autre petit ECR (n=30) réalisé en 1992 sur des femmes atteintes d’un cancer du sein métastatique a montré une amélioration significative chez les patientes traitées par prednisolone, solutés IV et furosémide par rapport aux solutés IV et au furosémide.16 D’autres essais non randomisés ont montré que la réponse était, au mieux, imprévisible.17 Malgré cela, les glucocorticoïdes conservent probablement un rôle limité pour le traitement dans des cas spécifiques, notamment l’hypercalcémie induite par des lymphomes élevant les niveaux de 1,25(OH)2 vitamine D (car celle-ci interagit avec un récepteur régulé par les stéroïdes), ou les myélomes multiples où ils ont un impact potentiel sur la progression de la maladie.
Le nitrate de gallium, sel anhydre d’un métal lourd, s’est avéré dans plusieurs essais randomisés être un agent thérapeutique efficace pour abaisser les taux de calcium chez les patients hypercalcémiques18,19. De plus, un essai en double aveugle portant sur 64 patients atteints d’hypercalcémie d’origine maligne a montré que le nitrate de gallium était au moins aussi efficace que le pamidronate pour le contrôle aigu de l’hypercalcémie liée au cancer.20 Cependant, la nécessité d’une perfusion continue sur une période de cinq jours a limité l’application de cet agent.
L’hémodialyse avec un dialysat pauvre en calcium s’est avérée, dans de petites études non randomisées, une méthode temporairement efficace pour réduire les taux de calcium sérique.21,22 Cependant, cette modalité de traitement devrait être réservée aux patients présentant une hypercalcémie sévère, chez qui une réplétion volumique intravasculaire agressive et les bisphosphonates ne sont pas recommandés (par exemple, ceux présentant une insuffisance cardiaque ou rénale importante) et dont l’étiologie sous-jacente est susceptible de répondre à un autre traitement. En outre, une réflexion sur la pertinence de telles procédures invasives de temporisation chez les patients atteints de cancer métastatique devrait être entreprise.
Retour au cas
Ce patient avait un taux de calcium ionisé de 1,9 mmol/L (normal 1,1-1,4 mmol/L). Il a été mis sous hydratation IV agressive avec du sérum physiologique et de l’acide zolédronique. Ses médicaments à domicile ont été examinés et il a été confirmé qu’il ne prenait pas de médicaments contre-indiqués tels que les thiazidiques ou la supplémentation en calcium/vitamine D.
Un bilan plus approfondi pour l’étiologie de son hypercalcémie a révélé une PTH intacte et supprimée de manière appropriée et des niveaux normaux de 25 (OH) vitamine D et de 1,25 (OH)2 vitamine D. Sa PTH-RP intacte était élevée à 10pmol/L, et compatible avec une hypercalcémie d’origine maligne.
Des consultations en oncologie et en soins palliatifs ont été demandées pour aider à la coordination du traitement du cancer du poumon sous-jacent du patient ; des plans ont été établis pour une chimiothérapie systémique. Ses symptômes se sont lentement améliorés, et 72 heures après l’admission, sa calcémie s’était normalisée. Il est sorti de l’hôpital avec un plan pour initier une chimiothérapie et un suivi continu avec l’oncologie.
Ligne de fond
La gestion aiguë de l’hypercalcémie d’origine maligne se concentre sur l’abaissement du calcium sérique par le biais d’une variété d’agents pharmacologiques. Cependant, des questions à long terme telles que le traitement de la malignité sous-jacente et les discussions sur les objectifs de soins dans cette population de patients à mortalité élevée sont primordiales. TH
Le Dr Hartley et le Dr Repaskey sont instructeurs cliniques en médecine interne à l’University of Michigan Health System. Le Dr Rohde est un professeur adjoint clinique de médecine interne à l’UMHS.
- Assadi F. Hypercalcémie : une approche fondée sur des preuves pour les cas cliniques. Iran J Kidney Dis. 2009;3 :(2):71-79.
- Stewart A. Hypercalcémie associée au cancer. N Engl J Med. 2005;542(4):373-379.
- Seccareccia D. Hypercalcémie liée au cancer. Can Fam Physician. 2010;56 :(3):244-246.
- Bilezikian JP. Prise en charge de l’hypercalcémie aiguë. N Engl J Med. 1992 ; 326(18):1196-1203.
- Suki WN, Yium JJ, VonMinden M, et al. Traitement aigu de l’hypercalcémie avec le furosémide. N Engl J Med. 1970;283:836-840.
- LeGrand SB, Leskuski D, Zama I. Narrative review : furosemide for hypercalcemia : an unproven yet common practice. Ann Intern Med. 2008;149:259-263.
- Drake MT, Bart LC, Khosla S. Bisphosphonates : mécanisme d’action et rôle dans la pratique clinique. Mayo Clinic Proc. 2008;83(9):1032-1045.
- Nussbaum SR, Younger J, Vandepol CJ, et al. Thérapie intraveineuse à dose unique avec pamidronate pour le traitement de l’hypercalcémie de la malignité : comparaison des dosages de 30-, 60-, et 90-mg. Am J Med. 1993 ; 95(3):297-304.
- Gucalp R, Ritch P, Riernik PH, et al. Étude comparative du pamidronate disodique et de l’étidronate disodique dans le traitement de l’hypercalcémie liée au cancer. J Clin Oncol. 1992;10(1):134-142.
- Major P, Lortholary A, Hon J, et al. L’acide zolédronique est supérieur au pamidronate dans le traitement de l’hypercalcémie liée à un cancer : une analyse groupée de deux essais cliniques contrôlés et randomisés. J Clin Oncol. 2001;19(2) : 558-567.
- Tanvetyanon T. Management of the adverse effects associated with intravenous bisphosphonates. Ann Oncol. 2006;17(6):897-907.
- Wisneski LA, Croom WP, Silva OL, et al. La calcitonine de saumon dans l’hypercalcémie. Clin Pharmacol Ther. 1978 ; 24:219-222.
- Binstock ML, Mundy GR. Effet de la calcitonine et des glucocorticoïdes en combinaison sur l’hypercalcémie de la malignité. Ann Intern Med. 1980;93(2):269-272.
- Nilsson O, Almqvist S, Karlberg BE. La calcitonine de saumon dans le traitement aigu de l’hypercalcémie modérée et sévère chez l’homme. Acta Med Scand. 1978;204(4) : 249-252.
- Percival RC, Yates AJ, Gray RE, et al. Role of glucocorticoids in management of malignant hypercalcemia. Br Med J. 1984;289(6440):287.
- Kristensen B, Ejlertsen B, Holmegaard SN, et al. Prednisolone in the treatment of severe malignant hypercalcemia in metastatic breast cancer : a randomized study. J Intern Med. 1992;232(3):237-245.
- Thalassinos NC, Joplin GF. Échec de la corticothérapie pour corriger l’hypercalcémie de la maladie maligne. Lancet. 1970;2(7672):537-538.
- Warrell RP Jr, Murphy WK, Schulman P, et al. Une étude randomisée en double aveugle du nitrate de gallium comparé à l’étidronate pour le contrôle aigu de l’hypercalcémie liée au cancer. J Clin Oncol. 1991;9(8):1467-1475.
- Warrell RP Jr, Israel R, Frisone M, et al. Le nitrate de gallium pour le traitement aigu de l’hypercalcémie liée au cancer : une comparaison randomisée en double aveugle avec la calcitonine. Ann Intern Med. 1988;108:669-674.
- Cvitkovic F, Armand JP, Tubiana-Hulin M, et al. Randomized, double-blind, phase II trial of gallium nitrate compared with pamidronate for acute control of cancer-related hypercalcemia. Cancer J. 2006;12 (1):47-53.
- Cardella CJ, Birkin BL, Rapoport A. Role of dialysis in the treatment of severe hypercalcemia : report of two cases successfully treated with hemodialysis and review of the literature. Clin Nephrol. 1979 ; 12(6):285-290.
- Koo WS, Jeon DS, Ahn SJ, et al. Calcium-free hemodialysis for the management of hypercalcemia. Nephron. 1996;72(3):424-428.