Caso
Un hombre de 63 años con hipertensión, diabetes y cáncer de pulmón de células escamosas recientemente diagnosticado se presenta con dolor abdominal difuso y confusión de dos días de duración. Pesa 105 kg, su presión arterial es de 105/65 mm/Hg, la frecuencia cardíaca es de 105 latidos por minuto y la temperatura es de 99,0 grados Fahrenheit. Sus respiraciones son de 18 respiraciones por minuto, la saturación de oxígeno es del 95% en aire ambiente, y su ortostatismo es positivo. En la exploración física se observa sequedad de las membranas mucosas con disminución de la turgencia de la piel. La evaluación de laboratorio revela un nivel de calcio de 15,5 mg/dL, un nivel de creatinina de 1,2 mg/dL, un nivel de albúmina de 4,3 g/dL y un nivel de fósforo de 2,9 mg/dL.
¿Cuál es el mejor tratamiento para esta enfermedad?
Resumen
La homeostasis del calcio implica complejas interacciones entre el riñón, el tracto gastrointestinal (GI) y el sistema esquelético a través de influencias hormonales. Aunque el 99% del calcio del cuerpo se almacena en los huesos, el 50% del calcio sérico está en la forma ionizada activa, el 40% está unido a la albúmina y el 10% está complejado con aniones.1 Es importante recordar estos porcentajes cuando se evalúa el calcio sérico de un paciente; el calcio sérico elevado puede validarse utilizando una fórmula de corrección (calcio corregido = calcio total medido + ) o mediante la medición directa del calcio ionizado, que es la forma fisiológicamente activa.
La hipercalcemia de origen maligno es la causa más común de hipercalcemia en el paciente hospitalizado. Entre el 20 y el 30% de los pacientes con cáncer desarrollarán hipercalcemia en algún momento del curso de su enfermedad.2 En general, esto augura un mal pronóstico con una supervivencia media de tres a cuatro meses.3
Cuatro mecanismos generales están implicados en la patogénesis de la hipercalcemia maligna; estos mecanismos constituyen la base de las estrategias de tratamiento disponibles:
- Los tumores osteolíticos, como el mieloma múltiple, pueden actuar directamente sobre el hueso, provocando la activación de los osteoclastos y la liberación de calcio;
- Los mediadores humorales elaborados por las células malignas, como el péptido relacionado con la hormona paratiroidea (PTH-RP), pueden efectuar la activación de los osteoclastos y disminuir la eliminación renal del calcio, provocando la hipercalcemia humoral de malignidad;
- Algunas neoplasias (más comúnmente los linfomas) pueden sintetizar directamente 1,25 (OH)2 vitamina D, lo que conduce a un aumento de la absorción luminal tanto de calcio como de fósforo en el tracto gastrointestinal; y
- La producción directa de la hormona paratiroidea (PTH) por parte de las células malignas es poco frecuente, pero se ha notificado.2
Otros factores, como el deterioro de la movilidad, podrían conducir a una mayor resorción ósea y a un empeoramiento del estado hipercalcémico.
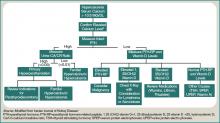
Un paciente con hipercalcemia debe someterse a un estudio sistemático, con conocimiento de otras causas de hipercalcemia que podrían estar presentes, independientemente de la malignidad. Algunos ejemplos son el hiperparatiroidismo primario, el efecto de los medicamentos y las etiologías genéticas. Aunque un análisis más detallado va más allá del alcance de este artículo, en la Figura 1 (a la derecha) se representa un enfoque diagnóstico amplio.
El tratamiento eficaz de la hipercalcemia exige que se considere tanto la situación clínica inmediata del paciente como la de más largo plazo a la luz del pronóstico del mismo. El objetivo principal en el tratamiento agudo de la hipercalcemia es normalizar los valores séricos y disminuir los síntomas. Sin embargo, esto debe hacerse teniendo en cuenta que la alteración metabólica ha sido generada por una neoplasia subyacente. El enfoque principal de la terapéutica clínica debe dirigirse a esto.
 haga clic para la versión grande
haga clic para la versión grande
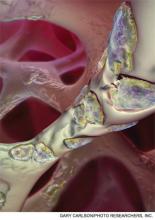
Una imagen generada por ordenador de osteoclastos multinucleados grabando el hueso trabecular en un proceso llamado resorción ósea. Los bifosfonatos inhiben este proceso en la hipercalcemia inducida por una enfermedad.
Revisión de los datos
Líquidos intravenosos (IV). La hidratación IV con solución salina isotónica representa la intervención más inmediata y crítica en el tratamiento agudo de la hipercalcemia maligna. Esta condición tiene múltiples efectos potencialmente nocivos en el riñón, incluyendo la vasoconstricción, la inhibición de la absorción de sal a nivel distal y el antagonismo de la hormona antidiurética (ADH), lo que conduce a la pérdida de sal y agua. La disminución del volumen intravascular potencia entonces el aumento de la reabsorción de sodio a nivel proximal en el riñón.
La solución salina isotónica restablece la depleción de volumen que se produce invariablemente en el contexto de la pérdida de sal urinaria provocada por la hipercalcemia. El restablecimiento del volumen intravascular da lugar a un aumento de la tasa de filtración glomerular y, por tanto, a un aumento de la filtración de calcio. Además, la reabsorción tubular proximal de sodio y calcio disminuye a medida que aumenta la tasa de filtración glomerular. Además, un aumento de la presentación de sodio y agua a los sitios tubulares renales distales provoca una calciuresis adicional.
Se estima que con la hidratación salina, la concentración de calcio debería disminuir, al menos en el grado en que la deshidratación la elevó, normalmente en el rango de 1,6 mg a 2,4 mg por decilitro.4 Sin embargo, la hidratación por sí sola rara vez conduce a la normalización de la concentración sérica de calcio en pacientes con hipercalcemia grave.
La velocidad de infusión se basa en la gravedad de la hipercalcemia, y en la edad y comorbilidades del paciente, con especial atención a la enfermedad cardíaca o renal. Un enfoque estándar para la mayoría de los pacientes sin edema y sin insuficiencia cardíaca o renal es comenzar una infusión de solución salina a una velocidad inicial de entre 200 mL/h y 300 mL/h. El objetivo es mantener la diuresis entre 100 mL/h y 150 mL/h.
Furosemida. Tras la administración de líquidos intravenosos para restablecer un estado euvolémico, históricamente se ha utilizado la furosemida porque tiene un efecto calcinúrico con diuresis forzada. También es útil para controlar y prevenir la sobrecarga de líquidos que se produce con la hidratación salina. Sin embargo, los datos no apoyan su uso rutinario para reducir los niveles de calcio en pacientes hipercalcémicos.
La mayoría de los artículos que estudian el uso de la furosemida se publicaron en los años 70 y 80, e implican una variedad de dosis y esquemas de administración que van desde 40 mg por vía oral diariamente hasta 100 mg por vía intravenosa cada hora, con una mejora variable en los niveles de calcio sérico y efectos que fueron de corta duración. Aunque algunos estudios han demostrado que estas dosis elevadas (2.400 mg/24 horas) de furosemida pueden disminuir los niveles de calcio, se encontraron graves desórdenes metabólicos resultantes en otros electrolitos. La aplicación clínica de estos estudios ha dado lugar a recomendaciones publicadas que son tan variables como las dosis utilizadas en los estudios iniciales hace más de 30 años.
Esto incluye la consideración de que, a la luz de la disponibilidad y eficacia de los bifosfonatos, la furosemida podría dejar de ser clínicamente útil en esta tarea.6 El papel actual de la furosemida en el manejo de los pacientes hipercalcémicos sigue siendo según la necesidad para el manejo de los estados de sobrecarga de fluidos producidos después de la reanimación agresiva de fluidos por vía intravenosa.
 Pulse para ver la versión grande
Pulse para ver la versión grande
Figura 1: Enfoque diagnóstico de la hipercalcemia.
Bisfosfonatos. Los bifosfonatos estuvieron disponibles por primera vez para el tratamiento de la hipercalcemia a principios de la década de 1990 y han cambiado radicalmente la intervención aguda y mejorado la evolución clínica a largo plazo de los pacientes con hipercalcemia maligna. Aunque se desarrollaron por primera vez en el siglo XIX con aplicaciones industriales, no fue hasta la década de 1960 cuando se apreció su papel en el metabolismo óseo.
Aunque su complejo mecanismo de acción sigue siendo objeto de investigaciones en curso, se sabe que los bifosfonatos se dirigen a los huesos, donde inhiben una enzima de la vía de la HMG-CoA reductasa y promueven la muerte celular apoptótica de los osteoclastos.7 Al bloquear la reabsorción ósea mediada por los osteoclastos, los bifosfonatos son eficaces en el tratamiento de la hipercalcemia que se produce con una variedad de procesos de enfermedades de reabsorción ósea, incluida la hipercalcemia maligna. Como compuestos relativamente no tóxicos capaces de conferir una disminución profunda y sostenida del calcio sérico, estos agentes se han convertido en los preferidos para el tratamiento de la hipercalcemia aguda y crónica de origen maligno.
Hay cinco bifosfonatos parenterales disponibles para el tratamiento de la hipercalcemia maligna: pamidronato, ácido zoledrónico, ibandronato, etidronato y clodronato. El etidronato y el clodronato son agentes de primera generación, que son menos potentes y tienen más efectos secundarios que otros agentes y no se utilizan tan comúnmente. El ibandronato es un agente útil con una vida media larga que ha demostrado ser tan eficaz como el pamidronato, aunque no se ha estudiado tan extensamente como los otros agentes.
El pamidronato se ha estudiado a fondo en múltiples ensayos observacionales y aleatorios, y ha demostrado ser altamente eficaz y mínimamente tóxico en el tratamiento de la hipercalcemia debida a múltiples causas, incluida la hipercalcemia maligna.8,9 El efecto máximo de reducción del calcio se produce con una dosis de 90 mg, y la dosis suele ajustarse en función del calcio sérico medido. Se administra en infusión durante dos o cuatro horas, produce una disminución del calcio sérico en uno o dos días y tiene un efecto sostenido que dura hasta dos semanas o más.
Como el bifosfonato más potente y más fácil de administrar, el ácido zoledrónico es considerado por muchos el agente de elección en el tratamiento de la hipercalcemia maligna. Puede administrarse una dosis de 4 mg a 8 mg por vía intravenosa en 15 minutos (frente a las dos horas del pamidronato). Dos ensayos de fase III con 275 pacientes han demostrado que la eficacia del ácido zoledrónico es superior a la del pamidronato, ya que el 88% de los pacientes consiguieron normalizar el calcio sérico (en comparación con el 70% de los pacientes que recibieron una dosis de 90 mg de pamidronato).10
Aunque estos agentes son relativamente no tóxicos, cada uno de ellos puede provocar una enfermedad leve y transitoria parecida a la gripe en los receptores. En raras ocasiones se ha observado una disfunción renal. Estos agentes deben dosificarse renalmente y utilizarse con precaución en pacientes con insuficiencia renal avanzada (creatinina sérica >2,5). Se ha observado osteonecrosis de la mandíbula en menos del 2% de los pacientes que reciben bifosfonatos IV. En consecuencia, se recomienda que los pacientes se sometan a una evaluación dental antes de recibir el agente (si es factible) y que eviten los procedimientos dentales invasivos alrededor del momento en que reciben el agente.11
 pulse para ver la versión grande
pulse para ver la versión grande
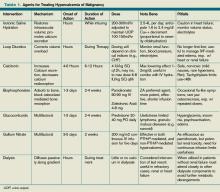
Tabla 1. Agentes para el tratamiento de la hipercalcemia de origen maligno
Otras intervenciones terapéuticas. Los bifosfonatos representan los agentes farmacéuticos mejor estudiados y más eficaces disponibles para tratar la hipercalcemia. Sólo debe considerarse el abandono de estos agentes cuando estén contraindicados, en circunstancias graves o después de que el paciente no haya respondido.
La calcitonina está aprobada desde hace tiempo por la FDA para el tratamiento de la hipercalcemia en adultos. Se ha demostrado en pequeños estudios no aleatorizados de los años 70 y 80 que disminuye rápidamente (en dos horas) los niveles de calcio en pacientes hipercalcémicos.12,13,14 Sin embargo, estas reducciones son pequeñas (<10%) y transitorias (suelen persistir hasta 72 a 96 horas) debido a la taquifilaxia observada con este medicamento. No obstante, la calcitonina puede utilizarse como puente coadyuvante para reducir los niveles de calcio en pacientes con hipercalcemia grave durante los primeros días antes de que otros agentes empiecen a hacer efecto.
Los glucocorticoides se han utilizado para tratar la hipercalcemia desde la década de 1950. La prednisona, la dexametasona y la metilprednisolona tienen indicaciones de la FDA para la hipercalcemia, pero los datos son escasos y contradictorios. Un pequeño (n=28) ensayo controlado aleatorio (ECA) realizado en 1984 no mostró ninguna eficacia adicional de los glucocorticoides con fluidos intravenosos en comparación con los fluidos intravenosos solos.15 Otro pequeño (n=30) ECA realizado en 1992 en mujeres con cáncer de mama metastásico mostró una mejora significativa en los pacientes tratados con prednisolona, fluidos intravenosos y furosemida en comparación con los fluidos intravenosos y furosemida.16 Otros ensayos no aleatorios han mostrado que la respuesta es impredecible en el mejor de los casos.17 A pesar de esto, es probable que los glucocorticoides conserven un papel limitado para el tratamiento en casos específicos, incluyendo la hipercalcemia inducida por linfomas que elevan los niveles de 1,25(OH)2 vitamina D (ya que ésta interactúa con un receptor regulado por esteroides), o los mielomas múltiples en los que potencialmente impactan en la progresión de la enfermedad.
El nitrato de galio, una sal anhidra de un metal pesado, ha demostrado en varios ensayos aleatorios ser un agente terapéutico eficaz para reducir los niveles de calcio en pacientes hipercalcémicos.18,19 Además, un ensayo doblemente ciego de 64 pacientes con hipercalcemia de origen maligno demostró que el nitrato de galio es al menos tan eficaz como el pamidronato para el control agudo de la hipercalcemia relacionada con el cáncer.20 Sin embargo, la necesidad de una infusión continua durante un periodo de cinco días ha limitado la aplicación de este agente.
La hemodiálisis con un dializado carente de calcio ha demostrado en pequeños estudios no aleatorizados ser un método temporalmente eficaz para reducir los niveles de calcio sérico.21,22 Sin embargo, esta modalidad de tratamiento se reservaría mejor para los pacientes con hipercalcemia grave, en los que la repleción de volumen intravascular agresiva y los bifosfonatos no son aconsejables (por ejemplo, aquellos con insuficiencia cardíaca o renal significativa) y tienen una etiología subyacente que probablemente responda a otro tratamiento. Además, debe considerarse la conveniencia de tales procedimientos invasivos de temporización en pacientes con cáncer metastásico.
Volver al caso
Este paciente tenía un nivel de calcio ionizado de 1,9 mmol/L (normal 1,1-1,4 mmol/L). Se inició una hidratación intravenosa agresiva con solución salina normal y ácido zoledrónico. Se revisó su medicación domiciliaria y se confirmó que no estaba tomando medicamentos contraindicados como tiazidas o suplementos de calcio/vitamina D.
Los análisis posteriores para la etiología de su hipercalcemia revelaron una PTH intacta adecuadamente suprimida y niveles normales de 25 (OH) Vitamina D y 1,25 (OH)2 Vitamina D. Su PTH-RP intacta estaba elevada a 10pmol/L, y era consistente con hipercalcemia de origen maligno.
Se solicitaron consultas de oncología y cuidados paliativos para ayudar a coordinar el tratamiento del cáncer de pulmón subyacente del paciente; se planificó la quimioterapia sistémica. Sus síntomas mejoraron lentamente, y 72 horas después del ingreso, su calcio sérico se había normalizado. Fue dado de alta con un plan para iniciar la quimioterapia y un seguimiento continuado con oncología.
Bottom Line
El tratamiento agudo de la hipercalcemia de origen maligno se centra en la disminución del calcio sérico mediante una variedad de agentes farmacológicos. Sin embargo, son primordiales cuestiones a largo plazo como el tratamiento de la neoplasia subyacente y las discusiones sobre los objetivos de la atención en esta población de pacientes de alta mortalidad. TH
Los doctores Hartley y Repaskey son instructores clínicos de medicina interna en el Sistema de Salud de la Universidad de Michigan. El Dr. Rohde es profesor clínico asistente de medicina interna en el UMHS.
- Assadi F. Hypercalcemia: an evidence-based approach to clinical cases. Iran J Kidney Dis. 2009;3:(2):71-79.
- Stewart A. Hypercalcemia associated with cancer. N Engl J Med. 2005;542(4):373-379.
- Seccareccia D. Cancer-related hypercalcemia. Can Fam Physician. 2010;56:(3):244-246.
- Bilezikian JP. Manejo de la hipercalcemia aguda. N Engl J Med. 1992; 326(18):1196-1203.
- Suki WN, Yium JJ, VonMinden M, et al. Tratamiento agudo de la hipercalcemia con furosemida. N Engl J Med. 1970;283:836-840.
- LeGrand SB, Leskuski D, Zama I. Narrative review: furosemide for hypercalcemia: an unproven yet common practice. Ann Intern Med. 2008;149:259-263.
- Drake MT, Bart LC, Khosla S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clinic Proc. 2008;83(9):1032-1045.
- Nussbaum SR, Younger J, Vandepol CJ, et al. Terapia intravenosa de dosis única con pamidronato para el tratamiento de la hipercalcemia de origen maligno: comparación de las dosis de 30, 60 y 90 mg. Am J Med. 1993; 95(3):297-304.
- Gucalp R, Ritch P, Riernik PH, et al. Estudio comparativo de pamidronato disódico y etidronato disódico en el tratamiento de la hipercalcemia relacionada con el cáncer. J Clin Oncol. 1992;10(1):134-142.
- Major P, Lortholary A, Hon J, et al. Zoledronic acid is superior to pamidronate in the treatment of hypercalcemia of malignancy: a pooled analysis of two randomized, controlled clinical trials. J Clin Oncol. 2001;19(2): 558-567.
- Tanvetyanon T. Management of the adverse effects associated with intravenous bisphosphonates. Ann Oncol. 2006;17(6):897-907.
- Wisneski LA, Croom WP, Silva OL, et al. Calcitonina de salmón en la hipercalcemia. Clin Pharmacol Ther. 1978; 24:219-222.
- Binstock ML, Mundy GR. Efecto de la calcitonina y los glucocorticoides en combinación en la hipercalcemia de la malignidad. Ann Intern Med. 1980;93(2):269-272.
- Nilsson O, Almqvist S, Karlberg BE. Calcitonina de salmón en el tratamiento agudo de la hipercalcemia moderada y grave en el hombre. Acta Med Scand. 1978;204(4): 249-252.
- Percival RC, Yates AJ, Gray RE, et al. Role of glucocorticoids in management of malignant hypercalcemia. Br Med J. 1984;289(6440):287.
- Kristensen B, Ejlertsen B, Holmegaard SN, et al. Prednisolone in the treatment of severe malignant hypercalcemia in metastatic breast cancer: a randomized study. J Intern Med. 1992;232(3):237-245.
- Thalassinos NC, Joplin GF. Fracaso del tratamiento con corticosteroides para corregir la hipercalcemia de la enfermedad maligna. Lancet. 1970;2(7672):537-538.
- Warrell RP Jr, Murphy WK, Schulman P, et al. A randomized double-blind study of gallium nitrate compared with etidronate for acute control of cancer-related hypercalcemia. J Clin Oncol. 1991;9(8):1467-1475.
- Warrell RP Jr, Israel R, Frisone M, et al. Gallium nitrate for acute treatment of cancer-related hypercalcemia: a randomized, double-blinded comparison to calcitonin. Ann Intern Med. 1988;108:669-674.
- Cvitkovic F, Armand JP, Tubiana-Hulin M, et al. Randomized, double-blind, phase II trial of gallium nitrate compared with pamidronate for acute control of cancer-related hypercalcemia. Cancer J. 2006;12 (1):47-53.
- Cardella CJ, Birkin BL, Rapoport A. Role of dialysis in the treatment of severe hypercalcemia: report of two cases successfully treated with hemodialysis and review of the literature. Clin Nephrol. 1979; 12(6):285-290.
- Koo WS, Jeon DS, Ahn SJ, et al. Calcium-free hemodialysis for the management of hypercalcemia. Nephron. 1996;72(3):424-428.