Einführung
Rezidivierende Papillomatose der Atemwege (RRP) ist eine chronische Erkrankung, die durch humane Papillomaviren (HPV), in der Regel die Typen 6 und 11, verursacht wird. Die Läsionen der RRP treten am häufigsten im Kehlkopf auf (Abbildung 1), können aber auch im Mund, in der Luftröhre, den Bronchien, dem Lungenparenchym und der Speiseröhre auftreten. Die juvenile Form der RRP, bei der die Symptome vor dem 12. Lebensjahr auftreten, ist aggressiver als die erwachsene Form, und die Symptome sind schwerer. Papillom-Rezidive treten besonders schnell bei Kindern unter 3 Jahren auf, bei denen die Intervalle zwischen den chirurgischen Eingriffen kürzer sind und die daher insgesamt häufiger operiert werden müssen. Die Wahrscheinlichkeit, dass sich die Infektion über den Kehlkopf hinaus ausbreitet, und die Häufigkeit eines Luftröhrenschnitts, um die Luftröhre offen zu halten, sind in dieser Bevölkerungsgruppe ebenfalls größer (1). Bei Patienten mit juveniler RRP werden im Durchschnitt 20 chirurgische Eingriffe vorgenommen, die meisten davon im Kindesalter (2).
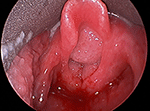
Abbildung 1. Direkte laryngoskopische Aufnahme einer großen, voluminösen Papillomatose der Atemwege, die den Kehlkopfeingang blockiert.
Die traditionelle chirurgische Methode zur chirurgischen Exstirpation verwendete klassischerweise KTP (Kaliumtitanylphosphat) oder Kohlendioxidlaser (3). Angesichts der potenziell schwerwiegenden Nebenwirkungen der Laserablation, einschließlich Verbrennungen der Atemwege und Vernarbung des Kehlkopfs, sind Mikrodebrider zu einem immer beliebteren chirurgischen Hilfsmittel geworden, insbesondere bei pädiatrischen HNO-Ärzten, wenn es um sperrige Erkrankungen geht (3). Mit diesem handgehaltenen Gerät kann das erkrankte Gewebe präziser entfernt werden, wodurch die Schädigung des umliegenden Gewebes verringert wird (3). Angesichts des aggressiven Charakters der juvenilen RRP sind Débridements jedoch nach wie vor häufig und führen im Laufe der Zeit zu einer erheblichen Abnutzung des darunter liegenden Gewebes mit einer hohen Inzidenz von Narbenbildung. Daher wurden verschiedene medizinische Therapien untersucht, um das Ergebnis der Operation zu verbessern, indem die Zeit zwischen den Operationen verlängert oder das Wiederauftreten von RRP-Läsionen minimiert wird.
Interferon α
Interferon α, ein Protein, das von Leukozyten als Reaktion auf verschiedene Stimuli, einschließlich Virusinfektionen, produziert wird, war eine der ersten untersuchten möglichen medizinischen Behandlungen (4). Sein Wert als adjuvante Behandlung ist umstritten. In einer großen Studie mit 85 Kindern und 84 Erwachsenen beendeten 58 % der Kinder die einjährige Behandlung mit dreimal wöchentlichen intramuskulären Interferon-α-Injektionen ohne Anzeichen von RRP (5). Die Häufigkeit des Wiederauftretens von Papillomen ging bei 74 % aller behandelten Kinder zurück (5). In einer randomisierten Kontrollstudie mit 123 Patienten unter 21 Jahren blieb die verlangsamte Wachstumsrate der Papillome in der Versuchsgruppe, die intramuskuläre Interferon-α-Injektionen erhielt, jedoch nicht über die Dauer der einjährigen Behandlung erhalten (6). In einer anderen Studie wurde festgestellt, dass 20 Jahre nach Abschluss der Behandlung mit Interferon α nur 42 % der Patienten ein langfristiges Ansprechen zeigten, und alle, die einen Rückfall erlitten, hatten die juvenile Form der RRP (7). Die meisten Studien, in denen Interferon α untersucht wurde, berichteten auch über schwerwiegende Nebenwirkungen wie neurologische Störungen, Leukopenie und Thrombozytopenie (5). Aus diesen Gründen ist seine Verwendung durch pädiatrische HNO-Ärzte zurückgegangen und wird im Allgemeinen nicht empfohlen (1). Im Jahr 2014 erhielten nur 4 % der Kinder mit RRP Interferon α als adjuvante Therapie (1).
Cidofovir
Dieses antivirale Breitspektrum-Medikament, das virale DNA-Polymerasen hemmt, hat sich als vielversprechende intraläsionale adjuvante Therapie zur Operation von RRP erwiesen. Intralesionale Cidofovir-Injektionen sind unter pädiatrischen HNO-Ärzten die am häufigsten angewandte medizinische Behandlung für RRP (1). Alle zwischen 1998 und 2011 veröffentlichten Arbeiten, die die Wirksamkeit von intraläsionalem Cidofovir untersuchten, berichteten über mindestens einen Fall von Krankheitsremission (8). Da es sich bei den meisten dieser Studien jedoch um unkontrollierte Fallstudien handelt, ist unklar, ob der Nutzen durch Cidofovir verursacht wird oder Teil des natürlichen Krankheitsverlaufs ist. Eine randomisierte Kontrollstudie ergab, dass es nach 12 Monaten Behandlung keine statistisch signifikanten Unterschiede in Bezug auf den Schweregrad der Papillome oder die gesundheitsbezogene Lebensqualität zwischen einer Kontrollgruppe, die mit chirurgischen Eingriffen nach Bedarf und intraläsionalen Kochsalzlösungsinjektionen behandelt wurde, und der experimentellen Gruppe, die mit chirurgischen Eingriffen und intraläsionalem Cidofovir behandelt wurde, gab (9). In beiden Gruppen ging der Schweregrad der Erkrankung im Laufe des Jahres deutlich zurück, was darauf hindeutet, dass sich die Krankheit mit der Zeit von selbst zurückbilden kann (9). Eine andere Übersichtsarbeit, die 27 Studien zur Verabreichung von Cidofovir untersuchte, die alle vor 2011 veröffentlicht wurden, ergab, dass die durchschnittliche Rate der vollständigen Remission mit Cidofovir in pädiatrischen Studien 37 % betrug (10). In einer Übersichtsarbeit wurde festgestellt, dass bei 1,7 bzw. 1 % von 447 RRP-Patienten eine maligne Transformation bzw. Nephrotoxizität auftrat (8). Weitere Nebenwirkungen sind Hautausschlag, Kopfschmerzen und Stimmbandvernarbung (11). Angesichts dieser potenziellen Komplikationen und des Fehlens eines anerkannten Protokolls für die Dosierung oder Häufigkeit der Verabreichung ist dieses Medikament kein zuverlässiges Adjuvans (4).
Cidofovir wurde auch als systemische und nicht als lokale Behandlung für RRP-Fälle verabreicht, die durch eine Lungenerkrankung kompliziert sind. Vier Einzelfallstudien haben gezeigt, dass intravenöses Cidofovir zu einer Remission der Krankheit führte, was nicht dem normalen Verlauf der Krankheit mit Lungenbeteiligung entspricht (11). In all diesen Studien wurden Hyperhydratation und Probenecid, ein Harnsäuresenker, eingesetzt, um das Risiko einer Nephrotoxizität zu verringern (11). Nur bei einem Patienten traten bei einer Kombinationstherapie aus Cidofovir und Interferon Nebenwirkungen wie partielle Alopezie und Leukopenie auf (12). Die Dosis beider Medikamente wurde daraufhin reduziert. Achtzehn Monate nach Beendigung der Behandlung musste die Patientin nur einmal wegen RRP operiert werden, und ihre Lungenerkrankung hatte sich stabilisiert (12).
Eine neue Methode der Cidofovir-Verabreichung ist die Inhalation. Nur wenige Studien haben die Wirksamkeit dieser Methode untersucht, aber sie könnte vielversprechend sein für Patienten, die auf andere Behandlungsformen nicht angesprochen haben, wie ein vier Monate alter Junge, bei dem sich die Symptome trotz zweiwöchentlicher Mikrodebridements und intraläsionaler Cidofovir- und intravenöser Interferon-α-Injektionen verschlimmerten (13). Innerhalb von 6 Wochen mit 40 mg vernebeltem Cidofovir täglich, 12 Tage an und 2 Tage aus, verlängerte sich die Zeit zwischen den Debridements (13). Sechs Monate später zeigte der Patient keine Symptome mehr (13). Zusammenfassend lässt sich sagen, dass Cidofovir in verschiedenen Verabreichungsformen zwar nach wie vor weit verbreitet ist, seine Behandlungsergebnisse jedoch bestenfalls gemischt sind und sein Potenzial für Nebenwirkungen etwas eingeschränkt ist.
Photodynamische Therapie
Bei der photodynamischen Therapie (PDT) wird eine lichtempfindliche Substanz, ein so genannter Photosensibilisator, oral oder durch Injektion in das erkrankte Gewebe eingebracht und mit Laserlicht aktiviert, um eine Nekrose auszulösen. Einer der Hauptvorteile der PDT ist die Fähigkeit, Tumore zu zerstören, ohne das umliegende Gewebe zu beeinträchtigen (4). Fallstudien haben gezeigt, dass das erneute Wachstum von Papillomen kurz nach der PDT, die als adjuvante oder alleinige Therapie verabreicht wurde, deutlich langsamer verläuft und in einigen Fällen nach einigen Wochen keine Erkrankung mehr auftritt (14, 15). Es gibt nur wenige randomisierte Kontrollstudien zur Untersuchung der Wirkung der PDT, aber die jüngste ergab, dass die Krankheit nach 3 bis 5 Jahren wieder auftrat, was wahrscheinlich darauf zurückzuführen ist, dass die PDT ihre Wirkung durch eine kurzfristige Immunreaktion entfaltet (16). Weitere Forschungen sollten durchgeführt werden, um die Wirksamkeit und Sicherheit der PDT zu ermitteln.
Indol-3-Carbinol
Indol-3-Carbinol, das in hohen Konzentrationen in Kreuzblütlern wie Brokkoli und Kohl vorkommt, modifiziert den Östrogenstoffwechsel, um die Zellproliferation und die DNA-Synthese zu verändern. Die jüngste klinische Studie ergab, dass nach zweimal täglicher Einnahme von Indol-3-Carbinol in einer Dosis von 200 mg bei Erwachsenen und einer gewichtsabhängigen Dosis bei Kindern über einen Zeitraum von durchschnittlich 50,2 Monaten bei 70 % der Probanden ein vollständiges oder teilweises Ansprechen eintrat (17). Von den pädiatrischen Patienten sprach einer vollständig, drei teilweise und fünf überhaupt nicht auf die Behandlung an (17). Es ist unklar, warum erwachsene Patienten besser auf Indol-3-Carbinol ansprachen als pädiatrische Patienten. Die weniger aggressive Natur der RRP bei Erwachsenen könnte ein Faktor sein. Angesichts der wenig vielversprechenden Ergebnisse in der pädiatrischen Population wurde die Behandlung der jugendlichen RRP mit Indol-3-Carbinol nicht weiter erforscht.
Celecoxib
Celecoxib ist ein entzündungshemmendes Medikament, das die Cyclooxygenase-2 (COX-2) hemmt, ein Enzym, das zu Entzündungen und Schmerzen führt, und wird häufig zur Behandlung von Arthritis eingesetzt. In-vitro-Studien haben gezeigt, dass Papillomzellen infolge einer verstärkten Signalisierung des epidermalen Wachstumsfaktorrezeptors (EGFR) COX-2 überexprimieren und dass diese Aktivität für ihr Wachstum wichtig ist (18). Eine Kombinationstherapie aus Celecoxib und Erlotinib, einem EGFR-Kinaseinhibitor, trug dazu bei, die fortschreitende RRP bei einem 58-jährigen Mann zu kontrollieren, indem sie das Wachstum der Papillome verlangsamte und eine weitere Operation unnötig machte (19). Eine laufende randomisierte Kontrollstudie, die von Northwell Health gesponsert wird, zielt darauf ab, festzustellen, ob Celecoxib die Rate des Wiederauftretens von Papillomen sowohl bei erwachsenen als auch bei pädiatrischen Patienten verringern kann (4).
Anti-Reflux-Medikamente
Fallstudien haben gezeigt, dass die Behandlung der gastroösophagealen Refluxkrankheit (GERD) mit Anti-Reflux-Medikamenten bei Patienten mit jugendlicher RRP dazu beitragen kann, die Rate des Wiederauftretens von Papillomen zu verlangsamen (20, 21). In einer Studie kam es bei Patienten, die die GERD-Behandlung nicht einhielten, zu einem Rezidiv (20). Eine retrospektive Übersichtsarbeit zeigte außerdem, dass bei pädiatrischen Patienten, die wegen RRP behandelt wurden und bei denen keine Refluxbehandlung durchgeführt wurde, die Wahrscheinlichkeit, dass sich nach der chirurgischen Entfernung der Papillome Kehlkopfstege bildeten, deutlich höher war (22). Obwohl es keine schlüssigen Beweise dafür gibt, dass GERD die RRP verschlimmert, ist eine Behandlung bei Patienten mit klinischer Präsentation von GERD und komplizierten, progressiven Fällen von RRP sinnvoll (23).
Hitzeschockprotein
Unter den 700 Kindern mit RRP, die von 74 pädiatrischen HNO-Ärzten behandelt wurden, die zu ihrer adjuvanten Behandlung befragt wurden, erhielten 11 Patienten HSP-E7, ein rekombinantes Fusionsprotein, das aus dem Hitzeschockprotein 65 (Hsp65) und dem E7-Protein von HPV Typ 16 besteht (1). HSP-E7 wurde als Behandlungsmöglichkeit für mehrere Krankheiten untersucht, die auf HPV zurückzuführen sind, darunter Genitalwarzen und intraepitheliale Neoplasien (24). Es gibt Hinweise darauf, dass es gegen mehr HPV-Stämme als nur HPV 16 wirksam sein könnte (24). In einer offenen Studie mit 27 pädiatrischen RRP-Patienten verlängerte sich das mediane Intervall zwischen den Operationen nach der Behandlung mit HSP-E7 im Vergleich zum Median vor der Behandlung signifikant (24). Es traten nur wenige Komplikationen auf, lediglich leichte bis mittelschwere Reaktionen an der Injektionsstelle. Obwohl es keine laufenden klinischen Studien zur Untersuchung der Wirksamkeit von Hsp-E7 gibt, ist es eine vielversprechende Behandlung.
HPV-Impfstoff
Ein paar Fallberichte und Studien haben die Verwendung des HPV-Impfstoffs als adjuvante Therapie dokumentiert. Derzeit gibt es drei zugelassene HPV-Impfstoffe: das bivalente Cervarix, das tetravalente Gardasil und das nicht-avalente Gardasil 9. Der tetravalente Impfstoff wirkt gegen HPV-6, HPV-11, HPV-16 und HPV-18. Eine kürzlich durchgeführte systematische Überprüfung und Meta-Analyse ergab, dass sich die durchschnittliche Dauer zwischen den Operationen bei 63 jugendlichen und erwachsenen RRP-Patienten nach der HPV-Impfung signifikant verlängerte, und zwar von durchschnittlich 7 auf 34 Monate (25). Die Studie fand keine signifikanten Unterschiede nach dem Alter des Auftretens der RRP (25). Andere Fallstudien, die nicht in die Meta-Analyse einbezogen wurden, haben ebenfalls die Wirksamkeit von Gardasil bei pädiatrischen Patienten gezeigt, da es die Zeit zwischen den Operationen signifikant verlängert oder in einigen Fällen zu einer vollständigen Remission führt (26, 27).
Die intramuskuläre HPV-Impfung könnte wirksamer sein als zuvor identifizierte, häufigere Behandlungen wie intraläsionales Cidofovir. Eine retrospektive Fallstudie, bei der jugendliche und erwachsene RRP-Patienten 22 Jahre lang beobachtet wurden, ergab, dass nur zwei der 13 Patienten, die mit einer Operation und Gardasil behandelt wurden, einen Rückfall erlitten, während bei allen Kontrollpatienten, die mit einer Operation und Cidofovir behandelt wurden, die Papillome wieder anwuchsen (28). Auch die durchschnittliche Zeitspanne bis zum Wiederauftreten der Krankheit war bei den behandelten Patientinnen deutlich länger als bei den Kontrollpersonen (28).
Einer der vielversprechendsten Aspekte der HPV-Therapie als adjuvante Therapie ist, dass sie keine schweren Nebenwirkungen hat. Außerdem könnte mit steigenden Impfraten die Inzidenz der juvenilen RRP insgesamt zurückgehen, da diese Form der Krankheit häufig erworben wird, wenn ein Baby während der Geburt mit Genitalwarzen in Berührung kommt, die durch das HPV 6- oder 11-Virus verursacht werden (4).
Mumps-Impfstoff
Es gibt nur sehr wenige Studien über die Wirksamkeit des Mumps-Impfstoffs als adjuvante Therapie, obwohl die derzeitige Forschung vielversprechend ist. In einer Fallstudie wurde festgestellt, dass bei neun von elf pädiatrischen Patienten, die mit intraläsionalen Injektionen des Impfstoffs in 3- bis 12-wöchigen Abständen zusammen mit einer Laseroperation behandelt wurden, eine Remission erzielt werden konnte (29). Eine retrospektive Studie, in der Cidofovir und der Impfstoff gegen Masern, Mumps und Röteln (MMR) als adjuvante Therapien in einer pädiatrischen Population verglichen wurden, ergab, dass es keine signifikanten Unterschiede zwischen den Kindern gab, die mit intraläsionalen Cidofovir- und MMR-Injektionen nach Debridements behandelt wurden (30).
Bevacizumab
Bevacizumab ist ein humaner monoklonaler Antikörper, der an den vaskulären endothelialen Wachstumsfaktor (VEGF) bindet und dessen Interaktion mit Rezeptoren verhindert. Die VEGF-Aktivität spielt bei der Entwicklung von RRP eine Rolle, da in vitro-Studien eine starke Expression von VEGF-A im Papillom-Epithel und die Expression von VEGFR-1- und VEGFR-2-Messenger-RNAs in den darunter liegenden vaskulären Endothelzellen gezeigt haben (31).
Die ersten Studien, die sich mit Bevacizumab als Behandlung für RRP befassten, untersuchten den Nutzen intraläsionaler Injektionen als Begleittherapie zur Operation. Eine Studie an drei Patienten im Alter von 3 bis 6 Jahren mit schwerer RRP (d. h. mit mindestens vier Eingriffen pro Jahr) ergab, dass bei allen Patienten der Zeitraum zwischen chirurgischem Debridement und gepulsten KTP-Laserbehandlungen verlängert wurde und die RRP einige Wochen nach Beendigung der Bevacizumab-Behandlung weniger schwerwiegend war als zuvor (32). Sie zeigten auch eine verbesserte stimmbezogene Lebensqualität (32).
Abgesehen von Fallberichten wurden auch Fallkontrollstudien durchgeführt, um die Wirksamkeit von Bevacizumab als adjuvante Therapie zu untersuchen. Nach einer 532-nm-KTP-Laserbehandlung, gefolgt von subläsionalen Bevacizumab-Injektionen in die stärker erkrankte Stimmlippe und Kochsalzlösungsinjektionen in die andere Falte, hatten 16 der 20 erwachsenen Patienten mit bilateraler Stimmlippen-RRP weniger Papillome in der behandelten Falte, wie durch endoskopische Bildgebung festgestellt wurde (33). Drei der 20 Patienten hatten keine Erkrankung in beiden Falten, und bei keinem der Patienten traten Komplikationen durch die Behandlung auf (33).
Aufgrund dieser vielversprechenden Ergebnisse wurde eine größere Studie über die Wirksamkeit von Bevacizumab in einer pädiatrischen Population durchgeführt. Bei 10 Kindern zwischen 18 Monaten und 18 Jahren mit progressiver, nicht ansprechender RRP führten drei intraläsionale Bevacizumab-Injektionen von 2,5 mg/ml im Abstand von 2-3 Wochen zusammen mit einer Lasertherapie zu einer Verlängerung der mittleren Zeitspanne zwischen den chirurgischen Eingriffen, einer Verringerung der mittleren Anzahl von Eingriffen pro Jahr und einer Verbesserung der stimmbezogenen Lebensqualität (3). Eine der Einschränkungen der Studie besteht darin, dass es sich bei der Dosierung um eine Schätzung auf der Grundlage von Dosierungen in der pädiatrischen Ophthalmologie handelt. Die in die Paillome injizierte Menge war auch nicht bei allen Patienten gleich, da sie je nach Schwere der Erkrankung variierte.
In einigen Studien wurde versucht, die optimale Dosierung zu bestimmen. Eine andere Studie, in der neun pädiatrische Patienten mit juveniler RRP untersucht wurden, ergab ebenfalls, dass nach einer Serie von fünf subepithelialen Injektionen, die im Abstand von 4-6 Wochen verabreicht wurden, mit einer mittleren Dosis von 14,25 mg, zusammen mit einer KTP-Laserablation, bei allen neun Patienten (mit einem Durchschnittsalter von 8 Jahren) die Zeitabstände zwischen den Injektionen verlängert wurden (34). Diese Ergebnisse deuten darauf hin, dass eine hochdosierte Bevacizumab-Behandlung keine Komplikationen verursacht und hochwirksam sein kann.
Nachdem die Wirksamkeit von intraläsionalem Bevacizumab nachgewiesen wurde, wandte sich die Forschung dem systemischen Bevacizumab zu, das eine besonders vielversprechende Behandlung für Patienten mit komplexen Diagnosen darstellt. Der erste Bericht über die intravenöse Verabreichung von Bevacizumab zeigte, dass alle behandelten Patienten mit progredienter RRP bei einem Median von sechs Behandlungen in Dosen von 5, 10 und 15 mg/kg eine Rückbildung der Papillome zeigten (35). Bei den Patienten handelte es sich um vier Fälle von RRP bei Erwachsenen und einen Fall von RRP bei Jugendlichen. Die fünf Patienten unterzogen sich im Jahr vor der Behandlung mit Bevacizumab insgesamt 18 chirurgischen Eingriffen, aber nur der erwachsene Patient musste nach der Behandlung wegen einer malignen Transformation im folgenden Jahr operiert werden (35).
Andere Einzelfallberichte haben die Wirksamkeit von systemischem Bevacizumab bestätigt, ohne dass Komplikationen festgestellt wurden, obwohl die meisten von ihnen erwachsene Patienten betrafen. Bei einem 42-jährigen Mann mit schwerer trachealer RRP führte eine niedrige Dosis von 5 mg/kg, die im Laufe der Zeit auf 10 mg/kg Bevacizumab erhöht wurde, drei Monate nach Beendigung der Behandlung zu einer Rückbildung der Krankheit (36). Eine 12-monatige Nachuntersuchung ergab, dass der Patient weiterhin krankheitsfrei war. Bei einem 87-jährigen Patienten, der auf intraläsionales Cidofovir, einen endobronchialen Stent oder eine HPV-Impfung nicht angesprochen hatte, konnte durch eine sechsmalige systemische Bevacizumab-Behandlung mit 5 mg/kg alle zwei Wochen ebenfalls eine deutliche Abnahme der Lappenmasse und ein offener Bronchus erreicht werden (37). Nach zwei Kursen von 10 mg/kg intravenöser Injektionen alle zwei Wochen zeigte ein 63-Jähriger mit schwerer RRP eine geringere Lungenbeteiligung und keine Anzeichen einer Trachealobstruktion (37).
Der einzige veröffentlichte Fallbericht bei Kindern ist der eines 12-jährigen Mädchens mit progredienter laryngotrachealer Papillomatose und Lungenbeteiligung, das nach 3 Monaten systemischer Bevacizumab-Behandlung ein teilweises Ansprechen im Kehlkopf und ein fast vollständiges Ansprechen in der Trachea zeigte (38). Nach 5 Monaten wies der Patient keine Lungenbeteiligung mehr auf. Diese Ergebnisse sind umso beeindruckender, wenn man bedenkt, dass der Patient über einen Zeitraum von 10 Jahren mit Gardasil, Interferon, Celecoxib, Antirefluxmitteln, Zithromycin und Propranolol behandelt wurde und auf nichts davon ansprach (38).
Das Potenzial von systemischem Bevacizumab zur Behandlung der aggressivsten Formen von RRP lässt sich am besten anhand der Ergebnisse einer elektronischen Umfrage der RRP Task Force der American Society of Pediatric Otolaryngology, der American Broncho-Esophagological Association und von Ärzten, die RRP mit systemischem Bevacizumab behandelt haben, zusammenfassen (39). Die elf ausgefüllten Fragebögen aus neun medizinischen Zentren zeigten, dass die meisten der mit Bevacizumab behandelten Patienten eine lange Vorgeschichte mit juveniler RRP aufwiesen und auf Cidofovir, Interferon und Celecoxib nicht nachhaltig angesprochen hatten. Die Ärzte verabreichten eine Behandlung im Bereich von 5-10 mg/kg pro Dosis. Sieben der acht behandelten Patienten zeigten ein teilweises Ansprechen und einer ein vollständiges Ansprechen auf die Behandlung (39). Bei allen Patienten verlängerten sich die Abstände zwischen den Operationen, die jetzt in der Größenordnung von Monaten liegen. Bei drei der vier Patienten mit Lungenbeteiligung kam es zu einer Besserung oder zum Verschwinden des Lungenpapilloms und bei einem zu einer Stabilisierung der Krankheit. Nur bei zwei Patienten traten geringfügige Komplikationen, Hämoptysen und Proteinurie, auf.
Um die kausale Wirkung von Bevacizumab zu ermitteln, geeignete Dosierungen zu bestimmen und mögliche Komplikationen zu erkennen, müssen randomisierte Kontrollstudien und größere Fallkontrollstudien durchgeführt werden. Darüber hinaus müssen Protokolle zur Festlegung der Behandlungsdauer bei gleichzeitiger Kontrolle möglicher Rebound-Effekte ausgearbeitet werden.
Schlussfolgerungen
Obwohl eine optimale, universell wirksame medikamentöse adjuvante Therapie für RRP noch nicht gefunden wurde, lassen vielversprechende Ergebnisse der RRP-Impfung als therapeutischer Ansatz zusammen mit dem Einsatz von systemischem Bevacizumab auf bessere Ergebnisse für diese Kinder in den kommenden Jahren hoffen. Optimale Behandlungsprotokolle sollten in naher Zukunft entwickelt werden.
Beiträge der Autoren
Alle aufgeführten Autoren haben einen substanziellen, direkten und intellektuellen Beitrag zu dieser Arbeit geleistet und sie zur Veröffentlichung freigegeben.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Der bearbeitende Redakteur erklärte eine frühere Co-Autorenschaft mit einem der Autoren DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. American Society of Pediatric Otolaryngology members‘ experience with recurrent respiratory papillomatosis and the use of adjuvant therapy. Arch Otolaryngol Head Neck Surg. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Ätiopathogenese der rezidivierenden laryngealen Papillomatose und moderne Behandlungsstrategien. Acta Med Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Einsatz von adjuvantem intraläsionalem Bevacizumab bei aggressiver respiratorischer Papillomatose bei Kindern. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Dall’Olio D. Recurrent respiratory papillomatosis: current and future perspectives. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferon alpha-2b als adjuvante Behandlung der rezidivierenden respiratorischen Papillomatose in Kuba: nationales Programm (Bericht 1994-1999). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Price KN. Behandlung der rezidivierenden respiratorischen Papillomatose mit humanem Leukozyteninterferon. New Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Use of interferon-alpha in recurrent respiratory papillomatosis: 20-year follow-up. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza H, Wierzbicka M. Outcomes of bevacizumab and cidofovir treatment in HPV-associated recurrent respiratory papillomatosis-review of the literature. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Die Wirksamkeit von Cidofovir bei rezidivierender respiratorischer Papillomatose: eine randomisierte, doppelblinde, placebokontrollierte Studie. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Intralesionales Cidofovir bei rezidivierender respiratorischer Papillomatose: Systematische Überprüfung von Wirksamkeit und Sicherheit. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Nebenwirkungen von Cidofovir bei der Behandlung der rezidivierenden respiratorischen Papillomatose. Eur Arch Otorhinolaryngol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Erfolgreiche Behandlung der mit juveniler Kehlkopfpapillomatose verbundenen multizystischen Lungenerkrankung mit Cidofovir: Fallbericht und Literaturübersicht. Chest. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Inhaliertes Cidofovir als adjuvante Therapie bei rezidivierender respiratorischer Papillomatose. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Klinische Auswirkungen der photodynamischen Therapie auf rezidivierende Larynxpapillome. Arch Otolaryngol Head Neck Surg. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Behandlung der Larynxpapillomatose mit photodynamischer Lasertherapie. Laryngorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Photodynamische Therapie bei rezidivierender respiratorischer Papillomatose. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indol-3-Carbinol bei rezidivierender respiratorischer Papillomatose: Langzeitergebnisse. J Voice. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. Epidermal growth factor-induced cyclooxygenase-2 expression is mediated through phosphatidylinositol-3 kinase, not mitogen-activated protein/extracellular signal-regulated kinase kinase, in recurrent respiratory papillomas. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Rückbildung der rezidivierenden respiratorischen Papillomatose mit einer Kombinationstherapie aus Celecoxib und Erlotinib. Chest. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Extraösophagealer saurer Reflux und rezidivierendes respiratorisches Papillom bei Kindern. Int. J. Pediatr. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Rezidivierende respiratorische Papillomatose assoziiert mit gastroösophagealer Refluxkrankheit bei Kindern. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s004050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Laryngopharyngealer Reflux und Kehlkopfstegbildung bei Patienten mit pädiatrischen rezidivierenden respiratorischen Papillomen. Laryngoscope. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. Der Zusammenhang zwischen gastroösophagealer Refluxkrankheit und rezidivierender respiratorischer Papillomatose: eine systematische Überprüfung. Laryngoscope. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. HspE7 treatment of pediatric recurrent respiratory papillomatosis: final results of an open-label trial. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Therapeutic use of the human papillomavirus vaccine on recurrent respiratory papillomatosis: a systematic review and meta-analysis. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Recurrent laryngeal papillomatosis: successful treatment with human papillomavirus vaccination. Arch Dis Child. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Juvenile laryngeale Papillomatose – Immunisierung mit dem polyvalenten Impfstoff Gardasil. Laryngorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. HPV-Impfung als präventiver Ansatz für rezidivierende respiratorische Papillomatose – eine 22-jährige retrospektive klinische Analyse. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. Kann der Mumps-Impfstoff eine Remission bei rezidivierendem Papillom der Atemwege bewirken? Arch Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/archotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Vergleich von Cidofovir und dem Masern-, Mumps- und Rötelnimpfstoff bei der Behandlung von rezidivierenden Papillomatosen der Atemwege. Ear Nose Throat J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Role of vascular endothelial growth factor-a in recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Einsatz des gepulsten 532-Nm-Kaliumtitanylphosphat-Lasers und adjuvantes intraläsionales Bevacizumab bei aggressiver respiratorischer Papillomatose bei Kindern: erste Erfahrungen. Arch Otolaryngol Head Neck Surg. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, Lopez-Guerra G, Burns JA, Friedman AD, et al. Lokale Injektion von Bevacizumab (Avastin) und angiolytische KTP-Laser-Behandlung der rezidivierenden Papillomatose der Stimmlippen: eine prospektive Studie. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. High-dose sublesional bevacizumab (Avastin) for pediatric recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Rapid response to systemic bevacizumab therapy in recurrent respiratory papillomatosis. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernandez-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Recurrent respiratory papillomatosis and bevacizumab treatment. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Systemic bevacizumab for recurrent respiratory papillomatosis: a single center experience of two cases. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Bevacizumab-Chemotherapie zur Behandlung einer pulmonalen und laryngotrachealen Papillomatose bei einem Kind. Laryngoscope. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Best SR, Mohr M, Zur KB. Systemisches Bevacizumab bei rezidivierender respiratorischer Papillomatose: eine nationale Studie. Laryngoscope. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar