Introdução
Padilomatose respiratória recorrente (RRP) é uma doença crônica causada pelo papilomavírus humano (HPV), geralmente tipos 6 e 11. As lesões da PRR aparecem mais freqüentemente na laringe (Figura 1), mas também podem surgir na boca, traquéia, brônquios, parênquima pulmonar e esôfago. A forma juvenil da PRRR, na qual os sintomas se apresentam antes dos 12 anos, é mais agressiva que a forma adulta, e os sintomas são mais graves. A recorrência do papiloma é especialmente rápida em crianças menores de 3 anos, que experimentam intervalos mais curtos entre as intervenções cirúrgicas e, portanto, mais cirurgias em geral. A probabilidade da infecção se espalhar além da laringe e a incidência de traqueostomia, para ajudar a manter a traquéia aberta, também é maior nesta população (1). Os pacientes com RRP de início juvenil são submetidos em média a 20 intervenções cirúrgicas, a maioria das quais na infância (2).
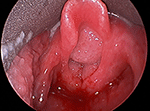
Figura 1. Imagem laringoscópica direta da papilomatose volumosa das vias aéreas obstruindo a entrada laríngea.
O método cirúrgico tradicional de extirpação cirúrgica envolveu classicamente KTP (potássio titanil fosfato) ou lasers de dióxido de carbono (3). Dados os efeitos secundários potencialmente graves da ablação a laser, incluindo queimaduras das vias respiratórias e cicatrizes laríngeas, os microdebridadores têm se tornado uma ferramenta cirúrgica cada vez mais popular, particularmente entre otorrinolaringologistas pediátricos, para doenças volumosas (3). Este dispositivo portátil pode remover o tecido doente com maior precisão, reduzindo os danos aos tecidos circundantes (3). Entretanto, dada a natureza agressiva do PRR juvenil, os desbridamentos ainda são freqüentes e, com o tempo, ainda desgastam significativamente o tecido subjacente, com alta incidência de formação de cicatrizes. Como tal, várias terapias médicas têm sido investigadas para melhorar o resultado da cirurgia, aumentando o tempo entre operações, ou minimizando a recorrência de lesões da PRR.
Interferon α
Interferon α, uma proteína produzida por leucócitos em reação a diversos estímulos, incluindo infecção viral, foi um dos primeiros tratamentos médicos potenciais estudados (4). O seu valor como tratamento adjuvante é controverso. Em um grande estudo com 85 crianças e 84 adultos, 58% das crianças terminaram o período de um ano de tratamento com interferão intramuscular α injeções três vezes por semana sem evidência de RRP (5). A frequência de recorrência do papiloma diminuiu em 74% de todas as crianças tratadas (5). Em um estudo de controle randomizado de 123 pacientes com menos de 21 anos, entretanto, a taxa de crescimento lento dos papilomas no grupo experimental que recebeu interferon α injeções intramusculares não foi sustentada ao longo do tratamento de um ano (6). Da mesma forma, outro estudo constatou que, 20 anos após a conclusão do tratamento com interferon α, apenas 42% dos pacientes indicaram uma resposta a longo prazo, e todos aqueles que recaíram tiveram a forma juvenil de início da PRR (7). A maioria dos estudos investigando o interferon α também relatou efeitos colaterais graves, como distúrbios neurológicos, leucopenia e trombocitopenia (5). Por estas razões, seu uso por otorrinolaringologistas pediátricos tem diminuído e geralmente não é recomendado (1). Em 2014, apenas 4% das crianças com PRR receberam interferon α como terapia adjuvante (1).
Cidofovir
Esta droga de amplo espectro, antiviral que inibe as polimerases do DNA viral tem se mostrado promissora como terapia adjuvante intralesional à cirurgia para PRR. Injeções de cidofovir intra-esional são o tratamento médico mais comumente administrado para a PRR entre otorrinolaringologistas pediátricos (1). Todos os artigos publicados entre 1998 e 2011 que investigaram a eficácia do cidofovir intralesional relataram pelo menos um caso de remissão da doença (8). Entretanto, como a maioria desses estudos são estudos de casos não controlados, não está claro se os benefícios são causados pelo cidofovir, ou se fazem parte do curso natural da doença. Um estudo de controle randomizado descobriu que não houve diferenças estatisticamente significativas na gravidade do papiloma ou na qualidade de vida relacionada à saúde entre um grupo controle, tratado com intervenções cirúrgicas quando necessário e injeções intralesionais de soro fisiológico, e o grupo experimental, tratado com cirurgia e Cidofovir intralesional, após 12 meses de tratamento (9). Ambos os grupos experimentaram uma diminuição significativa da gravidade da doença ao longo do ano, indicando que a doença pode regredir ao longo do tempo por si só (9). Outra revisão que analisou 27 estudos de administração do Cidofovir, todos publicados antes de 2011, constatou que a taxa média de remissão completa com cidofovir foi de 37% em estudos pediátricos (10). Também houve alguns efeitos colaterais graves associados ao cidofovir, pois uma revisão constatou que 1,7 e 1% dos 447 pacientes com PRR tiveram transformação maligna e nefrotoxicidade, respectivamente (8). Outros efeitos colaterais incluem erupção cutânea, dor de cabeça e cicatrização da corda vocal (11). Dadas essas potenciais complicações e a falta de um protocolo aceito para dosagem ou freqüência de administração, esse fármaco não é um adjuvante confiável (4).
Cidofovir também tem sido administrado como tratamento sistêmico e não local para casos de PRR que são complicados por doença pulmonar. Quatro estudos de um único caso mostraram que o cidofovir intravenoso levou à remissão da doença, que não é a progressão normal da doença com envolvimento pulmonar (11). Todos estes estudos empregaram hiperidratação e probenética, um redutor de ácido úrico, para reduzir as chances de nefrotoxicidade (11). Apenas um paciente apresentou efeitos colaterais, alopécia parcial e leucopenia, a partir de uma terapia combinada de cidofovir e interferon (12). As doses de ambos os fármacos foram reduzidas em resposta. Dezoito meses após o término do tratamento, a paciente só precisou de cirurgia para PRR uma vez, e sua doença pulmonar estabilizou (12).
Um novo método de administração de cidofovir é a inalação. Poucos estudos têm investigado a eficácia deste método, mas ele pode ser promissor para pacientes que não responderam a outras formas de tratamento, como um menino de 4 meses que, apesar dos microdebridamentos quinzenais e do Cidofovir intralesional e interferon intravenoso α injeções, apresentou piora dos sintomas (13). Dentro de 6 semanas de 40 mg de Cidofovir nebulizado diariamente, 12 dias de uso e 2 dias de folga, o tempo entre os desbridamentos aumentou (13). Seis meses depois, o paciente não apresentou nenhum sintoma (13). Resumindo, embora o Cidofovir em várias formas de administração continue sendo amplamente utilizado, seus resultados de tratamento, na melhor das hipóteses, são mistos, e seu potencial para efeitos colaterais é um pouco limitado.
Terapia Fotodinâmica
Terapia Fotodinâmica (TDP) envolve a introdução de uma substância sensível à luz, chamada fotossensibilizante, por via oral ou por injeção, no tecido doente e a ativação da substância com luz laser para induzir necrose. Um dos maiores benefícios da TDP é a capacidade de destruir tumores sem afectar o tecido circundante (4). Estudos de casos mostraram taxas significativamente mais lentas de crescimento do papiloma logo após a TDP, administrada como terapia adjuvante ou autônoma, e em alguns casos, a ausência de doença após várias semanas (14, 15). Houve apenas alguns estudos de controle aleatórios para investigar o impacto da TDP, mas o mais recente descobriu que a doença se repetiu após 3-5 anos, provavelmente porque gera seu impacto através de uma resposta imune de curto prazo (16). Mais pesquisas devem ser realizadas para verificar sua eficácia e segurança.
Indole-3-Carbinol
Found em altas concentrações em vegetais cruciferos como brócolis e repolho, o indole-3-carbinol modifica o metabolismo do estrogênio para alterar a proliferação celular e a síntese de DNA. O ensaio clínico mais recente descobriu que, após tomar o indole-3-carbinol duas vezes ao dia, com uma dose de 200 mg para adultos e doses determinadas para crianças, durante uma média de 50,2 meses, 70% dos sujeitos tiveram uma resposta completa ou parcial (17). Dos pacientes pediátricos, um teve uma resposta completa, três uma resposta parcial e cinco não tiveram resposta alguma (17). Não está claro por que os pacientes adultos responderam melhor ao indole-3-carbinol do que os pacientes pediátricos. A natureza menos agressiva do RRP adulto pode ser um fator. Dados os resultados pouco promissores na população pediátrica, não tem havido muito mais pesquisas sobre o tratamento da PRRR com indole-3-carbinol.
Celecoxib
Celecoxib é um medicamento anti-inflamatório que inibe a ciclooxigenase-2 (COX-2), uma enzima que leva à inflamação e dor, e é comumente usada para tratar a artrite. Estudos in-vitro mostraram que as células papilomatosas exageram na COX-2 como resultado de uma melhor sinalização do receptor do fator de crescimento epidérmico (EGFR), e que esta atividade é importante para o seu crescimento (18). Uma terapia combinada de celecoxib e erlotinibe, um inibidor da quinase EGFR, ajudou a controlar o RRP progressivo em um homem de 58 anos de idade, retardando o crescimento do papiloma, tornando desnecessária uma cirurgia adicional (19). Um estudo de controle randomizado em andamento patrocinado pela Northwell Health visa determinar se o celecoxib pode diminuir a taxa de recorrência de papilomas em pacientes adultos e pediátricos (4).
Medicação Anti-Refluxo
Estudos de caso mostraram que o tratamento da doença do refluxo gastroesofágico (DRGE) com medicação anti-refluxo em pacientes com DRGE juvenil pode ajudar a diminuir a taxa de crescimento do papiloma (20, 21). Em um estudo, pacientes que não cumpriram com o tratamento de DRGE apresentaram recidiva (20). Uma revisão retrospectiva do quadro também mostrou que pacientes pediátricos tratados para PRRR que não foram tratados para refluxo tinham uma probabilidade significativamente maior de desenvolver teias laríngeas após a remoção cirúrgica dos papilomas (22). Embora haja evidências inconclusivas de que a DRGE agrava a PRRD, seu manejo faz sentido para pacientes com apresentação clínica de DRGE e casos complicados e progressivos de PRRD (23).
Proteína de Choque de Calor
Entre as 700 crianças com DRGE administradas por 74 otorrinolaringologistas pediátricos, que foram pesquisados sobre o uso de tratamento adjuvante, 11 pacientes receberam HSP-E7, uma proteína de fusão recombinante composta pela proteína de choque térmico 65 (Hsp65) e a proteína E7 do HPV tipo 16 (1). A HSP-E7 tem sido investigada como tratamento em várias doenças que derivam do HPV, incluindo verrugas genitais e neoplasia intra-epitelial (24). As evidências sugerem que ela pode ser reativa contra mais linhagens de HPV do que apenas HPV 16 (24). Em um estudo open-label de 27 pacientes pediátricos com PRRP, o intervalo mediano entre as cirurgias após o tratamento da HSP-E7 foi significativamente prolongado em comparação com a mediana do pré-tratamento (24). Houve poucas complicações, apenas reações leves a moderadas no local da injeção. Embora não haja estudos clínicos em andamento para investigar a eficácia da HSP-E7, é um tratamento promissor.
Vacina contra o HPV
Poucos relatos de casos e estudos documentaram o uso da vacina contra o HPV como terapia adjuvante. Existem atualmente três vacinas aprovadas para o HPV: a bivalente Cervarix, a tetravalente Gardasil, e a nãoavalente Gardasil 9. A vacina tetravalente actua contra o HPV-6, HPV-11, HPV-16, HPV-18. Uma recente revisão sistemática e meta-análise revelou que a duração média entre cirurgias em 63 pacientes jovens e adultos com RRP aumentou significativamente após a vacinação contra o HPV, de 7 para 34 meses em média (25). O estudo não encontrou diferenças significativas por idade de início da PRR (25). Outros estudos de casos não incluídos na meta-análise também demonstraram a eficácia do Gardasil em pacientes pediátricos, pois aumenta significativamente o tempo entre as cirurgias ou, em alguns casos, causa remissão completa (26, 27).
A vacinação intramuscular contra o HPV pode ser mais eficaz do que previamente identificada, tratamentos mais comuns como o cidofovir intralesional. Um estudo de caso retrospectivo que acompanhou pacientes jovens e adultos com RRP por 22 anos constatou que apenas dois dos 13 pacientes tratados com cirurgia e Gardasil recaíram, enquanto todos os pacientes controle, tratados com cirurgia e Cidofovir, experimentaram recrescimento do papiloma (28). O tempo médio de recorrência da doença também foi significativamente maior nos pacientes tratados do que nos controles (28).
Um dos aspectos mais promissores do HPV como terapia adjuvante é que ele não tem nenhum efeito colateral grave. Além disso, com o aumento das taxas de vacinação, a incidência de RRP juvenil pode diminuir em geral, já que esta forma da doença é comumente adquirida quando um bebê é exposto a verrugas genitais causadas pelo vírus HPV 6 ou 11 durante o parto (4).
Vacina contra a papeira
Existiram muito poucos estudos sobre a eficácia da vacina contra a papeira como terapia adjuvante, embora as pesquisas atuais sejam promissoras. Um estudo de caso descobriu que a remissão foi induzida em nove dos 11 pacientes pediátricos tratados com injeções intralesionais da vacina em intervalos de 3 a 12 semanas, juntamente com a cirurgia a laser (29). Um estudo retrospectivo comparando Cidofovir e a vacina contra sarampo, papeira e rubéola (MMR) como terapias adjuvantes em uma população pediátrica constatou que não houve diferenças significativas entre as crianças tratadas com injeções de cidofovir intralesional e MMR após desbridamentos (30).
Bevacizumab
Bevacizumab é um anticorpo monoclonal humano que se liga e impede a interação do fator de crescimento endotelial vascular (VEGF) com os receptores. A atividade VEGF tem um papel no desenvolvimento do RRP, pois estudos in vitro têm mostrado forte expressão do VEGF-A no epitélio papiloma e a expressão dos RNAs mensageiros VEGFR-1 e VEGFR-2 em células endoteliais vasculares subjacentes (31).
Os primeiros estudos olhando o bevacizumab como tratamento para o RRP investigaram o benefício das injeções intralesionais como terapia adjuvante à cirurgia. Um estudo de três pacientes entre 3 e 6 anos de idade com RRP grave (ou seja, com pelo menos quatro procedimentos por ano) descobriu que todos os pacientes tiveram um tempo maior entre o desbridamento cirúrgico e os tratamentos a laser de KTP pulsado e RRP menos grave várias semanas após o término do tratamento com bevacizumab em comparação com antes (32). Eles também mostraram melhora na qualidade de vida relacionada à voz (32).
Além dos relatos de casos, estudos de controle de casos também foram realizados para investigar a eficácia do bevacizumab como terapia adjuvante. Após tratamento a laser KTP de 532 nm, seguido por injeções sublesionais de bevacizumab na prega vocal mais doente, e injeções salinas na outra prega, 16 dos 20 pacientes adultos com RRP de prega vocal bilateral tiveram menos papiloma na prega tratada, conforme determinado por imagem endoscópica (33). Três dos 20 pacientes não tinham nenhuma doença em nenhuma das dobras, e nenhum dos pacientes apresentou complicações decorrentes do tratamento (33).
Com base nesses resultados promissores, foi realizado um estudo mais amplo sobre a eficácia do bevacizumab em uma população pediátrica. Em 10 crianças entre 18 meses e 18 anos com RRP progressiva e não responsiva, três injeções intralesionais de bevacizumab de 2,5 mg/ml com 2-3 semanas de intervalo, juntamente com a laserterapia, aumentaram a mediana do tempo entre procedimentos cirúrgicos, diminuíram o número mediano de procedimentos por ano e melhoraram a qualidade de vida relacionada à voz (3). Uma das limitações do estudo é que a dosagem é uma estimativa baseada em doses em oftalmologia pediátrica. A quantidade injetada nos pailomas também não foi a mesma para cada paciente, pois variou com base na gravidade da doença.
Alguns estudos tentaram determinar as dosagens ideais. Outro estudo, observando nove pacientes pediátricos com RRP de início juvenil, também descobriu que, após uma série de cinco injeções subepiteliais administradas em intervalos de 4-6 semanas, com dose média de 14,25 mg, juntamente com a ablação a laser KTP, todos os nove pacientes (com idade média de 8 anos) experimentaram aumento do intervalo de tempo entre as injeções (34). Esses resultados indicam que o tratamento com altas doses de bevacizumab não apresenta complicações e pode ser altamente eficaz.
Das evidências que mostraram a eficácia do bevacizumab intralesional, a pesquisa voltou-se para o tratamento do bevacizumab sistêmico, que é um tratamento especialmente promissor para pacientes com diagnósticos complexos. O primeiro relato de administração intravenosa mostrou que, com uma mediana de 6 cursos em doses de 5, 10, 15 mg/kg, todos os pacientes tratados com RRP progressiva apresentaram regressão do papiloma (35). Os pacientes incluíram quatro casos de RRP de início adulto e um de início juvenil. Os cinco pacientes foram submetidos coletivamente a 18 intervenções cirúrgicas no ano anterior ao bevacizumab, mas apenas o caso adulto necessitou cirurgia após o tratamento devido a uma transformação maligna no ano seguinte (35).
Outros relatos de casos isolados corroboraram a eficácia do bevacizumab sistêmico sem encontrar complicações, embora a maioria delas esteja em pacientes adultos. Em um homem de 42 anos de idade com RRP traqueal grave, uma dose baixa de 5 mg/kg, aumentada para 10 mg/kg de bevacizumabe ao longo do tempo, ajudou a obter regressão da doença 3 meses após a interrupção do tratamento (36). Um acompanhamento de 12 meses revelou que o paciente permaneceu livre da doença. Seis cursos de tratamento sistêmico de bevacizumab de 5 mg/kg a cada 2 semanas para um paciente de 87 anos que não respondeu ao cidofovir intralesional, um stent endobrônquico, ou vacinação contra HPV, também ajudou a alcançar uma diminuição significativa na massa do lobo e um brônquio patente (37). Após dois cursos de 10 mg/kg de injeção intravenosa a cada 2 semanas, uma idosa de 63 anos com RRP grave mostrou menor comprometimento pulmonar e nenhuma evidência de obstrução traqueal (37).
O único relato de caso publicado em crianças é de uma mulher de 12 anos com papilomatose laringotraqueal progressiva e comprometimento pulmonar que, após 3 meses de iniciar o tratamento sistêmico com bevacizumab, mostrou uma resposta parcial na laringe e uma resposta quase completa na traquéia (38). Após 5 meses, o paciente não demonstrou mais comprometimento pulmonar. Estes resultados são ainda mais impressionantes dado que, num período de 10 anos, a paciente tinha sido iniciada com Gardasil, interferon, celecoxib, medicamento anti-refluxo, zitromicina e propranolol, e não respondeu a nenhum (38).
O potencial da bevacizumab sistêmica como tratamento para as formas mais agressivas de PRR é melhor resumido pelos resultados de uma pesquisa eletrônica da Força-Tarefa de PRR da American Society of Pediatric Otolaryngology, American Broncho-Esophagological Association, e médicos que trataram a PRR com bevacizumab sistêmica (39). As 11 pesquisas completas obtidas em nove centros médicos mostraram que a maioria dos pacientes tratados com bevacizumab tinha uma longa história de RRP de início juvenil e não tinha mostrado respostas sustentadas ao cidofovir, interferon e celecoxib. Os médicos deram tratamento na faixa de 5-10 mg/kg por dose. Sete dos oito pacientes tratados tiveram uma resposta parcial e um mostrou uma resposta completa ao tratamento (39). Todos os pacientes tiveram um tempo maior entre as cirurgias, agora na ordem de meses. Em três dos quatro pacientes com comprometimento pulmonar, três apresentaram melhora ou resolução do papiloma pulmonar e um mostrou estabilização da doença. Apenas dois pacientes apresentaram complicações menores, hemoptise e proteinúria.
Para verificar o efeito causal do bevacizumabe, determinar doses apropriadas e identificar quaisquer potenciais complicações, devem ser realizados estudos de controle randomizados e estudos de controle de casos maiores. Além disso, protocolos para definir a duração do tratamento, enquanto o controle para quaisquer potenciais efeitos de recuperação precisam ser elaborados.
Conclusões
Embora ainda não tenha sido encontrada uma terapia médica adjuvante ideal e universalmente eficaz para a PRR, resultados promissores da vacinação com PRR como abordagem terapêutica, juntamente com o uso de bevacizumab sistêmico, oferecem esperança de melhores resultados para essas crianças nos próximos anos. Protocolos ideais de tratamento devem ser desenvolvidos num futuro próximo.
Contribuições dos autores
Todos os autores listados fizeram uma contribuição substancial, direta e intelectual ao trabalho, e o aprovaram para publicação.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
O editor de manipulação declarou uma co-autoria passada com um dos autores DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. A experiência dos membros da Sociedade Americana de Otorrinolaringologia Pediátrica com papilomatose respiratória recorrente e o uso de terapia adjuvante. Cirurgia do Arco Otorrinolaringologista do Pescoço. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Etiopatogenia da papilomatose laríngea recorrente e estratégias de tratamento contemporâneas. Acta Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Uso de bevacizumab intralesional adjuvante para papilomatose respiratória agressiva em crianças. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Dall’Olio D. Papilomatose respiratória recorrente: perspectivas atuais e futuras. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferon alpha-2b como tratamento adjuvante da papilomatose respiratória recorrente em Cuba: programa nacional (Relatório 1994-1999). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Preço KN. Tratamento da papilomatose respiratória recorrente com interferon leucocitário humano. Novo Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Uso de interferon-alpha na papilomatose respiratória recorrente: acompanhamento de 20 anos. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza H, Wierzbicka M. Resultados do tratamento de bevacizumab e cidofovir em papilomatose respiratória recorrente associada ao HPV – revisão da literatura. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Cidofovir effectiveness in recurrent respiratory papillomatosis: a randomized, double-blind, placebo-controlled study. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Cidofovir intralesional para papilomatose respiratória recorrente: revisão sistemática da eficácia e segurança. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Efeitos colaterais do cidofovir no tratamento da papilomatose respiratória recorrente. Eur Arch Otorrinolaringol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Tratamento bem sucedido da papilomatose pulmonar multicística juvenil relacionada à laringe com cidofovir: relato de caso e revisão da literatura. Tórax. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Cidofovir inalado como terapia adjuvante para papilomatose respiratória recorrente. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Efeitos clínicos da terapia fotodinâmica sobre os papilomas laríngeos recorrentes da laringe. Cirurgia do Arco Otorrinolaringologico da Cabeça do Pescoço. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Tratamento da papilomatose laríngea com terapia laser fotodinâmica. Laringorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Terapia fotodinâmica para papilomatose respiratória recorrente. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indole-3-carbinol para papilomatose respiratória recorrente: resultados a longo prazo. J Voz. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. A expressão do fator de crescimento epidérmico induzido pela ciclooxigenase-2 é mediada através do fosfatidilinositol-3 quinase, não da proteína ativada por mitógeno/ sinal extracelular quinase, em papilomas respiratórios recorrentes. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Regressão da papilomatose respiratória recorrente com terapia combinada de celecoxib e erlotinibe. Tórax. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Refluxo de ácido extraesofágico e papiloma respiratório recorrente em crianças. Int. J. Pediatra. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Papilomatose respiratória recorrente associada à doença do refluxo gastroesofágico em crianças. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s004050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Refluxo laringofaríngeo e formação de trama laríngea em pacientes com papilomas respiratórios recorrentes pediátricos. Laringoscópio. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. A Associação entre a doença do refluxo gastroesofágico e a papilomatose respiratória recorrente: uma revisão sistemática. Laringoscópio. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. HspE7 tratamento da papilomatose respiratória recorrente pediátrica: resultados finais de um ensaio open-label. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Uso terapêutico da vacina contra o papilomavírus humano na papilomatose respiratória recorrente: uma revisão sistemática e uma meta-análise. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Papilomatose laríngea recorrente: tratamento bem sucedido com vacinação contra o papilomavírus humano. Criança Arch Dis. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Papilomatose laríngea juvenil-imunização com a vacina polivalente gardasil. Laringorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. Vacinação contra o HPV como abordagem preventiva para papilomatose respiratória recorrente – uma análise clínica retrospectiva de 22 anos. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. A vacina da papeira pode induzir a remissão no papiloma respiratório recorrente? Arco Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/arcotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Comparação do cidofovir e da vacina contra sarampo, papeira e rubéola no tratamento da papilomatose respiratória recorrente. Garganta do nariz do ouvido J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Role of vascular endothelial growth factor-a in recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Uso de laser pulsado de titanil fosfato de potássio 532-Nm e bevacizumab intralesional adjuvante para papilomatose respiratória agressiva em crianças: experiência inicial. Cirurgia de Arco Otorrinolaringol do Pescoço. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, Lopez-Guerra G, Burns JA, Friedman AD, et al. Injeção local de bevacizumab (Avastin) e tratamento a laser KTP angiolítico de papilomatose respiratória recorrente das pregas vocais: um estudo prospectivo. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. Alta dose de bevacizumab (Avastin) sublesional para papilomatose respiratória recorrente pediátrica. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Resposta rápida à terapia sistêmica com bevacizumab na papilomatose respiratória recorrente. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernandez-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Papilomatose respiratória recorrente e tratamento de bevacizumab. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Systemic bevacizumab para papilomatose respiratória recorrente: uma única experiência central de dois casos. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Quimioterapia Bevacizumab para o manejo da papilomatose pulmonar e laringotraqueal em uma criança. Laringoscópio. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Melhor SR, Mohr M, Zur KB. Bevacizumab sistêmico para papilomatose respiratória recorrente: uma pesquisa nacional. Laringoscópio. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar