Introducción
La papilomatosis respiratoria recurrente (PRR) es una enfermedad crónica causada por el virus del papiloma humano (VPH), generalmente los tipos 6 y 11. Las lesiones de la PRR aparecen con mayor frecuencia en la laringe (figura 1), pero también pueden aparecer en la boca, la tráquea, los bronquios, el parénquima pulmonar y el esófago. La forma de inicio juvenil de la PRR, en la que los síntomas se presentan antes de los 12 años, es más agresiva que la forma de inicio adulto, y los síntomas son más graves. La recurrencia del papiloma es especialmente rápida en los niños menores de 3 años, que experimentan intervalos más cortos entre las intervenciones quirúrgicas y, por tanto, más cirugías en general. La probabilidad de que la infección se extienda más allá de la laringe y la incidencia de una traqueotomía, para ayudar a mantener la tráquea abierta, también son mayores en esta población (1). Los pacientes con PRR de inicio juvenil se someten a una media de 20 intervenciones quirúrgicas, la mayoría de ellas en la infancia (2).
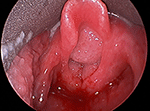
Figura 1. Imagen laringoscópica directa de una papilomatosis voluminosa de las vías respiratorias que obstruye la entrada de la laringe.
El método quirúrgico tradicional para la extirpación quirúrgica implicaba clásicamente el láser de KTP (fosfato de titanilo de potasio) o de dióxido de carbono (3). Dados los efectos secundarios potencialmente graves de la ablación con láser, incluidas las quemaduras del tracto respiratorio y las cicatrices laríngeas, los microdesbridadores se han convertido en una herramienta quirúrgica cada vez más popular, especialmente entre los otorrinolaringólogos pediátricos, para la enfermedad voluminosa (3). Este dispositivo manual puede eliminar el tejido enfermo con mayor precisión, reduciendo el daño a los tejidos circundantes (3). Sin embargo, dada la naturaleza agresiva de la PRL juvenil, los desbridamientos siguen siendo frecuentes y, con el tiempo, siguen desgastando el tejido subyacente de forma significativa, con una alta incidencia de formación de cicatrices. Por ello, se han investigado varias terapias médicas para mejorar el resultado de la cirugía, aumentando el tiempo entre operaciones, o minimizando la recurrencia de las lesiones de la PRR.
Interferón α
El interferón α, una proteína producida por los leucocitos en reacción a diversos estímulos, incluida la infección viral, fue uno de los primeros tratamientos médicos potenciales estudiados (4). Su valor como tratamiento adyuvante es controvertido. En un amplio estudio de 85 niños y 84 adultos, el 58% de los niños terminaron el período de tratamiento de un año de duración con inyecciones de interferón α intramuscular tres veces por semana sin evidencia de PRR (5). La frecuencia de recidiva del papiloma disminuyó en el 74% de todos los niños tratados (5). Sin embargo, en un ensayo de control aleatorio de 123 pacientes menores de 21 años, la disminución de la tasa de crecimiento de los papilomas en el grupo experimental que recibió inyecciones intramusculares de interferón α no se mantuvo en el curso del tratamiento de un año de duración (6). Del mismo modo, otro estudio descubrió que, 20 años después de la conclusión del tratamiento con interferón α, sólo el 42% de los pacientes indicaron una respuesta a largo plazo, y todos los que recayeron tenían la forma de aparición juvenil de la PRR (7). La mayoría de los estudios que investigan el interferón α también han informado de efectos secundarios graves, como trastornos neurológicos, leucopenia y trombocitopenia (5). Por estas razones, su uso por parte de los otorrinolaringólogos pediátricos ha disminuido y generalmente no se recomienda (1). En 2014, solo el 4% de los niños con PRR recibieron interferón α como terapia adyuvante (1).
Cidofovir
Este fármaco antiviral de amplio espectro que inhibe las polimerasas de ADN virales ha demostrado ser prometedor como terapia intralesional adyuvante a la cirugía para la PRR. Las inyecciones intralesionales de cidofovir son el tratamiento médico más administrado para la PRR entre los otorrinolaringólogos pediátricos (1). Todos los trabajos publicados entre 1998 y 2011 que investigaron la eficacia del cidofovir intralesional informaron de al menos un caso de remisión de la enfermedad (8). Sin embargo, dado que la mayoría de estos estudios son estudios de casos no controlados, no está claro si los beneficios son causados por el cidofovir, o son parte del curso natural de la enfermedad. Un ensayo de control aleatorio descubrió que no había diferencias estadísticamente significativas en la gravedad del papiloma o en la calidad de vida relacionada con la salud entre un grupo de control, tratado con intervenciones quirúrgicas según fuera necesario e inyecciones intralesionales de solución salina, y el grupo experimental, tratado con cirugía y Cidofovir intralesional, tras 12 meses de tratamiento (9). Ambos grupos experimentaron una disminución significativa de la gravedad de la enfermedad en el transcurso del año, lo que indica que la enfermedad puede remitir con el tiempo por sí sola (9). Otra revisión que analizó 27 estudios sobre la administración de cidofovir, todos ellos publicados antes de 2011, descubrió que la tasa media de remisión completa con cidofovir era del 37% en los estudios pediátricos (10). También ha habido algunos efectos secundarios graves asociados al cidofovir, ya que una revisión encontró que el 1,7 y el 1% de 447 pacientes con PRL experimentaron transformación maligna y nefrotoxicidad, respectivamente (8). Otros efectos secundarios son la erupción cutánea, el dolor de cabeza y las cicatrices en las cuerdas vocales (11). Dadas estas complicaciones potenciales y la falta de un protocolo aceptado para la dosis o la frecuencia de administración, este fármaco no es un adyuvante fiable (4).
El cidofovir también se ha administrado como tratamiento sistémico en lugar de local para los casos de PRR que se complican con enfermedad pulmonar. Cuatro estudios de casos individuales han demostrado que el cidofovir intravenoso condujo a la remisión de la enfermedad, que no es la progresión normal de la enfermedad con afectación pulmonar (11). En todos estos estudios se empleó la hiperhidratación y el probenecid, un reductor del ácido úrico, para reducir las posibilidades de nefrotoxicidad (11). Sólo un paciente experimentó efectos secundarios, alopecia parcial y leucopenia, por un tratamiento combinado de cidofovir e interferón (12). Las dosis de ambos fármacos se redujeron en respuesta. Dieciocho meses después de finalizar el tratamiento, la paciente sólo había necesitado una vez una intervención quirúrgica por PRR, y su enfermedad pulmonar se había estabilizado (12).
Un método novedoso de administración de cidofovir es la inhalación. Pocos estudios han investigado la eficacia de este método, pero puede ser prometedor para los pacientes que no han respondido a otras formas de tratamiento, como un niño de 4 meses que, a pesar de los microdesbridamientos quincenales y las inyecciones intralesionales de Cidofovir e interferón α intravenoso, experimentó un empeoramiento de los síntomas (13). Al cabo de 6 semanas de tomar 40 mg de Cidofovir nebulizado diariamente, 12 días sí y 2 días no, el tiempo entre desbridamientos aumentó (13). Seis meses después, el paciente no presentaba ningún síntoma (13). En resumen, aunque el Cidofovir en varias formas de administración sigue siendo ampliamente utilizado, los resultados de su tratamiento son, en el mejor de los casos, contradictorios, y su potencial de efectos secundarios es algo limitante.
Terapia fotodinámica
La terapia fotodinámica (TFD) consiste en introducir una sustancia sensible a la luz, llamada fotosensibilizador, por vía oral o por inyección, en el tejido enfermo y activar la sustancia con luz láser para inducir la necrosis. Una de las principales ventajas de la TFD es la capacidad de destruir los tumores sin afectar al tejido circundante (4). Los estudios de casos han mostrado tasas significativamente más lentas de rebrote del papiloma poco después de la TFD, administrada como terapia adyuvante o independiente, y en algunos casos, la ausencia de enfermedad después de varias semanas (14, 15). Sólo ha habido unos pocos ensayos controlados aleatorios para investigar el impacto de la TFD, pero el más reciente encontró que la enfermedad reaparecía después de 3-5 años, probablemente porque genera su impacto a través de una respuesta inmune a corto plazo (16). Deben realizarse más investigaciones para determinar su eficacia y seguridad.
Indole-3-Carbinol
El indol-3-carbinol, que se encuentra en altas concentraciones en las verduras crucíferas como el brócoli y la col, modifica el metabolismo del estrógeno para alterar la proliferación celular y la síntesis de ADN. En el ensayo clínico más reciente se observó que, tras tomar indol-3-carbinol dos veces al día, con una dosis de 200 mg para los adultos y dosis determinadas por el peso para los niños, durante una media de 50,2 meses, el 70% de los sujetos experimentaron una respuesta completa o parcial (17). De los pacientes pediátricos, uno experimentó una respuesta completa, tres una respuesta parcial y cinco ninguna respuesta (17). No está claro por qué los pacientes adultos respondieron mejor al indol-3-carbinol que los pacientes pediátricos. La naturaleza menos agresiva de la PRR en adultos puede ser un factor. Dados los resultados poco prometedores en la población pediátrica, no se ha investigado mucho más sobre el tratamiento de la PRR de inicio juvenil con indol-3-carbinol.
Celecoxib
Celecoxib es un fármaco antiinflamatorio que inhibe la ciclooxigenasa-2 (COX-2), una enzima que provoca inflamación y dolor, y se utiliza habitualmente para tratar la artritis. Los estudios in vitro han demostrado que las células del papiloma sobreexpresan la COX-2 como resultado de una mayor señalización del receptor del factor de crecimiento epidérmico (EGFR), y que esta actividad es importante para su crecimiento (18). Una terapia combinada de celecoxib y erlotinib, un inhibidor de la cinasa del EGFR, ayudó a controlar la PRR progresiva en un hombre de 58 años a al frenar el crecimiento del papiloma, haciendo innecesaria una nueva cirugía (19). Un ensayo de control aleatorio en curso patrocinado por Northwell Health tiene por objeto determinar si el celecoxib puede disminuir la tasa de recurrencia de los papilomas en pacientes adultos y pediátricos (4).
Medicación antirreflujo
Estudios de casos han demostrado que el tratamiento de la enfermedad por reflujo gastroesofágico (ERGE) con medicación antirreflujo en pacientes con PRR de inicio juvenil puede ayudar a ralentizar la tasa de rebrote del papiloma (20, 21). En un estudio, los pacientes que no cumplieron el tratamiento de la ERGE experimentaron una recidiva (20). Una revisión retrospectiva de las historias clínicas también demostró que los pacientes pediátricos tratados por PRR que no recibieron tratamiento para el reflujo tenían una probabilidad significativamente mayor de desarrollar telarañas laríngeas tras la extirpación quirúrgica de los papilomas (22). Aunque no hay pruebas concluyentes de que la ERGE agrave la PRR, su tratamiento tiene sentido en los pacientes que tienen una presentación clínica de ERGE y casos complicados y progresivos de PRR (23).
Proteína de choque térmico
Entre los 700 niños con PRR tratados por 74 otorrinolaringólogos pediátricos, a los que se encuestó sobre su uso de tratamiento adyuvante, 11 pacientes recibieron HSP-E7, una proteína de fusión recombinante compuesta por la proteína de choque térmico 65 (Hsp65) y la proteína E7 del VPH tipo 16 (1). La HSP-E7 se ha investigado como tratamiento en varias enfermedades derivadas del VPH, incluidas las verrugas genitales y la neoplasia intraepitelial (24). Las pruebas sugieren que puede ser reactivo contra más cepas del VPH que sólo el VPH 16 (24). En un ensayo abierto de 27 pacientes pediátricos con PRR, la mediana del intervalo entre cirugías tras el tratamiento con HSP-E7 se prolongó significativamente en comparación con la mediana anterior al tratamiento (24). Hubo pocas complicaciones, sólo reacciones leves o moderadas en el lugar de la inyección. Aunque no hay ensayos clínicos en curso para investigar la eficacia de Hsp-E7, es un tratamiento prometedor.
Vacuna contra el VPH
Unos pocos informes de casos y estudios han documentado el uso de la vacuna contra el VPH como terapia adyuvante. Actualmente hay tres vacunas aprobadas contra el VPH: la bivalente Cervarix, la tetravalente Gardasil y la noavalente Gardasil 9. La vacuna tetravalente actúa sobre el VPH-6, el VPH-11, el VPH-16 y el VPH-18. Una revisión sistemática y un metaanálisis recientes descubrieron que la duración media entre cirugías en 63 pacientes juveniles y adultos con PRL aumentó significativamente tras la vacunación contra el VPH, de 7 a 34 meses de media (25). El estudio no encontró diferencias significativas según la edad de inicio de la PRR (25). Otros estudios de casos no incluidos en el metaanálisis también han demostrado la eficacia de Gardasil en pacientes pediátricos, ya que aumenta significativamente el tiempo entre cirugías o, en algunos casos, provoca la remisión completa (26, 27).
La vacunación intramuscular contra el VPH podría ser más eficaz que los tratamientos más comunes identificados anteriormente, como el cidofovir intralesional. En un estudio retrospectivo de casos en el que se realizó un seguimiento de pacientes con PRR juvenil y de adultos durante 22 años, se observó que sólo dos de los 13 pacientes tratados con cirugía y Gardasil sufrieron una recaída, mientras que todos los pacientes de control, tratados con cirugía y cidofovir, experimentaron un rebrote del papiloma (28). La duración media del tiempo hasta la recidiva de la enfermedad también fue significativamente mayor en las pacientes tratadas que en los controles (28).
Uno de los aspectos más prometedores del VPH como terapia adyuvante es que no tiene efectos secundarios graves. Además, con el aumento de las tasas de vacunación, la incidencia de la PRL juvenil podría disminuir en general, ya que esta forma de la enfermedad se adquiere comúnmente cuando un bebé se expone a las verrugas genitales causadas por el virus del VPH 6 u 11 durante el parto (4).
Vacuna contra las paperas
Hay muy pocos estudios sobre la eficacia de la vacuna contra las paperas como terapia adyuvante, aunque la investigación actual es prometedora. Un estudio de casos encontró que se indujo la remisión en nueve de 11 pacientes pediátricos tratados con inyecciones intralesionales de la vacuna a intervalos de 3 a 12 semanas junto con cirugía láser (29). Un estudio retrospectivo que comparaba el cidofovir y la vacuna contra el sarampión, las paperas y la rubéola (SPR) como terapias adyuvantes en una población pediátrica encontró que no había diferencias significativas entre los niños tratados con cidofovir intralesional y las inyecciones de SPR después de los desbridamientos (30).
Bevacizumab
Bevacizumab es un anticuerpo monoclonal humano que se une e impide la interacción del factor de crecimiento endotelial vascular (VEGF) con los receptores. La actividad del VEGF tiene un papel en el desarrollo de la PRR, ya que los estudios in vitro han demostrado una fuerte expresión del VEGF-A en el epitelio del papiloma y la expresión de los ARN mensajeros del VEGFR-1 y del VEGFR-2 en las células endoteliales vasculares subyacentes (31).
Los primeros estudios que analizaron el bevacizumab como tratamiento de la PRR investigaron el beneficio de las inyecciones intralesionales como terapia adyuvante a la cirugía. Un estudio de tres pacientes de entre 3 y 6 años de edad con PRR grave (es decir, con al menos cuatro procedimientos al año) descubrió que todos los pacientes experimentaron un mayor tiempo entre el desbridamiento quirúrgico y los tratamientos con láser KTP pulsado y una PRR menos grave varias semanas después de la finalización del tratamiento con bevacizumab en comparación con el anterior (32). También mostraron una mejor calidad de vida relacionada con la voz (32).
Además de los informes de casos, también se han realizado estudios de casos y controles para investigar la eficacia de bevacizumab como tratamiento adyuvante. Tras el tratamiento con láser KTP de 532 nm seguido de inyecciones sublesionales de bevacizumab en el pliegue vocal más enfermo, y de inyecciones salinas en el otro pliegue, 16 de los 20 pacientes adultos con PRL bilateral en las cuerdas vocales tenían menos papilomas en el pliegue tratado, según se determinó mediante imágenes endoscópicas (33). Tres de los 20 pacientes no presentaban enfermedad en ninguno de los dos pliegues, y ninguno de los pacientes experimentó complicaciones derivadas del tratamiento (33).
A partir de estos prometedores resultados, se llevó a cabo un estudio más amplio para analizar la eficacia de bevacizumab en una población pediátrica. En 10 niños de entre 18 meses y 18 años con PRR progresiva y sin respuesta, tres inyecciones intralesionales de bevacizumab de 2,5 mg/ml con un intervalo de 2 a 3 semanas, junto con la terapia con láser, aumentaron la mediana de tiempo entre los procedimientos quirúrgicos, disminuyeron la mediana del número de procedimientos por año y mejoraron la calidad de vida relacionada con la voz (3). Una de las limitaciones del estudio es que la dosificación es una estimación basada en las dosis en oftalmología pediátrica. La cantidad inyectada en los pailomas tampoco era la misma para cada paciente, ya que variaba en función de la gravedad de la enfermedad.
Algunos estudios han intentado determinar las dosis óptimas. Otro estudio en el que se analizaron nueve pacientes pediátricos con PRR de inicio juvenil también descubrió que, tras una serie de cinco inyecciones subepiteliales administradas a intervalos de 4 a 6 semanas, con una dosis media de 14,25 mg, junto con la ablación con láser KTP, los nueve pacientes (con una edad media de 8 años) experimentaron un aumento del intervalo de tiempo entre las inyecciones (34). Estos resultados indican que el tratamiento con bevacizumab a dosis altas no presenta complicaciones y puede ser muy eficaz.
Tras las pruebas que demostraron la eficacia del bevacizumab intralesional, la investigación se centró en el bevacizumab sistémico, que es un tratamiento especialmente prometedor para los pacientes con diagnósticos complejos. El primer informe sobre la administración intravenosa demostró que, con una mediana de 6 cursos en dosis de 5, 10 y 15 mg/kg, todos los pacientes tratados con PRR progresiva mostraron una regresión del papiloma (35). Los pacientes incluían cuatro casos de PRR de inicio en la edad adulta y uno de inicio en la edad juvenil. Los cinco pacientes se sometieron colectivamente a 18 intervenciones quirúrgicas el año anterior al bevacizumab, pero sólo el caso del adulto requirió cirugía después del tratamiento debido a una transformación maligna al año siguiente (35).
Otros informes de casos únicos han corroborado la eficacia del bevacizumab sistémico sin encontrar complicaciones, aunque la mayoría de ellos son en pacientes adultos. En un hombre de 42 años con PRL traqueal grave, una dosis baja de 5 mg/kg, aumentada a 10 mg/kg de bevacizumab con el tiempo, ayudó a conseguir la regresión de la enfermedad 3 meses después de la interrupción del tratamiento (36). Un seguimiento de 12 meses reveló que la paciente seguía libre de enfermedad. Seis ciclos de tratamiento con bevacizumab sistémico de 5 mg/kg cada 2 semanas para un paciente de 87 años que no había respondido al cidofovir intralesional, a un stent endobronquial o a la vacunación contra el VPH, también ayudaron a lograr una disminución significativa de la masa del lóbulo y un bronquio permeable (37). Tras dos ciclos de inyecciones intravenosas de 10 mg/kg cada 2 semanas, una persona de 63 años con PRR grave mostró una menor afectación pulmonar y ninguna evidencia de obstrucción traqueal (37).
El único caso publicado en niños es el de una niña de 12 años con papilomatosis laringotraqueal progresiva y afectación pulmonar que, tras 3 meses de iniciar el tratamiento sistémico con bevacizumab, mostró una respuesta parcial en la laringe y una respuesta casi completa en la tráquea (38). Al cabo de 5 meses, el paciente ya no presentaba afectación pulmonar. Estos resultados son aún más impresionantes si se tiene en cuenta que, en un lapso de 10 años, la paciente había sido iniciada con Gardasil, interferón, celecoxib, medicación antirreflujo, zitromicina y propranolol, y no había respondido a ninguno (38).
El potencial de bevacizumab sistémico como tratamiento para las formas más agresivas de PRR se resume mejor en los resultados de una encuesta electrónica del Grupo de Trabajo de PRR de la Sociedad Americana de Otorrinolaringología Pediátrica, la Asociación Americana de Bronco-Esofagología y los médicos que han tratado la PRR con bevacizumab sistémico (39). Las 11 encuestas completadas obtenidas de nueve centros médicos mostraron que la mayoría de los pacientes tratados con bevacizumab tenían una larga historia de PRR de inicio juvenil y no habían mostrado respuestas sostenidas a cidofovir, interferón y celecoxib. Los médicos administraron el tratamiento en un rango de 5-10 mg/kg por dosis. Siete de los ocho pacientes tratados tuvieron una respuesta parcial y uno mostró una respuesta completa al tratamiento (39). Todos los pacientes experimentaron un aumento del tiempo entre cirugías, ahora del orden de meses. En tres de los cuatro pacientes con afectación pulmonar, tres mostraron la mejora o resolución del papiloma pulmonar y uno la estabilización de la enfermedad. Sólo dos pacientes experimentaron complicaciones menores, hemoptisis y proteinuria.
Para determinar el efecto causal de bevacizumab, determinar las dosis adecuadas e identificar cualquier complicación potencial, deben realizarse ensayos de control aleatorios y estudios de control de casos más amplios. Además, deben elaborarse protocolos para definir la duración del tratamiento, al tiempo que se controlan los posibles efectos de rebote.
Conclusiones
Aunque todavía no se ha encontrado un tratamiento médico adyuvante óptimo y universalmente eficaz para la PRR, los resultados prometedores de la vacunación contra la PRR como enfoque terapéutico junto con el uso de bevacizumab sistémico ofrecen la esperanza de mejorar los resultados para estos niños en los próximos años. Los protocolos óptimos para el tratamiento deberían desarrollarse en un futuro próximo.
Contribuciones de los autores
Todos los autores enumerados han realizado una contribución sustancial, directa e intelectual al trabajo, y lo han aprobado para su publicación.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
El editor encargado declaró una coautoría pasada con uno de los autores DP.
1. Schraff S, Derkay CS, Burke B, Lawson L. American Society of Pediatric Otolaryngology members’ experience with recurrent respiratory papillomatosis and the use of adjuvant therapy. Arch Otolaryngol Head Neck Surg. (2004) 130:1039-42. doi: 10.1001/archotol.130.9.1039
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Krstic M, Pavlović JM, Stanković P, Milenković MT. Etiopatogenia de la papilomatosis laríngea recurrente y estrategias de tratamiento contemporáneas. Acta Med Medianae. (2014) 53:64-74. doi: 10.5633/amm.2014.0411
CrossRef Full Text | Google Scholar
3. Rogers DJ, Ojha S, Maurer R, Hartnick CJ. Uso de bevacizumab intralesional adyuvante para la papilomatosis respiratoria agresiva en niños. JAMA Otolaryngol Head Neck Surg. (2013) 139:496-501. doi: 10.1001/jamaoto.2013.1810
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Carifi M, Napolitano D, Morandi M, Dall’Olio D. Papilomatosis respiratoria recurrente: perspectivas actuales y futuras. Ther Clin Risk Manag. (2015) 11:731-8. doi: 10.2147/TCRM.S81825
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Nodarse-Cuní H, Iznaga-Marín N, Viera-Alvarez D, Rodríguez-Gómez H, Fernández-Fernández H, Blanco-López Y, et al. Interferón alfa-2b como tratamiento adyuvante de la papilomatosis respiratoria recurrente en Cuba: programa nacional (Informe 1994-1999). J Laryngol Otol. (2004) 118:681-7. doi: 10.1258/0022215042244741
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Healy GB, Gelber RD, Trowbridge AL, Grundfast KM, Ruben RJ, Price KN. Treatment of recurrent respiratory papillomatosis with human leukocyte interferon. New Engl J Med. (1988) 319:401-7. doi: 10.1056/NEJM198808183190704
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Gerein V, Rastorguev E, Gerein J, Jecker P, Pfister H. Use of interferon-alpha in recurrent respiratory papillomatosis: 20-year follow-up. Ann Otol Rhinol Laryngol. (2005) 114:463-71. doi: 10.1177/000348940511400608
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Jackowska J, Piersiala K, Klimza H, Wierzbicka M. Outcomes of bevacizumab and cidofovir treatment in HPV-associated recurrent respiratory papillomatosis-review of the literature. Otolaryngol Pol. (2018) 72:1-8. doi: 10.5604/01.3001.0012.0484
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McMurray JS, Connor N, Ford CN. Eficacia del cidofovir en la papilomatosis respiratoria recurrente: un estudio aleatorizado, doble ciego y controlado con placebo. Ann Otol Rhinol Laryngol. (2008) 117:477-83. doi: 10.1177/000348940811700702
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chadha NK. Cidofovir intralesional para la papilomatosis respiratoria recurrente: revisión sistemática de la eficacia y la seguridad. J Laryngol Voice. (2011) 1:22-6. doi: 10.4103/2230-9748.76133
CrossRef Full Text | Google Scholar
11. Broekema FI, Dikkers FG. Side-effects of cidofovir in the treatment of recurrent respiratory papillomatosis. Eur Arch Otorhinolaryngol. (2008) 265:871-9. doi: 10.1007/s00405-008-0658-0
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Dancey DR, Chamberlain DW, Krajden M, Palefsky J, Alberti PW, Downey GP. Tratamiento exitoso de la enfermedad pulmonar multiquística relacionada con la papilomatosis laríngea juvenil con cidofovir: informe de un caso y revisión de la literatura. Chest. (2000) 118:1210-4. doi: 10.1378/chest.118.4.1210
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Ksiazek J, Prager JD, Sun GH, Wood RE, Arjmand EM. Cidofovir inhalado como terapia adyuvante para la papilomatosis respiratoria recurrente. Otolaryngol Head Neck Surg. (2011) 144:639-41. doi: 10.1177/0194599810395353
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Abramson AL, Shikowitz MJ, Mullooly VM, Steinberg BM, Amella CA, Rothstein HR. Clinical effects of photodynamic therapy on recurrent laryngeal papillomas. Arch Otolaryngol Head Neck Surg. (1992) 118:25-9. doi: 10.1001/archotol.1992.01880010029011
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Feyh J, Kastenbauer E. Tratamiento de la papilomatosis laríngea con terapia láser fotodinámica. Laryngorhinootologie. (1992) 71:190-2.
PubMed Abstract | Google Scholar
16. Lieder A, Khan MK, Lippert BM. Terapia fotodinámica para la papilomatosis respiratoria recurrente. Cochrane Database Syst Rev. (2014) 5:CD009810. doi: 10.1002/14651858.CD009810.pub2
CrossRef Full Text | Google Scholar
17. Rosen CA, Bryson PC. Indole-3-carbinol para la papilomatosis respiratoria recurrente: resultados a largo plazo. J Voice. (2004) 18:248-53. doi: 10.1016/j.jvoice.2003.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Wu R, Abramson AL, Shikowitz MJ, Dannenberg AJ, Steinberg BM. La expresión de la ciclooxigenasa-2 inducida por el factor de crecimiento epidérmico está mediada por la fosfatidilinositol-3 quinasa, y no por la proteína activada por mitógenos/señal extracelular regulada quinasa, en los papilomas respiratorios recurrentes. Clin. Cancer Res. (2005) 11:6155-61. doi: 10.1158/1078-0432.CCR-04-2664
CrossRef Full Text | Google Scholar
19. Limsukon A, Susanto I, Soo Hoo GW, Dubinett SM, Batra RK. Regresión de la papilomatosis respiratoria recurrente con terapia combinada de celecoxib y erlotinib. Chest. (2009) 136:924-6. doi: 10.1378/chest.08-2639
PubMed Abstract | CrossRef Full Text | Google Scholar
20. McKenna M, Brodsky L. Extraesophageal acid reflux and recurrent respiratory papilloma in children. Int. J. Pediatr. Otorhinolaryngol. (2005) 69:597-605. doi: 10.1016/j.ijporl.2004.11.021
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Borkowski G, Sommer P, Stark T, Sudhoff H, Luckhaupt H. Recurrent respiratory papillomatosis associated with gastroesophageal reflux disease in children. Eur Arch Otorhinolaryngol. (1999) 256:370-2. doi: 10.1007/s004050050166
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Holland BW, Koufman JA, Postma GN, McGuirt WF Jr. Laryngopharyngeal reflux and laryngeal web formation in patients with pediatric recurrent respiratory papillomas. Laryngoscope. (2002) 112:1926-9. doi: 10.1097/00005537-200211000-00003
PubMed Abstract | CrossRef Full Text | Google Scholar
23. San Giorgi MRM, Helder HM, Lindeman RJS, de Bock GH, Dikkers FG. The Association between gastroesophageal reflux disease and recurrent respiratory papillomatosis: a systematic review. Laryngoscope. (2016) 126:2330-9. doi: 10.1002/lary.25898
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Derkay CS, Smith RJH, McClay J, van Burik JAH, Wiatrak BJ, Arnold J, et al. Tratamiento con HspE7 de la papilomatosis respiratoria recurrente pediátrica: resultados finales de un ensayo abierto. Ann Otol Rhinol Laryngol. (2005) 114:730-7. doi: 10.1177/000348940511400913
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Rosenberg T, Philipsen BB, Mehlum CS, Dyrvig AK, Wehberg S, Chirilǎ M, et al. Uso terapéutico de la vacuna contra el virus del papiloma humano en la papilomatosis respiratoria recurrente: una revisión sistemática y metaanálisis. J Infect Dis. (2019) 219:1016-25. doi: 10.1093/infdis/jiy616
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mudry P, Vavrina M, Mazanek P, Machalova M, Litzman J, Sterba J. Recurrence laryngeal papillomatosis: successful treatment with human papillomavirus vaccination. Arch Dis Child. (2011) 96:476-7. doi: 10.1136/adc.2010.198184
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Förster G, Boltze C, Seidel J, Pawlita M, Müller A. Juvenile laryngeal papillomatosis-immunisation with the polyvalent vaccine gardasil. Laryngorhinootologie. (2008) 87:796-9. doi: 10.1055/s-2008-1077527
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Mauz PS, Schäfer FA, Iftner T, Gonser P. HPV vaccination as preventive approach for recurrent respiratory papillomatosis-a 22-year retrospective clinical analysis. BMC Infect Dis. (2018) 18:343. doi: 10.1186/s12879-018-3260-0
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pashley NRT. ¿Puede la vacuna contra las paperas inducir la remisión en el papiloma respiratorio recurrente? Arch Otolaryngol Head Neck Surg. (2002) 128:783-6. doi: 10.1001/archotol.128.7.783
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Meacham RK, Thompson JW. Comparación de cidofovir y la vacuna contra el sarampión, las paperas y la rubéola en el tratamiento de la papilomatosis respiratoria recurrente. Ear Nose Throat J. (2017) 96:69-74. doi: 10.1177/014556131709600209
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Rahbar R, Vargas SO, Folkman J, McGill TJ, Healy GB, Tan X, et al. Role of vascular endothelial growth factor-a in recurrent respiratory papillomatosis. Ann Otol Rhinol Laryngol. (2005) 114:289-95. doi: 10.1177/000348940511400407
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Maturo S, Hartnick CJ. Uso de láser de titanil fosfato de potasio pulsado de 532 Nm y bevacizumab intralesional adyuvante para la papilomatosis respiratoria agresiva en niños: experiencia inicial. Arch Otolaryngol Head Neck Surg. (2010) 136:561-5. doi: 10.1001/archoto.2010.81
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Zeitels SM, Barbu AM, Landau-Zemer T, López-Guerra G, Burns JA, Friedman AD, et al. Inyección local de bevacizumab (Avastin) y tratamiento con láser KTP angiolítico de la papilomatosis respiratoria recurrente de las cuerdas vocales: un estudio prospectivo. Ann Otol Rhinol Laryngol. (2011) 120:627-34. doi: 10.1177/000348941112001001
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Sidell DR, Nassar M, Cotton RT, Zeitels SM, de Alarcon A. Alta dosis de bevacizumab sublesional (Avastin) para la papilomatosis respiratoria recurrente pediátrica. Ann Otol Rhinol Laryngol. (2014) 123:214-21. doi: 10.1177/0003489414522977
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Mohr M, Schliemann C, Biermann C, Schmidt LH, Kessler T, Schmidt J, et al. Respuesta rápida al tratamiento con bevacizumab sistémico en la papilomatosis respiratoria recurrente. Oncol Lett. (2014) 8:1912-8. doi: 10.3892/ol.2014.2486
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Fernández-Bussy S, Labarca G, Vial MR, Soto R, Mehta HJ, Jantz M, et al. Papilomatosis respiratoria recurrente y tratamiento con bevacizumab. Am J Respir Crit Care Med. (2017) 197:539-41. doi: 10.1164/rccm.201702-0279LE
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Bedoya A, Glisinski K, Clarke J, Lind RN, Buckley CE, Shofer S. Bevacizumab sistémico para la papilomatosis respiratoria recurrente: una experiencia de un solo centro de dos casos. Am J Case Rep. (2017) 18:842-6. doi: 10.12659/AJCR.904416
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Zur KB, Fox E. Quimioterapia con bevacizumab para el tratamiento de la papilomatosis pulmonar y laringotraqueal en un niño. Laryngoscope. (2017) 127:1538-42. doi: 10.1002/lary.26450
PubMed Abstract | CrossRef Full Text | Google Scholar
39. Best SR, Mohr M, Zur KB. Bevacizumab sistémico para la papilomatosis respiratoria recurrente: una encuesta nacional. Laryngoscope. (2017) 127:2225-9. doi: 10.1002/lary.26662
PubMed Abstract | CrossRef Full Text | Google Scholar