Jest nowy rok i nowy sezon oddechowy, więc moje myśli zwracają się ku najczęstszej infekcji w pediatrii, w której antybiotyk może być odpowiednio przepisany – ostremu zapaleniu ucha środkowego (AOM). Wytyczne Amerykańskiej Akademii Pediatrii zostały sfinalizowane w 2012 roku, a opublikowane w 2013 roku i oparte na danych, które podkomisja AAP brała pod uwagę. Pojawiło się zalecenie, aby amoksycylina pozostała leczeniem z wyboru, jeśli antybiotyk miałby być w ogóle przepisany, pozostawiając opcję obserwacji jako nadal rozważaną w określonych okolicznościach klinicznych. Zalecanymi doustnymi antybiotykami alternatywnymi były amoksycylina/klawulanian i cefdinir (Pediatrics. 2013. doi: 10.1542/peds.2012-3488).
Od czasu obrad podkomisji AAP nastąpiły zmiany w etiologii AOM i częstości występowania oporności na antybiotyki wśród powszechnie występujących bakterii wywołujących zakażenie. Nasza grupa w Rochester (N.Y.) nadal jest jedynym miejscem w Stanach Zjednoczonych prowadzącym prospektywną ocenę AOM; mamy nadzieję, że nasze dane można uogólnić na cały kraj, ale nie jest to pewne. W Rochester po wprowadzeniu szczepionki Prevnar 7 zaobserwowaliśmy ogólne zmniejszenie częstości występowania AOM o około 10%-15%, co w miarę dobrze odpowiadało częstości występowania AOM wywołanych przez Streptococcus pneumoniae obejmujących siedem serotypów zawartych w szczepionce PCV7. Następnie nastąpił ponowny wzrost liczby zachorowań na AOM, spowodowany głównie serotypem 19A, tak że do 2010 roku ogólna zapadalność na AOM powróciła do poziomu niemal identycznego jak przed szczepieniem PCV7. Wraz z wprowadzeniem Prevnar 13 i dramatycznym zmniejszeniem kolonizacji nosa serotypem 19A – niezbędnego prekursora AOM – ogólna zapadalność na AOM ponownie spadła i w porównaniu z erą przed PCV7 szacuję, że obecnie obserwujemy około 20%-25% mniej AOM.
Pod koniec 2017 roku opublikowaliśmy artykuł opisujący epidemiologię AOM w erze PCV (Pediatrics. 2017 Aug. doi: 10.1542/peds.2017-0181), w którym opisaliśmy zmiany w dystrybucji otopatogenów w czasie od 1996 do 2016 roku. Wykazano w nim, że do końca 2016 roku dominującymi bakteriami wywołującymi AOM były Haemophilus influenzae, stanowiące 60% wszystkich AOM (52% wykrywanych na podstawie hodowli z tympanocentezy i kolejne 8% wykrywanych za pomocą reakcji łańcuchowej polimerazy). Wśród H. influenzae pochodzących z płynu z ucha środkowego produkcja beta-laktamaz występowała u 45%. Zatem, zgodnie z zasadami prognozowania skuteczności antybiotyków w chorobach zakaźnych, zastosowanie amoksycyliny w dawce standardowej lub wysokiej nie wyeliminowałoby około połowy H. influenzae wywołujących AOM. W tabeli zawartej w tej kolumnie przedstawiam obliczenia przewidywanych wyników leczenia amoksycyliną, amoksycyliną/klawulanianem i cefdinirem w oparciu o przewidywaną mieszankę otopatogenów i częstości oporności w 2016 roku. Do danych dotyczących H. influenzae dołączyłam wyniki dotyczące wysokiej niewrażliwości S. pneumoniae u 5% szczepów oraz wytwarzania beta-laktamazy przez Moraxella catarrhalis u 100% szczepów.
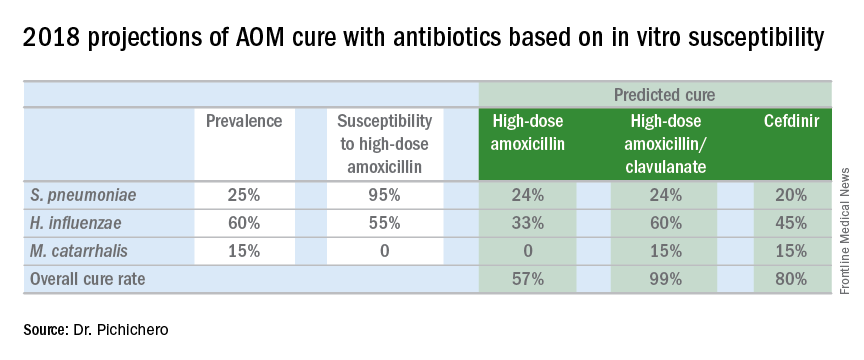
Strictly based on in vitro susceptibility and the known otopathogen mix, the calculations show that amoxicillin could result in a maximum cure of 57%, amoxicillin/clavulanate of 99%, and cefdinir of 80% of treated children.
In vitro susceptibility has its limitations. Obliczenia farmakodynamiczne obniżyłyby przewidywany sukces wszystkich trzech antybiotyków, ponieważ suboptymalne wchłanianie po podaniu doustnym występuje w przypadku amoksycyliny i amoksycyliny/klawulanianu bardziej niż w przypadku cefdyniru, powodując w ten sposób niższe niż przewidywane poziomy antybiotyku w miejscu zakażenia w uchu środkowym, podczas gdy osiągalny poziom cefdyniru przy zalecanym dawkowaniu czasami jest poniżej pożądanego punktu odcięcia in vitro.
Aby zrównoważyć tę obniżoną przewidywaną skuteczność, każdy z otopatogenów ma powiązany „wskaźnik spontanicznego wyleczenia”, który jest często podawany jako 20% dla S. pneumoniae, 50% dla H. influenzae i 80% dla M. catarrhalis. Jednak, aby było jasne, wskaźniki te pochodzą w dużej mierze z ocen około 5 dni po rozpoczęciu antybiotykoterapii nieskutecznymi lekami lub placebo i nie uwzględniają prawdziwego spontanicznego klinicznego wskaźnika wyleczenia AOM, jeśli jest on oceniany w ciągu pierwszych kilku dni po wystąpieniu choroby (kiedy ból i gorączka są największe) lub jeśli jest oceniany 14-30 dni później, kiedy prawie wszystkie dzieci zostały wyleczone przez ich układy odpornościowe.
Obliczenia te nie uwzględniają również nadrozpoznawalności w praktyce klinicznej. W rzeczywistości, jeśli dziecko nie ma AOM, to zostanie wyleczone niezależnie od tego, jaki antybiotyk zostanie wybrany. Wskaźniki nadrozpoznawalności AOM były oceniane za pomocą różnych metod i podlegają ograniczeniom. Ale ogólnie dane i większość ekspertów zgadza się, że nadrozpoznawalność przez pediatrów, lekarzy rodzinnych, lekarzy pilnej opieki, pielęgniarki i asystentów lekarzy mieści się w zakresie 30%-50%.
Przed wysunięciem przez czytelnika wniosku, że popieram jakikolwiek antybiotyk oparty ściśle na przewidywanej skuteczności in vitro, chciałbym stwierdzić, że należy wziąć pod uwagę wiele czynników, aby zdecydować, czy użyć antybiotyku na AOM i jaki antybiotyk zastosować, w jakiej dawce i przez jaki czas. Ta kolumna to tylko wskazanie kilku kluczowych, aktualnych faktów do rozważenia.

Dr Michael E. Pichichero
Dr Pichichero, specjalista w dziedzinie pediatrycznych chorób zakaźnych, jest dyrektorem Instytutu Badawczego w Rochester (N.Y.) General Hospital. Nie posiada on żadnych istotnych informacji finansowych. Proszę wysłać mu e-mail na adres .