Właściwości wody
Jedną z rzeczy, która czyni naszą planetę wyjątkową, jest obecność wody w stanie ciekłym. Woda jest podstawą wszelkiego życia; bez niej każda żywa istota umarłaby.
Woda pokrywa około 70% powierzchni Ziemi i stanowi 65-75% naszego ciała (82% naszej krwi to woda). Mimo że woda może wydawać się nudna – nie ma koloru, smaku ani zapachu – ma niesamowite właściwości, które czynią ją niezbędną do podtrzymywania życia.
(Nasza potrzeba wody i zwierząt oceanicznych, które żyją w wodzie, jest tym, co sprawia, że wycieki ropy są tak szkodliwe.)
Skład chemiczny wody to H2O – dwa atomy wodoru i jeden atom tlenu. Właściwości wody są szczególne ze względu na sposób, w jaki jej atomy łączą się ze sobą, tworząc cząsteczkę wody, oraz sposób, w jaki cząsteczki oddziałują ze sobą.
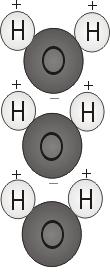
Polaryzacja wody
Gdy dwa atomy wodoru łączą się z tlenem, przyczepiają się do górnej części cząsteczki, jak uszy Myszki Miki. Ta struktura molekularna daje cząsteczkę wody polaryzacji, lub jednostronny ładunek elektryczny, który przyciąga inne atomy.
Końcówka cząsteczki z dwoma atomami wodoru jest dodatnio naładowana. Drugi koniec, z tlenem, jest naładowany ujemnie. Podobnie jak w magnesie, gdzie bieguny północne przyciągają się do południowych („przeciwieństwa się przyciągają”), dodatni koniec cząsteczki wody połączy się z ujemnym końcem innych cząsteczek.
Co to oznacza dla nas? Polarność wody pozwala jej bardzo łatwo rozpuszczać inne substancje polarne. Kiedy substancja polarna jest włożona do wody, dodatnie końce jej cząsteczek są przyciągane do ujemnych końców cząsteczek wody i na odwrót. Przyciąganie powoduje, że cząsteczki nowej substancji mieszają się równomiernie z cząsteczkami wody.
Woda rozpuszcza więcej substancji niż jakakolwiek inna ciecz – nawet najsilniejszy kwas! Z tego powodu jest często nazywana „uniwersalnym rozpuszczalnikiem”. Zdolność rozpuszczania wody jest bardzo ważna dla życia na Ziemi. Gdziekolwiek woda płynie, niesie rozpuszczone chemikalia, minerały i składniki odżywcze, które są wykorzystywane do wspierania żywych istot.
Z powodu ich polarności, cząsteczki wody są silnie przyciągane do siebie, co daje wodzie wysokie napięcie powierzchniowe. Cząsteczki na powierzchni wody „przylegają” do siebie tworząc rodzaj „skóry” na wodzie, wystarczająco mocnej, aby utrzymać bardzo lekkie obiekty. Owady, które chodzą po wodzie, wykorzystują to napięcie powierzchniowe.
Napięcie powierzchniowe powoduje, że woda zbiera się w krople, zamiast rozprzestrzeniać się w cienkiej warstwie.
Pozwala również wodzie przemieszczać się przez korzenie i łodygi roślin, termometry i najmniejsze naczynia krwionośne w twoim ciele. Gdy jedna cząsteczka porusza się w górę, „pociąga” za sobą inne.
Trzy stany materii
Woda jest jednym z czterech pierwiastków i jedyną naturalną substancją, która może istnieć we wszystkich trzech stanach materii – stałym, ciekłym i gazowym – w temperaturach normalnie występujących na Ziemi.
Wiele innych substancji musi być przegrzanych lub schłodzonych, aby zmienić stan skupienia.
Stan gazowy wody jest stale obecny w naszej atmosferze jako para wodna. Stan ciekły występuje wszędzie w rzekach, jeziorach i oceanach.
Stan stały wody, lód, jest wyjątkowy. Większość cieczy kurczy się podczas chłodzenia, ponieważ molekuły poruszają się wolniej i mają mniej energii, aby oprzeć się przyciąganiu do siebie. Kiedy zamarzają w ciało stałe, tworzą ciasno upakowane kryształy, które są znacznie gęstsze niż ciecz była pierwotnie.
Woda nie działa w ten sposób. Kiedy zamarza, rozszerza się: molekuły układają się w bardzo „otwartą” strukturę krystaliczną, która jest mniej gęsta niż woda w stanie ciekłym.
To dlatego lód pływa. I to dobrze, że tak jest! Gdyby woda zachowywała się jak większość innych cieczy, jeziora i rzeki zamarzłyby na stałe i całe życie w nich by umarło.
Trzy inne właściwości wody
Woda ma wysokie ciepło właściwe. Oznacza to, że w przeciwieństwie do powietrza, woda może wchłonąć dużo ciepła bez zmiany temperatury. To dlatego pływanie jest tak orzeźwiające w gorący dzień.
Woda traci również ciepło wolniej niż powietrze. W rezultacie latem woda w jeziorach i oceanach jest zwykle najzimniejsza na początku sezonu i najcieplejsza pod koniec sezonu (po wielu dniach pochłaniania energii słonecznej).
Na temperaturę wrzenia wody (212°F lub 100°C na poziomie morza) ma wpływ wysokość nad poziomem morza. Ogólnie rzecz biorąc, im wyższa wysokość, tym niższa temperatura wrzenia wody. Na przykład w Denver, CO (5 280 stóp), woda wrze w temperaturze 202,4° F. Na Mount Everest w Nepalu (29 012 stóp), woda wrze w temperaturze 156° F.
Projekty naukowe dotyczące wody:
- Cykl wodny
- Koło wodne
- Superchłodzona woda
- Zbiornik wodny
.