Program badawczy został przeprowadzony w celu poprawy technologii przetwarzania do ekstrakcji tlenku glinu z nonbauxitic. Sukces tego programu zapewnił technologię niezbędną do produkcji odpowiedniej podaży wysokiej jakości tlenku glinu ze źródeł krajowych, spełniając w ten sposób krajowe potrzeby gospodarcze i strategiczne związane z produkcją aluminium. Jednym z procesów badanych w ramach programu badawczego jest proces odzyskiwania tlenku glinu z niskogatunkowych rud przy użyciu kwasu solnego.
Jedna z faz tego procesu wykorzystuje wpływ stężenia jonów chlorkowych na rozpuszczalność jonów glinu w roztworze. W temperaturze 25° C rozpuszczalność AlCl3 w czystej wodzie wynosi około 31% wagowych i zmniejsza się wraz ze wzrostem stężenia kwasu solnego (HCl), stając się 0,1 pct, gdy stężenie HCl jest zwiększone do 37 pct. Zachowanie to było przedmiotem licznych badań, procesów i patentów. Tak więc możliwe jest ługowanie rudy nieboksytowej za pomocą HCl, dekantacja i filtracja cieczy, a następnie dodanie gazowego HCl w celu wytrącenia AlCl3-6H2O. Pozostały roztwór kwasu może być następnie użyty do ługowania innej rudy, a wytrącony AlCl3-6H2O może być kalcynowany w celu otrzymania Al2O3 . Obszerna dyskusja i ocena tego procesu została przedstawiona przez Petersa, Johnsona i Kirby’ego. Dane termodynamiczne, takie jak aktywności jonowe i rozpuszczalność, wymagane do pełnej analizy, interpretacji i poprawy tego procesu są rzadkie, a istniejące dane dotyczące rozpuszczalności są ograniczone do wąskiego zakresu temperatur. Dlatego też, celem tego badania było (1) określenie rozpuszczalności AlCl3, w zakresie temperatur od 25° do 85° C przy stężeniu HCl od 0,0 do 37.2 pct; (2) obliczenie aktywności AlCl3 i H2O w roztworach zawierających różne elektrolity oraz stałej równowagi dla rozpuszczania AlCl3-6H2O; oraz (3) zaproponowanie obszarów badań w celu uzyskania użytecznych danych.
- Aparatura
- Procedura doświadczalna
- Analiza
- Wyniki
- Porównanie z innymi danymi
- Obróbka termodynamiczna
- Produkt rozpuszczalności i aktywność w układzie AlCl3-6H2O-H2O
- Oszacowanie aktywności w układzie AlCl3-6H2O-H2O
- Iloczyn rozpuszczalności i aktywności w układzie AlCl3-6H2O-HCl-H2O
- Oszacowanie aktywności w układzie AlCl3-6H2O-HCl-H2O
- Układ AlCl3-FeCl3-KCl-NaCl-HCl-H2O
- Obszary zalecane do badań
- Chlorek glinu w wodnych roztworach kwasu solnego
Aparatura
Przyrząd używany do pomiarów rozpuszczalności jest pokazany na rysunku 1. Kolba o pojemności 100 ml, A, zawiera roztwór elektrolitów i pewien nadmiar soli. Filtr szklany, B, umieszczony na rurce Pyrex 6 mm-OD jest połączony z rurką zewnętrzną przymocowaną do dwóch korków teflonowych, D i E. Górny zespół jest przymocowany do A w C za pomocą gwintowanego nylonowego złącza zaciskowego z neoprenowym pierścieniem 0-ring. Rurka polietylenowa 6 mm-OD, F-L, dostarcza próbkę roztworu przefiltrowanego w B do drugiej kolby, K, gdy A jest pod ciśnieniem przez kurek D, a E jest otwarty. Łącznik w J jest podobny do tego w C. Kolby są zamocowane na pręcie, G, który jest przymocowany do mechanizmu kołysania, z H jako osią kołysania do wstrząsania kolb, A i K, na przemian w górę i w dół. Zakryty termostat, 0, jest kontrolowany w zakresie ±0,2° C. Dokładniejsza kontrola temperatury nie jest konieczna, ponieważ rozpuszczalność jest bardzo słabą funkcją temperatury.
Procedura doświadczalna
Pomiary rozpuszczalności w temperaturach 25°, 45°, 65° i 85° C zostały wykonane w warunkach równowagi fazowej przy użyciu materiałów analitycznych klasy odczynnikowej. Odpowiednie ilości AlCl3-6H2O, 37-procentowy roztwór HCl i wodę destylowaną umieszczono w kolbie A, tworząc około 90 ml roztworu z niewielką ilością nadmiaru kryształów soli (dalej „sól” odnosi się do sześciowodzianu chlorku glinu). Ilości materiałów oszacowano na podstawie istniejących danych o rozpuszczalności w układzie trójskładnikowym AlCl3-6H2O-HCl-H2O. Po utworzeniu roztworu w kolbie A i zmontowaniu aparatu, zanurzono go w wodzie do poziomu N, a termostat ustawiono na żądaną temperaturę. Podczas każdej serii trwającej od 2 do 3 dni stosowano ciągłe mechaniczne mieszanie kolb. Okresowo stosowano również energiczne mieszanie ręczne w celu zapewnienia
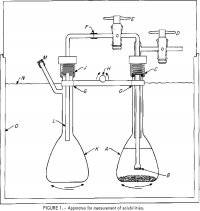
równowagi, szczególnie jeśli sól mogła tworzyć złożone ciało stałe z HCl. Pod koniec okresu wyrównywania kolby pozostawiono na 1 godzinę w pozycji pionowej, aby zapewnić osadzanie się cząstek stałych. Następnie otwarto korki D i E, aby przenieść około połowy roztworu do kolby do pobierania próbek K. Poziom B poniżej poziomu cieczy w A zwykle określał ilość roztworu przeniesionego do K. Masa roztworu w K została określona przez zważenie kolby przed zmontowaniem oraz po wprowadzeniu roztworu i zdemontowaniu. Przez L do kolby wstrzykiwano znaną ilość wody destylowanej w celu rozcieńczenia próbki i rozpuszczenia oparów w fazie gazowej. Ciśnienie cząstkowe HCl w czystej wodzie przekracza 1 torr w temperaturze 25° C przy molalności przekraczającej 8 m (m po liczbie w zdaniu oznacza molal); dlatego przy stężeniach mniejszych niż 8 m wątpliwe jest, aby jakiekolwiek straty HCl mogły wystąpić podczas pobierania próbek. Z tego powodu niektóre próby w temperaturze 25° C, zawierające mniej niż 4 m HCl, wykonano w pojedynczej kolbie z korkiem, a po wyrównaniu stężenia część roztworu ostrożnie zdekantowano i przefiltrowano w celu pobrania próbki.
Analiza
Roztwory analizowano po odpowiednim rozcieńczeniu pod kątem całkowitego stężenia jonów chlorkowych i jonów glinu. Całkowite stężenie jonów chlorkowych oznaczano metodą miareczkowania potencjometrycznego z Ag+. Stężenie Al++ oznaczano przez pierwsze kompleksowanie z nadmiarem kwasu etylenodiamino-tetraoctowego (EDTA), a następnie wsteczne miareczkowanie nadmiaru EDTA z Cu++ przy pH 3,8.
Zawartość AlCl3 obliczano z analizy Al++. Odjęcie jonu chlorkowego w obliczonej ilości AlCl3 od całkowitego stężenia jonów chlorkowych umożliwiło obliczenie stężenia HCl w nasyconych roztworach.
Tę metodę obliczeń zastosowano do wszystkich analiz z wyjątkiem tych, w których wiadomo było, że stężenie HCl wynosi zero, to znaczy, gdy AlCl3 był jedynym elektrolitem w czystej wodzie. W przypadku tych analiz stężenie AlCl3 obliczano po prostu z analizy jonów chlorkowych, która była dokładniejsza z dwóch analiz, chociaż dla tych próbek nadal wykonywano analizy Al++ i Cl-.
Różnica w analizie Cl- obliczonej z całkowitej analizy Cl- i Cl- z analizy Al++ dla eksperymentów bez dodatku HCl wynosiła ±0,2 wt-pct Cl-. Wskazuje to, że średnio analiza Al++ była obarczona błędem +0,05 wt-pct, ponieważ wiadomo, że analiza Cl jest znacznie dokładniejsza niż analiza Al++. W roztworach zawierających HCl, błąd ±0,05% w zawartości Al+++ był odzwierciedlony jako ±0,20pkt w zawartości HCl; było to spowodowane tym, że podczas gdy całkowita zawartość Cl była bardzo dokładna, Cl wniesiony przez dodany HCl, a tym samym molalność HCl, została obliczona przez różnicę, jak wspomniano wcześniej.
Wyniki
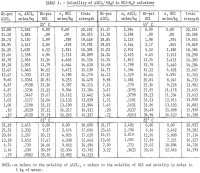
Wyniki zostały podsumowane w tabeli 1 i pokazane na rysunku 2. Maksymalne stężenie HCl dla danych podanych w tabeli 1 dla temperatury 85° C wynosi około 30 % mas. Pomiary zostały przerwane przy tym stężeniu z powodu zbyt wysokich ciśnień równowagi w układzie przy wyższych stężeniach. Należy również zauważyć, że w temperaturach 65° i 85° C przeprowadzono mniej oznaczeń niż w 25° i 45° C. W dwóch niższych temperaturach przeprowadzono powtórzenia w celu uzyskania wskazania zadowalającej powtarzalności wyników. Rysunek 2 pokazuje, że rozpuszczalność soli glinu drastycznie spada wraz ze wzrostem stężenia HCl. W związku z tym ługowanie rud nieboksytowych roztworem HCl i wytrącanie czystej soli w celu ekstrakcji aluminium przez dodanie HCl jest procesem wykonalnym; proces taki był przedmiotem kilku patentów. Wyniki pokazują, że rozpuszczalność nie zmienia się znacznie z temperaturą, a dla wzrostu temperatury o 60° C (25° do 85° C) rozpuszczalność czystej soli w wodzie wzrasta tylko o 2,2 pct w stosunku do rozpuszczalności w 25° C.
Porównanie z innymi danymi
Rozpuszczalność czystej soli w wodzie w 25° C zgadza się dokładnie z danymi Palitzcha oraz Ehreta i Frere’a. Wyniki podane przez Malquori są o około 10 pct wyższe. Rozpuszczalność uzyskana przez Tanakę jest około 3.3 pct wyższa niż w obecnym badaniu w 45° i w 65° C.
Wpływ HCl w wodzie na rozpuszczalność soli został zbadany przez Seidla i Fishera w 0° C oraz przez Malquori w 25° C. Wyniki pierwszych badaczy w 0° C zgadzają się bardzo ściśle z danymi w tabeli 1, ekstrapolowanymi do 0° C, podczas gdy wyniki drugiego badacza w 25° C nieco się rozproszyły i nie zgadzają się w przybliżeniu o 3 pet przy niskich stężeniach HCl; jednakże zgodność w zakresie od 5 do 30 % masowych HCl jest w granicach 1 pct.
Obróbka termodynamiczna
Produkt rozpuszczalności i aktywność w układzie AlCl3-6H2O-H2O
Współczynnik aktywności jonowej Y12 AlCl3 w wodzie został zmierzony do 1,8 m przez Masona, a przeliczone wartości są podane przez Robinsona i Stokesa. Ponieważ oczekuje się, że współczynnik aktywności od 1,8 m do wartości nasycenia 3,3835 m wzrośnie ponad pięciokrotnie, wartość nasycenia jest używana do obliczeń metodą opisaną szczegółowo w poprzednim raporcie (1 m = 1 mol w 1 kg rozpuszczalnika). Metoda ta, wraz z jej odpowiednim nowym zastosowaniem, jest krótko podsumowana w niniejszym raporcie. Średnia aktywność jonowa AlCl3, oznaczona jako a12, jest wyrażona następującym szeregiem potęgowym w kategoriach molowości m:

Odpowiednie równanie dla aktywności wody aw, otrzymuje się przez zastosowanie zależności Gibbsa-Duhema; wynik jest
![]()
Zauważ, że wykładniki m przy tych samych współczynnikach C, D, itd, są o 1 wyższe w równaniu 2 niż w równaniu 1, a współczynnik m w równaniu 2 pochodzi z teorii Debye-Huckela omówionej przez Gokcena.
Reakcja rozpuszczania soli jest następująca
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),………………………….(3)
gdzie (s) oznacza ciało stałe, a (l) ciecz.
Odpowiednia stała równowagi wynosi
![]()
gdzie mianownik, aktywność ciała stałego, przyjmujemy jako jedność, gdyż jego skład pozostaje niezmieniony po dodaniu innych elektrolitów w roztworze. Zastępujemy a12 w 1n Kp bezpośrednio z równania 1, a aw z równania 2 po pomnożeniu równania 2 przez 0,108093, aby współczynnik 1n aw był równy 6. Ponieważ Kp jest niezależne od składu, widać, że
![]()
Po dokonaniu wymaganych podstawień z równań 1 i 2, a następnie podstawieniu wartości średniej m = 3.3835 z dwóch pierwszych przebiegów w tabeli 1, otrzymuje się jedno równanie do rozwiązania sześciu nieznanych współczynników w równaniu 1, a pozostałe pięć równań otrzymuje się przez podstawienie każdej z pięciu doświadczalnych wartości średniego współczynnika aktywności jonowej AlCl3 , y12 z tabeli 2, do
![]()
, a następnie podstawienie każdego wyniku do równania 1. Otrzymane w ten sposób sześć równań równoczesnych rozwiązuje się komputerowo. Wyniki są następujące:
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
i H = +11,6880.
Zastąpienie tych wartości w równaniach 1, 2 i 4 daje wartości Y12, aw i Kp. Wyniki są wymienione w tabeli 3 pod nagłówkiem „Wyniki Biura:”. Należy zauważyć, że aktywność wody można teraz obliczyć z równania 2, a prężność pary wodnej nad roztworem, P, z
aw = P/P°,……………………………….(7)
gdzie P° jest prężnością pary czystej wody w tej samej temperaturze. Zauważmy, że prężność pary wodnej nad roztworem nasyconym jest nieco większa niż połowa prężności nad czystą wodą, ponieważ aw = 0.509. Powyższe wyniki stanowią pierwszy zestaw danych dotyczących aktywności opartych na rozpuszczalności soli.
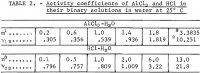
Uwaga.- W tej tabeli, m odnosi się do molowości AlCl3, n odnosi się do molowości HCl, a molowość jest molami w 1 kg wody.
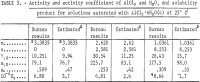
Uwaga.- W tej tabeli, m odnosi się do molowości AlCl3, n odnosi się do molowości HCl, a molowość jest molami w 1 kg wody.

Uwaga.- W tej tabeli, m odnosi się do molowości AlCl3, n odnosi się do molowości HCl, a molowość jest molami w 1 kg wody.W tej tabeli, m odnosi się do molowości AlCl3, n odnosi się do molowości HCl, a molowość jest molami w 1 kg wody.
Oszacowanie aktywności w układzie AlCl3-6H2O-H2O
Do uzyskania aktywności w układzie AlCl3-6H2O-H2O poza istniejącymi bezpośrednimi danymi doświadczalnymi przy m = 1,8 stosuje się dwie istniejące wiarygodne metody szacowania. Pierwsza metoda, opisana przez Kusika i Meissnera, daje szacunkową wartość γ12 = 9,94 przy 3,3835 m. Ta szacunkowa wartość jest w bliskiej zgodności z 10,251, wartością otrzymaną w obecnym badaniu. Odpowiadająca szacunkowa wartość aktywności wody, aw, wynosi 0,47, ponownie w bliskiej zgodności z wartością 0,509 znalezioną w obecnym dochodzeniu. Stała równowagi Kp obliczona na podstawie tych wartości nie jest daleka od 6,8 x 10 5, biorąc pod uwagę fakt, że czwarta potęga a12 i szósta potęga aw są mnożone w celu uzyskania Kp.
Druga metoda szacowania należna Bromley’owi daje 10,42 dla γ12, wartość bliższą tej uzyskanej przez poprzednią metodę. Współczynnik aktywności wody został otrzymany przez obecnych autorów poprzez całkowanie równania Gibbsa-Duhema, w którym wykorzystano wartości a12 oszacowane metodą Bromleya. Otrzymany wynik to aw = 0,540. Średnia z obu metod wynosi 0,505, co jest bardzo dobrą zgodnością z wartością podaną przez Biuro, wynoszącą 0,509. Metoda Bromleya nie zawiera jednak dogodnej metody wyznaczania aw zawartej w metodzie Kusik-Meissnera.
Zgodność oszacowanych wartości z wartościami z danych o rozpuszczalności nie zawsze jest tak dobra, jak tu pokazano dla każdego elektrolitu przy każdym składzie. Na przykład, nawet dla AlCl3 przy 1 m, dwa oszacowania γ12 różnią się tylko o 13 procent od siebie.
Iloczyn rozpuszczalności i aktywności w układzie AlCl3-6H2O-HCl-H2O
Wpływ wzrastającego stężenia HCl na rozpuszczalność soli jest w dużej mierze spowodowany wzrastającym stężeniem jonów chlorkowych. Stała równowagi w tym przypadku przy aktywnościach a1 i a2 poszczególnych jonów wynosi
![]()
gdzie γ12 = γ1γ2 z definicji γ12 z poszczególnych aktywności jonowych γ1 (dla Al+++) i γ2 (dla Cl-), a n jest molalnością HCl. Wartość Kp jest taka sama jak w równaniu 4, ale prawa strona w równaniu 8 jest inna niż w równaniu 4. Można zauważyć, że wraz ze wzrostem n, m, stężenie Al+++, musi się zmniejszać, pod warunkiem, że γ12 i aw nie zmniejszą się znacznie; dlatego sól wytrąca się, co jest znane jako efekt wysalania.
Obliczanie aktywności w roztworze trójskładnikowym wymaga równania podobnego do równania 1 dla HCl. Ponieważ dane dla HCl są znane dokładnie w szerokim zakresie stężeń, możliwe jest przyjęcie równania z dowolną liczbą zmiennych. Następujące równanie daje dokładną reprezentację danych dla współczynnika aktywności HCl, γ32, gdzie indeks 3 jest dla H+, a 2 dla Cl-:
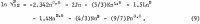
Dane wybrane w tym celu z Haase, Naas, i Thutnm są wymienione w trzecim i czwartym wierszu tabeli 2. Wartości współczynników obliczonych na podstawie tych danych są następujące:
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
i P = +0,02634.
Równania aktywności AlCl3 i H2O zawierają te współczynniki, jak również współczynniki iloczynów krzyżowych (m h/2)(n k/2), gdzie h i k są liczbami całkowitymi, a równania te są następujące:
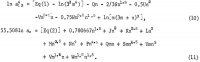
Pięć dodatkowych współczynników w tych równaniach wyznacza się przez dodanie równania 10 i 6 1n aw z równania 11 w celu otrzymania 1n Kp oraz przez zastosowanie następujących wybranych danych o rozpuszczalności z tabeli 1:
m: 2.620, 2.016, 1.333, 0.953, i 0.535,
n: 2.581, 4.460, 6.780, 8.397, i 10.063,
W wyniku obliczeń otrzymano następujące wartości współczynników w równaniach 10 i 11:
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
i W = +4,60246.
Wyniki dla γ12, a12, aw i Kp obliczone z poprzednich równań zestawiono w tabeli 3. Wartości γ12 z równania 9 zgadzają się z wartościami uzyskanymi przez Harneda i Gary’ego przy bardzo niskich stężeniach HCl i AlCl3.
Ciśnienie cząstkowe HCl(g), P32, nad roztworem można obliczyć z następującego równania (4):
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
gdzie Kp(HCl) jest stałą równowagi w 25° C dla H+ + Cl- = HCl(g), a a32 jest średnią aktywnością jonową HCl w roztworze. W tym celu konieczne jest napisanie równania dla a32, podobnego do równania 10, wykorzystując parametry z równania 11, jak pokazano szczegółowo w innym miejscu.
Wpływ temperatury na rozpuszczalność soli jest niewielki, jak pokazano w tabeli 1. Oczekuje się zatem, że wpływ na aktywność jonową będzie niewielki, ponieważ wszystkie parametry w równaniu 11 można było uzyskać z danych dotyczących rozpuszczalności, jeżeli błąd doświadczalny był mniejszy niż ±0,01 wt-pct dla analizy aluminium. Ogólnie, dla zakresu temperatury do około 80° C, każdy parametr jest liniową funkcją temperatury, a zależność ta może być określona, jeśli równanie 11 byłoby znane w innej temperaturze, co najmniej 50° C wyższej niż 25° C.
Oszacowanie aktywności w układzie AlCl3-6H2O-HCl-H2O
Wartości aktywności, współczynnika aktywności i produktu rozpuszczalności oszacowane w niniejszym raporcie zgodnie z metodą opracowaną przez Kusika i Meissnera, są wymienione w tabeli 3. Współczynnik aktywności γ12 dla AlCl3 jest około dwukrotnie wyższy niż wartość oszacowana dla wybranych roztworów zawierających HCl. Aktywność wody, aw, zgadza się natomiast dobrze z wartościami oszacowanymi z wyjątkiem m = 2,620. Jest oczywiste, że obliczenia byłyby znacznie bardziej wiarygodne, gdyby ciśnienie pary wody, aw, było mierzone, ponieważ aw wchodzi do Kp jako aw, tak że małe błędy w aw powodują duże błędy w γ12 i Kp . W tym celu zaleca się przeprowadzenie ograniczonej liczby pomiarów ciśnienia pary, aby sprawdzić dokładność obecnych obliczeń i metod szacowania.
Zależność temperaturowa właściwości termodynamicznych wymienionych w tabeli 3 może być oszacowana w sposób opisany przez Kusika i Meissnera. Jednakże, oszacowanie to prawdopodobnie daje wyższy stopień zależności od temperatury niż ten, na który wskazuje słaba zależność rozpuszczalności od temperatury. Nie można było podjąć próby obliczenia wpływu temperatury metodą Biura, ponieważ (1) a12 przy niskich stężeniach AlCl3 nie jest znana w różnych temperaturach, (2) rozpuszczalność AlCl3 nie może być określona z dokładnością zbliżoną do 0,01 pct w Al++, oraz (3) zakres stężeń HCl w 65° i 85° C jest zbyt mały, aby wybrać wystarczającą liczbę różniących się znacznie danych dotyczących rozpuszczalności AlCl3 w celu dokładnego określenia parametrów w równaniach 10 i 11.
Układ AlCl3-FeCl3-KCl-NaCl-HCl-H2O
Wstępne dane dotyczące rozpuszczalności AlCl3, FeCl3 , KCl i NaCl w roztworach wodnych zawierających od 24 do 31% masowych HCl w temperaturze 25° C uzyskano w celu oceny zanieczyszczenia AlCl3-6H2O ekstrahowanego z rud niebauksytowych. W tym celu przygotowano 2 litry roztworu zawierającego znane ilości soli, 90 ml tego roztworu umieszczono w kolbie dla każdej próby, a następnie wpuszczono znaną ilość gazowego HCl, aby uzyskać od 24 do 31% wagowych rozpuszczonego HCl. W tym zakresie stężenia HCl w roztworze wytrącały się bezbarwne anizotropowe kryształy AlCl3-6H2O, jasne anizotropowe kryształy FeCl3-2KCl-H2O oraz sześcienne izotropowe przezroczyste kryształy KCl i NaCl, które identyfikowano badaniem mikroskopowym. Procedura i analizy stężenia jonów glinu i jonów chlorkowych były takie same jak dla układu AlCl3-6H2O-HCl-H2O przedstawionego wcześniej w tym raporcie. Dodatkowo, stężenie jonów żelazowych oznaczono za pomocą standardowego miareczkowania K2Cr2O7, stężenie jonów sodowych oznaczono za pomocą technik absorpcji atomowej, a stężenie jonów potasowych oznaczono przez odjęcie stężenia jonów sodowych od oznaczenia połączonych stężeń jonów potasowych i sodowych po rozdzieleniu za pomocą wymiany jonowej. Wyniki są wymienione w tabeli 4 i wykreślone na rysunku 3. Podobne wyniki uzyskane przez Milesa są również wykreślone na rysunku 3, aby pokazać, że zgodność jest doskonała. Opublikowane dane dla powiązanych prostszych systemów zawierających mniej składników zostały zebrane przez Linke.
W procesach krystalizacji wyparnej lub krystalizacji z użyciem gazu HCl do produkcji czystego heksahydratu chlorku glinu, zanieczyszczenie innymi chlorkami metalicznymi staje się problemem, ponieważ poziomy zanieczyszczeń wzrastają w roztworach ługujących. Rysunek 3 przedstawia poziomy stężenia, przy których zanieczyszczenia takie jak NaCl, KCl i FeCl2-2KCl-H2O również krystalizują z roztworu jako odrębne fazy, powodując zanieczyszczenie kryształów AlCl3-6H2O. Na przykład, przy zawartości mniejszej niż 2,4 części wagowych FeCl3 w obecności 1,6 części wagowych KCl w temperaturze 25° C, stężenie HCl musi być mniejsze niż 28 części wagowych, aby uniknąć zanieczyszczenia AlCl3-6H2O przez podwójną sól FeCl3-2KCl-H2O. Rysunek 3 jest również przydatny do ponownego rozpuszczenia osadu frakcyjnej rekrystalizacji w celu oczyszczenia soli glinu. Ponadto, niektóre z soli pierwiastków przejściowych, takich jak FeCl3, może być zminimalizowane przez częściową elektrolizę do płytki wystarczającej ilości żelaza przed zakwaszeniem HCl.
Termodynamiczne leczenie systemu z typowym błędem ±0,05 wt-pct w stężeniu jonów chlorkowych nie jest wykonalne, zwłaszcza w przypadku braku danych ciśnienia pary dla H2O(g) i HCl(g). Jednakże przybliżone szacunki aktywności mogą być dokonane metodą Kusika-Meissnera. Przewiduje się, że takie szacunki mogą dać tylko przybliżone wartości aktywności dla uwodnionych i złożonych soli oraz dla wody.

Obszary zalecane do badań
Pomiary aktywności są przydatne w interpretacji termodynamiki i kinetyki ługowania, wytrącania i oczyszczania pożądanych składników różnych rud. Istnieją dwa powody, że działania mogą być określone dokładnie z pomiarów ciśnienia pary wody: (1) Ciśnienie pary można zmierzyć z dużą dokładnością za pomocą przetworników różnicy ciśnień, aby uzyskać aw według równania 7, a następnie obliczyć wartości parametrów w równaniu 11, tak że wszystkie powiązane właściwości mogą być obliczone, jak omówiono wcześniej szczegółowo (2) Iloczyn rozpuszczalności i aktywności mogą być zarówno dokładnie określone dla soli wielowartościowych, które zawierają dużą liczbę cząsteczek wody w swoich uwodnionych kryształach. Drugi powód wynika z faktu, że wykładnik aktywności wody w równaniu 4 jest równy molom wody w uwodnionym krysztale.
Chlorek glinu w wodnych roztworach kwasu solnego
Innym interesującym rodzajem eksperymentu dla omawianego tu układu trójskładnikowego jest pomiar ciśnienia cząstkowego HCl(g) nad różnymi roztworami zawierającymi dostatecznie duże ilości rozpuszczonego HCl. Procedura eksperymentalna do tego celu została opisana w innym miejscu. Grupa IIA, IIIA i sole metali przejściowych są doskonałymi kandydatami do tego typu badań, ponieważ elektrolity o wyższych wartościach niż 1:1 zwykle tworzą uwodnione sole.
Rozpuszczalność i aktywność sześciowodnego chlorku glinu, AlCl3-6H2O, w roztworach wodnych zostały określone jako część Bureau of Mines, U.S. Department of the Interior, badania mające na celu poprawę technologii przetwarzania minerałów do odzyskiwania tlenku glinu z krajowych zasobów niskiej jakości. Stwierdzono, że rozpuszczalność AlCl3 w czystej wodzie wynosiła 31,09 i 31,77% mas. w temperaturze 25° i 85° C i drastycznie spadała do 10 i 0,1% mas. po dodaniu do roztworu odpowiednio 20,3 i 37% mas. kwasu solnego (HCl). Obliczono stałe równowagi dla rozpuszczalności heksahydratu, aktywności oraz współczynniki aktywności AlCl3 i H2O i porównano je z wynikami uzyskanymi dostępnymi metodami szacowania. Wykazano przydatność uzyskanych wyników do ługowania rud nieboksytowych w celu ekstrakcji tlenku glinu poprzez zmianę rozpuszczalności soli składowych po dodaniu HCl.
Określono również równoczesną rozpuszczalność AlCl3 , FeCl3, KCl i NaCl w roztworach HCl-H2O oraz krótko omówiono ich wpływ na czystość AlCl3-6H2O krystalizowanego z roztworów soli mieszanych.
.