Strona Microbial Biorealm poświęcona rodzajowi Rhodospirillum rubrum
Klasyfikacja
Taksony wyższego rzędu
Kingdom: Bacteria
Phylum: Proteobacteria
Class: Alphaproteobacteria
Order: Rhodospirillales
Family: Rhodospirillaceae
Genus: Rhodospirillum
Gatunek
Rhodospirillum rubrum
Opis i znaczenie
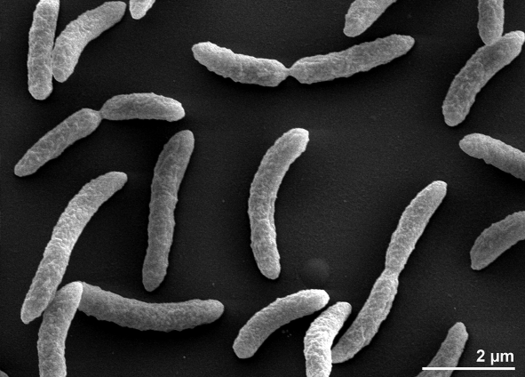
Rhodospirillum rubrum jest Gram-ujemną, mezofilnąproteobakterią. Jej optymalna temperatura wzrostu wynosi 25-30 stopni Celsjusza. Ma wielowarstwowe otoczki zewnętrzne, które zawierają głównie nienasycone, ale niektóre nasycone tłuszcze w ścianie komórkowej. R. rubrum należy do spirilli, co oznacza, że ma kształt spirali. Jest polarnie flagellowana, a więc ruchliwa. Jego długość wynosi 3-10 um, a szerokość 0,8-1,0 um.
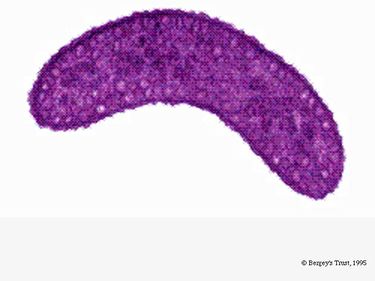
R. rubrum jest fakultatywnym anaerobem. W zależności od obecności tlenu, może ulegać fermentacji alkoholowej lub oddychaniu tlenowemu. Jest również zdolny do fotosyntezy i zawiera karotenoid i bateriochlorofil w swoich cząsteczkach chromatoforowych. Cząsteczki te pomagają w absorpcji światła i przekształcaniu go w energię, a także nadają jej wyraźny fioletowo-czerwony kolor w warunkach beztlenowych. W warunkach tlenowych R. rubrum jest bezbarwny.
Pomimo że fotosynteza jest aktywna w warunkach tlenowych, to w obecności O2 jest ona na ogół tłumiona. Siarka jest głównym produktem ubocznym fotosyntezy, a nie O2. R. rubrum może rosnąć heterotroficznie lub autotroficznie w warunkach fotosyntezy. W przeciwieństwie do wielu roślin, R. rubrum nie zawiera chlorofilu a (spektrum absorpcji 430-662 nm). Zawiera natomiast chlorofil b (spektrum absorpcji 660-680 nm) i bakteriochlorofil (800-925 nm). Dzięki temu może wykorzystywać więcej energii z widma elektromagnetycznego. R. rubrum utlenia również tlenek węgla (CO), którego produktem końcowym jest wodór, a w niskich stężeniach może wykorzystywać siarczek jako donor elektronów w redukcji dwutlenku węgla. Dodatkowo, jest bakterią wiążącą azot; wykorzystuje nitrogenazę do przekształcania azotu atmosferycznego w amoniak (Munk i in., 2011).
Istnieje kilka zastosowań R. rubrum w dziedzinie biotechnologii. Jest on modelowym systemem konwersji energii świetlnej na chemiczną oraz dla jego szlaków wiązania azotu. Jest również przedmiotem badań nad odpornością na promieniowanie. Może być również wykorzystana na kilka sposobów do celów konsumpcyjnych. Proteobakterie mogą być źródłem pożywienia dla zwierząt i nawozów rolniczych. Inną ważną rolę w badaniach odgrywa produkcja witamin. Badana jest również pod kątem produkcji biologicznego tworzywa sztucznego z prekursorów kwasu polihydroksy-butrynowego. R. rubrum może mieć również udział w biologicznych paliwach wodorowych, głównie poprzez ewolucję enzymu nitrogenazy.
Struktura genomu
Sekwencjonowanie genomu zostało zakończone. Składa się on z kolistego chromosomu o długości 4 352 825 par zasad, z czego 65% stanowią pary guanina-cystozyna. Istnieje również plazmid z 53 732 parami zasad o 60% zawartości guaniny i cytozyny. W sumie istnieje 3 850 genów kodujących białka i 83 geny RNA. Spośród tych genów 6,9% jest związanych z transkrypcją; 4,6% z translacją, strukturą rybosomów i biosyntezą; 4,0% z replikacją, rekombinacją i naprawą; 7,9% z mechanizmami transdukcji sygnału; 5,9% z biogenezą ściany komórkowej i błon; 6,6% z produkcją i konwersją energii; 5,0% z transportem i metabolizmem węglowodanów; 9.9% transport i metabolizm aminokwasów; 4,7% transport i metabolizm koenzymów; 3,7% transport i metabolizm lipidów; oraz 6,5% transport i metabolizm jonów nieorganicznych(Munk et al, 2011).
Ekologia
Dzięki temu, że Rhodospirillum rubrum może rosnąć zarówno tlenowo jak i beztlenowo, jest w stanie zasiedlać wiele różnych warunków. R. rubrum występuje w wielu naturalnych środowiskach wodnych, takich jak stawy, jeziora, strumienie i wody stojące (Reslewic et. al, 2005). R. rubrum jest również często znajdowany w błocie i ściekach (Brock i in., 2000). Badania wykazały, że R. rubrum może dokonywać dużych zmian w swoim składzie chemicznym, aby dostosować się do różnych środowisk (Cohen-Bazire i Kunisawa, 1963). R. rubrum preferuje wzrost w siedliskach o pH 6,8-7,2 (Bergey i Holt, 1994). Badania wykazały również, że optymalna temperatura wzrostu R. rubrum wynosi 22-35 stopni Celcjusza (Weaver, 1971).
Struktura komórki i metabolizm
R. rubrum jest wszechstronnym organizmem, który może pozyskiwać energię za pomocą różnych mechanizmów. Mechanizmy oddychania i fotosyntezy występują razem, a ich aktywność zależy od obecności światła i energii. R. rubrum może rosnąć w ciemnym chemo-tropikalnym środowisku z obecnością tlenu lub może rosnąć w fototropikalnym środowisku bez tlenu.
Fotosynteza u R. rubrum rozpoczyna się od oddania wodoru z substratu organicznego do substratu utleniającego. Bakteriochlorofil i kartenoidy, fotoreaktywne pigmenty znajdujące się w błonie komórkowej, są związane z chromatoforami (Schachman, Pardee i Stanier, 1952). Chromatofory są spłaszczonymi dyskami, które zawierają fosfolipidy cholinowe, kardio lipiny i diglicerydy galaktozylowe (Benson, Wintermans i Wiser, 1959; Benson 1961). Dodatkowo, chromatofory zawierają kompletny łańcuch transportu elektronów, który obejmuje różne cytochromy, flawiny i nukleotydy pirydynowe (Newton i Newton, 1957; Hulcher i Conti, 1960; Kamen, 1961). Błona komórkowa zawiera również maszynerię do syntezy ATP, w tym syntetazy ATP.
W obecności tlenu R. rubrum jest w stanie oddychać tlenowo przy użyciu tradycyjnego łańcucha transportu elektronów z NAD+/NADH jako głównym nośnikiem elektronów (Keister i Minton, 1969). Wśród białek transportujących elektrony znajduje się cytochrom C428 (Chance i Smith, 1955). Oddychanie tlenowe jest jednak hamowane przez fotosyntezę (Oelze i Weaver, 1971).
R. rubrum jest również zdolny do oddychania beztlenowego. Jego nietlenowe akceptory elektronów końcowych mogą obejmować sulfotlenek dimetylu i tlenek trimetyloaminy. Obecność tych akceptorów elektronów sprawia, że substraty takie jak bursztynian, jabłczan i octan mogą wspomagać wzrost R. rubrum. Te akceptory są jednak tylko w przybliżeniu 33-41% tak wydajne jak tlen pod względem zachowania energii (Schultz i Weaver, 1982).
Dodatkowo R. rubrum posiada unikalną zdolność do utleniania tlenku węgla przy użyciu dehydrogenazy tlenku węgla. Ta ścieżka utleniania kończy się redukcją i wodorem oraz produkcją wodoru.
Bez terminalnego akceptora elektronów, R. rubrum kończy mieszaną fermentację kwasową. Głównymi produktami fermentacji pirogronianowej są octan, mrówczan, dwutlenek węgla i wodór. W obecności jonu wodorowęglanowego, fruktoza może być fermentowana. Produkty końcowe tego szlaku są takie same jak dla pirogronianu, ale z dodatkiem bursztynianu i propionianu (Schultz i Weaver 1982).
Poza zdolnością do wiązania dwutlenku węgla (Schon i Biedermann, 1972), identyfikującą właściwością anaboliczną R. rubrum jest jego zdolność do wiązania azotu. W ciemnych warunkach z obecnością fruktozy, R. rubrum używa nitrogenazy do wiązania gazowego azotu do amonu. Zawiera on zarówno nitrogenazy Fe-Mo jak i Fe-only.
Patologia
R. rubrum nie został uznany za infekcję ludzi lub zwierząt.
Bieżące badania
Odporność na promieniowanie
Rhodospirillum rubrum dostarczyło ostatnio wglądu w odporność na promieniowanie. Felice Mastroleo et al, w Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), scharakteryzowali tolerancję R. rubrum na promieniowanie.
Poddając bakterie subletalnym dawkom promieni gamma Cobalt-60, rodzajowi promieniowania jonizującego, scharakteryzowano w organizmie R. rubrum geny markerowe specyficzne dla promieniowania jonizującego. Geny te zwiększały swoją ekspresję w miarę upływu czasu regeneracji po danym promieniowaniu gamma. Analiza ekspresji genów przez R. rubrum po napromieniowaniu gamma stwarza potencjał dla dalszych badań mikrobiologicznych, które mogą prowadzić do postępu w stosowanej odporności na promieniowanie w przyszłości.
Biodegradowalne tworzywa sztuczne
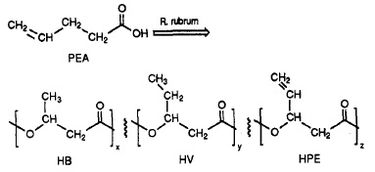
R. rubrum został uznany za zdolnego do produkcji klasy biodegradowalnych tworzyw sztucznych, poli beta-hydroksyalkanianów (PHA). Zastosowania tych badań mogą rozwiązać wiele problemów spowodowanych przez syntetyczne, nie ulegające degradacji tworzywa sztuczne, które negatywnie wpływają na środowisko. Eksperyment badawczy przeprowadzony przez Herberta. W. Ulmer et al opisał produkcję PHAs zawierających jednostki 3HV przez Rhodospriillum rubrum (1993). Ulmer użył kwasu 4-pentenowego (PEA) jako podłoża wzrostowego dla R. rubrum. Kiedy bakteria została umieszczona w „warunkach produkujących PHA”, syntetyzowano PHA zawierające 3 powtarzające się podjednostki (uwaga: R = grupa podstawnikowa): HB (R = metyl), HV (R = etyl), HPE (R = winyl) (patrz Rysunek 1).
Synteza funkcjonalnych, biodegradowalnych tworzyw sztucznych przez bakterie ma potencjał do zmniejszenia globalnego zanieczyszczenia i wydatków na paliwo z fabryk tworzyw sztucznych. R. rubrum może być wykorzystany jako mikrobiologiczne narzędzie do produkcji przyjaznych dla środowiska biopolimerów.
Odnawialna energia
Wzrastające zaniepokojenie zanieczyszczeniem środowiska w wyniku spalania paliw kopalnych doprowadziło do wzrostu badań nad Rhodospirillum rubrum. Wykorzystanie R. rubrum jako źródła wodoru, który ma być wykorzystywany w odnawialnych paliwach wodorowych, rozwiązuje kilka problemów wynikających z konsumpcji paliw kopalnych. Wodór utlenia się do wody jako produktu spalania, w przeciwieństwie do paliw kopalnych, które tworzą zanieczyszczenia takie jak CO, CO2, SOx i NOx. R. rubrum może produkować wodór wykorzystując następującą reakcję „przesunięcia woda-gaz” (Najafpour et al, 2004):
CO + H2O → H2 + CO2
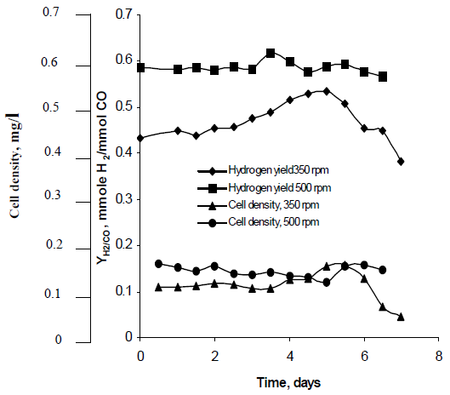
Najafpour w swojej metodzie badawczej obserwował, jak mieszanie, wytworzone przez zestawy wirników turbinowych ustawionych z szybkością 350 rpm, jak również 500 rpm, wpłynęło na szybkość produkcji wodoru przez R. rubrum. Jego badania wykazały, że paliwo wodorowe ma potencjał, aby ograniczyć globalne ocieplenie i zapewnić przyjazne dla środowiska rozwiązanie technologiczne do produkcji i konsumpcji paliw. Jego badania wykazały, że „wyższe tempo mieszania dawało wyższy poziom wodoru, jak również gęstość komórek” R. rubrum (patrz Rysunek 2).
W innym badaniu mikrobiologicznym, przeprowadzonym przez Matthew Ross Melnicki, stwierdzono, że R. rubrum zapewnia potencjał dla energii odnawialnej, takiej jak paliwo wodorowe, poprzez syntezę wodoru. Jego ścieżki biologiczne mogą produkować wodór z dużą szybkością, gdy jest uprawiany razem z Chlamydomonas reinhardtii, gatunkiem glonów, z którym R. rubrum może harmonijnie rosnąć. Melnicki zaproponował niekonwencjonalne podejście do syntezy wodoru, które pozwoliło na uzyskanie zwiększonych poziomów syntezy wodoru, które mogą nie być osiągnięte, jeśli współkultura jest odłączona. C. reinhardtii był faworyzowany przy wyższych intensywnościach światła, podczas gdy R. rubrum był bardziej produktywny przy niższych intensywnościach światła, podkreślając zalety ich współkultury.
Używając techniki wsadowej do hodowli R. rubrum, stwierdzono, że zaszczepione kultury produkowały wodór podczas fazy wzrostu wykładniczego, a synteza wodoru kwitła nieprzerwanie przez 70 godzin. Kiedy wzrost ustał, Melnicki dodał bursztynian, który działa jako donor elektronów w szlaku metabolicznym, i ewolucja wodoru została wznowiona, mimo że bakterie już nie rosły. Jednakże, należy zauważyć, że przy ciągłym dodawaniu bursztynianu, stwierdzono zmniejszone tempo wydzielania wodoru. Po dodaniu dodatkowego podłoża wzrostowego, szybkość produkcji wodoru ponownie wzrosła.
Melnicki stwierdził również, „podczas gdy wzrost nie jest wymagany do produkcji wodoru, ta praca ustanawia konieczność wzrostu komórek w celu utrzymania maksymalnych wskaźników, sugerując przydatność przemysłową strategii półciągłej hodowli” (Melnicki, 2009).
Cool Factor
Sekwencja genomu Rhodospirillum rubrum jest dopiero drugą z rodzaju Rhodospirillum, która została opublikowana, po R. centenum (Munk et al, 2011).

Interesującym aspektem Rhodospirillum rubrum jest jego zdolność do zmiany koloru w różnych warunkach. Jest to anoksygeniczny fototrof, ale nie wytwarza pozakomórkowego tlenu. Zamiast tego produkuje siarkę elementarną podczas pozyskiwania światła. Wynika to z faktu, że R. rubrum nie posiada kompleksu 2 (Munk i in., 2011). Bakteria używa bakteriochlorofilu, co umożliwia jej absorbowanie fal świetlnych, których rośliny nie wykorzystują. Bakteriochlorofil absorbuje fale o długości 800-925 nm.
W warunkach tlenowych aktywność fotosyntetyczna R. rubrum jest genetycznie stłumiona, a bakteria staje się bezbarwna. Natomiast w warunkach beztlenowych fotosynteza jest aktywowana i bakteria przybiera wyraźny purpurowo-czerwony kolor (patrz Obraz 5). Dzieje się tak z powodu aktywności w chromatoforach, znajdujących się w błonie (Munk i in., 2011). Chromatofory zawierają bakteriochlorofilowe pigmenty bakterii i ulegają zmianom absorpcyjnym podczas aktywacji fotosyntezy.
Benson, A. „Chloroplast lipid metabolizm.” W Sympozjum no. VI. 5th international Congress on Biochemistry. 1961. Oxford: Pergamon Press. (In the Press.)
Benson, A., Wintermans, J. and Wiser, R. „Chloroplast lipids as carbohydrate reservoirs.” Plant Physiology. 1959. Tom 34. s. 815.
Bergey, D. i Holt, J. Bergey’s podręcznik bakteriologii determinatywnej. Dziewiąte wydanie. Baltimore. Lippincott Williams and Wilkins. 1994. s. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, and J Parker. Biology of Microorganisms. 9th Edition. Upper Saddle River: Prentice Hall, 2000. s. 459.
Chance, B. and Smith, L. „Pigmenty oddechowe Rhodospirillum rubrum”. Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. and Kunisawa, R. „The Fine Structure of Rhodospirillum Rubrum .” Journal of Cell Biology. 1963. Volume 16. p. 401-419.
Hulcher, M. and Conti, S. „Cytochronies in chlorophyll-containing particles of Chromatium and Chlorobium thiosuphatophilum.” Biochemistry and Biophysics Research Communications. 1960. Tom 3. str. 497.
Kamen, M. „The Haem Proteins of Photosynthetic Tissues.” W Sympozjum no. VI. 5th International Congress on Biochemistry. 1961. Oxford: pergamon Press. (In the Press.)
Keister, D. and Minton, N. „Energy-linked reactions in photosynthetic bacteria. 3. Dalsze badania nad energią powiązaną z redukcją dinukleotydu nikotynamidoadeninowego przez chromatofory Rhodospirillum rubrum.” Biochemistry. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., and Leys, N. „Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods”. Zgromadzenie Naukowe COSPAR. 2010. p. 4.
Melnicki, M. R. „Modes of hydrogen production in the photosynthetic bacterium, Rhodosphirillum rubrum”. University of California, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. „Complete genome sequence of Rhodospirillum rubrum type strain (S1T)”. Standards in Genomic Sciences. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., and Kamaruddin, A. H. „Hydrogen as clean fuel via continuous fermentation by anaerobic photosynthetic bacteria, Rhodospirillum rubrum”. African Journal of Biotechnology. 2004. Tom 3. str. 503-507.
Newton, J. and Newton, G. „Skład fotoaktywnych cząsteczek subkomórkowych z Chromatium.” The Archives of Biochemistry and Biophysics. 1957. Volume 71. p. 250.
Oelze, J. and Weaver, P. „The adjustment of photosynthetically grown cells of Rhodospirillum rubrum to aerobic light conditions.” The Archives of Microbiology. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., and Schwartz, D. „Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum .” Applied and Environmental Microbiology. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., and Stanier, R. „Studies on the macromolecular organization of microbial cells.” The Archives of Biochemistry and Biophysics. 1952. Tom 38. str. 245-260.
Schön, G. and Biedermann, M. „Synteza lotnych kwasów przez fermentację pirogronianu i fruktozy w beztlenowych ciemnych kulturach Rhodospirillum rubrum.” Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. and Weaver, P. „Fermentacja i oddychanie beztlenowe przez Rhodospirillum rubrum i Rhodopseudomonas capsulate.” The Journal of Bacteriology. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., and Lenz, R. „Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum”. Macromolecules. 1994. Volume 27. p. 1675-1679.
Weaver, P. „Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum.” Proceedings of the National Academy of Sciences of the United States of America. 1971. Tom 68. s. 136-138.
Edytowane przez studentów dr Iris Keren: Allison Almeida, Matthew Cozzolino, Trung Nguyen i Jessica Wong.
NEUF2011
.