J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817
Research Paper
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Department of Radiation Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Department of Biostatistics, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Department of Surgical Oncology, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Outcomes after Treatment of Metaplastic Versus Other Breast Cancer Subtypes. J Cancer 2020; 11(6):1341-1350. doi:10.7150/jca.40817. Available from https://www.jcancer.org/v11p1341.htm
Purpose: Metaplastic breast cancer (BC) is an uncommon yet aggressive histologic subtype of BC. Staraliśmy się zidentyfikować czynniki związane z jego rozpoznaniem oraz porównać postępowanie i wyniki leczenia metaplastycznego BC z innymi BC, a w szczególności z potrójnie ujemnym inwazyjnym rakiem przewodowym, biorąc pod uwagę, jak często ma on fenotyp potrójnie ujemny.
Pacjenci i metody: Zidentyfikowaliśmy kobiety, u których zdiagnozowano inwazyjnego BC w latach 2010-2014 w National Cancer Data Base i zastosowaliśmy analizę jednoczynnikową, aby porównać wyjściową charakterystykę pacjenta i guza według podtypu BC. Całkowite przeżycie (OS) oszacowano za pomocą metody Kaplana-Meiera, a wieloczynnikowe modele proporcjonalnych zagrożeń Coxa wykorzystano do identyfikacji niezależnych predyktorów OS.
Wyniki: Spośród 247 355 przypadków, 2 084 (0,8%) stanowiły BC metaplastyczne, 55 998 (23%) BC potrójnie ujemne, a 77% inne BC. W porównaniu do niemetaplastycznego BC, kobiety z metaplastycznym BC częściej były starsze w momencie diagnozy (mediana wieku, 62 vs. 59 lat), miały ≥1 chorobę współistniejącą (22% vs. 18%) i były objęte Medicare (41% vs. 33%; P<0.001). BC metaplastyczne miały raczej charakter podstawnokomórkowy (77%), a w porównaniu z BC potrójnie ujemnymi lub innymi BC, BC metaplastyczne wiązały się z wyższym stopniem zaawansowania klinicznego T (cT3-4, 18% vs. 11%, 8%), brakiem zajęcia węzłów klinicznych (cN0, 86%, 77%, 80%), brakiem inwazji limfowaskularnej (72%, 65%, 62%) i guzami o wysokim stopniu złośliwości (71%, 77%, 35%) (P<0.001). Większość metaplastycznych BC była leczona mastektomią (58%), wycięciem węzłów chłonnych wartowniczych (65%), napromienianiem ściany klatki piersiowej lub piersi (74%) i chemioterapią (75%) jako terapią adjuwantową (60%). Przy medianie czasu obserwacji wynoszącej 44,5 miesiąca, wskaźniki OS były niższe dla metaplastycznego BC niż dla potrójnie ujemnego lub innego BC we wszystkich stopniach zaawansowania klinicznego po 5 latach (stopień I, 85%, 87%, 91%; II, 73%, 77%, 87%; III, 43%, 53%, 75%) i po 3 latach (stopień IV, 15%, 22%, 64%; P<0,001). W analizie wieloczynnikowej wyższy wiek, zaawansowanie kliniczne, inwazja naczyń limfatycznych, wycięcie węzła pachowego (vs. węzeł wartowniczy) oraz brak radioterapii lub chemioterapii wiązały się z gorszymi wynikami w metaplastycznym BC. Rozległość operacji miała wpływ na przeżycie w przypadku potrójnie ujemnego i innego BC, ale nie w przypadku metaplastycznego BC.
Wnioski: Wyniki leczenia metaplastycznego BC są nadal gorsze niż w przypadku innych podtypów BC, pomimo nowoczesnych metod leczenia. Optymalizacja opcji leczenia systemowego, która była istotnym predyktorem przeżycia, powinna być priorytetem w leczeniu metaplastycznego BC.
Słowa kluczowe: metaplastyczny rak piersi, potrójnie ujemny rak piersi, wyniki leczenia raka piersi, radioterapia, chemioterapia.
Wprowadzenie
Chociaż rak piersi jest najczęstszym nowotworem złośliwym u kobiet, z ponad 268 000 udokumentowanych przypadków rocznie, metaplastyczny rak piersi (BC) stanowi mniej niż 1%-2% wszystkich przypadków raka piersi. Klinicznie, metaplastyczny BC objawia się jako szybko rosnąca masa piersi o złożonej echogeniczności (tj. z komponentami litymi i torbielowatymi) w badaniu ultrasonograficznym oraz masa o dużej gęstości w badaniu mammograficznym. Pod względem histologicznym BC metaplastyczny składa się z heterogennej populacji guzów, które można sklasyfikować na podstawie obecności niegruczołowych lub mezenchymalnych typów komórek lub poprzez dalszą kategoryzację na podtypy w zależności od obecności różnych cech, takich jak komórki olbrzymie osteoklastyczne lub komórki wrzecionowate.
Przy prezentacji wskaźnik zajęcia klinicznych węzłów chłonnych w BC metaplastycznym jest zwykle niski. Metaplastyczny BC jest jednak częściej rozpoznawany w zaawansowanych stadiach klinicznych ze względu na większe guzy pierwotne w porównaniu z innymi BC i wiąże się z wyższym odsetkiem chemiooporności, przerzutów odległych i gorszym przeżyciem całkowitym (overall survival, OS). Metaplastyczny BC charakteryzuje się szczególnie wysoką częstością występowania potrójnie ujemnego statusu receptorowego lub brakiem amplifikacji receptora estrogenowego, progesteronowego i receptora 2 ludzkiego naskórkowego czynnika wzrostu (HER2). Bez białek docelowych, metaplastyczny BC pozostaje trudny do leczenia. Biorąc pod uwagę rzadkość występowania tego nowotworu, dane prospektywne dotyczące wyboru najlepszej metody leczenia metaplastycznego BC są ograniczone. Zamiast tego, większość obecnych standardów opieki nad metaplastycznym BC została ekstrapolowana na podstawie wyników badań małych serii z jednego ośrodka lub opisów przypadków. Dlatego wykorzystaliśmy National Cancer Data Base (NCDB), która obejmuje około 70% wszystkich zdiagnozowanych przypadków raka w Stanach Zjednoczonych, do oceny charakterystyki, postępowania i wyników opartych na leczeniu i cechach guza u pacjentów z metaplastycznym BC w porównaniu z pacjentami z potrójnie ujemnym BC i wszystkimi innymi podtypami BC. Zastosowaliśmy również analizę wielowariantową w celu zidentyfikowania niezależnych predyktorów przeżycia dla kobiet z metaplastycznym BC.
Źródło danych i wybór kohorty
Wspólny projekt założony w 1989 roku przez Komisję ds. Raka American College of Surgeons i American Cancer Society, NCDB zebrał dane onkologiczne z około 1500 akredytowanych placówek w Stanach Zjednoczonych, łącznie ponad 34 miliony rekordów. Dostępne informacje o pacjentach są pozbawione tożsamości i dlatego są zwolnione z nadzoru ochrony ludzi przez instytucjonalną komisję rewizyjną.
Kryteria wyboru stosowane w tym badaniu przedstawiono na rycinie 1. Włączono kobiety w wieku 18 lat i starsze, u których zdiagnozowano inwazyjnego raka piersi od 2010 do 2014 roku. Wykluczono pacjentki z nieznanym statusem receptora hormonalnego (estrogenowego i progesteronowego) (HR). Dodatkowymi powodami wykluczenia były brakujące informacje dotyczące zabiegu operacyjnego, chemioterapii lub stopnia zaawansowania klinicznego według 6. lub 7. edycji American Joint Committee On Cancer (AJCC). Pacjenci zostali podzieleni na trzy grupy: 1-metaplastyczny BC (z kodami histologicznymi 8575 lub 8573), 2-trójujemny BC (TNBC, który obejmował tylko histologie niemetaplastyczne) i 3-wszystkie pozostałe typy BC. Termin „niemetaplastyczny BC” został użyty w odniesieniu do potrójnie ujemnego BC i innych BC łącznie.
SchematONSORT. BC, breast cancer.
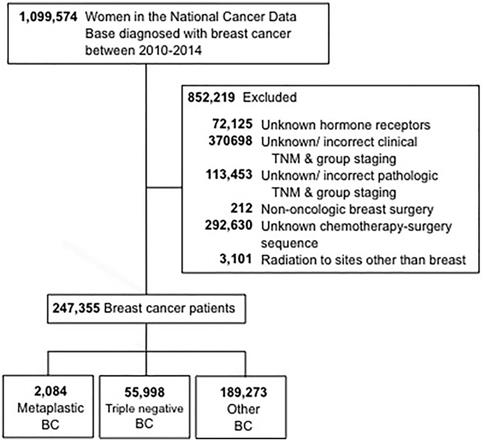 (Kliknij na obraz, aby powiększyć.)
(Kliknij na obraz, aby powiększyć.)
Zmienne
Informacje uzyskane i przeanalizowane z NCDB obejmowały wiek pacjenta w momencie rozpoznania, rok rozpoznania, rasę, wskaźnik współchorobowości Charlsona/Deyo, status ubezpieczenia medycznego, medianę dochodu gospodarstwa domowego oraz typ ośrodka leczącego (dychotomizowany na akademicki/badawczy versus nieakademicki). Cechy kliniczno-patologiczne obejmowały oznaczenie kliniczne AJCC T i N (węzłowe), ogólną grupę zaawansowania klinicznego AJCC, status HR, status receptora HER2, stopień zaawansowania guza i inwazję limfowaskularną (LVSI). Podtypy molekularne zostały zdefiniowane jako HR(+)/HER2(-), HER2(+), potrójnie ujemne (receptor estrogenowy(-), receptor progesteronowy (-), HER2(-)) lub nieznane. Pacjentki z metaplastycznym BC z potrójnie ujemnym statusem receptora zostały oznaczone jako tn-metaplastyczny BC, aby odróżnić je od niemetaplastycznego TNBC. Pierwotne postępowanie obejmowało chirurgię (z zachowaniem piersi, mastektomię lub brak), radioterapię z lub bez napromieniania węzłów regionalnych, chemioterapię (neoadjuwantową, adjuwantową lub brak) oraz hormonoterapię. Chirurgiczne leczenie pachy było zdefiniowane jako dysekcja węzłów pachowych (axillary node dissection, ALND), gdy usunięto 10 lub więcej węzłów chłonnych, lub dysekcja węzłów wartowniczych (sentinel lymph node dissection, SLND), gdy usunięto <10 węzłów chłonnych.
Analiza statystyczna
Analizę jednoczynnikową zastosowano do oceny potencjalnych związków między cechami demograficznymi, nowotworowymi i klinicznymi a rozpoznaniem metaplastycznego BC, stosując testy chi kwadrat dla zmiennych kategorycznych oraz test t/analizę wariancji lub ich odpowiedniki w podejściach nieparametrycznych (Wilcoxon rank-sum lub Kruskal-Wallis) dla zmiennych ciągłych. OS definiowano jako czas od momentu postawienia diagnozy do momentu zgonu. Czas OS dla pacjentów, którzy przeżyli, był cenzurowany prawostronnie w momencie ostatniego kontaktu. Rozkład OS oszacowano metodą Kaplana-Meiera. Do testowania różnic w przeżyciu między grupami użyto testu log-rank. Dla OS przeprowadzono analizę regresji danych dotyczących przeżycia w oparciu o model proporcjonalnych zagrożeń Coxa. Wielowariantowy model proporcjonalnych zagrożeń Coxa uzyskano, włączając najpierw wstępny zestaw kandydujących zmiennych prognostycznych o wartości P < 0,05 w analizie jednoczynnikowej. Następnie zastosowano stopniową eliminację wsteczną, z 0,05 dla poziomu istotności chi kwadrat Walda, aby efekt pozostał w modelu.
Analizy przeżycia przeprowadzono w obrębie każdego z typów nowotworów oddzielnie.
Lokalizacja i typ ośrodka nie zostały uwzględnione w procesie selekcji modelu metaplastycznego BC, ponieważ żaden z tych czynników nie był statystycznie istotny dla tej grupy w ustawieniu jednoczynnikowym, a dane nie były w pełni dostępne dla pacjentów młodszych niż 40 lat. W celu zbadania, czy szczegóły terapii systemowej i napromieniania wpływają na wyniki wśród pacjentów z metaplastycznym BC, przeprowadziliśmy analizy podzbiorów tej kohorty, aby ocenić potencjalny wpływ sekwencjonowania chemioterapii i zakresu napromieniania na OS. Wszystkie testy były dwuwartościowe, a istotność statystyczną definiowano jako wartość P <0,05. SAS wersja 9.4 (SAS Institute, Cary, NC) i S-Plus wersja 8.2 (TIBCO Software Inc., Palo Alto, CA) zostały użyte do przeprowadzenia obliczeń dla wszystkich analiz.
Charakterystyka kohorty i guza
Zidentyfikowaliśmy 247 355 kobiet z rozpoznaniem inwazyjnego raka piersi w latach 2010-2014, z których 0,8% (n=2 084) miało metaplastyczny BC, 23% (n=55 998) TNBC, a 77% (n=189 273) inny BC. Charakterystykę socjodemograficzną, kliniczną i patologiczną nowotworu oraz charakterystykę leczenia w zależności od typu BC przedstawiono w Tabeli 1. Mediana wieku wynosiła 63 lata (zakres 22-90) dla kobiet z metaplastycznym BC i 59 lat (zakres 18-90) zarówno dla TNBC, jak i innych BC. Kobiety z BC metaplastycznym częściej miały wskaźnik chorób współistniejących ≥1 (22% vs. 18% TNBC vs. 16% inne BC) i posiadały ubezpieczenie publiczne (50% vs. 42% TNBC vs. 41% inne BC) (wszystkie P<0,001). Diagnoza metaplastycznego BC lub TNBC była częściej związana z rasą czarną niż z innymi BC (18% vs. 21% vs. 11%, P<0.001).
Niezwykle istotne różnice w stadium klinicznym choroby i cechach guza były widoczne w zależności od typu nowotworu. Metaplastyczny BC był często diagnozowany w bardziej zaawansowanych stadiach, tylko 31% pacjentów z metaplastycznym BC miało kliniczne stadium I choroby, w porównaniu z 46% TNBC i 54% innych BC (P<0,001). Wzorzec ten wydawał się korelować z wyższym odsetkiem większych guzów w grupie metaplastycznego BC (cT3-4, odpowiednio 18% vs. 11% vs. 8%), ale obecność klinicznego zajęcia węzłów była najniższa w przypadku metaplastycznego BC (cN1-3, odpowiednio 14% vs. 23% vs. 20%) (wszystkie P<0,001). W przeciwieństwie do klinicznego statusu węzłowego, wskaźnik patologicznego zajęcia węzłów był nieco niższy w przypadku BC metaplastycznego i TNBC, ale dwukrotnie wyższy w przypadku innych BC (pN1-3, odpowiednio 18% vs. 26% vs. 40%, P<0,001). W odniesieniu do statusu receptora, 77% grupy metaplastycznego BC miało tn-metaplastyczny BC, co jest 3,4 razy więcej niż grupa niemetaplastycznego BC (23%), z czego HR(+)/HER2(-) był najczęstszym podtypem molekularnym w 59% (P<0,001). Ponadto, tylko 5% metaplastycznych BC było HER2(+) w porównaniu do 16% niemetaplastycznych BC. Zarówno BC metaplastyczny, jak i TNBC miały prawie dwukrotnie większy odsetek guzów stopnia 3 w porównaniu z innymi BC (odpowiednio 71%, 77% i 35%, P<0,001), a BC metaplastyczny miał niższy odsetek LVSI w porównaniu z TNBC i innymi BC (odpowiednio 13%, 20% i 24%, P<0,001).
Charakterystyka pacjentów i leczenia.
| Charakterystyka | Metaplastyczny BC, No. (%) | Triple-Negative BC, No. (%) | Other BC, No. (%) | P Value |
|---|---|---|---|---|
| Mediana wieku, lata (zakres) | 62 (22-90) | 59 (18-90) | <0.001 | |
| Rasa | ||||
| Biały | 1623 (77.9) | 41791 (74.6) | 158406 (83.7) | <0,001 |
| Czarny | 368 (17,7) | 11771 (21) | 20722 (10,9) | |
| Inny | 80 (3.8) | 2041 (3.6) | 8507 (4.5) | |
| Nieznane | 13 (0.6) | 395 (0.7) | 1638 (0.9) | |
| Comorbidity score | ||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | |
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | |
| Dochód mediany | ||||
| <$30,000 | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | |
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | |
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | |
| Nieznany | 63 (3) | 1673 (3) | 6165 (3.3) | |
| Ubezpieczenie medyczne | ||||
| Prywatne | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 |
| Medicaid | 154 (7.4) | 4716 (8.4) | 13267 (7) | |
| Medicare | 862 (41.4) | 18355 (32.8) | 61535 (32.5) | |
| Inne | 19 (0.9) | 665 (1.2) | 2212 (1.2) | |
| Nieubezpieczeni | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | |
| Nieznani | 31 (1.5) | 577 (1) | 2257 (1.2) | |
| Typ powiatu | ||||
| Metropolitalny | 1720 (82.5) | 46252 (82.6) | 157058 (83) | 0,152 |
| Miejski | 271 (13) | 7456 (13.3) | 24367 (12.9) | |
| Wieś | 43 (2.1) | 951 (1.7) | 3219 (1.7) | |
| Nieznany | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | |
| Typ placówki | ||||
| Akademicka | 668 (32.1) | 16117 (28,8) | 52120 (27,5) | <0,001 |
| Nieakademickie | 1318 (63,2) | 35472 (63,3) | 126101 (66.6) | |
| Nieznany | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Lokalizacja placówki | ||||
| Środkowy Zachód | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 |
| Północny Wschód | 410 (19.7) | 10411 (18.6) | 37787 (20) | |
| Południe | 716 (34.4) | 20595 (36.8) | 66519 (35.1) | |
| Zachód | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | |
| Nieznany | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | |
| Stopień zaawansowania klinicznego choroby | ||||
| I | 639 (30.7) | 25843 (46.1) | 102257 (54) | <0,001 |
| II | 1215 (58.3) | 23912 (42.7) | 70846 (37.4) | |
| III | 201 (9.6) | 5579 (10) | 14283 (7.5) | |
| IV | 29 (1.4) | 664 (1.2) | 1887 (1) | |
| Kliniczny status T | ||||
| cT0 | 5 (0.2) | 131 (0,2) | 341 (0,2) | <0,001 |
| cT1 | 674 (32,3) | 28452 (50,8) | 113113 (59.8) | |
| cT2 | 1026 (49.2) | 21530 (38.4) | 61145 (32.3) | |
| cT3 | 252 (12.1) | 3702 (6.6) | 10061 (5.3) | |
| cT4 | 127 (6.1) | 2183 (3.9) | 4613 (2.4) | |
| Stan kliniczny N | ||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0.001 |
| cN1 | 224 (10.7) | 9659 (17.2) | 30427 (16.1) | |
| cN2 | 51 (2.4) | 1804 (3.2) | 5414 (2.9) | |
| cN3 | 22 (1.1) | 1178 (2.1) | 2542 (1.3) | |
| Stopień patologiczny | ||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | |
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | |
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | |
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | |
| Patologiczny status T | ||||
| pTis | 7 (0.3) | 432 (0,8) | 1862 (1) | <0,001 |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2.1) | |
| pT1 | 634 (30.4) | 29055 (51.9) | 106130 (56.1) | |
| pT2 | 1017 (48.8) | 18530 (33.1) | 63484 (33.5) | |
| pT3 | 290 (13.9) | 2540 (4.5) | 10588 (5.6) | |
| pT4 | 93 (4.5) | 1097 (2) | 2892 (1.5) | |
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | |
| Stan patologiczny N | ||||
| pN0 | 1705 (81.9) | 41587 (74,3) | 113787 (60,2) | <0,001 |
| pN1 | 284 (13.6) | 9725 (17.4) | 51483 (27.2) | |
| pN2 | 66 (3.2) | 3031 (5.4) | 16111 (8.5) | |
| pN3 | 27 (1.3) | 1607 (2.9) | 7685 (4.1) | |
| Grupa receptorów | ||||
| HR(+)/HER2(-.) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 |
| Potrójnie ujemny | 1604 (77) | 55998 (100) | 0 (0) | |
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | |
| Nieznany | 49 (2.4) | 0 (0) | 6860 (3.6) | |
| Stopień zaawansowania nowotworu | ||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | |
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | |
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | |
| Nieznany | 284 (13.6) | 3030 (5.4) | 11186 (5,9) | |
| LVSI | ||||
| Nie występuje | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0,001 |
| Obecny | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | |
| Nieznany | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | |
| Typ operacji | ||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 |
| Mastektomia | 1200 (57,6) | 26561 (47,4) | 95910 (50.7) | |
| Bez operacji | 8 (0.4) | 295 (0.5) | 1341 (0,7) | |
| Chirurgia szczękowa | ||||
| Bez operacji | 47 (2.3) | 1034 (1.8) | 4433 (2.3) | <.001 |
| SLND | 1353 (64.9) | 34880 (62.3) | 109718 (58) | |
| ALND | 666 (32) | 19229 (34.3) | 73181 (38.7) | |
| Nieznany | 18 (0.9) | 855 (1.5) | 1941 (1) | |
| Promieniowanie | ||||
| Tak | 1087 (52.2) | 33938 (60,6) | 109268 (57,7) | <.001 |
| Nie | 989 (47,5) | 21860 (39) | 79375 (41.9) | |
| Nieznany | 8 (0.4) | 200 (0.4) | 630 (0.3) | |
| Cele radioterapii | ||||
| Tylko pierś/CW | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 |
| Pierś/CW + węzły regionalne | 284 (26.1) | 9234 (27.2) | 36858 (33.7) | |
| Chemioterapia | ||||
| Tak | 1571 (75.4) | 44321 (79,1) | 133965 (70,8) | <0,001 |
| Nie | 499 (23.9) | 11195 (20) | 53062 (28) | |
| Nieznany | 14 (0,7) | 482 (0,9) | 2246 (1.2) | |
| Sekwencja chemioterapii do operacji | ||||
| Adiuwant | 1241 (59,5) | 31519 (56.3) | 116645 (61,6) | <0,001 |
| Neoadjuwant | 324 (15.5) | 12581 (22.5) | 16717 (8.8) | |
| Brak | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | |
| Hormonoterapia | ||||
| Tak | 220 (10.6) | 1178 (2.1) | 103906 (54.9) | <0.001 |
| Nie | 1798 (86.3) | 53274 (95.1) | 76820 (40.6) | |
| Nieznany | 66 (3.2) | 1546 (2.8) | 8547 (4.5) | |
| Rok postawienia diagnozy | ||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | |
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | |
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | |
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19,3) |
Skróty: BC, rak piersi; ALND, axillary lymph node dissection; BCS, breast conserving surgery; CW, chest wall; HER2, human epidermal growth factor receptor; HR, hormone receptor; LVSI, lymphovascular invasion; SLND, sentinel lymph node dissection.
Treatment by Breast Cancer Type
Większość chorych (99%) poddano onkologicznej operacji piersi, w tym chirurgicznej ocenie pachy (97%). Mastektomia była częściej stosowana w grupie metaplastycznego BC (58% vs. 47% TNBC vs. 51% innego BC, P<0,001), podobnie jak SLND (65% vs. 62% TNBC vs. 58% innego BC; P<0,001). Regionalne napromienianie węzłów było częściej stosowane jako część leczenia w przypadku innych BC niż w przypadku metaplastycznego BC i TNBC (odpowiednio 26%, 27% i 34%; P<0,001).
W odniesieniu do leczenia systemowego, chemioterapia neoadjuwantowa była stosowana prawie dwukrotnie częściej w przypadku metaplastycznego BC i TNBC niż w przypadku innych BC (16%, 23%, 9%; P<0,001), a około jedna czwarta wszystkich kobiet nie otrzymała żadnej chemioterapii. Hormonoterapia była stosowana najrzadziej w przypadku TNBC (2%), ale stanowiła część paradygmatu leczenia w 11% przypadków metaplastycznego BC i 55% przypadków innych BC.
Analiza przeżycia
Mediana czasu obserwacji wyniosła 44,5 miesiąca. Pacjenci z metaplastycznym BC mieli znamiennie gorsze nieskorygowane OS niezależnie od stopnia zaawansowania klinicznego (ryc. 2). Szacunkowe 5-letnie OS dla pacjentów z metaplastycznym BC, TNBC i innym BC w stadium I choroby wynosiło 85%, 87% i 91%; w stadium II – 73%, 77% i 87%; a w stadium III – 43%, 53% i 75% (P<0,001). Wskaźniki 3-letniego OS dla pacjentów z chorobą przerzutową były 2-4 razy wyższe w grupach TNBC i innych BC i wynosiły odpowiednio 30% i 64% w porównaniu z 15% dla BC metaplastycznego (P<0,001). Analizowano również przeżycia w zależności od podtypu molekularnego (ryc. 3). Wśród pacjentów z metaplastycznym BC, nie stwierdzono różnic w OS w zależności od podtypu molekularnego (HR(+)/HER2(-), HER2(+) lub tn-metaplastyczne BC) (P=0,778). Z kolei w przypadku BC niemetaplastycznego, podtyp potrójnie ujemny wiązał się z gorszym OS niż podtypy HER+ i HR(+)/HER2(-) (P<0,001). Rasa również nie wydawała się być związana z przeżyciem wśród pacjentów z metaplastycznym BC (5-letnie wskaźniki OS 73% dla białych vs. 74% dla czarnych, P=0,876), podczas gdy rasa była związana z OS zarówno w grupie TNBC (P<0,001), jak i innych grupach BC (P<0,001; Ryc. 4).
Overall survival curves of breast cancer types by clinical stage, examining metaplastic, triple negative, and other breast cancers. Skróty: MBC, metaplastyczny rak piersi.
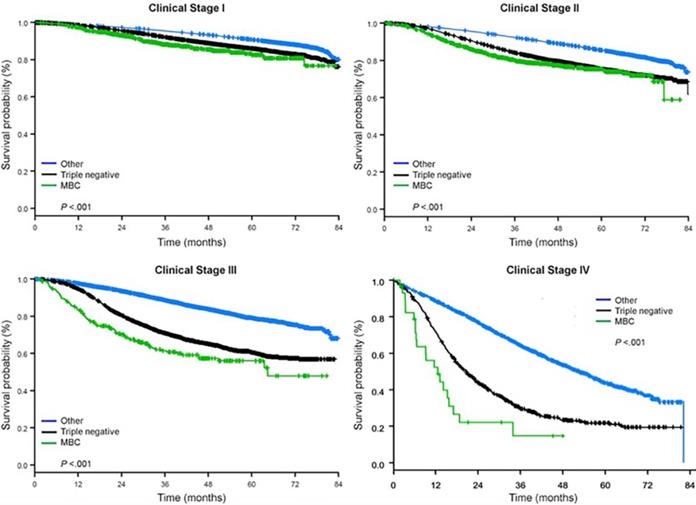 (Kliknij na obraz, aby powiększyć.)
(Kliknij na obraz, aby powiększyć.)
Krzywe przeżycia całkowitego chorych na metaplastycznego i niemetaplastycznego raka piersi stratyfikowane według statusu receptora. Skróty: HER2, receptor 2 ludzkiego naskórkowego czynnika wzrostu; HR, receptor hormonalny; MBC, metaplastyczny rak piersi.
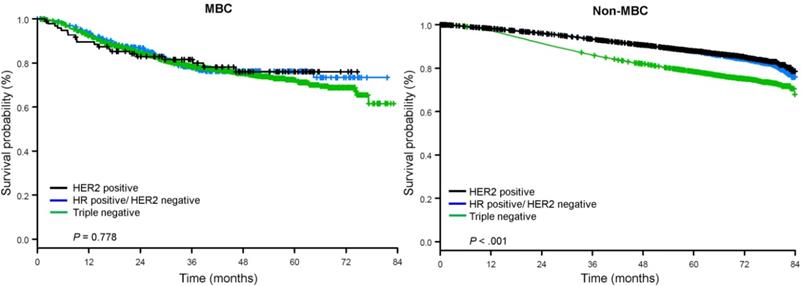 (Kliknij na obraz, aby powiększyć.)
(Kliknij na obraz, aby powiększyć.)
Krzywe przeżycia całkowitego dla pacjentów z metaplastycznym, potrójnie ujemnym i innym rakiem piersi stratyfikowanych według rasy. Skróty: BC, breast cancer.
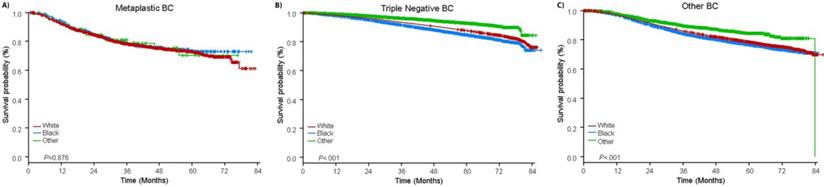 (Kliknij na obraz, aby powiększyć.)
(Kliknij na obraz, aby powiększyć.)
Wielozmienna analiza czynników związanych z przeżyciem całkowitym dla pacjentek z metaplastycznym BC.
| Factors Associated with Overall Survival in Metaplastic BC | |||
|---|---|---|---|
| Variable (Reference) | Hazard Ratio (95% Confidence Interval) | P Value | |
| Age | Per year increase | 1.024 (1,015-1,033) | <0,0001 |
| Inwazja limfowaskularna (brak) | Występowanie | 1,307 (1,017-1,679) | 0.0364 |
| Clinical N Status (cN0) | cN+ | 1.758 (1.328-2.326) | <0.0001 |
| Clinical T Status (cT1) | cT0 | 2,226 (0,301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3,029 (2,183-4,204) | ||
| cT4 | 3.145 (2,124-4,657) | ||
| Clinical M Status (cM0) | cM1 | 3,330 (2.020-5.488) | <0.0001 |
| Chirurgia osiowa (SLND) | ALND | 1.333 (1.065-1.670) | 0.0247 |
| No Surgery | 1.538 (0.884-2,675) | ||
| Radioterapia (Nie) | Tak | 0,709 (0.572-0,878) | 0,0016 |
| Chemoterapia (Nie) | Tak | 0,579 (0,446-0,752) | <0,0001 |
Skróty: ALND, Axillary lymph node dissection; BC, breast cancer; SLND, sentinel lymph node dissection.
W analizie wielowariantowej rosnący wiek, wyższa kliniczna klasyfikacja T, obecność klinicznej choroby węzłowej lub LVSI oraz leczenie za pomocą ALND wszystkie korelowały z gorszymi wynikami u chorych na metaplastyczne BC, TNBC i inne BC (tabela dodatkowa 1). Dodanie chemioterapii i radioterapii niezależnie od typu raka piersi niezależnie poprawiało OS. Inne cechy pacjenta i guza związane z przeżyciem w TNBC i innym BC, w tym rasa, choroby współistniejące i stopień zaawansowania nowotworu, nie były związane z wynikami przeżycia w przypadku metaplastycznego BC w analizie wieloczynnikowej.
Zważywszy na stosunkowo złe wyniki wśród pacjentów z metaplastycznym BC, przeprowadzono analizy podgrup w grupie metaplastycznego BC, aby ocenić, czy jakiekolwiek metody leczenia były związane z lepszymi wynikami. Po skorygowaniu o status węzłowy (cN0 vs. N+), leczenie bardziej agresywną operacją pachową (ALND vs. SLND) wiązało się z gorszymi wynikami, co było zjawiskiem obserwowanym również w grupie TNBC i innych BC (Tabela 2). Wśród chorych poddanych radioterapii napromienianie regionalnych węzłów chłonnych vs napromienianie tylko piersi lub tylko ściany klatki piersiowej nie miało istotnego wpływu na wyniki leczenia u chorych z metaplastycznym BC (P=0,077 i 0,200 odpowiednio dla klinicznego N0 i N+). Zastosowanie chemioterapii neoadiuwantowej wiązało się z gorszymi wynikami niż chemioterapia adiuwantowa wśród chorych na metaplastycznego BC z węzłami klinicznymi (HR 1,9, 95% CI 1,3-2,6, P<0.001), ale nie u chorych z klinicznie węzłowo-dodatnim metaplastycznym BC (P=0,43).
Dyskusja
Metaplastyczny rak piersi jest rzadką, ale szczególnie agresywną postacią raka piersi, zwłaszcza w porównaniu z innymi podtypami nowotworów piersi. Ta jednostka chorobowa jest stosunkowo słabo reprezentowana w literaturze. Obszerne poszukiwania przeprowadzone przez Raysona i wsp. w publikacjach z lat 1966-1997 przyniosły w sumie tylko 27 przypadków. Duże narodowe bazy danych, takie jak NCDB, są korzystne dla badania rzadkich nowotworów, takich jak metaplastyczny BC. Jednak częstość rozpoznawania metaplastycznego BC w Stanach Zjednoczonych według tych baz danych jest nadal niska i wynosi mniej niż 500 przypadków rocznie. W naszym badaniu stwierdziliśmy, że metaplastyczny BC był najczęściej diagnozowany jako duży guz z niekorzystnymi cechami ryzyka, takimi jak słabo zróżnicowany stopień guza i status receptora potrójnie ujemnego. Pacjenci z metaplastycznym BC mieli znacząco gorsze przeżycie niezależnie od stadium w momencie rozpoznania w porównaniu z potrójnie ujemnymi i innymi BC. Otrzymanie chemioterapii i radioterapii były niezależnymi czynnikami predykcyjnymi lepszego OS, ale sekwencjonowanie chemioterapii wydawało się wpływać na wyniki, szczególnie w przypadku pacjentów z metaplastycznym BC bez klinicznego zajęcia węzłów, uznając, że niektórzy z tych pacjentów mieli patologiczne zajęcie węzłów. Nasze wyniki mogą jednak odzwierciedlać potencjalną heterogenność mechanizmów biologicznych leżących u podstaw odpowiedzi na leczenie w tej szczególnej grupie pacjentów z BC i podkreślają potrzebę lepszej stratyfikacji ryzyka i opcji terapii systemowej w celu poprawy wyników.
Mimo że większość metaplastycznych BC ma fenotyp potrójnie ujemny, zachowanie metaplastycznych BC wydaje się być wyjątkowe w porównaniu z innymi TNBC. TNBC ma tendencję do gorszego rokowania niż inne typy BC, a koncepcja, że metaplastyczny BC jest bardziej agresywny niż TNBC została potwierdzona przez wiele mniejszych, retrospektywnych badań. Badania te wykazały podobne wzorce diagnozowania w zaawansowanych stadiach zaawansowania dla metaplastycznego BC w porównaniu z TNBC, ze względu na wyższy odsetek choroby cT3-4, a nie zajęcia węzłów, a w przeglądzie 46 przypadków metaplastycznego BC przeprowadzonym przez jeden ośrodek, pacjenci z metaplastycznym BC mieli znacząco wyższe ryzyko miejscowego nawrotu choroby (30% vs. 15%; P=0,004). Cechy te ostatecznie korelowały z gorszymi wskaźnikami 5-letniego przeżycia wolnego od choroby (30% vs. 90%; P<0,001) i OS (65% vs. 87%; P=0,002) dla pacjentów z metaplastycznym BC w porównaniu z TNBC. Badanie Surveillance Epidemiology and End Results obejmujące 1112 pacjentów z metaplastycznym BC również wykazało gorsze wskaźniki przeżycia swoistego dla nowotworu w ciągu 3 lat dla metaplastycznego BC niż dla TNBC (78% vs. 84%). Badając tn-metaplastyczny BC, Li i wsp. stwierdzili gorsze przeżycie wolne od choroby (HR 1,48, 95% CI 1,19-1,84, P<0,01) i OS (HR 1,42 ; P<0,01) dla tn-metaplastycznego BC w porównaniu z TNBC. Nasze badanie, obejmujące jedną z największych dotychczas grup chorych z metaplastycznym BC (n=2,084), wzmacnia te ustalenia i podkreśla, że status receptorowy nie jest niezależnym predyktorem przeżycia dla metaplastycznego BC (P=0.778), tak jak w przypadku niemetaplastycznego BC.
Krytycznym elementem terapeutycznym związanym z poprawą wyników u wszystkich pacjentów z metaplastycznym BC w naszym badaniu było zastosowanie chemioterapii (HR 0,58, 95% CI 0,45-0,75, P<0,001). Nasze doniesienie jest pierwszym, według naszej wiedzy, opisem wyników u chorych na metaplastycznego BC w oparciu o sekwencjonowanie chemioterapii. Co uderzające, nasza subanaliza wykazała, że szczególnie u pacjentów z cN0 metaplastycznym BC, chemioterapia neoadjuwantowa wiązała się z gorszym OS w porównaniu z chemioterapią adjuwantową (HR 1,88, 95% CI 1,34-2,64, P<0,001), podczas gdy sekwencjonowanie chemioterapii nie miało wpływu na klinicznie węzłowe metaplastyczne BC. Jednym z możliwych wyjaśnień tego zjawiska może być fakt, że nasi pacjenci z metaplastycznym BC mieli wyższy status kliniczny T, który w innych doniesieniach był związany z niższym odsetkiem patologicznych odpowiedzi całkowitych i późniejszym gorszym wynikiem przeżycia. Co więcej, kliniczne metody stagingowe (tj. samo badanie fizykalne, włączenie ultrasonografii) mogą wprowadzać heterogeniczność w klinicznej populacji N0 poprzez pominięcie prawdziwego obciążenia chorobą węzłową, co samo w sobie może być związane z gorszymi wynikami. Ogólnie, odpowiedź na chemioterapię neoadiuwantową w metaplastycznym BC wynosi zaledwie 18%, co jest znacznie niższe niż znane wskaźniki odpowiedzi dla TNBC na schematy chemioterapii oparte na antracyklinach i taksanach.
Based on the poorer survival and relatively rapid development of distant metastatic spread compared to other breast cancer subtypes noted in our study and in other reports, the need for better systemic therapy options is clearly evident for metaplastic BC. Profilowanie transkrypcyjne wykazało, że ten podtyp nowotworu wykazuje cechy nowotworzenia podobne do komórek macierzystych, częste aberracje w szlaku PI3K/AKT/mTOR i nadekspresję czynnika wzrostu śródbłonka naczyniowego (VEGF). Cechy te są podobne do tych, które stwierdza się w mezenchymalnych TNBC. Prowadzone są obiecujące badania mające na celu zidentyfikowanie alternatywnych schematów terapii systemowej dla tych chorych, w tym ostatnie badanie I fazy, w którym wykazano poprawę wskaźników obiektywnej odpowiedzi na liposomalną doksorubicynę, bevacizumab (przeciwciało monoklonalne przeciwko VEGF-A) i ewerolimus (inhibitor mTOR) u chorych na metaplastyczne TNBC z aberracją szlaku PI3K.
W odniesieniu do leczenia miejscowego, mastektomia była częściej stosowana w naszym badaniu w przypadku metaplastycznego BC, ale nie wiązała się z poprawą przeżycia w stosunku do chirurgii zachowawczej piersi. Nie wykazano również korzyści w zakresie przeżycia w przypadku leczenia obejmującego ALND w porównaniu z SLND. Radioterapia była jednak istotnym czynnikiem prognostycznym przeżycia, przy czym prawdopodobieństwo zgonu chorych na metaplastyczne BC leczonych radioterapią adiuwantową było o 30% mniejsze niż chorych, którzy nie otrzymali radioterapii. Istotne ograniczenia w naszej analizie radioterapii obejmują nieznane szczegóły dotyczące planowania leczenia, wybranej modalności, zapewnienia jakości lub tego, czy stosowano takie techniki, jak głębokie wstrzymanie oddechu wdechowego. Podczas gdy nawrót lokoregionalny nie może być zbadany w NCDB, instytucjonalna seria 113 pacjentów z metaplastycznym BC (54%, którzy otrzymali radioterapię) wykazała, że napromienianie było jedynym czynnikiem, który korelował ze zmniejszeniem nawrotu lokoregionalnego (ryzyko względne bez napromieniania 3.1; 95% CI 1,13-9,88, P=0,027).
Nasze wyniki należy interpretować z ostrożnością, biorąc pod uwagę poważne ograniczenia wynikające z braku wiedzy na temat tego, jakie schematy chemioterapii były stosowane, czasu trwania leczenia lub odpowiedzi na chemioterapię neoadjuwantową, ponieważ informacje te są niedostępne w NCDB. Zdajemy sobie również sprawę z ograniczeń kliniczno-patologicznych czynników ryzyka uchwyconych w NCDB, bez których może nie być możliwe pełne scharakteryzowanie różnic klinicznych, które napędzają niektóre z różnic w wynikach, które znaleźliśmy, takie jak gorsze wyniki przeżycia z ALND nawet przy kontroli statusu węzłów chłonnych. Chociaż nasza próba pacjentów z metaplastycznym BC była niewielka w porównaniu z badaniami dotyczącymi BC niemetaplastycznego, paradoksalnie jest to prawdopodobnie największe istniejące badanie analizujące to zagadnienie, biorąc pod uwagę ograniczoną liczbę pacjentów z metaplastycznym BC zgłoszonych w seriach instytucjonalnych. Potrzebne są dodatkowe badania w celu zrozumienia biologicznej predylekcji do rozsiewu przerzutów w metaplastycznym BC i potwierdzenia naszych ustaleń w oddzielnych zbiorach danych pacjentów z metaplastycznym BC.
Nasz obecny standard opieki wyraźnie nie jest odpowiedni dla tej wyjątkowej populacji nowotworów, a uzyskanie randomizowanych danych dotyczących metaplastycznego BC w przyszłości będzie wymagało współpracy ze względu na małą liczbę pacjentów. NCDB zapewnia godną uwagi zaletę, jaką jest możliwość badania schematów leczenia i wyników związanych z rzadkim rozpoznaniem. Z 2 084 osobami z metaplastycznym BC w tej kohorcie, jest to jedno z największych badań dotyczących metaplastycznego BC, jakie przeprowadzono w obecnych czasach. Przeżywalność tych pacjentów jest niska w porównaniu z innymi typami BC i chociaż fakt ten prawdopodobnie skłania do włączenia agresywnej terapii, nasze badanie sugeruje, że bardziej rozległe leczenie miejscowo-regionalne (np. ALND lub napromienianie węzłów regionalnych) powinno być starannie rozważane w każdym przypadku indywidualnie. Ogólnie rzecz biorąc, stosowanie terapii systemowej jest kluczowe w leczeniu metaplastycznego BC niezależnie od obciążenia węzłowego, a rozwój skutecznych terapii celowanych opartych na analizie profilowania genomowego guza jest obiecujący w przyszłości.
Materiały uzupełniające
![]()
Tabela uzupełniająca.
Podziękowania
Szczególne podziękowania dla Christine Wogan za pomoc redakcyjną.
Funding
Supported in part by Cancer Center Support (Biostatistics Core) Grant CA016672 from the National Cancer Institute, National Institutes of Health, to The University of Texas MD Anderson Cancer Center.
Competing Interests
Autorzy zadeklarowali brak konkurencyjnych interesów.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Breast carcinoma-rare types: review of the literature. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast: clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Worse prognosis of metaplastic breast cancer patients than other patients with triple-negative breast cancer. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Metaplastyczne raki piersi: V. Metaplastic carcinoma with osteoclastic giant cells. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Metaplastic carcinoma of the breast. I. Matrix-producing carcinoma. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastic carcinomas of the breast. II. Spindle cell carcinoma. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastic breast cancer: clinicopathological features and its prognosis. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Prognosis in different subtypes of metaplastic breast cancer: a population-based analysis. Breast Cancer Res Treat. October. 2018
10. Krajowa Baza Danych o Nowotworach.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Factors Determining Adequacy of Axillary Node Dissection in Breast Cancer Patients. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Lymph-node dissection in breast cancer. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Statistical Methods for the Analysis of Biomedical Data. New York, USA: John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Nonparametric Estimation from Incomplete Observations NONPARAMETRIC ESTIMATION FROM INCOMPLETE OBSERVATIONS*. Źródło J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modele regresji i tablice trwania życia. Cox Life Tables. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Metaplastic breast cancer: prognosis and response to systemic therapy. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. The National Cancer Data Base: a powerful initiative to improve cancer care in the United States. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients: A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Triple-negative breast cancer in African-American women: disparities versus biology. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Prognostic markers in triple-negative breast cancer. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Breast Cancer Epidemiology and Risk Factors. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. The Clinicopathological Features and Survival Outcomes of Different Histological Subtypes in Triple-negative Breast Cancer. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Metaplastic Carcinoma of the Breast Is More Aggressive Than Triple-negative Breast Cancer: A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer: the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effect of preoperative chemotherapy on local-regional disease in women with operable breast cancer: findings from National Surgical Adjuvant Breast and Bowel Project B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Lack of efficacy to systemic chemotherapy for treatment of metaplastic carcinoma of the breast in the modern era. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identification of prognosis-relevant subgroups in patients with chemoresistant triple-negative breast cancer. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Comparative Effectiveness of an mTOR-Based Systemic Therapy Regimen in Advanced, Metaplastic and Nonmetaplastic Triple-Negative Breast Cancer. Oncologist. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold: Techniques and Advantages for Cardiac Sparing During Breast Cancer Irradiation. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Review of deep inspiration breath-hold techniques for the treatment of breast cancer. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Predictive factors on outcomes in metaplastic breast cancer. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Metaplastic carcinoma of the breast: Rokowanie i odpowiedź na leczenie systemowe w chorobie przerzutowej. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Adjuvant Treatment of Triple-Negative Metaplastic Breast Cancer With Weekly Paclitaxel and Platinum Chemotherapy: Retrospective Case Review From a Single Institution. Clin Breast Cancer. May. 2019
Kontakt z autorem
.