Nazwa ogólna: lidokainy chlorowodorek
Postać dawkowania: roztwór doustny
Wyłącznie na receptę
Leki miejscowo znieczulające błony śluzowe jamy ustnej i gardła.
Zgłaszano po wprowadzeniu produktu do obrotu przypadki drgawek, zatrzymania krążenia i zgonu u pacjentów w wieku poniżej 3 lat w związku ze stosowaniem produktu Lidocaine Viscous 2%, gdy nie był on podawany ściśle według zaleceń dotyczących dawkowania i podawania. W przypadku bólu związanego z ząbkowaniem, generalnie nie należy stosować produktu Lidocaine Viscous 2%. W innych stanach chorobowych stosowanie produktu u pacjentów w wieku poniżej 3 lat powinno być ograniczone do sytuacji, w których bezpieczniejsze alternatywy nie są dostępne lub były próbowane, ale nie przyniosły rezultatu.
W celu zmniejszenia ryzyka poważnych zdarzeń niepożądanych związanych ze stosowaniem produktu Lidocaine Viscous 2% należy poinstruować opiekunów, aby ściśle przestrzegali przepisanej dawki i częstości podawania leku oraz bezpiecznie przechowywali butelkę z receptą w miejscu niedostępnym dla dzieci.
- OPIS
- Lidokaina Roztwór doustny do stosowania miejscowego – Farmakologia kliniczna
- Mechanizm działania
- Hemodynamika
- Farmakokinetyka i metabolizm
- Wskazania i stosowanie lidokainy w postaci roztworu doustnego do stosowania miejscowego
- Przeciwwskazania
- Ostrzeżenia
- Zagrażające życiu i śmiertelne zdarzenia u niemowląt i małych dzieci
- Methemoglobinemia
- Środki ostrożności
- Informacje dla pacjentów
- Ogólne
- Interakcje lekowe
- Karcynogeneza, mutageneza, upośledzenie płodności
- Ciąża
- Karmiące matki
- Stosowanie u dzieci
- Działania niepożądane
- Centralny układ nerwowy
- Przedawkowanie
- Postępowanie w nagłych przypadkach związanych ze stosowaniem środków znieczulenia miejscowego
- DAWKOWANIE I ADMINISTRACJA
- Dorośli
- Pediatryczny
- Jak podawać
- Package/Label Display Panel
- Package/Label Display Panel
OPIS
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) zawiera środek miejscowo znieczulający i jest podawany miejscowo. Lidokaina Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) zawiera lidokainy chlorowodorek, który jest chemicznie oznaczony jako acetamid, 2-(dietyloamino)-N-(2,6-dimetylofenylo)-,monohydrochlorowodorek i ma następujący wzór strukturalny:
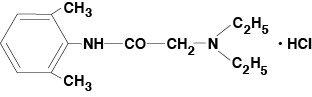
Wzór cząsteczkowy lidokainy to C14H22N2O. Masa cząsteczkowa wynosi 234,34.
Skład roztworu:
Każdy mL zawiera 20 mg (2%) lidokainy chlorowodorku USP oraz następujące składniki nieaktywne: sól sodowa karboksymetylocelulozy, aromat, metyloparaben, propyloparaben, woda oczyszczona i sacharyna sodowa.
Lidokaina Roztwór doustny do stosowania miejscowego – Farmakologia kliniczna
Mechanizm działania
Lidokaina stabilizuje błonę komórkową neuronów poprzez hamowanie przepływów jonowych wymaganych do inicjacji i przewodzenia impulsów, przez co wywołuje miejscowe działanie znieczulające.
Hemodynamika
Nadmierne stężenie we krwi może powodować zmiany w rzucie serca, całkowitym oporze obwodowym i średnim ciśnieniu tętniczym. Zmiany te można przypisać bezpośredniemu działaniu depresyjnemu miejscowego środka znieczulającego na różne elementy układu sercowo-naczyniowego. Efektem netto jest zwykle umiarkowane niedociśnienie, gdy zalecane dawki nie są przekraczane.
Farmakokinetyka i metabolizm
Lidokaina jest wchłaniana po podaniu miejscowym na błony śluzowe, przy czym szybkość i zakres wchłaniania zależy od stężenia i całkowitej podanej dawki, konkretnego miejsca zastosowania i czasu trwania ekspozycji. Ogólnie rzecz biorąc, szybkość wchłaniania środków znieczulenia miejscowego po podaniu miejscowym jest największa po podaniu dotchawiczym. Lidokaina jest również dobrze wchłaniana z przewodu pokarmowego, ale niewiele nienaruszonego leku pojawia się w krążeniu z powodu biotransformacji w wątrobie. Wiązanie lidokainy w osoczu jest zależne od stężenia leku, a frakcja związana zmniejsza się wraz ze wzrostem stężenia. Przy stężeniach 1 do 4 mcg wolnej zasady na mL, 60 do 80 procent lidokainy wiąże się z białkami. Wiązanie zależy również od stężenia w osoczu glikoproteiny alfa-1-kwasowej.
Lidokaina przekracza barierę krew-mózg i barierę łożyskową, przypuszczalnie na drodze dyfuzji biernej.
Lidokaina jest szybko metabolizowana przez wątrobę, a metabolity i niezmieniony lek są wydalane przez nerki. Biotransformacja obejmuje oksydacyjną N-dealkilację, hydroksylację pierścienia, rozszczepienie wiązania amidowego i koniugację. N-dealkilacja, główny szlak biotransformacji, prowadzi do powstania metabolitów: monoetyloglicynoksylidynu i glicynoksylidynu. Działania farmakologiczne/toksykologiczne tych metabolitów są podobne do działania lidokainy, ale mniej silne niż lidokainy. Około 90% podanej lidokainy jest wydalane w postaci różnych metabolitów, a mniej niż 10% jest wydalane w postaci niezmienionej. Podstawowym metabolitem w moczu jest koniugat 4-hydroksy-2, 6-dimetyloaniliny.
Eliminacyjny okres półtrwania lidokainy po podaniu dożylnym w postaci bolusa wynosi zwykle 1,5 do 2 godzin. Ze względu na szybkie tempo, w jakim lidokaina jest metabolizowana, każdy stan, który wpływa na czynność wątroby może zmieniać kinetykę lidokainy. Okres półtrwania może być wydłużony dwukrotnie lub więcej u pacjentów z zaburzeniami czynności wątroby. Zaburzenia czynności nerek nie wpływają na kinetykę lidokainy, ale mogą zwiększać kumulację metabolitów.
Czynniki takie jak kwasica oraz stosowanie środków pobudzających i depresyjnych OUN wpływają na stężenie lidokainy w OUN wymagane do wywołania jawnych działań ogólnoustrojowych. Obiektywne objawy niepożądane stają się coraz bardziej widoczne wraz ze wzrostem stężenia w osoczu krwi żylnej powyżej 6 mcg wolnej zasady na mL. U małpy rhesus wykazano, że stężenie we krwi tętniczej wynoszące od 18 do 21 mcg/mL stanowi wartość progową dla aktywności konwulsyjnej.
Wskazania i stosowanie lidokainy w postaci roztworu doustnego do stosowania miejscowego
Lidokaina jest wskazana do stosowania w celu znieczulenia miejscowego podrażnionych lub zmienionych zapalnie błon śluzowych jamy ustnej i gardła. Jest również przydatna do zmniejszania uczucia knebla podczas wykonywania zdjęć rentgenowskich i wycisków dentystycznych.
Przeciwwskazania
Lidokaina jest przeciwwskazana u pacjentów ze stwierdzoną w wywiadzie nadwrażliwością na środki miejscowo znieczulające typu amidowego lub na inne składniki roztworu.
Ostrzeżenia
DAWKOWANIE EKSPRESYWNE LUB KRÓTKIE PRZERWY MIĘDZY DAWKAMI, MOGĄ POWODOWAĆ WYSOKIE POZIOMY PLASTYCZNE I POWAŻNE DZIAŁANIA NIEPOŻĄDANE. PACJENTÓW NALEŻY POINSTRUOWAĆ, ABY ŚCIŚLE PRZESTRZEGALI ZALECANYCH DAWEK I ZALECEŃ DOTYCZĄCYCH PODAWANIA, PRZEDSTAWIONYCH W NINIEJSZEJ ULOTCE DOŁĄCZONEJ DO OPAKOWANIA. Postępowanie w przypadku wystąpienia poważnych reakcji niepożądanych może wymagać zastosowania sprzętu do resuscytacji, tlenu i innych leków resuscytacyjnych.
Lidokainę należy stosować z zachowaniem szczególnej ostrożności, jeśli błona śluzowa w miejscu podania uległa urazowi, ponieważ w takich warunkach istnieje możliwość szybkiego wchłaniania ogólnoustrojowego.
Zagrażające życiu i śmiertelne zdarzenia u niemowląt i małych dzieci
Postmarketingowe przypadki drgawek, zatrzymania krążenia i śmierci u pacjentów w wieku poniżej 3 lat zostały zgłoszone w związku ze stosowaniem produktu Lidocaine Viscous 2%, gdy nie był on podawany w ścisłej zgodności z zaleceniami dotyczącymi dawkowania i podawania. W przypadku bólu związanego z ząbkowaniem, generalnie nie należy stosować produktu Lidocaine Viscous 2%. W innych stanach chorobowych stosowanie produktu u pacjentów w wieku poniżej 3 lat powinno być ograniczone do sytuacji, w których bezpieczniejsze alternatywy nie są dostępne lub zostały wypróbowane, ale zawiodły.
Methemoglobinemia
Zgłaszano przypadki methemoglobinemii w związku ze stosowaniem środków znieczulenia miejscowego. Chociaż wszyscy pacjenci są narażeni na ryzyko wystąpienia methemoglobinemii, pacjenci z niedoborem dehydrogenazy glukozo-6-fosforanowej, wrodzoną lub idiopatyczną methemoglobinemią, niewydolnością serca lub płuc, niemowlęta w wieku poniżej 6 miesięcy i jednoczesną ekspozycją na czynniki utleniające lub ich metabolity są bardziej podatni na wystąpienie objawów klinicznych tego stanu. Jeśli u tych pacjentów konieczne jest zastosowanie środków znieczulenia miejscowego, zaleca się ścisłe monitorowanie objawów i oznak methemoglobinemii.
Objawy methemoglobinemii mogą wystąpić natychmiast lub mogą być opóźnione o kilka godzin po ekspozycji i charakteryzują się siniczym odbarwieniem skóry i (lub) nieprawidłowym zabarwieniem krwi. Poziom methemoglobiny może nadal wzrastać; dlatego też wymagane jest natychmiastowe leczenie w celu uniknięcia poważniejszych działań niepożądanych ze strony ośrodkowego układu nerwowego i układu krążenia, w tym drgawek, śpiączki, zaburzeń rytmu serca i śmierci. Należy zaprzestać stosowania leku Lidocaine Viscous 2% i wszelkich innych środków utleniających. W zależności od nasilenia oznak i objawów, pacjenci mogą reagować na leczenie podtrzymujące, tj. tlenoterapię, nawadnianie. Cięższy obraz kliniczny może wymagać leczenia błękitem metylenowym, transfuzji wymiennej lub tlenu hiperbarycznego.
Środki ostrożności
Informacje dla pacjentów
Rodziców i opiekunów należy ostrzec o następujących kwestiach:
– W przypadku pacjentów w wieku poniżej 3 lat należy zwrócić szczególną uwagę na dokładne odmierzenie przepisanej dawki i nie podawanie produktu częściej niż jest to zalecane. – Aby zapewnić dokładność, zaleca się stosowanie urządzenia pomiarowego w celu dokładnego odmierzenia odpowiedniej objętości. – Produkt powinien być stosowany wyłącznie w zalecanych wskazaniach. – Aby zmniejszyć ryzyko przypadkowego połknięcia, pojemnik z produktem powinien być szczelnie zamknięty, a bezpośrednio po każdym użyciu produkt należy przechowywać w miejscu niedostępnym dla dzieci. – Jeśli u pacjenta wystąpią objawy toksyczności ogólnoustrojowej (np. senność, spłycenie oddechu, drgawki), należy natychmiast zwrócić się o pomoc lekarską i nie podawać dodatkowego produktu. – Niewykorzystany produkt należy wyrzucić w sposób zapobiegający ewentualnemu narażeniu dzieci i zwierząt domowych.
Wszyscy pacjenci powinni być świadomi, że w przypadku stosowania środków miejscowo znieczulających w jamie ustnej lub gardle, wytwarzanie znieczulenia miejscowego może upośledzać połykanie, a tym samym zwiększać niebezpieczeństwo aspiracji. Z tego powodu nie należy spożywać pokarmów przez 60 minut po zastosowaniu preparatów miejscowo znieczulających w okolicy jamy ustnej lub gardła. Jest to szczególnie ważne u dzieci ze względu na częstość spożywania posiłków.
Dumność języka lub błony śluzowej policzków może zwiększać niebezpieczeństwo urazów związanych z gryzieniem. Z tego powodu nie należy spożywać pokarmów i (lub) żuć gumy, gdy obszar jamy ustnej lub gardła jest znieczulony.
Poinformować pacjentów, że stosowanie środków znieczulenia miejscowego może spowodować methemoglobinemię, poważny stan, który musi być natychmiast leczony. Należy poinformować pacjentów lub opiekunów o konieczności natychmiastowego zwrócenia się o pomoc medyczną, jeśli u nich lub u osoby pozostającej pod ich opieką wystąpią następujące oznaki lub objawy: blada, szara lub niebieskawa skóra (sinica); ból głowy; szybkie bicie serca; spłycenie oddechu; światłowstręt; lub zmęczenie.
Ogólne
Bezpieczeństwo i skuteczność lidokainy zależą od właściwego dawkowania, prawidłowej techniki, odpowiednich środków ostrożności i gotowości do działania w nagłych przypadkach (patrz OSTRZEŻENIA i DZIAŁANIA NIEPOŻĄDANE). Należy stosować najmniejszą dawkę, która prowadzi do skutecznego znieczulenia, aby uniknąć wysokiego stężenia w osoczu i poważnych działań niepożądanych. Powtarzane dawki lidokainy mogą powodować znaczne zwiększenie stężenia leku we krwi po każdej powtórzonej dawce z powodu powolnego gromadzenia się leku i (lub) jego metabolitów. Tolerancja zmienia się w zależności od stanu pacjenta. Pacjenci osłabieni, w podeszłym wieku, ostro chorzy i dzieci powinni otrzymywać zmniejszone dawki, proporcjonalne do ich wieku, masy ciała i stanu fizycznego. Lidokainę należy również stosować ostrożnie u pacjentów z ciężkim wstrząsem lub blokiem serca.
Lidokainę należy stosować ostrożnie u osób ze znaną wrażliwością na leki. Pacjenci uczuleni na pochodne kwasu paraaminobenzoesowego (prokaina, tetrakaina, benzokaina, itp.) nie wykazują wrażliwości krzyżowej na lidokainę.
Interakcje lekowe
Pacjenci, którym podawane są środki znieczulenia miejscowego, są narażeni na zwiększone ryzyko rozwoju methemoglobinemii w przypadku jednoczesnej ekspozycji na następujące leki, do których mogą należeć inne środki znieczulenia miejscowego:
Przykłady leków związanych z methemoglobinemią:
|
Klasa |
Przykłady |
|
Nitraty/Nitryny |
nitrogliceryna, nitroprusydek, tlenek azotu, podtlenek azotu |
|
Znieczulenia miejscowe |
benzokaina, lidokaina, bupiwakaina, mepiwakaina, tetrakaina, prilokaina, prokaina, articaina, ropiwakaina |
|
Środki przeciwnowotworowe |
cyklofosfamid, flutamid, rasburicaza, ifosfamid, hydroksymocznik |
|
Antybiotyki |
dapson, sulfonamidy, nitrofurantoina, kwas para-aminosalicylowy |
|
Antymalaryki |
chlorochina, primaquine |
|
Antykonwulsanty |
fenytoina, walproinian sodu, fenobarbital |
|
Inne leki |
acetaminofen, metoklopramid, sulfasalazyna, chinina |
Karcynogeneza, mutageneza, upośledzenie płodności
Badania lidokainy u zwierząt w celu oceny potencjału rakotwórczego i mutagennego lub wpływu na płodność nie zostały przeprowadzone.
Ciąża
Działanie teratogenne
Kategoria B: Badania nad rozrodczością zostały przeprowadzone na szczurach przy dawkach do 6,6 razy większych od dawki stosowanej u ludzi i nie wykazały dowodów na szkodliwe działanie lidokainy na płód. Nie ma jednak odpowiednich i dobrze kontrolowanych badań u kobiet w ciąży. Ponieważ badania nad reprodukcją u zwierząt nie zawsze pozwalają przewidzieć reakcję u ludzi, lek ten powinien być stosowany w ciąży tylko w przypadku zdecydowanej konieczności.
Karmiące matki
Nie wiadomo, czy lek ten jest wydzielany do mleka ludzkiego. Ponieważ wiele leków jest wydzielanych do mleka ludzkiego, należy zachować ostrożność, gdy lidokaina jest podawana kobietom karmiącym piersią.
Stosowanie u dzieci
Dawkowanie u dzieci powinno być zmniejszone, odpowiednio do wieku, masy ciała i stanu fizycznego. Patrz punkt POSTAĆ I DAWKOWANIE.
Działania niepożądane
Doświadczenia niepożądane po podaniu lidokainy mają podobny charakter do doświadczeń obserwowanych podczas stosowania innych amidowych środków znieczulenia miejscowego. Te działania niepożądane są, ogólnie rzecz biorąc, związane z dawką i mogą wynikać z wysokiego stężenia w osoczu spowodowanego nadmierną dawką lub szybkim wchłanianiem, lub mogą wynikać z nadwrażliwości, idiosynkrazji lub zmniejszonej tolerancji ze strony pacjenta. Poważne działania niepożądane mają na ogół charakter ogólnoustrojowy. Następujące rodzaje są najczęściej zgłaszane:
Centralny układ nerwowy
Objawy ze strony OUN są pobudzające i (lub) depresyjne i mogą charakteryzować się światłowstrętem, nerwowością, niepokojem, euforią, dezorientacją, zawrotami głowy, sennością, szumem w uszach, niewyraźnym lub podwójnym widzeniem, wymiotami, uczuciem ciepła, zimna lub drętwienia, drgawkami, drżeniem, konwulsjami, utratą przytomności, depresją oddechową i zatrzymaniem oddechu. Objawy pobudzenia mogą być bardzo krótkie lub mogą w ogóle nie wystąpić, w którym to przypadku pierwszym objawem toksyczności może być senność łącząca się z utratą przytomności i zatrzymaniem oddechu.
Senność po podaniu lidokainy jest zwykle wczesnym objawem wysokiego stężenia leku we krwi i może wystąpić jako konsekwencja szybkiego wchłaniania.
Układ sercowo-naczyniowy
Objawy ze strony układu sercowo-naczyniowego mają zwykle charakter depresyjny i charakteryzują się bradykardią, niedociśnieniem i zapaścią sercowo-naczyniową, która może prowadzić do zatrzymania akcji serca.
Alergia
Reakcje alergiczne charakteryzują się zmianami skórnymi, pokrzywką, obrzękiem lub reakcjami anafilaktoidalnymi. Reakcje alergiczne mogą wystąpić w wyniku wrażliwości albo na miejscowy środek znieczulający, albo na metyloparaben i (lub) propyloparaben zastosowane w tym preparacie. Reakcje alergiczne wynikające z wrażliwości na lidokainę występują niezwykle rzadko, a jeśli wystąpią, należy je leczyć konwencjonalnymi metodami. Wykrycie wrażliwości za pomocą testów skórnych ma wątpliwą wartość.
Przedawkowanie
Ostre stany nagłe po podaniu środków znieczulenia miejscowego są na ogół związane z dużymi stężeniami w osoczu występującymi podczas terapeutycznego stosowania środków znieczulenia miejscowego. (Patrz: DZIAŁANIA NIEPOŻĄDANE, OSTRZEŻENIA i PRZECIWWSKAZANIA)
Postępowanie w nagłych przypadkach związanych ze stosowaniem środków znieczulenia miejscowego
Pierwszą kwestią jest zapobieganie, najlepiej osiągane przez staranne i stałe monitorowanie parametrów życiowych układu sercowo-naczyniowego i oddechowego oraz stanu świadomości pacjenta po każdym podaniu środka znieczulenia miejscowego.
Pierwszym krokiem w postępowaniu w przypadku drgawek jest natychmiastowe zwrócenie uwagi na utrzymanie drożności dróg oddechowych i wspomaganą lub kontrolowaną wentylację tlenem. W sytuacjach, gdy przeszkolony personel jest łatwo dostępny, wentylacja powinna być utrzymana, a tlen powinien być dostarczany przez system umożliwiający natychmiastowe uzyskanie dodatniego ciśnienia w drogach oddechowych przez maskę. Natychmiast po wprowadzeniu tych środków wentylacyjnych należy ocenić prawidłowość krążenia, pamiętając, że leki stosowane w leczeniu drgawek czasami powodują depresję krążenia, gdy są podawane dożylnie. Jeżeli drgawki utrzymują się pomimo odpowiedniego wsparcia oddechowego i jeżeli stan krążenia na to pozwala, można podać dożylnie małe dawki ultrakrótko działającego barbituranu (takiego jak tiopental lub tiamylal) lub benzodiazepiny (takiej jak diazepam). Przed zastosowaniem środków znieczulenia miejscowego klinicysta powinien być zaznajomiony z tymi lekami przeciwdrgawkowymi. Leczenie podtrzymujące depresji układu krążenia może wymagać podawania płynów dożylnych oraz, w razie potrzeby, wazopresora zgodnie ze wskazaniami sytuacji klinicznej (np. efedryny).
Jeżeli nie są natychmiast leczone, zarówno drgawki, jak i depresja układu krążenia mogą prowadzić do niedotlenienia, kwasicy, bradykardii, zaburzeń rytmu serca i zatrzymania akcji serca. Jeśli dojdzie do zatrzymania krążenia, należy zastosować standardowe środki resuscytacji krążeniowo-oddechowej.
Dializa ma znikomą wartość w leczeniu ostrego przedawkowania lidokainy.
LD50 doustnej dawki lidokainy u nie karmionych samic szczurów wynosi 459 (346 do 773) mg/kg (jako sól) i 214 (159 do 324) mg/kg (jako sól) u karmionych samic szczurów.
DAWKOWANIE I ADMINISTRACJA
Dorośli
Maksymalna zalecana jednorazowa dawka lidokainy dla zdrowych dorosłych powinna być taka, aby dawka lidokainy nie przekraczała 4.5 mg/kg lub 2 mg/lb masy ciała i w żadnym przypadku nie przekraczała całkowitej dawki 300 mg.
W leczeniu objawowym podrażnionej lub zmienionej zapalnie błony śluzowej jamy ustnej i gardła, zwykle stosowana dawka dla dorosłych wynosi 15 mL nierozcieńczonego roztworu. W przypadku stosowania w jamie ustnej, roztwór należy przepłukać w jamie ustnej, a następnie wypluć. W przypadku stosowania w gardle, nierozcieńczony roztwór należy wypłukać i można go połknąć. Dawki tej nie należy podawać w odstępach krótszych niż trzy godziny, a w ciągu 24 godzin nie należy podawać więcej niż osiem dawek. Dawkę należy dostosować do wieku, masy ciała i stanu fizycznego pacjenta (patrz PRECAUTIONS).
Pediatryczny
Należy zachować ostrożność, aby zapewnić prawidłowe dawkowanie u wszystkich pacjentów pediatrycznych, ponieważ odnotowano przypadki przedawkowania spowodowane niewłaściwym dawkowaniem.
Trudno jest zalecić maksymalną dawkę jakiegokolwiek leku dla dzieci, ponieważ zmienia się ona w zależności od wieku i masy ciała. Dla dzieci w wieku powyżej 3 lat, które mają prawidłową beztłuszczową masę ciała i prawidłowy rozwój ciała, maksymalna dawka jest określana na podstawie masy ciała lub wieku dziecka. Na przykład: u dziecka w wieku 5 lat ważącego 50 funtów dawka lidokainy nie powinna być większa niż 75 do 100 mg (3,7 do 5 mL lidokainy).
U niemowląt i dzieci w wieku poniżej 3 lat roztwór należy dokładnie odmierzyć i nie więcej niż 1,2 mL nanieść na najbliższą okolicę za pomocą aplikatora z końcówką bawełnianą. Przed podaniem kolejnej dawki należy odczekać co najmniej 3 godziny; w ciągu 12 godzin można podać maksymalnie cztery dawki. Lidokaina powinna być stosowana tylko wtedy, gdy stan podstawowy wymaga leczenia objętością produktu mniejszą lub równą 1,2 mL.
Jak podawać
Lidokaina Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP)
Doustny roztwór miejscowy 2% jest dostarczany jako przejrzysty, bezbarwny, lepki roztwór.
NDC 0054-0548-44: Squeeze Bottle of 20 mL
NDC 0054-3500-49: Squeeze Bottle of 100 mL
Przechowywać w temperaturze 20° do 25°C (68° do 77°F).
Podawać w pojemniku zabezpieczającym przed dostępem dzieci, określonym w USP/NF.
SPOSÓB UŻYCIA: Dobrze wstrząsnąć przed użyciem.
Distr. by: West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Revised October 2018
Package/Label Display Panel
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100mL

Package/Label Display Panel
NDC 0054-0548-.44 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 15mL

| LIDOCAINE VISCOUS roztwór chlorowodorku lidokainy. |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINE VISCOUS chlorowodorek lidokainy roztwór |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Wytwórca -. West-Ward Pharmaceuticals Corp. (080189610)
| Establishment | |||
| Nazwa | Adres | ID/FEI | Operations |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Zastrzeżenia medyczne
.