Atomy mogą zdobywać lub tracić elektrony w celu utworzenia jonów w procesie zwanym jonizacją (związki utworzone w ten sposób są nazywane związkami jonowymi). Kiedy związki jonowe rozpuszczają się w wodzie, ich jony oddzielają się od siebie w procesie zwanym dysocjacją. Jedną z interesujących cech wody i wielu innych związków kowalencyjnych jest to, że one również mogą dysocjować na jony. W przeciwieństwie do związków jonowych, takich jak chlorek sodu, nie są one zjonizowane przed dysocjacją; dokonują one jonizacji i dysocjacji w tym samym czasie.
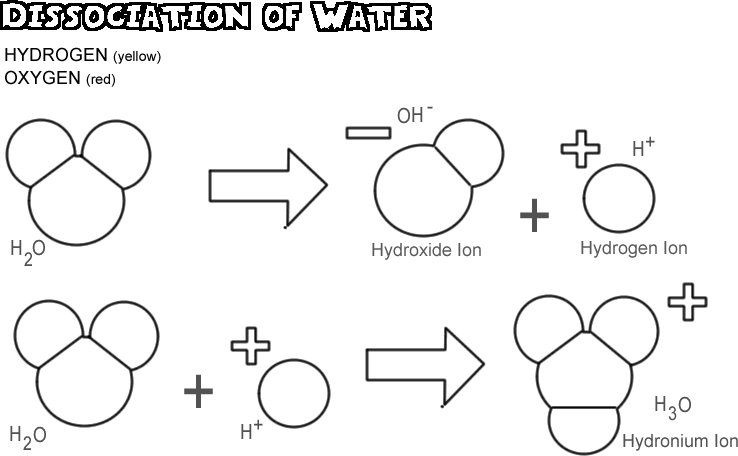
Dysocjacja wody
Gdy woda dysocjuje, jedno z jąder wodoru pozostawia swój elektron za atomem tlenu, stając się jonem wodorowym, podczas gdy tlen i inne atomy wodoru stają się jonami wodorotlenkowymi. Ponieważ jon wodorowy nie ma elektronu, który neutralizowałby ładunek dodatni na jego protonie, ma on pełną jednostkę ładunku dodatniego i jest symbolizowany jako H+. Jon wodorotlenkowy zachowuje pozostawiony elektron i dlatego posiada pełną jednostkę ładunku ujemnego, symbolizowaną przez OH-. Jon wodorowy (proton) nie wędruje długo sam, zanim dołączy do atomu tlenu drugiej niezjonizowanej cząsteczki wody, tworząc jon hydroniowy (H3O +)
W dowolnej próbce wody, bardzo niewiele cząsteczek jest zdysocjowanych w danym momencie: w rzeczywistości tylko około jedna na 550 milionów. Zachodzi jednak stała zmiana; gdy jeden jon wodorowy przyłącza się ponownie do jonu wodorotlenkowego, tworząc cząsteczkę wody, inna cząsteczka wody dysocjuje, zastępując jon wodorowy i jon wodorotlenkowy w roztworze.
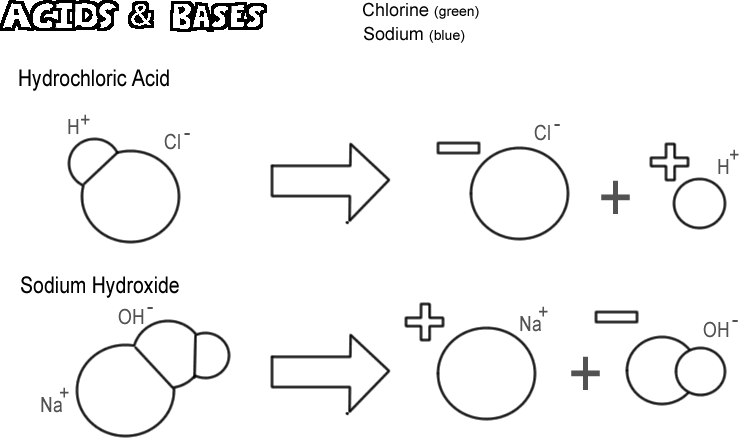
Kwas solny
Niektóre cząsteczki, jonowe i kowalencyjne, dysocjują w taki sposób, że uwalniają jon wodorowy bez uwalniania jonu wodorotlenkowego. Substancje te nazywane są kwasami. Ponieważ w większości przypadków jon wodorowy to tak naprawdę tylko jeden proton, chemicy definiują kwas jako „dawcę protonów”. Jeśli bardzo wiele protonów (jonów wodorowych) jest „oddawanych”, efekt może być bardzo głęboki, np. oparzenie skóry lub rozpuszczenie metalu. Kwasem przedstawionym na ilustracji jest kwas solny. Czysty kwas chlorowodorowy jest gazem, ale łatwo rozpuszcza się w wodzie, tworząc roztwór jonów wodorowych i chlorkowych. Ponieważ prawie cały kwas jest zdysocjowany w wodzie, nazywamy go mocnym kwasem. Kwasy, które nie dysocjują całkowicie są nazywane słabymi kwasami.
Wodorotlenek sodu
Przeciwieństwem kwasu jest zasada, znana również jako alkalia. Typową mocną zasadą jest wodorotlenek sodu, główny składnik ługu. Wodorotlenek sodu dysocjuje, tworząc jon sodowy i jon wodorotlenkowy. Zasadę definiuje się jako „akceptor protonów”. Najpopularniejsze zasady wytwarzają jon wodorotlenkowy, kiedy dysocjują, i to właśnie jon wodorotlenkowy przyjmuje proton. Silna zasada może spowodować znacznie gorsze oparzenia skóry niż kwas.
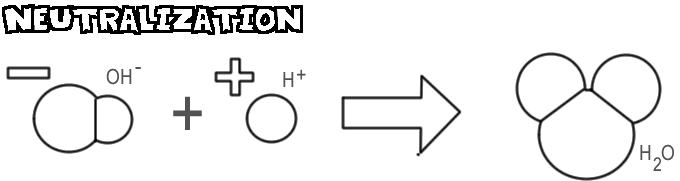
Neutralizacja
Gdy zasada i kwas są mieszane, jon wodorotlenkowy i zasada łączy się z jonem wodorowym z kwasu, tworząc wodę. Proces ten nazywany jest neutralizacją.
Pytania:
1. Co się dzieje, gdy atom zyskuje lub traci elektron?