Migotanie przedsionków (AF) jest najczęstszą utrwaloną tachyarytmią, występującą u 1% do 2% populacji ogólnej. Izolacja żył płucnych (PVI) jest podstawową metodą ablacji AF.1 Chociaż procedura ta jest skuteczna w zapobieganiu nawrotom arytmii u pacjentów z napadowym migotaniem przedsionków, jeśli jest wykonywana samodzielnie, ma ograniczoną skuteczność w przypadku przetrwałego AF.1,2 Początkowe dane sugerowały, że nawroty arytmii można zmniejszyć poprzez dodatkową ablację liniową lub złożoną frakcjonowaną ablację elektrogramu przedsionkowego. Jednak korzyści z dodatkowej ablacji poza PVI nie zostały potwierdzone w najnowszych wynikach metaanaliz3 i randomizowanych badań kontrolowanych,4 podkreślających znaczenie trwałej PVI, nawet w przetrwałym AF.
W ciągu ostatnich kilku lat ablacja kriobalonowa stała się realną alternatywą dla ablacji prądem o częstotliwości radiowej (RF) i okazała się co najmniej tak samo skuteczna jak PVI u pacjentów z napadowym AF. Niedawne wyniki badania FIRE & ICE definitywnie rozstrzygnęły debatę w tej dziedzinie.5 Ponadto ze względu na względną prostotę, szybszą krzywą uczenia się i – co być może jeszcze ważniejsze – niezwykłą powtarzalność6 tej procedury, została ona szeroko przyjęta do praktyki klinicznej.6
Z drugiej strony, leczenie interwencyjne przetrwałego AF pozostaje wyzwaniem: podejście to nie zostało ustandaryzowane ani udoskonalone i jest w nim miejsce na innowacje. W tym kontekście interesujące jest pytanie o możliwą rolę krioablacji.
DOŚWIADCZENIA KLINICZNE
Mimo rosnącego zainteresowania skutecznością ablacji AF u pacjentów z przetrwałym AF, dane dotyczące obserwacji po zastosowaniu nowego 28-mm cewnika krioablacyjnego drugiej generacji (Arctic Front Advance, Medtronic Inc., Minneapolis, MN) są nadal ograniczone. Dotychczas wyniki ablacji po użyciu kriobalonu w przetrwałym AF oceniano pośrednio na podstawie metaanaliz, nierandomizowanych porównań7 i badań obserwacyjnych.8-10
Ciconte i wsp.9 podali, że 60% pacjentów z przetrwałym AF było wolnych od tachyarytmii przedsionkowej po leczeniu nowym cewnikiem kriobalonowym. Czas trwania przetrwałego AF, który był niezależnym czynnikiem predykcyjnym nawrotu arytmii podczas obserwacji, stanowi wyraźne wsparcie dla ablacji we wcześniejszych stadiach choroby.
W retrospektywnym badaniu 48 pacjentów z przetrwałym AF jednoroczny wskaźnik powodzenia klinicznego wynosił 69%.10
W innym badaniu jednoramiennym oceniano skuteczność krioablacji drugiej generacji w grupie 100 pacjentów z przetrwałym AF jako procedury wskaźnikowej (średni czas trwania 5,5 ± 3,7 miesiąca).8 Po średnim okresie obserwacji wynoszącym 10,6 ± 6,3 miesiąca nie stwierdzono nawrotów tachyarytmii przedsionkowej u 67% pacjentów po 3-miesięcznym okresie przerwy w leczeniu. Jedynym istotnym niezależnym czynnikiem predykcyjnym nawrotu było wystąpienie tachyarytmii przedsionkowej podczas okresu przerwy w leczeniu.
W jednoośrodkowym, nieprospektywnym, nierandomizowanym badaniu oceniano również RF w porównaniu z krioablacją tylko u pacjentów z przetrwałym AF.7 W badaniu tym oceniano wyniki proceduralne ablacji RF (z użyciem cewnika do ablacji typu contact-force) w porównaniu z krioablacją (z użyciem 28-mm kriokablażu drugiej generacji) w kohorcie 100 pacjentów z przetrwałym AF opornym na leczenie farmakologiczne (średni czas trwania AF wynosił 7,2 i 7,6 miesiąca, odpowiednio w grupach ablacji RF i krioablacji). Zarówno czas zabiegu, jak i czas fluoroskopii były istotnie krótsze w grupie poddanej krioablacji, ale odsetek pacjentów wolnych od arytmii przedsionkowej był podobny w obu grupach po 12 miesiącach obserwacji (60% w grupie poddanej krioablacji vs 56% w grupie poddanej ablacji RF, P = .71). W analizie wieloczynnikowej jedynymi niezależnymi czynnikami predykcyjnymi niepowodzenia ponownie okazały się czas trwania przetrwałego AF i nawroty podczas okresu wygaszania.
Wreszcie, w prospektywnym, wieloośrodkowym, nierandomizowanym badaniu porównano wyniki po pojedynczym zabiegu ablacji, stosując ablację krioablacyjną pierwszej generacji tylko dla PVI vs ablację RF z otwartą irygacją, stosując podejście krokowe w kohorcie pacjentów z przetrwałym AF, dobranych pod względem częstości występowania.11 Wyniki, wskazujące na około 55% brak arytmii przedsionkowych podczas średniej obserwacji wynoszącej 15,6 ± 11,5 miesiąca po pojedynczej ablacji, zarówno z użyciem kriobalonu, jak i RF, były podobne do dostępnych danych. Na uwagę zasługuje kilka wyników:
- –
Po pierwsze, wyniki kliniczne były podobne w 2 ramionach leczenia, mimo że w grupie RF wykonano dodatkową i bardziej rozległą ablację poza PVI.
- –
Po drugie, odsetek powikłań był podobny w przypadku 2 technik.
- –
Po trzecie, czas trwania zabiegu był krótszy w przypadku krioablacji.
Nadal nie ma pewności co do patofizjologii i optymalnej strategii ablacji przetrwałego AF, dlatego podstawą tej terapii pozostaje osiągnięcie trwałego PVI.4 Aby to osiągnąć, krioablacja wydaje się być alternatywną metodą terapeutyczną w stosunku do RF. Wykonywanie dodatkowej ablacji na szczycie PVI wiąże się z dłuższym czasem zabiegu.4 Ponieważ podejście do ablacji RF nie zostało wystandaryzowane (u większości pacjentów w ramieniu RF pojawiły się dodatkowe zmiany), nie jest jasne, czy wyniki wynikają ze źródła energii czy ze strategii ablacji. Co więcej, średnioterminowe wyniki nie wydają się być znacząco poprawione przez dodatkowe zmiany w przedsionkach poza PVI u pacjentów z przetrwałym AF.4
SHOOTING AT THE RIGHT TARGET?
Przyczyny braku zwiększonej korzyści z dodatkowej ablacji pozostają do wyjaśnienia. Jedną z możliwości jest jatrogenny potencjał podejścia substratowego z bardziej rozległą ablacją, które może sprzyjać rozwojowi nowych obszarów arytmogenezy z powodu niekompletnie ablowanej tkanki lub niekompletnych linii bloku przewodzenia. Inną możliwością jest to, że obszar sprawcy nie jest rutynowo identyfikowany i ani złożone frakcjonowane elektrogramy przedsionkowe, ani zmiany liniowe nie są optymalnymi celami uzupełniającymi dla ablacji.12 W tej hipotezie pozostaje potrzeba wskazania oka burzy (poprzez celowanie w rotory lub zwoje),13 być może poprzez zastosowanie nowszych algorytmów mapowania. Dostępne dane potwierdzają również rolę czasu trwania AF, a w konsekwencji elektrycznej przebudowy AF (AF rodzi AF), ponieważ tylko czas trwania AF był niezależnym predyktorem nawrotu arytmii w porównaniu propensity-score,11 jak wcześniej podali Tilz i wsp.2
Kilka prowadzonych obecnie badań pomoże wyjaśnić bezpieczeństwo i skuteczność krioablacji u pacjentów z przetrwałym AF. Badanie Cryoballoon Ablation for Early Persistent Atrial Fibrillation (Cryo4 Persistent AF – NCT02213731) jest europejskim, wieloośrodkowym, prospektywnym, jednoramiennym badaniem pilotażowym, mającym na celu ocenę skuteczności PVI wyłącznie za pomocą krioablacji w ciągu 1 roku u pacjentów z przetrwałym migotaniem przedsionków w wywiadzie krótszym niż 12 miesięcy. Badanie to jest nadal w fazie rekrutacji, a pierwsze wyniki spodziewane są pod koniec 2017 roku. Kolejnym celem będzie porównanie wyników w randomizowanym badaniu pomiędzy podejściem stopniowym RF a krioablacją PVI w jednorodnej grupie pacjentów z przetrwałym AF. Wyniki tego zakrojonego na szeroką skalę randomizowanego badania są niecierpliwie oczekiwane.
ZALETY I OGRANICZENIA
W przypadku pacjentów z przetrwałym AF nawet najwyższe maksymalne średnice PV (pomiędzy 20 mm a 23 mm) są znacznie niższe niż wartość krytyczna 28 mm (maksymalna średnica krioablacji stosowana w rutynowej praktyce klinicznej).14 Z powodu tego niedopasowania między średnicami balonu i PV, gdy urządzenie jest umieszczone przy antrum PV, jego chłodząca część jest w kontakcie zarówno z antrum PV, jak i z przyległą tkanką przedsionka, co wydaje się być istotną korzyścią tej procedury. Kenigsberg i wsp.15 obliczyli obszar ablowanej tkanki serca po krioablacji PV za pomocą trójwymiarowego elektroanatomicznego mapowania napięcia w lewym przedsionku po krioablacji. Stosując tę metodę, autorzy ci ładnie wykazali, że po krioablacji urządzeniem z 28-mm kriokabalonem odsetek powierzchni tylnej ściany lewego przedsionka, która pozostała elektrycznie nienaruszona, wynosił tylko 27%.
Należy zauważyć, że chociaż kriokabalon jest koncepcyjnie ukierunkowany tylko na PV, wykonuje on również znaczące elektryczne usuwanie uszkodzeń tylnej ściany lewego przedsionka (rycina). Rozszerzając obwód obszaru chłodzenia, urządzenie to może przynosić dodatkowe korzyści poprzez ablację lokalnych czynników przyczyniających się do wyzwalania i utrzymywania AF, takich jak sploty zwojowe i rotory, co może mieć istotne implikacje terapeutyczne dla pacjentów z przetrwałym AF.13 Ta cecha mogłaby również wyjaśnić, przynajmniej częściowo, wyniki wyżej wymienionych badań.
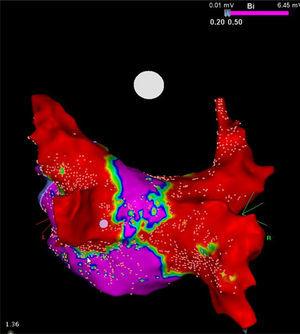
Mapa napięciowa o dużej gęstości ściany tylnej po zabiegu krioablacji u pacjenta z przetrwałym migotaniem przedsionków. Należy zwrócić uwagę na wąski korytarz (fioletowy) pozostający pomiędzy obiema dużymi bliznami (czerwonymi) uzyskanymi za pomocą 28-milimetrowego kriobalonu Artic Front Advance (Medtronic, Minneapolis, MN, Stany Zjednoczone). Dzięki uprzejmości Prof. Mario Oliveira, Szpital Santa Marta, Lizbona, Portugalia.
Ale chociaż wskaźniki skuteczności kriobalonu są porównywalne ze wskaźnikami skuteczności RF w nierandomizowanych badaniach pacjentów z przetrwałym AF, stosunkowo wysoki wskaźnik nawrotów arytmii w obu grupach pozostaje niewyjaśniony i może być przypisany nie tylko odzyskaniu przewodnictwa w PVs. Możliwość ta była wymieniana w badaniach budzących obawy co do roli źródeł innych niż PVs, stanowiących mechanizm nawrotu.9
W przetrwałym AF leczenie inwazyjne pozostaje wyzwaniem ze względu na jego zróżnicowaną patofizjologię. Potrzebny jest nowy wgląd w mechanikę, aby umożliwić indywidualne podejście do przetrwałego AF, ale dopóki taka wiedza nie będzie dostępna, samodzielna PVI pierwszego rzutu może być wystarczająca, przynajmniej u pacjentów z mniej nasilonym przetrwałym AF. W oparciu o podejście „mniej znaczy więcej” krioballonowa PVI może okazać się odpowiednią strategią ablacji w przetrwałym AF, umożliwiając niezawodną PVI z dodatkowym usunięciem miokardium sąsiednich przedsionków. Nie wydaje się, aby dodatkowa modyfikacja substratu przynosiła dodatkowe korzyści. Ta „minimalistyczna” procedura jest akceptowalną pierwszą opcją u pacjentów ze stosunkowo niedawną historią objawowego przetrwałego AF, tj. z „większą liczbą czynników wyzwalających niż substratu” (lub z substratem skoncentrowanym wokół ostróg PVs…). Rzeczywiście, duży (28 mm) kriobalon drugiej generacji zapewnia podobne wyniki jak w przypadku bardziej złożonych zabiegów z użyciem energii RF i wyrafinowanych metod. Warto zauważyć, że krzywa uczenia się, powtarzalność i bezpieczeństwo wydają się przemawiać na korzyść urządzenia z kriobalonem w mniej doświadczonych rękach. W tym środowisku i w wyżej wymienionej podgrupie pacjentów PVI z użyciem dużego kriobalonu drugiej generacji wydaje się być rozsądnym podejściem początkowym, zapewniającym znaczącą poprawę u ponad połowy kandydatów. W przypadku pacjentów z nawrotami AF ta pierwsza procedura nie będzie bezużyteczna. Rzeczywiście, w znacznej ilości substratu (otaczającego prawą i lewą antrę PV), który był już leczony, druga procedura, tym razem z użyciem RF, skupi się głównie na ogniskach poza PV, fragmentarycznych potencjałach, obwodach mikro- lub makroreentry itp.
W naszej opinii ta dwuetapowa strategia jest zgodna z rozmieszczeniem ośrodków o niskiej lub średniej objętości, skupiających się głównie na PVI i pracujących ramię w ramię z trzeciorzędowymi ośrodkami referencyjnymi wykonującymi bardziej złożone procedury. Te ostatnie będą musiały poradzić sobie z około 40% pacjentów mających nawroty po pierwszym „cryo-debulking”.
„Mniej znaczy więcej”, ale to wciąż za mało…
KONFLIKTY INTERESÓW
S. Boveda otrzymuje honoraria za konsultacje od firm Medtronic, Boston Scientific i Livanova.
.