Jak powstało życie na Ziemi? W jaki sposób na młodej, skalistej planecie chemikalia mogły się połączyć w odpowiedni sposób, aby utworzyć pierwsze komórki? Jak te prymitywne komórki zaczęły zachowywać się jak życie: rosnąć, dzielić się i przekazywać korzystne cechy następnym pokoleniom?
Początki życia są szczególnie niejasne, ponieważ zapis geologiczny – warstwy skał i osadzonych skamieniałości, które zawierają wskazówki dotyczące historii Ziemi i życia – zniknął około 3,9 miliarda lat temu, wymazany przez ruchy skorupy planety. W rezultacie naukowcom brakuje bezpośrednich dowodów na warunki panujące na wczesnej Ziemi, w tym dowodów na istnienie cząsteczek, które mogły zawirować w pierwotnych stawach i uformować budulec życia.
Przedstawia to mnóstwo pytań, dokładnie takich, do których ciągnie Jacka Szostaka. On i inni wierzą, że mogą zrekonstruować w laboratorium długą drogę, która prowadziła od chemikaliów w kosmosie, do powstania Ziemi, do chemii przed powstaniem życia na naszej planecie, do wczesnych protokomórek, a w końcu do zaawansowanych komórek z metabolizmem i syntezą białek. Rozległe badania takie jak te wymagają wiedzy z wielu dziedzin, w tym chemii i biochemii, geologii i geofizyki oraz astronomii.
Szostak (wymawiane jako shah-stak) może być idealną osobą do poszukiwania odpowiedzi. Laureat Nagrody Nobla, profesor genetyki w Harvard Medical School, profesor chemii i biologii chemicznej na Wydziale Sztuk i Nauk, Rich Distinguished Investigator w Massachusetts General Hospital (MGH) oraz badacz Howard Hughes Medical Institute, jest opisywany przez innych jako błyskotliwy, zdeterminowany naukowiec. Ale jest również znany z łagodnej pokory, w tym gotowości do głębokiego zagłębiania się w tematy, które są dla niego nowe, oraz z koleżeńskości, z pomagania w dzieleniu się pomysłami, które posuwają naukę naprzód.
Jego własne badania koncentrują się na jednym segmencie drogi do życia: protokomórce, „naprawdę, naprawdę prostej pierwotnej komórce, która mogłaby się złożyć z substancji chemicznych, które były na początku, na powierzchni Ziemi”, wyjaśnia Szostak. Szostak ma nadzieję, że uda mu się zrozumieć, w jaki sposób mogła ona rosnąć, dzielić się i replikować, a w końcu ewoluować. „Być może nie wiemy, co się właściwie stało, ale może uda nam się opracować różne możliwe ścieżki” – mówi. „Wszystko, co możemy zrobić, to spróbować zmontować w laboratorium rzeczy, które wydają się prawdopodobne.”
„Kierowana ewolucja”
W sierpniu tego roku Szostak kończy czterdzieści lat na Harvardzie i trzydzieści pięć w MGH (gdzie znajduje się jego laboratorium). W latach 80. jego laboratorium przeprowadzało eksperymenty na drożdżach, aby zrozumieć genetykę i biochemię rekombinacji DNA – prace te doprowadziły do powstania modelu naprawy zerwania podwójnej nici, który opisuje, jak długie nici DNA pękają, zamieniają się segmentami, a następnie łączą się ponownie. Spowodowało to późniejsze badania nad mechanizmem rekombinacji podczas mejozy, podziału komórek, który prowadzi do powstania plemników i jajeczek.
W tym samym okresie jego zespół dokonał również ważnych odkryć dotyczących telomerów – ochronnych czapeczek znajdujących się na końcach chromosomów, które zapewniają prawidłową replikację DNA podczas podziału komórek. Za te badania Szostak otrzymał później w 2009 roku Nagrodę Nobla w dziedzinie fizjologii lub medycyny, którą dzielił z badaczami Elizabeth Blackburn, Sc.D. ’06, obecnie emeryta na UC, San Francisco, i Carol Greider z Johns Hopkins.
Do czasu, gdy Szostak otrzymał wczesnym rankiem telefon ze Szwecji w październiku 2009 roku, spędził już ponad 20 lat, dokonując fundamentalnego wkładu w innych dziedzinach nauki. Po odkryciach telomerów w połowie lat 80-tych (badania połączyły skrócone telomery z wieloma chorobami związanymi ze starzeniem się), wielu naukowców weszło na to pole i Szostak postanowił zmienić kierunek. „Było całkiem jasne, jakie będą następne eksperymenty i wydawało się, że wszystko, co zrobimy, i tak zostanie zrobione”, wspomina. „Nigdy nie uważałem, że robienie rzeczy, które i tak zostaną zrobione, ma sens. To sprawiło, że zacząłem się rozglądać i zastanawiać nad innymi rodzajami pytań naukowych, którymi mógłbym się zająć”. W 1984 roku przyjął ofertę przeniesienia swojego laboratorium z ówczesnego Sidney Farber Cancer Institute do MGH, aby dołączyć do tamtejszych badaczy pracujących nad naukami podstawowymi. „To była niesamowita oferta: wszystkie moje badania byłyby w pełni finansowane przez 10 lat” – wspomina Szostak. „To było dla mnie idealne rozwiązanie, ponieważ pozwoliło mi zmienić kierunek bez martwienia się o pisanie grantów w nowej dziedzinie.”
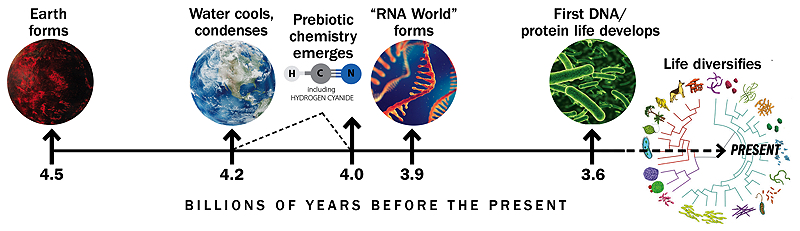
Linia czasowa oparta na podobnej grafice Geralda Joyce’a
Po rozważeniu swoich opcji, osiadł na enzymach RNA znanych jako rybozymy, dziedzinie, którą postrzegał jako „interesującą, łatwą do opanowania i nie bardzo konkurencyjną.” On i jego studenci zaczęli rozwijać narzędzia do ewolucji RNA, jednoniciowych cząsteczek w komórkach, które kopiują informacje genetyczne zawarte w DNA. W probówkach jego zespół nakłaniał RNA do przyjmowania nowych ról, takich jak rozpoznawanie cząsteczek docelowych i katalizowanie reakcji. Proces ten, znany jako „kierowana ewolucja”, polegał na wprowadzaniu mutacji do nici RNA, szukaniu wariantów, które mogłyby pełnić użyteczne funkcje, oraz pozwalaniu tym nowym cząsteczkom na rozmnażanie. Wykonali również podobną pracę z DNA, peptydami i białkami.
W 1994 roku Szostak otrzymał nagrodę Narodowej Akademii Nauk w dziedzinie biologii molekularnej, wraz z badaczem Geraldem Joyce’em, obecnie z Salk Institute for Biological Studies, za jednoczesne, ale niezależne rozwijanie ewolucji in vitro RNA. „Jest to technologia tworzenia cząsteczek, które wykonują twoje polecenia” – wyjaśnił Joyce w wywiadzie, opisując ją jako podobną do sposobu, w jaki naukowcy zajmujący się rolnictwem hodują krowy, aby produkowały więcej mleka, lub rozwijają uprawy odporne na suszę. „To jest molekularna wersja tego. I jest to coś, co jest teraz bardzo szeroko praktykowane”, dodaje (patrz „Harnessing Evolution”, styczeń-luty 2017, strona 15), sposób opracowywania nowych cząsteczek do różnych zastosowań, w tym leków.
Dla Szostaka praca nad ewolucją kierowaną zrodziła nowe pytania. „Coraz bardziej interesowało mnie, jak ewolucja zaczęła się sama z siebie na wczesnej Ziemi”, wspomina. „To jedna rzecz narzucić selektywne naciski i przeprowadzić darwinowską ewolucję w laboratorium, gdzie masz enzymy, studentów i instrumenty. Ale w jakiś sposób ewolucja darwinowska zaczęła się sama.” Biorąc pod uwagę, że zdolność do ewolucji jest kluczową cechą życia, Szostak zadawał jedno z fundamentalnych pytań nauki: Jak życie się zaczęło?
Origins: „Three Big, Fundamental Questions”
Kanadyjsko-amerykański Szostak urodził się w Londynie, gdzie jego ojciec studiował na kierunku inżynierii aeronautycznej. Rodzina ostatecznie wróciła do Kanady, gdzie mieszkali w Ottawie, a następnie w Montrealu, a jego ojciec pracował dla Kanadyjskich Sił Powietrznych. (Jego matka przez wiele lat pracowała na stanowiskach administracyjnych w przemysłowej firmie chemicznej, a Szostak po raz pierwszy pracował tam latem jako nastolatek, testując trwałość kolorów w firmowym laboratorium barwników. „Praca ta była powtarzalna i nudna, ale dała mi pierwszy pogląd na to, jak ważne jest testowanie i ponowne testowanie produktów pod kątem ich rzeczywistego zastosowania” – wspomina. W tym czasie był już „poważnie zainteresowany” naukami ścisłymi, matematyką i inżynierią. W wieku 25 lat uzyskał doktorat z biochemii w Cornell, a swojego doradcę, Raya Wu, nazywa ważnym mentorem: „Stworzył świetne środowisko laboratoryjne, ale także pokazał mi, jak uzyskać pomoc w projekcie, gdy napotyka się problemy.”
Ale choć Szostak przeprowadził w swojej karierze kilka praktycznych, stosowanych badań – jedna z firm, którą założył, Ra Pharma, odkryła lek na chorobę miastenię gravis, który ma rozpocząć badania kliniczne III fazy – jego największą pasją są nauki podstawowe.
„To ekscytujący czas na zajmowanie się neurobiologią, ponieważ można teraz rozwiązywać problemy, o których nie można było nawet myśleć 30 lat temu.”
„Moim zdaniem istnieją trzy wielkie fundamentalne pytania naukowe, które są bardzo interesujące: pochodzenie życia, pochodzenie wszechświata i pochodzenie umysłu lub świadomości”, oferuje, siedząc w swoim cichym, prawie pustym biurze w Mallinckrodt Laboratory na Oxford Street w Cambridge. (Biuro służy do okazjonalnych spotkań; Szostak pracuje głównie w swoim laboratorium w MGH). Po pochodzeniu życia, najbardziej interesuje go pochodzenie umysłu. W latach 80., kiedy planował, co robić po zakończeniu badań nad telomerami, rozważał przeniesienie się na studia neurobiologiczne i nawet uczestniczył w seminariach na Harvardzie na ten temat. „To było fascynujące, ale i przygnębiające, bo technologia była tak prymitywna” – wspomina. Od tamtej pory z zainteresowaniem obserwuje rozwój narzędzi w tej dziedzinie. „To ekscytujący czas dla młodych ludzi, którzy chcą zajmować się neurobiologią, ponieważ dzięki nowej technologii można teraz rozwiązywać problemy, o których 30 lat temu nie można było nawet pomyśleć” – mówi. „Jednak cały problem jest wciąż tak ogromny i nieco zniechęcający. Ja patrzę na to w ten sposób, że pracuję nad najłatwiejszym z tych wielkich problemów.” Ponieważ pytania o początki życia są dobrze dopasowane do obecnych technologii badawczych, dodaje, uważa, że jest to „problem możliwy do rozwiązania.”
Modelowe protokomórki i „niechlujne” RNA
Zespół Szostaka tworzy modelowe protokomórki od wczesnych lat 2000, starając się dowiedzieć, w jaki sposób mogły się one pierwotnie złożyć i wyewoluować. Jak wyjaśnia, te prymitywne struktury były „niezwykle proste” w porównaniu z najprostszą jednokomórkową bakterią żyjącą obecnie na Ziemi. Protokomórki prawdopodobnie posiadały minimalną błonę tłuszczową i początkowo tylko jeden gen, który nadawał komórce jakąś przewagę. Współczesne bakterie, w przeciwieństwie do nich, „mają co najmniej setki, a zazwyczaj tysiące genów.”
Pomimo niektórych teorii, że wczesne życie powstało w pobliżu kominów hydrotermalnych w głębokim oceanie, Szostak jest bardziej przekonany badaniami pokazującymi, że najwcześniejsze komórki rozwinęły się na lądzie w stawach lub basenach, prawdopodobnie w regionach aktywnych wulkanicznie. Światło ultrafioletowe i uderzenia piorunów mogły pomóc w przekształceniu cząsteczek atmosfery w cyjanek i inne użyteczne materiały, które stały się podstawą do powstania życia. Płytka woda dałaby tym materiałom miejsce do gromadzenia się w wysokich stężeniach, a aktywność wulkaniczna mogłaby stworzyć gorące i zimne wahania temperatury pomocne dla pewnych reakcji chemicznych.
Historia Ziemi i początki życia
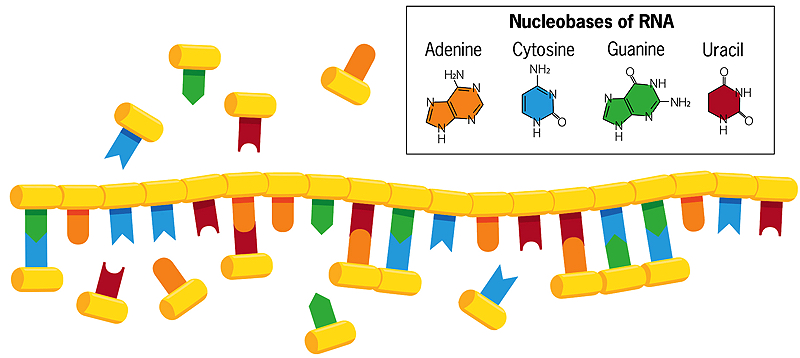
W przeciwieństwie do dwuniciowego DNA, w którym zasady cytozyna i tymina łączą się w pary z guaniną i adeniną na przeciwległej nici, zasady pojedynczej spiralnej nici RNA w wodzie mogą tworzyć asocjacje ze swobodnie pływającymi nukleobazami (pokazanymi na powyższym obrazku). Jeśli te swobodnie pływające zasady połączą się ze sobą, powstaje nowa, lustrzana kopia nici RNA, która po podgrzaniu wody odrywa się od oryginału. Kiedy ta nowa nić replikuje się z kolei, tworzy lustrzaną kopię samej siebie, która pasuje do oryginalnej nici RNA. Czasami w tym procesie kopiowania pojawiają się błędy, a korzystne pomyłki utrwalają się. Każdy łańcuch, działając jako szablon dla własnej replikacji, w ten sposób ewoluuje i wchodzi w interakcje ze swoim środowiskiem.
Niektórzy naukowcy, w tym Gerald Joyce, sugerują, że życie mogło rozpocząć się poza komórkami, ze swobodnie pływającymi cząsteczkami napotykającymi się nawzajem i tworzącymi wiązania, które pozwoliłyby im działać jak życie. Ale Szostak twierdzi, że błona komórkowa była konieczna, częściowo dlatego, że utrzymywałaby korzystne cząsteczki genetyczne razem i zapobiegała pożytecznym metabolitom wytworzonym przez genetycznie zakodowane rybozymy od unoszenia się w otaczającej wodzie lub bycia złapanym przez inne przechodzące protocells.
Doświadczenia w jego laboratorium pokazały, jak taka błona mogłaby rosnąć i dzielić się. Badacze połączyli kwasy tłuszczowe, takie jak kwas oleinowy z wodą i buforem (aby utrzymać pH roztworu na stałym poziomie), a następnie wstrząsnęli roztworem. Po obejrzeniu pod mikroskopem okazało się, że składniki połączyły się w pęcherzyki: okrągłe, wypełnione płynem struktury z dwuwarstwowymi błonami. Dodanie dodatkowych kwasów tłuszczowych do środowiska – służących jako składniki odżywcze – spowodowało, że z pęcherzyków wyrosły długie, przypominające włosy włókna, tak kruche, że nawet delikatne muśnięcie powietrza na szkiełku mikroskopowym spowodowało ich rozpad na kawałki. Zespół Szostaka osiągnął podobne wyniki z różnymi cząsteczkami tworzącymi błony i w różnych środowiskach, co sugeruje, że jest to prawdopodobny sposób, w jaki błona protokomórki może rosnąć, a następnie dzielić się. Ale w jaki sposób taka struktura może przekazywać korzystny materiał genetyczny do następnej generacji komórek potomnych? „
Aby dzielić się odziedziczonymi cechami z kolejnymi pokoleniami, dzisiejsze komórki polegają na DNA – cząsteczce o podwójnej helisie złożonej z nukleobaz: adeniny, cytozyny, guaniny i tyminy – do przechowywania i przekazywania informacji genetycznej. Jednak replikacja DNA w komórkach wymaga zarówno jednoniciowej cząsteczki RNA, jak i enzymów białkowych, a genetycznie zakodowane białka są zbyt złożone, by mogły powstać spontanicznie na początku Ziemi. Ponieważ RNA może zarówno przechowywać i przekazywać informacje genetyczne (jak DNA), jak i katalizować reakcje chemiczne (jak enzymy białkowe), wielu badaczy uważa, że prymitywne komórki wykorzystywały cząsteczki RNA do pełnienia zarówno ról genetycznych, jak i enzymatycznych.
Pod koniec lat sześćdziesiątych brytyjski naukowiec Leslie Orgel zaproponował, że RNA, lub coś podobnego, mogło być pierwszą cząsteczką na Ziemi, która się replikowała i ewoluowała; stało się to znane jako hipoteza „Świata RNA”. Orgel i inni przez dziesięciolecia pracowali nad zrozumieniem, w jaki sposób łańcuchy RNA mogły się łączyć i replikować, ale ich wysiłki nie zakończyły się pełnym sukcesem. „Na początku był duży postęp, a potem wszystko stanęło w miejscu, ponieważ istniało kilkanaście różnych problemów i w tamtym czasie nie było oczywistej odpowiedzi na żaden z nich” – wyjaśnia Szostak. „Prawie wszyscy byli sfrustrowani i pomyśleli: 'Może życie nie zaczęło się od RNA. Może istnieje coś prostszego, łatwiejszego do wytworzenia, łatwiejszego do replikacji.”
„Wiemy teraz o wiele więcej i po prostu rozkładając rzeczy na pojedyncze, mniejsze problemy, byliśmy w stanie rozwiązać niektóre z nich.”
Badacze szukali alternatyw dla RNA, „a to doprowadziło do 10 do 20 lat naprawdę interesującej chemii, wymyślając wiele interesujących cząsteczek”, zauważa Szostak. „Ale jak dotąd nie pojawiło się nic prostszego ani lepszego niż RNA, co naprawdę by działało”. Niektórzy badacze popierają hipotezę „metabolizm-pierwszy”, sugerując, że życie mogło rozpocząć się bez materiału genetycznego, poprzez serię samopodtrzymujących się reakcji, ale Szostak i inni pozostają nieprzekonani. Około siedem lat temu zaczął ponownie analizować przeszkody, z którymi Orgel i jego rówieśnicy musieli się zmierzyć, aby zrozumieć syntezę RNA. „Wiemy teraz o wiele więcej”, wyjaśnia, „i tylko poprzez rozbicie rzeczy na poszczególne, mniejsze problemy, byliśmy w stanie rozwiązać niektóre z nich.”
Laboratorium Szostaka skupia się teraz prawie całkowicie na tym, jak pierwotne RNA mogło samo się kopiować. Współczesne RNA łączy się w bardzo regularne, przewidywalne sposoby, z nukleotydowymi blokami konstrukcyjnymi, które łączą się ze sobą jak łańcuch. Każdy blok zawiera cukier (rybozę), fosforan i jedną z czterech nukleobaz (zwanych również zasadami azotowymi) – adeninę, cytozynę, guaninę i uracyl (zwykle nazywane A, C, G i U). Jednostki rybozowo-fosforanowe są połączone razem, tworząc „szkielet” RNA. We współczesnych komórkach enzymy białkowe katalizują reakcję, która łączy jednostki nukleotydowe w łańcuchy RNA.
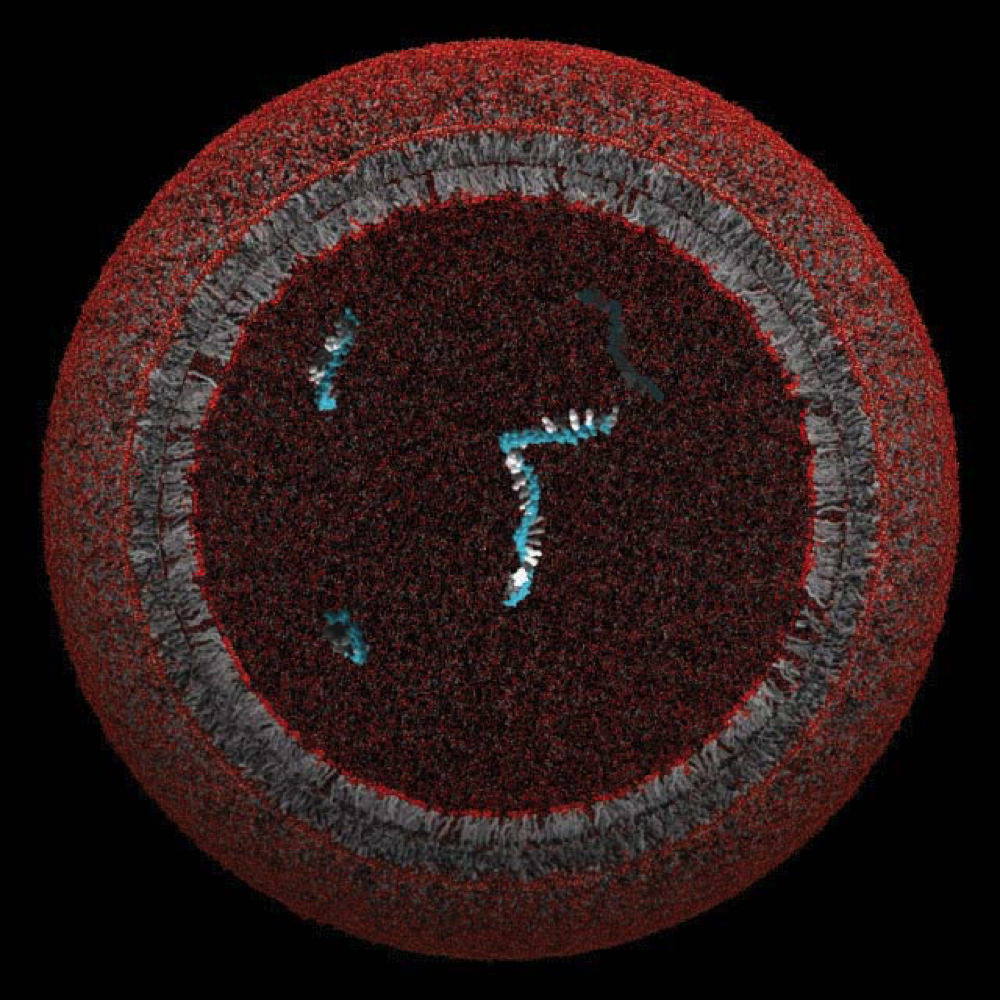
Modelowa protokomórka, której błona lipidowa mogła zamknąć i chronić pojedynczy gen
Obraz dzięki uprzejmości Laboratorium Szostaka
W protokomórkach na wczesnej Ziemi łańcuch RNA służyłby jako szablon, na którym montowałby się nowy, komplementarny łańcuch nukleotydów, zanim odłączyłby się, by stać się dodatkowym szablonem, na którym inne swobodnie pływające nukleotydy mogłyby się połączyć. Ale w przeciwieństwie do przewidywalnego współczesnego RNA, wczesne RNA nie miało korzyści w postaci białek, które katalizowałyby proces budowy. (Ponieważ białka nie mogą powstać bez skomplikowanej i wysoce rozwiniętej maszynerii komórkowej wymaganej do ich syntezy, większość badaczy uważa, że ich istnienie na pierwotnej Ziemi było mało prawdopodobne). Wczesne RNA było więc prawdopodobnie bardziej zabałaganione, z dużo większą zmiennością szkieletu cukrowego i zasad, mówi Szostak. Jego zespół obecnie eksperymentuje, „aby uzyskać pewne pojęcie o tym, jaka zmienność będzie tolerowana, a jaka zostanie wyeliminowana. Nasz obecny model jest taki, że zaczynasz z czymś, co jest niechlujne i ma wiele różnych wariacji, a przez cykle replikacji kończysz z czymś, co jest bliższe współczesnemu homogenicznemu RNA.”
Praca z 2018 roku autorstwa Szostaka i studenta Seohyun Kima ilustruje możliwą zmienność wczesnego RNA, a także jego elementy składowe A, C, G i U. Naukowcy poczynili postępy w zrozumieniu, w jaki sposób C i U mogły zostać wygenerowane przez prebiotyczne reakcje chemiczne, ale zmagali się z A i G. Szostak i Kim sugerują, że RNA mogło rozpocząć się od różnych nukleobaz, a ich eksperymenty wykazały, że nukleozyd inozyna, który można wytworzyć z A (adeniny), działa skutecznie w miejsce G (guanozyny). „To upraszcza cały problem” – wyjaśnia Szostak. „Teraz musimy tylko wiedzieć, jak wytworzyć A.”
Inne ostatnie eksperymenty w laboratorium koncentrowały się na jonach metali potrzebnych do uruchomienia procesu kopiowania RNA. Naukowcy zazwyczaj używają magnezu, „ale musimy go używać w bardzo wysokich stężeniach”, co ma negatywne skutki uboczne, wywołując degradację RNA lub zniszczenie błony komórkowej. „Miejmy nadzieję, że znajdziemy jakiś prosty, wiarygodny sposób, aby wszystko działało z mniejszą ilością magnezu, a może będziemy musieli przemyśleć cały problem i podejść do niego z innej strony” – wyjaśnia Szostak. „Po prostu czujemy się po omacku, próbując dostrzec, gdzie może być ścieżka do rozwiązania.”

Podgrzewanie i chłodzenie przypisywane wulkanizmowi, jak w Yellowstone’s Grand Prismatic Spring, ułatwiłoby wczesną ewolucję RNA.
Photograph by Istock Images
Niektóre ścieżki nie sprawdzają się, a nawet przynoszą błędy. W 2016 r. laboratorium Szostaka opublikowało w Nature Chemistry pracę, która wykazała, że peptyd mógł pomóc RNA replikować się bez enzymów. Wkrótce potem do laboratorium dołączyła badaczka Tivoli Olsen, która nie potrafiła powtórzyć tych odkryć. Jej recenzja pracy ujawniła, że zespół źle zinterpretował dane, a Szostak wycofał pracę. „Pracujemy nad trudnymi problemami, a najtrudniejszą rzeczą w nauce, jak powiedział chyba Feynman, jest nie oszukiwać samego siebie” – mówi Szostak. Potencjalne rozwiązanie było ekscytujące, „i myślę, że to po prostu zaślepiło nas na to, co się działo”. Dodaje, że „łaską ocalenia” jest to, że odkryli błędy na własną rękę, choć chciałby, żeby stało się to „przed opublikowaniem pracy, a nie po”. Powiedziałbym, że wiele z naszych pomysłów kończy się źle, ale zazwyczaj zdajemy sobie z tego sprawę dość szybko.”
Jest optymistą co do potencjału ostatnich odkryć w innych laboratoriach; na przykład John Sutherland z Medical Research Council (MRC) Laboratory of Molecular Biology w Cambridge, Anglia, niedawno odkrył nową technikę aktywacji nukleotydów – chemicznie modyfikując te bloki budulcowe, aby zasilić proces replikacji. Sutherland podzielił się tymi odkryciami z laboratorium Szostaka przed ich opublikowaniem, a Szostak mówi, że bada sposoby włączenia tej techniki do swoich własnych eksperymentów.
Gdy jego zespół zmontuje działające protokomórki, które zawierają kawałki RNA, spodziewa się, że informacje w niektórych specyficznych sekwencjach RNA przyniosą pewne korzyści protokomórce, która je otacza. Na przykład, poprzednia praca sugeruje, że niektóre sekwencje RNA mogą składać się, aby stać się rybozymem, który mógłby zrobić nieco bardziej zaawansowane lipidy dla błony komórkowej. „Każda sekwencja RNA, która robi cokolwiek, co pomaga jej własnym komórkom przetrwać lub szybciej się replikować, zacznie przejmować kontrolę nad populacją” – wyjaśnia Szostak. „To są początki ewolucji darwinowskiej. I wtedy znów stajemy się biologami.”
Po zdobyciu Nagrody Nobla Szostak mógł opuścić laboratorium, by poświęcić się podróżom i zaproszeniom na wykłady, ale „skupia się na nauce” – mówi Gerald Joyce. „To właśnie najbardziej w nim podziwiam”. Niektórzy mogą postrzegać badania podstawowe jako intelektualny luksus, ale ich praktycy twierdzą, że wszystkie nauki stosowane zaczynają się od ustaleń nauk podstawowych. „Kiedy Crick i Watson usiedli i zaczęli tworzyć kartonowe modele struktury DNA, nie mieli pojęcia, że 70 lat później zapoczątkuje to przemysł wart miliardy dolarów” – zauważa John Sutherland. „Mam nadzieję, że uda mi się zbudować ewoluujący system komórkowy, zanim przejdę na emeryturę” – mówi. Jest optymistą co do swoich szans. „Myślę, że jesteśmy coraz bliżej. Jest jeszcze kilka trudnych problemów, a potem myślę, że wszystko zostanie, miejmy nadzieję, rozwiązane w ciągu kilku lat.”