Czym są enzymy i co robią w naszych ciałach? Enzymy to białka, które są produkowane przez żywe organizmy w celu wywołania pewnych reakcji metabolicznych i biochemicznych w organizmie. Są one biologicznymi katalizatorami, które przyspieszają reakcje zachodzące w organizmie. Dowiedzmy się więcej na ich temat.
Sugerowane filmy:
Jaka jest struktura enzymów?
Enzymy, jak wspomniano powyżej, są biologicznymi katalizatorami. Podczas gdy one przyspieszają lub przyśpieszają proces, w rzeczywistości zapewniają alternatywną ścieżkę dla procesu. Ale, w procesie, struktura lub skład enzymów pozostają niezmienione.
Enzymy są rzeczywiście wykonane z 1000s aminokwasów, które są połączone w specyficzny sposób, aby utworzyć różne enzymy. Łańcuchy enzymatyczne tworzą unikalne kształty i to właśnie te kształty zapewniają enzymom ich charakterystyczny potencjał chemiczny. Większość enzymów zawiera również składnik niebiałkowy, znany jako kofaktor.
Browse more Topics under Biomolecules
- Biomakromolekuły
- Monomery łączące wiązania
- Enzymy
- Metaboliczne podstawy życia
- Kwasy nukleinowe
- Polisacharydy
- Białka
.
Typy enzymów:
Reakcje biochemiczne zachodzące w organizmie mają zasadniczo 6 typów, a enzymy, które doprowadzają do tych reakcji, noszą odpowiednie nazwy:
- Oksydoreduktazy: Enzymy te przynoszą o reakcje utleniania i redukcji, a zatem są nazywane oksydoreduktazy. W tych reakcjach, elektrony w postaci jonów wodorkowych lub atomów wodoru są przenoszone. Kiedy substrat jest utleniany, enzymy te działają jako donor wodoru. Enzymy te nazywane są dehydrogenazami lub reduktazami. Gdy atom tlenu jest akceptorem, enzymy te nazywane są oksydazami.
- Transferazy: Enzymy te są odpowiedzialne za przenoszenie grup funkcyjnych z jednej cząsteczki do drugiej. Przykład: aminotransferaza alaninowa, która przenosi grupę alfa-aminową między alaniną a asparaginianem itd. Niektóre transferazy przenoszą również grupy fosforanowe między ATP a innymi związkami, resztami cukrowymi w celu utworzenia disacharydów, np. heksokinaza w glikolizie.
- Hydrolazy: Enzymy te katalizują reakcje, w których zachodzi proces hydrolizy.Zrywają one wiązania pojedyncze przez dodanie wody. Niektóre hydrolazy funkcjonują jako enzymy trawienne, ponieważ rozbijają wiązania peptydowe w białkach. Hydrolazy mogą być również rodzajem transferaz, ponieważ przenoszą cząsteczkę wody z jednego związku do drugiego. Przykład: Glukozo-6-fosfataza, która usuwa grupę fosforanową z glukozo-6-fosforanu, pozostawiając glukozę i H3PO4.
- Liazy: Enzymy te katalizują reakcje, w których grupy funkcyjne są dodawane w celu przerwania wiązań podwójnych w cząsteczkach lub w których wiązania podwójne są tworzone przez usunięcie grup funkcyjnych. Przykład: Dekarboksylaza pirogronianowa jest liazą, która usuwa CO2 z pirogronianu. Inne przykłady obejmują deaminaz i dehydrataz.
- Izomerazy: Enzymy te katalizują reakcje, w których grupa funkcyjna jest przenoszona do innej pozycji w obrębie tej samej cząsteczki w taki sposób, że powstająca cząsteczka jest w rzeczywistości izomerem wcześniejszej cząsteczki. Przykład: izomeraza triozofosforanowa i izomeraza fosfoglukozowa do przekształcania 6-fosforanu glukozy w 6-fosforan fruktozy.
- Ligazy: Enzymy te pełnią funkcję przeciwstawną do hydrolaz. Podczas gdy hydrolazy zrywają wiązania przez dodanie wody, ligazy tworzą wiązania przez usunięcie składnika wodnego. Istnieją różne podklasy ligaz, które wiążą się z syntezą ATP.
Jak działają enzymy?
Aby jakakolwiek reakcja mogła zajść we wszechświecie, konieczna jest energia. W przypadkach, gdy nie ma energii aktywacji, katalizator odgrywa ważną rolę, aby zmniejszyć energię aktywacji i przeprowadzić reakcję. Działa to zarówno u zwierząt, jak i u roślin. Enzymy pomagają zmniejszyć energię aktywacji złożonych cząsteczek w reakcji. Następujące kroki upraszczają sposób działania enzymu w celu przyspieszenia reakcji:
Krok 1: Każdy enzym posiada „miejsce aktywne”, w którym może związać się jedna z cząsteczek substratu. W ten sposób powstaje kompleks enzym-substrat.
Krok 2: Cząsteczka enzymu-substratu reaguje teraz z drugim substratem tworząc produkt, a enzym jest uwalniany jako drugi produkt.
Istnieje wiele teorii wyjaśniających działanie enzymów. Ale, są dwie ważne teorie, które tutaj omówimy.
Teoria 1: Hipoteza zamka i klucza
Jest to najbardziej akceptowana z teorii działania enzymów.

Ta teoria stwierdza, że substrat dokładnie pasuje do miejsca aktywnego enzymu, tworząc kompleks enzym-substrat. Model ten opisuje również dlaczego enzymy są tak specyficzne w swoim działaniu, ponieważ są specyficzne dla cząsteczek substratu.
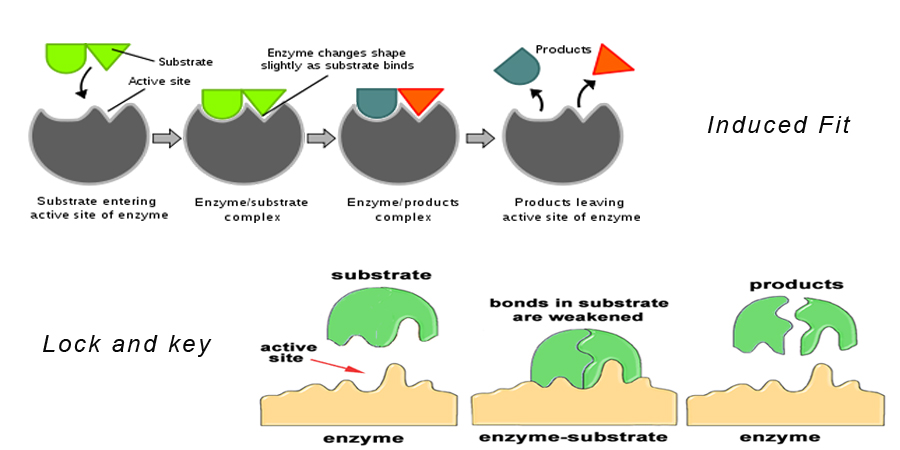
Teoria 2: Induced Fit Hypothesis
Jest ona podobna do hipotezy zamka i klucza. Mówi ona, że kształt cząsteczki enzymu zmienia się w miarę zbliżania się do cząsteczki substratu w taki sposób, że cząsteczka substratu dokładnie pasuje do miejsca aktywnego enzymu.
Jakie czynniki wpływają na aktywność enzymów w komórce?
- Stężenie enzymów i substratów: Szybkość reakcji wzrasta wraz ze wzrostem stężenia substratu aż do punktu, poza którym każdy dalszy wzrost stężenia substratu nie powoduje istotnej zmiany szybkości reakcji. Dzieje się tak, ponieważ po pewnym stężeniu substratu, wszystkie miejsca aktywne na enzymie są pełne i nie może wystąpić dalsza reakcja.
- Temperatura: Wraz ze wzrostem temperatury aktywność enzymów wzrasta ze względu na wzrost energii kinetycznej cząsteczek. Istnieje optymalny poziom, kiedy enzymy działają najlepiej i maksymalnie. Temperatura ta jest często normalną temperaturą ciała. Kiedy temperatura wzrasta powyżej pewnego limitu, enzymy, które w rzeczywistości składają się z białek, zaczynają się rozpadać i szybkość reakcji spowalnia.
- pH: Enzymy są bardzo wrażliwe na zmiany w pH i działają w bardzo małym oknie dopuszczalnych poziomów pH. Poniżej lub powyżej optymalnego poziomu pH, istnieje ryzyko rozpadu enzymów, a tym samym spowolnienia reakcji.
- Inhibitory: Obecność pewnych substancji, które hamują działanie danego enzymu. Dzieje się tak, gdy substancja hamująca przyłącza się do miejsca aktywnego enzymu uniemożliwiając w ten sposób przyłączenie substratu i spowalnia proces.
Solved Example for You
Q: An enzyme acts by?
a. Zwiększanie energii aktywacji
b. Zmniejszanie energii aktywacji
c. Zmniejszanie pH
d. Zwiększanie pH
Roztwór: a. Zwiększanie energii aktywacji
Reagenty nie ulegają przemianie chemicznej automatycznie. Robią to w stanie przejściowym. Stan przejściowy ma więcej energii swobodnej niż reaktanty lub produkty. Niezdolność reaktantów do ulegania przemianom z powodu wymogu dodatkowej energii potrzebnej do przekształcenia ich w stan przejściowy nazywamy „barierą energetyczną”. Energia wymagana do pokonania bariery energetycznej nazywana jest „energią aktywacji”.
.