Zawartość
- 1 Funkcja
- 2 Ludzka dehydrogenaza mleczanowa
- 2.1 Struktura
- 2.2 Kataliza
- 2.3 Kinetyka
- 2.4 Regulacja
- 3 Struktury 3D dehydrogenazy mleczanowej
Funkcja
Dehydrogenaza mleczanowa L (L-LDH) katalizuje interkonwersję pirogronianu i NADH+ do L-mleczanu i NAD+.
Dehydrogenaza mleczanowa H (H-LDH) katalizuje interkonwersję D-mleczanu i żelazicytochromu c do pirogronianu i żelazocytochromu c.
Dehydrogenaza mleczanowa (LDH) jest ważnym enzymem u ludzi. Występuje w różnych regionach ciała, a każdy region ma unikalną konformację różnych podjednostek. LDH jest kluczowym enzymem w oddychaniu beztlenowym. Oddychanie beztlenowe odbywa się w warunkach braku tlenu. Ten szlak jest ważny dla glikolizy na dwa główne sposoby. Pierwszym z nich jest to, że jeśli pirogronian będzie gromadził się w glikolizie, a tym samym wytwarzanie ATP będzie spowolnione. Po drugie, oddychanie beztlenowe pozwala na regenerację NAD+ z NADH. NAD+ jest potrzebny, gdy dehydrogenaza gliceraldehydo-3-fosforanowa utlenia gliceraldehydo-3-fosforan w glikolizie, co generuje NADH. Dehydrogenaza mleczanowa jest odpowiedzialna za beztlenową konwersję NADH do NAD+. w artykule Lactate Dehydrogenase from Cryptosporidium parvum (4nd4).
Dehydrogenaza mleczanowa człowieka
Struktura
jest białkiem czwartorzędowym powstałym z połączenia dwóch podjednostek, M i H (Muscle and Heart) w strukturę czterech podjednostek. Różne kombinacje znalezione w organizmie człowieka są:
- (4H) Serce
- (3H1M) Siatkówka
- (2H2M) Płuca
- (1H3M) Nerki
- (4M) Mięsień i Wątroba
Przedstawiona tu postać LDH składa się w 40% z heliksów alfa i w 23% z arkuszy beta. Dane SCOP klasyfikują tę formę dehydrogenazy mleczanowej jako mieszaną beta-alfa-beta, z głównie równoległymi arkuszami beta.
Zobacz także
- Ludzka dehydrogenaza mleczanowa
- Jasper Lactate Final
- Rossmann fold.
Kataliza
Badania wykazały, że mechanizm reakcji LDH przebiega według uporządkowanej sekwencji.
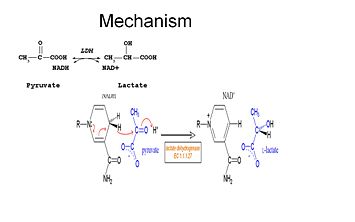
Aby mleczan mógł zostać utleniony, NADH musi najpierw związać się z enzymem, a następnie z mleczanem. . Po związaniu NADH z enzymem, możliwe jest związanie mleczanu (pokazany jest substrat – oksamat; grupa -CH3 jest zastępowana przez -NH2 tworząc oksamat). Mleczan wiąże się z enzymem pomiędzy pierścieniem nikotynamidowym a kilkoma resztami LDH. Następnie następuje szybkie przeniesienie jonu wodorkowego w obu kierunkach, co daje mieszaninę dwóch kompleksów trzeciorzędowych, enzym-NAD+-mleczan i enzym-NADH-pirogronian. W końcu pirogronian odłącza się od enzymu, a za nim NAD+.
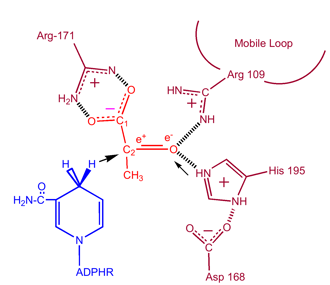
Kinetyka
Kinetyczne badania dehydrogenazy mleczanowej z szczawianem i szczawianem (strukturalne analogi mleczanu i pirogronianu) udowodniły mechanizm przedstawiony powyżej. Etapem ograniczającym szybkość tej reakcji jest szybkość dysocjacji NAD+ i NADH. Konwersja pirogronianu do mleczanu z następującą po niej regeneracją NAD+ jest bardzo korzystna.
Regulacja
Ponieważ mechanizm jest mechanizmem równowagi, wydaje się, że nie ma regulacji specjalnie zaprojektowanej dla dehydrogenazy mleczanowej, zamiast tego jest ona zależna od aktywacji reparacji beztlenowej i obecności pirogronianu i NADH, lub mleczanu i NAD+.
Struktury 3D dehydrogenazy mleczanowej
Struktury 3D dehydrogenazy mleczanowej
.
