- Tablica geometrii
- CEle kształcenia
- KEY TAKEAWAYS
- Key Points
- Kluczowe pojęcia
- Model VSEPR
- Geometrie molekularne
- How to Determine Molecular Geometry – YouTube: Ten film opisuje jedną z metod szybkiego znajdowania głównych kształtów geometrycznych dla prostych molekuł.
- Geometrie molekularne
- CEle kształcenia
- KEY TAKEAWAYS
- Key Points
- Kluczowe pojęcia
- Metoda AXE
- Główne geometrie (bez samotnych par elektronów):
- Trigonal Planar
- Tetrahedral
- Oktahedral
- Interaktywne: Geometria elektronowa: Molekuły przyjmują różne kształty ze względu na wzorce współdzielonych i nie współdzielonych elektronów. W tych przykładach wszystkie elektrony wpływające na kształt cząsteczek są współdzielone w wiązaniach kowalencyjnych trzymających atomy razem w celu utworzenia cząsteczek.
- Samotne pary elektronów
- CELE NAUCZANIA
- KEY TAKEAWAYS
- Key Points
- Key Terms
- Geometrie molekularne z elektronami samotnej pary
- Liczba koordynacyjna i atom centralny
- Efekt odpychający elektronów samotnej pary
- Interactive: Niewspólne elektrony i „wygięty” kształt: Użyj modelu 3D, aby zobaczyć, jak elektrony niedzielone odpychają te, które są dzielone w wiązaniach między wodorem i tlenem, powodując, że cząsteczka ma „wygięty” kształt.
- LICENCJE I ATRYBUTY
- CC LICENSED CONTENT, SHARED PREVIOUSLY
- CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
Tablica geometrii
Teoria VSEPR określa geometrie molekularne (liniowe, trygonalne, trygonalne bipiramidalne, tetraedryczne i oktaedryczne).
CEle kształcenia
Zastosuj model VSEPR do określenia geometrii cząsteczki, która nie zawiera samotnych par elektronów na atomie centralnym.
KEY TAKEAWAYS
Key Points
- Podstawowo, model VSEPR teoretyzuje, że regiony o ujemnym ładunku elektrycznym będą się odpychać od siebie, powodując, że będą one (i tworzone przez nie wiązania chemiczne) znajdować się jak najdalej od siebie.
- Geometrie cząsteczek uwzględniają liczbę atomów i liczbę elektronów samotnej pary.
- Główne geometrie bez samotnej pary elektronów to: liniowa, trygonalna, tetraedryczna, trygonalna dwupiramidowa i oktaedryczna.
Kluczowe pojęcia
- Teoria VSEPR: model chemiczny używany do przewidywania kształtu poszczególnych cząsteczek w oparciu o odpychanie elektrostatyczne par elektronów
Model VSEPR
Model odpychania par elektronów powłoki walencyjnej (VSEPR) skupia się na wiążących i niewiążących parach elektronów obecnych w najbardziej zewnętrznej (walencyjnej) powłoce atomu, która łączy się z dwoma lub więcej innymi atomami.
Fundamentalnie, model VSEPR teoretyzuje, że te regiony ujemnego ładunku elektrycznego będą odpychać się nawzajem, powodując je (i wiązania chemiczne, które tworzą), aby pozostać tak daleko od siebie, jak to możliwe. Dlatego dwie chmury elektronowe zawarte w prostej trójatomowej cząsteczce ![]() będą rozchodzić się w przeciwnych kierunkach. Kątowa separacja 180° umieszcza dwa orbitale wiążące tak daleko od siebie, jak to tylko możliwe; dlatego spodziewamy się, że dwa wiązania chemiczne będą rozciągać się w przeciwnych kierunkach, tworząc liniową cząsteczkę.
będą rozchodzić się w przeciwnych kierunkach. Kątowa separacja 180° umieszcza dwa orbitale wiążące tak daleko od siebie, jak to tylko możliwe; dlatego spodziewamy się, że dwa wiązania chemiczne będą rozciągać się w przeciwnych kierunkach, tworząc liniową cząsteczkę.

 . Dwa atomy X (w kolorze białym) są oddalone od siebie o 180°.
. Dwa atomy X (w kolorze białym) są oddalone od siebie o 180°.Jeśli atom centralny zawiera również jedną lub więcej par elektronów niewiążących, te dodatkowe regiony o ładunku ujemnym będą się zachowywać podobnie jak te związane z atomami związanymi. Orbitale zawieraj±ce różne wi±ż±ce i niewi±ż±ce pary w powłoce walencyjnej rozci±gn± się od atomu centralnego w kierunkach, które minimalizuj± ich wzajemne odpychanie. Jeśli centralny atom posiada częściowo zajęte d-orbitale, może być w stanie pomieścić pięć lub sześć par elektronów, tworząc to, co czasami nazywane jest „rozszerzonym oktetem”.”
Geometrie molekularne
Geometrie molekularne (liniowa, trygonalna, tetraedryczna, trygonalna dwupiramidalna i oktaedryczna) są określane przez teorię VSEPR. Tabela geometrii wykorzystująca teorię VSEPR może ułatwić rysowanie i zrozumienie cząsteczek. Tabela geometrii molekularnych znajduje się na pierwszym rysunku. Drugi rysunek służy jako pomoc wizualna dla tabeli.


How to Determine Molecular Geometry – YouTube: Ten film opisuje jedną z metod szybkiego znajdowania głównych kształtów geometrycznych dla prostych molekuł.
Geometrie molekularne
Teoria VSEPR opisuje pięć głównych kształtów prostych molekuł: liniowy, trójkątny planarny, tetraedryczny, trójkątny dwupiramidowy i oktaedryczny.
CEle kształcenia
Zastosuj model VSEPR do określenia geometrii cząsteczek, w których atom centralny zawiera jedną lub więcej samotnych par elektronów.
KEY TAKEAWAYS
Key Points
- Liniowa: prosta trójatomowa cząsteczka typu
 ; jej dwa orbitale wiążące są oddalone od siebie o 180°.
; jej dwa orbitale wiążące są oddalone od siebie o 180°. - Trigonalna planarna: trójkątna i w jednej płaszczyźnie, z kątami wiązań 120°.
- Tetraedryczny: cztery wiązania na jednym atomie centralnym z kątami wiązań 109.5°.
- Trigonalny dwupiramidowy: pięć atomów wokół atomu centralnego; trzy w płaszczyźnie z kątami wiązań 120° i dwa na przeciwległych końcach cząsteczki.
- Oktaedryczny: sześć atomów wokół atomu centralnego, wszystkie z kątami wiązań 90°.
Kluczowe pojęcia
- Teoria VSEPR: model odpychania par elektronów w powłoce walencyjnej (VSEPR) jest używany do przewidywania kształtu poszczególnych cząsteczek na podstawie stopnia odpychania elektrostatycznego par elektronowych
Metoda AXE
Innym sposobem patrzenia na geometrię molekularną jest „metoda AXE” liczenia elektronów. A w AXE reprezentuje centralny atom i zawsze ma implikowany indeks jeden; X reprezentuje liczbę wiązań sigma pomiędzy centralnym i zewnętrznymi atomami (wielokrotne wiązania kowalencyjne – podwójne, potrójne, itp. – liczą się jako jeden X), a E reprezentuje liczbę samotnych par elektronów otaczających centralny atom. Suma X i E, znana jako liczba steryczna, jest również związana z całkowitą liczbą zhybrydyzowanych orbitali używanych przez teorię wiązań walencyjnych. VSEPR używa liczby sterycznej i rozkładu X i E do przewidywania kształtów geometrycznych cząsteczek.

Zauważ, że geometrie są nazwane tylko według pozycji atomowych, a nie rozmieszczenia elektronów.

Główne geometrie (bez samotnych par elektronów):
W modelu liniowym atomy są połączone w linii prostej, a kąt wiązania to po prostu kąt geometryczny pomiędzy dwoma sąsiednimi wiązaniami. Prosta cząsteczka trójatomowa typu ![]() ma swoje dwa orbitale wiążące oddalone od siebie o 180°. Przykłady cząsteczek trójatomowych, dla których teoria VSEPR przewiduje kształt liniowy, to
ma swoje dwa orbitale wiążące oddalone od siebie o 180°. Przykłady cząsteczek trójatomowych, dla których teoria VSEPR przewiduje kształt liniowy, to ![]() (który nie posiada wystarczającej liczby elektronów, aby spełnić regułę oktetu) i
(który nie posiada wystarczającej liczby elektronów, aby spełnić regułę oktetu) i ![]() . Wypisując wzór kropki elektronowej dla dwutlenku węgla zauważ, że wiązania C-O są wiązaniami podwójnymi; nie ma to żadnego znaczenia dla teorii VSEPR. Centralny atom węgla jest nadal połączony z dwoma innymi atomami. Chmury elektronowe, które łączą dwa atomy tlenu są oddalone od siebie o 180°.
. Wypisując wzór kropki elektronowej dla dwutlenku węgla zauważ, że wiązania C-O są wiązaniami podwójnymi; nie ma to żadnego znaczenia dla teorii VSEPR. Centralny atom węgla jest nadal połączony z dwoma innymi atomami. Chmury elektronowe, które łączą dwa atomy tlenu są oddalone od siebie o 180°.

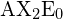 .
.Trigonal Planar
Cząsteczki o kształcie trójkątnym planarnym są trójkątne i w jednej płaszczyźnie, czyli płaskiej powierzchni. Cząsteczka ![]() taka jak
taka jak ![]() ma trzy regiony gęstości elektronów rozciągające się od centralnego atomu. Odpychanie między nimi będzie w minimum, gdy kąt między dwoma wynosi 120o.
ma trzy regiony gęstości elektronów rozciągające się od centralnego atomu. Odpychanie między nimi będzie w minimum, gdy kąt między dwoma wynosi 120o.
Tetrahedral
Tetra- oznacza cztery, a -hedral odnosi się do twarzy ciała stałego; „tetrahedral” dosłownie oznacza „posiadające cztery twarze. „Ten kształt jest znaleziony, gdy istnieją cztery wiązania wszystkie na jednym centralnym atomie, bez samotnych par elektronów. Zgodnie z teorią VSEPR, kąty wiązań pomiędzy wiązaniami elektronowymi wynoszą 109,5o. Przykładem cząsteczki tetraedrycznej jest metan ![]() . Cztery równoważne wiązania skierowane są w czterech równoważnych geometrycznie kierunkach w trzech wymiarach, co odpowiada czterem narożom czworościanu skupionego na atomie węgla.
. Cztery równoważne wiązania skierowane są w czterech równoważnych geometrycznie kierunkach w trzech wymiarach, co odpowiada czterem narożom czworościanu skupionego na atomie węgla.

Kształt bipiramidy trygonalnej tworzy się, gdy atom centralny jest otoczony przez pięć atomów w cząsteczce. W tej geometrii trzy atomy znajdują się w tej samej płaszczyźnie, a kąty wiązań wynoszą 120°; pozostałe dwa atomy znajdują się na przeciwległych końcach cząsteczki. Niektóre pierwiastki z grupy 15 układu okresowego tworzą związki typu ![]() ; przykładami są
; przykładami są ![]() i
i ![]() .
.

Oktahedral
Octa- oznacza osiem, a -hedral odnosi się do twarzy ciała stałego, więc „oktahedral” dosłownie oznacza „posiadający osiem twarzy”. Kąty wiązań są wszystkie 90°, i tak jak cztery pary elektronów doświadczają minimalnego odpychania, gdy są skierowane w stronę rogów czworościanu, sześć par elektronów próbuje skierować się w stronę rogów ośmiościanu. Przykładem cząsteczki oktaedrycznej (![]() ) jest sześciofluorek siarki (
) jest sześciofluorek siarki (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktywne: Geometria elektronowa: Molekuły przyjmują różne kształty ze względu na wzorce współdzielonych i nie współdzielonych elektronów. W tych przykładach wszystkie elektrony wpływające na kształt cząsteczek są współdzielone w wiązaniach kowalencyjnych trzymających atomy razem w celu utworzenia cząsteczek.
Samotne pary elektronów
Niewiążące elektrony są na orbitalach, które zajmują przestrzeń, odpychają inne orbitale i zmieniają kształt cząsteczki.
CELE NAUCZANIA
Rozpoznać wpływ samotnych par elektronów na geometrię cząsteczek.
KEY TAKEAWAYS
Key Points
- Orbitale zawierające różne wiążące i niewiążące pary w powłoce walencyjnej będą rozciągać się od atomu centralnego w kierunkach, które minimalizują ich odpychanie.
- Orbital niewiążący nie ma jądra atomowego na jego dalekim końcu, aby przyciągnąć chmurę elektronów w jego kierunku; ładunek w takim orbitalu będzie zatem skoncentrowany bliżej centralnego atomu.
- Orbitale niewiążące wywierają większe odpychanie na inne orbitale niż orbitale wiążące.
Key Terms
- liczba koordynacyjna: w chemii i krystalografii, liczba sąsiadów atomu centralnego w cząsteczce lub krysztale
- samotna para: walencyjny zestaw dwóch elektronów, który istnieje bez wiązania lub dzielenia się z innymi atomami
Geometrie molekularne z elektronami samotnej pary
Do tej pory omawialiśmy tylko geometrie bez żadnych samotnych par elektronów. Jak zapewne zauważyłeś w tabeli z geometriami i metodą AXE, dodanie samotnych par zmienia kształt cząsteczki. Wspomnieliśmy wcześniej, że jeśli centralny atom zawiera również jedną lub więcej par elektronów niezwiązanych, to te dodatkowe regiony o ujemnym ładunku będą zachowywały się podobnie jak te związane z atomami związanymi. Orbitale zawieraj±ce różne wi±ż±ce i niewi±ż±ce pary w powłoce walencyjnej rozci±gn± się od atomu centralnego w kierunkach, które minimalizuj± ich wzajemne odpychanie.

Liczba koordynacyjna i atom centralny
Liczba koordynacyjna odnosi się do liczby par elektronowych, które otaczają dany atom, często określany jako atom centralny. Geometrie cząsteczek z samotnymi parami będą się różnić od tych bez samotnych par, ponieważ samotna para wygląda jak pusta przestrzeń w cząsteczce. Obie klasy geometrii są nazwane po kształtach wyimaginowanych figur geometrycznych (głównie regularnych wielokątów foremnych), które byłyby wyśrodkowane na centralnym atomie i mają parę elektronów w każdym wierzchołku.
W cząsteczce wody (![]() ), centralny atom jest
), centralny atom jest ![]() , a wzór kropki elektronowej Lewisa przewiduje, że będą dwie pary elektronów niezwiązanych. Atom tlenu będzie zatem skoordynowany tetraedrycznie, co oznacza, że znajduje się w centrum tetraedru. Dwie z pozycji koordynacyjnych są zajęte przez współdzielone pary elektronowe, które tworzą wiązania O-H, a pozostałe dwie przez pary niewiążące. Dlatego, mimo że atom tlenu jest skoordynowany tetraedrycznie, geometrię wiązania (kształt) cząsteczki
, a wzór kropki elektronowej Lewisa przewiduje, że będą dwie pary elektronów niezwiązanych. Atom tlenu będzie zatem skoordynowany tetraedrycznie, co oznacza, że znajduje się w centrum tetraedru. Dwie z pozycji koordynacyjnych są zajęte przez współdzielone pary elektronowe, które tworzą wiązania O-H, a pozostałe dwie przez pary niewiążące. Dlatego, mimo że atom tlenu jest skoordynowany tetraedrycznie, geometrię wiązania (kształt) cząsteczki ![]() określa się jako wygiętą.
określa się jako wygiętą.

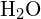 jest opisana jako wygięta.
jest opisana jako wygięta.Efekt odpychający elektronów samotnej pary
Istnieje ważna różnica pomiędzy orbitalami elektronowymi wiążącymi i niewiążącymi. Ponieważ niewiążący orbital nie ma jądra atomowego na jego dalekim końcu, aby przyciągnąć chmurę elektronów do niego, ładunek w takim orbitalu będzie skoncentrowany bliżej centralnego atomu; w konsekwencji, niewiążące orbitale wywierają więcej odpychania na inne orbitale niż orbitale wiążące. W ![]() , dwa niewiążące orbitale popychają orbitale wiążące bliżej siebie, czyniąc kąt H-O-H 104.5° zamiast tetraedrycznego kąta 109.5°.
, dwa niewiążące orbitale popychają orbitale wiążące bliżej siebie, czyniąc kąt H-O-H 104.5° zamiast tetraedrycznego kąta 109.5°.
Elektronowo-kropkowa struktura ![]() umieszcza jedną parę niewiążących elektronów w powłoce walencyjnej atomu azotu. Oznacza to, że istnieją trzy związane atomy i jedna samotna para dla liczby koordynacyjnej cztery wokół azotu, tak samo jak występuje w
umieszcza jedną parę niewiążących elektronów w powłoce walencyjnej atomu azotu. Oznacza to, że istnieją trzy związane atomy i jedna samotna para dla liczby koordynacyjnej cztery wokół azotu, tak samo jak występuje w ![]() .
.

 …: Samotna para dołączona do centralnego azotu tworzy kąty wiązań, które różnią się od tetraedrycznych 109,5 °.
…: Samotna para dołączona do centralnego azotu tworzy kąty wiązań, które różnią się od tetraedrycznych 109,5 °.Możemy zatem przewidzieć, że trzy atomy wodoru będą leżeć na rogach czworościanu skupionego na atomie azotu. Orbital samotnej pary będzie skierowany w stronę czwartego rogu czworościanu, ale ponieważ ta pozycja będzie pusta, sama cząsteczka ![]() nie może być czworościanem; zamiast tego przyjmuje kształt piramidy, a dokładniej ostrosłupa trójkątnego (ostrosłupa o podstawie trójkąta). Wszystkie atomy wodoru znajdują się w tej samej płaszczyźnie, a azot poza nią. Niewiążące elektrony popychają orbitale wiążące razem nieznacznie, co sprawia, że kąty wiązania H-N-H około 107°.
nie może być czworościanem; zamiast tego przyjmuje kształt piramidy, a dokładniej ostrosłupa trójkątnego (ostrosłupa o podstawie trójkąta). Wszystkie atomy wodoru znajdują się w tej samej płaszczyźnie, a azot poza nią. Niewiążące elektrony popychają orbitale wiążące razem nieznacznie, co sprawia, że kąty wiązania H-N-H około 107°.
W 5 skoordynowanych cząsteczkach zawierających samotne pary, te niewiążące orbitale (które są bliżej centralnego atomu, a więc bardziej prawdopodobne, aby być odpychane przez inne orbitale) będą preferencyjnie rezydować w płaszczyźnie równikowej. To umieści je pod kątem 90° w stosunku do nie więcej niż dwóch osiowo zorientowanych orbitali wiążących. Możemy zatem przewidzieć, że cząsteczka ![]() (taka, w której centralny atom A jest skoordynowany z czterema innymi atomami X i z jedną niewiążącą parą elektronów) taka jak
(taka, w której centralny atom A jest skoordynowany z czterema innymi atomami X i z jedną niewiążącą parą elektronów) taka jak ![]() będzie miała kształt „piły”.
będzie miała kształt „piły”.

Zastąpienie par niewiążących dla związanych atomów zmniejsza koordynację trójkątnej piramidy do jeszcze prostszych kształtów molekularnych.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interactive: Niewspólne elektrony i „wygięty” kształt: Użyj modelu 3D, aby zobaczyć, jak elektrony niedzielone odpychają te, które są dzielone w wiązaniach między wodorem i tlenem, powodując, że cząsteczka ma „wygięty” kształt.
LICENCJE I ATRYBUTY
CC LICENSED CONTENT, SHARED PREVIOUSLY
- Curation and Revision. Dostarczone przez: Boundless.com. Licencja: CC BY-SA: Attribution-ShareAlike
CC LICENSED CONTENT, SPECIFIC ATTRIBUTION
- VSEPR Theory. Dostarczone przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencja: CC BY-SA: Attribution-ShareAlike
- Geometria molekularna. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/Molecular_geometry. Licencja: CC BY-SA: Attribution-ShareAlike
- Teoria VSEPR. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licencja: CC BY-SA: Attribution-ShareAlike
- Geometria molekularna. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/Molecular_geometry. Licencja: Public Domain: No Known Copyright
- VSEPR geometries. Dostarczone przez: Wikimedia. Zlokalizowane na: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencja: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Zlokalizowane na: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencja: Public Domain: No Known Copyright. Warunki licencji: Standardowa licencja YouTube
- Kulki liniowe-3D. Dostarczone przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencja: CC BY: Attribution
- Geometria molekularna. Dostarczone przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/Molecular_geometry. Licencja: CC BY-SA: Attribution-ShareAlike
- Teoria VSEPR. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencja: CC BY-SA: Attribution-ShareAlike
- Teoria VSEPR. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licencja: CC BY-SA: Attribution-ShareAlike
- Geometria molekularna. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/Molecular_geometry. Licencja: Public Domain: No Known Copyright
- VSEPR geometries. Dostarczone przez: Wikimedia. Zlokalizowane na: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencja: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Zlokalizowane na: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencja: Public Domain: No Known Copyright. Warunki licencji: Standardowa licencja YouTube
- Kulki liniowe-3D. Dostarczone przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencja: CC BY: Atrybucja
- Teoria VSEPR. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencja: Public Domain: No Known Copyright
- VSEPR Theory. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencja: Public Domain: No Known Copyright
- numer koordynacyjny. Dostarczony przez: Wiktionary. Zlokalizowane na: http://en.wiktionary.org/wiki/coordination_number. Licencja: CC BY-SA: Attribution-ShareAlike
- John Hutchinson, Studia nad rozwojem koncepcji w chemii. September 18, 2013. Dostarczone przez: OpenStax CNX. Zlokalizowane na: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licencja: CC BY: Attribution
- Bez ograniczeń. Dostarczony przez: Boundless Learning. Zlokalizowane na: http://www.boundless.com//chemistry/definition/lone-pair. Licencja: CC BY-SA: Attribution-ShareAlike
- Geometria molekularna. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/Molecular_geometry. Licencja: Public Domain: No Known Copyright
- VSEPR geometries. Dostarczone przez: Wikimedia. Zlokalizowane na: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licencja: CC BY-SA: Attribution-ShareAlike
- How to Determine Molecular Geometry – YouTube. Zlokalizowane na: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licencja: Public Domain: No Known Copyright. Warunki licencji: Standardowa licencja YouTube
- Kulki liniowe-3D. Dostarczone przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licencja: CC BY: Atrybucja
- Teoria VSEPR. Udostępnione przez: Wikipedia. Zlokalizowane na: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencja: Public Domain: No Known Copyright
- VSEPR Theory. Udostępnione przez: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licencja: Public Domain: No Known Copyright
- VSEPR Theory. Udostępnione przez: Wikipedia. Located at: http://en.wikipedia.org/wiki/VSEPR_Theory. Licencja: Public Domain: No Known Copyright
- Tetrahedral_Structure_of_Water.png. Dostarczone przez: Wikimedia. Located at: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licencja: Public Domain: No Known Copyright
model chemiczny służący do przewidywania kształtu poszczególnych cząsteczek na podstawie odpychania elektrostatycznego elektronów i par elektronów
całkowita liczba atomów bezpośrednio sąsiadującychpara odpychanie elektrostatyczne
całkowita liczba atomów, które bezpośrednio sąsiadują z atomem centralnym w cząsteczce lub jonie
dwa (para) elektrony walencyjne, które nie są wykorzystywane do tworzenia wiązania kowalencyjnego
.