Interakcje między mózgiem a procesem krzepnięcia mają długą historię, włączając obserwację, że mechanizm krzepnięcia w centralnym układzie nerwowym ma pewną liczbę różnic od tego znalezionego w innych organach- śródbłonek mózgu wyrażający mało trombomoduliny, na przykład.
Cokolwiek mechanizm, to jest trudne do uniknięcia obserwacji , że leczenie z antykoagulacją (np., heparyną drobnocząsteczkową) często radykalnie odwraca objawy, w tym migrenę, trudności z pamięcią i pląsawicę. Takie obserwacje sugerują, że patologia mózgu w wielu przypadkach może nie być tak bardzo zawał, ale może odnosić się bardziej do „szlamowania” dopływu krwi i upośledzonego natlenienia.
Migrena & Udar
„Czy cierpiałeś na bóle głowy jako nastolatek?”
„Tak, doktorze. Przez pewien czas występowały prawie co tydzień. Ustąpiły na kilka lat, ale teraz wróciły z całą mocą. Występują w mojej rodzinie.”
Tak mówi 30-letnia pacjentka z APS (męscy członkowie rodziny rzadziej pojawiają się w klinikach APS).
Jest to tak ważna wskazówka diagnostyczna w ocenie pacjenta z możliwym APS. Jednak mimo wielu lat doświadczeń z APS, zaskakująco mało jest danych oceniających prawdziwą rolę APS w szerszym świecie migreny. Jest tak wiele powodów, aby badać to skojarzenie – odpowiedź na antykoagulację – zwykle dobra, często uderzająca – badanie rodzeństwa i innych członków rodzin pacjentów z migreną/APS. I ponad wszystko inne, związki teraz zgłaszane między migreną i udarem.
APS/Hughes syndrom jest bardzo dużo neurologiczny warunek. Funkcja mózgu wydaje się być szczególnie ukierunkowana – im więcej pacjentów z APS się widzi, tym szerzej rozchodzą się neuropsychiatryczne fale.
Podobnie jak migrena, udar jest jednym z uznanych powikłań APS/zespołu Hughesa. Odnotowano, że 1 na 5 młodych udarów (poniżej 45 roku życia) ma dodatni wynik testu na obecność aPL.14-19
Jednakże, podobnie jak w przypadku migreny, rozpoznawanie aPL w etiologii udaru jest, ogólnie rzecz biorąc, nadal słabe. Na przykład udar mózgu u dzieci – dobrze rozpoznany klinicznie – jest głównym celem badań nad aPL.
Kilka lat temu rząd Wielkiej Brytanii rozpoczął ważną inicjatywę dotyczącą udaru mózgu, edukując społeczeństwo na temat objawów, oznak i leczenia udaru. Zespół antyfosfolipidowy nie znalazł się na liście.
Zajęcia
W 1985 roku zaobserwowaliśmy, że u pacjentów z toczniem, napady drgawkowe były częstsze u pacjentów z dodatnimi testami aPL.20 Od tego czasu stało się jasne, że padaczka, we wszystkich swoich formach, jest ważnym towarzyszem APS. Do tego stopnia, że w jednym z badań nad idiopatyczną padaczką u nastolatków, u 1 na 5 stwierdzono dodatni wynik testu na aPL.21

Wstępne badanie położnej lub położnika powinno obejmować prosty kwestionariusz w celu wykluczenia APS.
Image Credit: SPL/Science Source
Rozwiązania wynikające z tych obserwacji są liczne. Podam dwa przykłady kliniczne:
Po pierwsze, padaczka płata skroniowego w APS może być niedostatecznie rozpoznana. Jedna z moich pacjentek, kobieta z klasycznym APS, została technikiem EEG. Podczas szkolenia wykorzystała czwórkę swojego rodzeństwa jako króliki doświadczalne. Troje z nich miało nieprawidłową aktywność płatów skroniowych. Interesujące jest to, jak często wywiad rodzinny dotyczący padaczki pojawia się w wywiadzie pacjentów z APS.
Druga anegdota kliniczna została opublikowana w innym miejscu.22 42-letnia pacjentka miała w przeszłości łagodny toczeń. Jednak jej głównym problemem – mającym istotny wpływ na jej pracowite życie – były nawracające napady drgawek, zarówno małych, jak i dużych, przy czym te ostatnie wymagały specjalistycznej opieki i połączenia kilku leków przeciwpadaczkowych. Podczas pobytu w Londynie wystąpiła u niej DVT (stwierdzono, że jest aPL dodatnia) i rozpoczęto rutynową antykoagulację warfaryną. Natychmiastowym i nieoczekiwanym bonusem było znaczne zmniejszenie częstotliwości i ciężkości napadów, wymagających znacznie mniej agresywnego leczenia przeciwpadaczkowego.
’THE STILLBIRTH SCANDAL: Każdego dnia aż trzy dzieci w Wielkiej Brytanii rodzą się martwe, które mogły żyć. Jeden na 200 porodów u brytyjskich kobiet będzie martwo urodzony. Nadszedł czas, aby NHS przyjął nową politykę i nowe podejście. -The Times (Londyn), 28 listopada 2012
Utrata pamięci
Prawdopodobnie najczęstszym objawem APS jest utrata pamięci. Często problem ten wychodzi na światło dzienne dopiero wtedy, gdy pacjent jest pytany o ten symptom. Tak wielu pacjentów przyznaje się do obaw związanych z chorobą Alzheimera. Jak dotąd, szczegółowych badań klinicznych jest niewiele. Od czasu do czasu, i trzeba przyznać, że w sposób dość sporadyczny, przeprowadzaliśmy testy psychometryczne na wybranych pacjentach z APS – wyniki były często zaskakujące. Tym bardziej, biorąc pod uwagę uderzającą poprawę widoczną w testach pamięci po rozpoczęciu antykoagulacji.23
Stwardnienie rozsiane
Wobec widocznych w APS cech neurologicznych, w tym zaburzeń widzenia i mielopatii fluktuacyjnej, nie jest zaskakujące, że wiele przypadków jest diagnozowanych jako stwardnienie rozsiane.24,25
Ten temat jest daleki od prostoty. Niektórzy w neurologii twierdzą, że pozytywne wyniki testów na aPL są w rzeczywistości czasami obserwowane w klasycznym MS. Ja wolałbym odwrócić ten obraz. Tacy pacjenci, przynajmniej niektórzy, mogą być APS pierwszym i MS drugim. Chociaż anegdotycznie pewna liczba takich przypadków odpowiada na antykoagulację, w innych odpowiedź jest, w najlepszym razie, graniczna. Uthman dokonał ostatnio przeglądu dość obszernej literatury dotyczącej APS i MS.26
Inne cechy neurologiczne
Należą do nich problemy z utrzymaniem równowagi (kilka przypadków prezentujących się jako choroba Meniere’a), pląsawica (czasami ciężka),27,28 anosmia, zaburzenia snu (w tym katapleksja i narkolepsja) oraz, ostatnio, zaburzenia autonomiczne z serią przypadków POTS (zespół posturalnej tachykardii ortostatycznej).29
Jedną z kwestii, na temat których toczy się debata, jest częstość występowania objawów psychiatrycznych.
Moim zdaniem ostra psychoza była bardziej cechą tocznia niż APS, ale w tym mogę się mylić. Jeden z moich pacjentów, kobieta z APS i OCD (obsessive compulsive disorder), poprawił się z leczeniem przeciwzakrzepowym. Interesująco, jej nastoletni syn, również pacjent z OCD (i aPL pozytywny), znalazł neuropsychiatryczne manifestacje były dużo mniej widoczne kiedy aspiryna leczenie było zaczęte.
Nie mózg
Kości & stawy-Czy cierpiałeś na jakiekolwiek złamania? Pytanie, które być może nie jest częścią rutynowego zbierania wywiadu u pacjentów z APS. A jednak spontaniczne złamania kości stają się dobrze rozpoznawane po doniesieniu o 27 spontanicznych złamaniach kości śródstopia przez dr Shirisha Sangle u pacjentów z APS.30
Potwierdzone doniesienia sugerują, że (niedokrwienne) złamania kości mogą być ważną manifestacją choroby: Mój kolega, profesor Munther Khamashta, ma pacjenta z zespołem Hughesa z prawidłowymi wynikami badań DEXA i przytarczyc, u którego doszło do 57 spontanicznych złamań. Najwyraźniej jest to ważny obszar dla badań klinicznych.
Podobnie, ból biodra spowodowany martwicą awaskularną (AVN) nie jest rzadkością u naszych pacjentów z APS. MRI wykazał wczesną AVN w niektórych przypadkach bez innych czynników ryzyka, takich jak steroidy. Moje wrażenie kliniczne jest takie, że ból biodra często poprawia się po włączeniu heparyny lub warfaryny.
Serce-Poważnym problemem jest obecność dławicy piersiowej i innych objawów sercowych w APS. Pomimo kilku wczesnych doniesień o niedokrwieniu mięśnia sercowego i zakrzepicy naczyń wieńcowych, dopiero w ostatnich latach wzrosła częstość publikacji ujawniających dużą częstość tych powikłań.
Dwoma przykładami są badania Greco i wsp. wykazujące stosunkowo dużą częstość występowania dodatnich testów aPL u pacjentów z niedokrwieniem mięśnia sercowego oraz uderzająca obserwacja, że kobiety palące w trakcie przyjmowania pigułek, u których stwierdzono dodatni wynik testu aPL, miały 22-krotnie większe ryzyko względne rozwoju zawału mięśnia sercowego.31,32
Kardiologiczne powiązania zwiększa doniesienie o związku z zespołem sercowym X, dławicą piersiową z prawidłowym obrazem angiograficznym naczyń wieńcowych.33 Można się założyć, że badanie aPL stanie się standardem w klinice kardiologicznej, zwłaszcza u objawowych kobiet poniżej 40. roku życia.
Podobnie jak migrena, udar mózgu jest jednym z uznanych powikłań APS/zespołu Hughesa. Odnotowano nawet 1 na 5 młodych udarów (poniżej 45 r.ż.) z dodatnimi testami na obecność aPL.
Droga jelitowa &wątrobaOd czasu naszych obserwacji dotyczących ogniskowych zmian zwężających w różnych tętnicach, w tym w tętnicach celiakii i krezkowych, skupiliśmy się bardziej na objawach dławicy piersiowej u pacjentów z aPL/APS.34 Jest to stan trudny do określenia ilościowego, ale widzieliśmy wiele przypadków, w których klopidogrel lub heparyna spowodowały poprawę (czasami znaczną) w bólu poposiłkowym.
Chociaż zajęcie wątroby w toczniu jest rzadkie, nieprawidłowe testy czynnościowe wątroby w APS są postrzegane często. Chociaż mogą one zapowiadać poważną zakrzepicę wątroby, taką jak zespół Budda-Chiariego lub zespół HELLP w ciąży, ostrzegający przed zbliżającą się katastrofą APS, częściej mają bardziej łagodne rokowanie.35,36
Jeden bardzo pozytywny przypadek: We wczesnych latach 80. widziałem nastoletnią dziewczynę z DVT, dodatnią aPL i zespołem Budda-Chiariego.
Pogorszone rokowanie?
Po ponad trzydziestu latach nadal ma się dobrze, lecz jest ostrożnie leczona warfaryną przez całe życie przez swoich lekarzy w Portugalii.
Choroba Goldblatta, nerka & APS- Zwężenie tętnicy nerkowej, widziane na jasnym tle inaczej normalnych tętnic, może naśladować wczesne obserwacje Goldblatta na temat rozwoju nadciśnienia u zwierząt z doświadczalnie zatkanymi tętnicami nerkowymi. Odkrycie przez Sangle’a zmian zlokalizowanych w zwężeniu tętnicy nerkowej doprowadziło do podobnych obserwacji w innych naczyniach, co doprowadziło do powstania teorii o zlokalizowanej patologii zakrzepowo-śródbłonkowej.37
Skóra: livedo reticularis, enigma – Chociaż owrzodzenia skóry, poszerzone żyły i krwotoki podpaznokciowe są dobrze znanymi następstwami zakrzepicy skóry w APS, livedo reticularis ma aurę tajemniczości.38,39
Diagnostycznie, jego obecność jest ważną wskazówką u pacjentów podejrzewanych o posiadanie zespołu Hughesa- włączając seronegatywny APS.
Patrząc wstecz na niektóre ze stanów wspomnianych w tym artykule-MS, migrena, wielokrotne złamania, problemy z pamięcią-na przykład, można się zastanawiać czy staranne odnotowanie obecności lub braku livedo może okazać się istotne w diagnostyce różnicowej tych stanów.
Jedna rzecz jest pewna: Obecność livedo dodaje dodatkowy wymiar do ciężkości obrazu klinicznego.
Ciąża
Oczywiście, główną historią zespołu jest ciąża, gdzie wskaźnik powodzenia zdrowych porodów w ciążach aPL-dodatnich wzrósł z poniżej 15% do ponad 90%. Bez wątpienia rozpoznanie i leczenie tych przypadków stanowiło znaczący postęp w świecie położnictwa.40
Niestety, my wszyscy pracujący z APS opiekowaliśmy się pacjentkami aPL-dodatnimi (niektóre z nich wcześnie poroniły), które straciły dziecko w późnym okresie ciąży. Martwe urodzenia.
Dwa lata temu londyński The Times opublikował artykuł zatytułowany „Skandal związany z martwymi urodzeniami”, podkreślając słabe dane dotyczące martwych urodzeń w Wielkiej Brytanii.41 Jednak niektórym przypadkom martwych urodzeń u kobiet aPL-dodatnich można było zapobiec. Na przykład ostatnie badanie z Utah wykazało, że ciąże z aPL miały trzy- do pięciokrotnie zwiększone prawdopodobieństwo martwego urodzenia.42
Czy bardziej rutynowe badanie aPL w ciąży pomogłoby? Należy wziąć pod uwagę koszty. Poronienia są częste i mają wiele przyczyn. W związku z tym obecne zalecenia nakazują zarezerwowanie badań dla kobiet, u których wystąpiły trzy lub więcej poronień. Wydaje się to surowe. Być może prosty proces przesiewowy mógłby pomóc.
Zasugerowałem, że część wstępnych badań położnej lub położnika powinna zawierać prosty trzyczęściowy kwestionariusz:
- Czy miała Pani zakrzepicę?
- Czy cierpi Pani na migrenę?
- Czy ma Pani w rodzinie historię chorób autoimmunologicznych (tj, toczeń, RZS, stwardnienie rozsiane, choroby tarczycy)?
Jestem pewien, że taki prosty kwestionariusz mógłby pomóc w identyfikacji małej grupy ryzyka.
W większości ośrodków, po bezpiecznym odesłaniu matki i dziecka do domu, nie prowadzi się długoterminowej obserwacji. Często jednak pacjentki z APS zgłaszające się w wieku, powiedzmy, 40 lat z problemem zakrzepowym, podają historię poronienia sprzed 20 lat. W idealnym świecie kobiety z nawracającymi poronieniami zasługują na regularną, długoterminową obserwację. Ale świat jest daleki od ideału.
Lupus & APS
Wczesne badania kliniczne APS były prowadzone w klinikach tocznia i mogły równie dobrze zawierać „cechy tocznia”. Być może zaskakująco, czas pokazał niewielką różnicę pomiędzy pierwotnym APS a APS związanym z toczniem. Istnieją niewątpliwie pewne klasyczne cechy tocznia (np. zapalenie wsierdzia Libmana Sachsa, udar, drgawki), które są bardziej prawdopodobne, że są związane z aPL. Wydaje się również prawdopodobne, że pozytywność aPL w toczniu przyznaje wyższy wskaźnik przewlekłości.
Przebieg czasu ujawnił również jedno pozytywne odkrycie: Jest to bardzo nietypowe dla pacjentów z pierwotnym APS, aby rozwinąć toczeń w późniejszych latach.
Wielka trójka
Stowarzyszenie pomiędzy zespołem Hughesa, chorobą Sjögrena i niedoczynnością tarczycy jest tak powszechne, że podjąłem się nazywania ich wielką trójką. Klinicznie, to jest ważne stowarzyszenie ponieważ kliniczne objawy trzech warunków – zmęczenie, zimne krążenie, bóle i bóle, równowaga i problemy z pamięcią – są wspólne dla wszystkich trzech. Podobnie, wielu z tych pacjentów jest obciążonych etykietą fibromialgii.
Każdy z tych trzech połączonych zespołów może dobrze reagować na leczenie – na przykład kliniczny zespół Sjögrena na hydroksychlorochinę i tak dalej. Wielu z tych pacjentów jest na moich dwóch drzewach leczenia – wierzbie (aspiryna) i cinchonie (chinina).
Seronegatywny APS
Wierzę, że jedną z korzyści płynących z czasu spędzonego przez klinicystę stażystę w laboratorium jest uznanie, że wiele testów laboratoryjnych jest otwartych na zmienność. W wielu, wielu badaniach próbowano ocenić znaczenie miana, klasy immunoglobulin, potrójnej lub podwójnej dodatniości, znaczenia „innych” aPL, takich jak antyfosfatydyloseryna itp.43,44
Ogólnie rzecz biorąc, wszystkie te cechy mają znaczenie, ale w klinice niektóre z nich nie pasują, jak na przykład pacjenci ze wszystkimi klinicznymi cechami APS, u których testy aPL pozostają uparcie ujemne.
Kilka lat temu napisaliśmy pracę wprowadzającą termin seronegatywny APS, zwracając uwagę na pacjentów z silnymi klinicznymi cechami APS, ale z ujemnymi testami.45 Koncepcja ta sięga wczesnych dni seronegatywnego RZS i seronegatywnego tocznia – oba te oznaczenia, chociaż oparte wyłącznie na obserwacji klinicznej, miały ważne konsekwencje terapeutyczne i prognostyczne.
Trzy możliwe wyjaśnienia seronegatywnego APS to: 1) diagnoza jest nieprawidłowa (mało prawdopodobne we wszystkich przypadkach); 2) poprzednio pozytywne testy stały się negatywne z czasem (rzadkie w moim doświadczeniu); lub 3) potrzebne są nowe testy.46
Prawdopodobnie najsilniejszy powód dla otwartości umysłu na temat seronegatywnego APS pochodzi z badań rodzinnych. Kilka tygodni temu widziałem parę identycznych bliźniąt – pierwsze z klasycznym seropozytywnym APS, które później przyprowadziło swoją (absolutnie) identyczną siostrę bliźniaczkę. Druga bliźniaczka miała identyczny zestaw objawów, ale w przeciwieństwie do pierwszej bliźniaczki miała negatywne wyniki testów na aPL. Obie pacjentki odpowiedziały na leczenie.
Co roku organizujemy w naszym szpitalu spotkanie pacjentów. Na ostatnim spotkaniu przygotowaliśmy prosty anonimowy kwestionariusz z dwoma pytaniami: Czy jesteś pacjentem z APS lub przyjacielem/ współmałżonkiem? Czy masz bliską krewną płci żeńskiej (siostrę, matkę, ciotkę) z chorobą autoimmunologiczną (np. toczeń, RZS, tarczyca, stwardnienie rozsiane, APS)? Wynik: Sześćdziesiąt procent pacjentów miało pozytywny wywiad dotyczący chorób autoimmunologicznych u bliskich krewnych. Mniej niż 20% przyjaciół/małżonków odpowiedziało pozytywnie.
Może być , że moje własne doświadczenie jest wypaczone przez referral bias od rodzin pacjentów APS- ale seropozytywny albo nie, większość pacjentów z seronegatywnym APS odpowiada tak samo dobrze do leczenia.
Jeśli kilka z tych osobników w badaniu rodziny zrobiło, w rzeczywistości, mają seronegatywny APS jeszcze byli potencjalnie reagujący na leczenie, wtedy możliwości są intrygujące. Być może większy procent naszych migreny, młodego udaru, młodych pacjentów dławicy piersiowej mógłby skorzystać z bliższego spojrzenia dla więcej z wskazówek do APS- suchy Schirmera, livedo, rodzinna historia choroby autoimmunologicznej- na przykład.
Aspekty leczenia
Na wiele sposobów, to jest rozczarowujące wyznać , że 30 lat dalej, są mało nowych terapii. Wprowadzenie nowych doustnych antykoagulantów w leczeniu APS było przewidywalnie ostrożne i jest zbyt wcześnie na uogólnienia.47
Statyny, IVIG i hydroksychlorquina zostały wrzucone do mieszanki i, oczywiście, terapia przeciw komórkom B otrzymała korzystne anegdoty. W niedawnym badaniu z Paryża zasugerowano, że sirolimus, stosowany w przeszczepach nerek, może mieć ochronny wpływ na waskulopatię wywołaną przez aPL.48
Więc w 2016 roku obecne leczenie APS jest nadal w dużej mierze ograniczone do aspiryny, klopidogrelu, heparyny i warfaryny.
Aspiryna w niskich dawkach, pomimo jej krytyków, jest oczywiście lekiem pierwszego wyboru u wielu pacjentów z APS. Klopidogrel pozostaje jednak użyteczną alternatywą u pacjentów z zapaleniem błony śluzowej żołądka lub u astmatyków. Ale jest jeszcze trzecia rola dla klopidogrelu – ważna w prawdziwym świecie medycyny praktycznej – to znaczy u tych pacjentów, którzy z jakiegokolwiek powodu próbowali aspiryny bez wyraźnych korzyści.
Heparyna – heparyna drobnocząsteczkowa w większości krajów w znacznym stopniu zastąpiła starą heparynę, a wraz z nią zniknęły obawy przed małopłytkowością i osteoporozą. Jest to ważny punkt, ponieważ wielu lekarzy jest niechętnych przedłużaniu stosowania heparyny.
Dwie obserwacje: Po pierwsze, liczba pacjentów poprawia się dramatycznie na heparynie, tylko po to, aby czuć się gorzej na warfarynie.
Gdzie iść dalej? Po wykluczeniu (miejmy nadzieję) problemów z dawkowaniem, opornością na warfarynę i przestrzeganiem zaleceń, jedną z opcji jest tymczasowy powrót do heparyny. W niektórych przypadkach tymczasowy powrót zamienił się w półdługoterminowy. W naszej klinice APS mamy kilkudziesięciu takich pacjentów, którzy z wyboru pozostali na heparynie podskórnej przez dwa lata lub dłużej. Tak, oni doświadczyli zasinienia, ale dotychczas, nie widzieliśmy pogarszających się skanów DEXA.
Druga (i bardzo kliniczna) obserwacja dotyczy próby heparyny. To jest regularna obserwacja , że aPL/APS pacjenci na heparynie podczas ciąży są często wolni od bólu głowy dla pełnych ośmiu albo dziewięciu miesięcy. To doprowadziło nas do opracowania narzędzia klinicznego – próby terapeutycznej, która bardzo nam się przydała. Próbą tą jest trzy- lub czterotygodniowy kurs heparyny LMW.49
Pozwólcie mi podać przykład jej zastosowania: U pacjenta z aPL/APS z coraz silniejszymi bólami głowy pomimo aspiryny/klopidogrelu (i z prawidłowym MRI mózgu), próba 10 000 jednostek dalteparyny (lub enoksaparyny) przez trzy lub cztery tygodnie może przynieść znaczące rezultaty. Po pierwsze, może dać zaskakująco jasne wskazanie, czy antykoagulacja jest właściwą drogą. Po drugie, u pacjenta z urazem, który przeszedł znaną drogę wielu konsultacji specjalistycznych, z granicznym sukcesem klinicznym, może to być główny punkt zwrotny – pierwszy namacalny znak poprawy.
Warfaryna – Niewiele nowego można powiedzieć o warfarynie. Została ona oczerniona przez media, ale pozostaje jednym z najbardziej użytecznych leków w naszym armamentarium. Warfaryna, mówiąc najprościej, chroni przed udarem mózgu i zawałem serca w APS.
Wspominano już o częstej potrzebie podwyższenia INR u wielu pacjentów z APS – zwłaszcza tych z cechami neurologicznymi. Jestem zdecydowanym zwolennikiem stosowania maszyn do samokontroli INR, kiedy tylko jest to możliwe u naszych pacjentów.
Niestety, niektóre kliniki leczenia przeciwzakrzepowego sprzeciwiają się stosowaniu maszyn do samokontroli. Według mnie, jest to błędne. Spójrz na wolność, jaką osiągnęła samokontrola dla insulinozależnych diabetyków.
Jako lekarze uważam, że mamy obowiązek (dopóki nie powstaną lepsze, nowsze antykoagulanty) wspierać warfarynę jako w dużej mierze bezpieczny, skuteczny lek, który uratował wiele tysięcy istnień.
W 2015 roku obecne leczenie zespołu Hughesa jest nadal w dużej mierze ograniczone do aspiryny, klopidogrelu, heparyny & warfaryny.
Miscellany
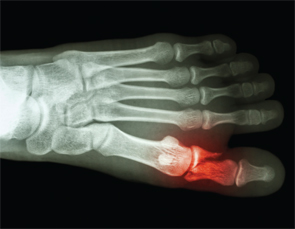
Spontaniczne złamania kości stają się dobrze rozpoznane po doniesieniu o 27 spontanicznych złamaniach kości śródstopia przez dr. Shirish Sangle u pacjentów z APS.
Image Credit: Puwadol Jaturawutthichai/.com
Rodzina-Nie jest niespodzianką, że historia rodziny jest ważną wskazówką w zespole Hughesa. Choroba autoimmunologiczna (szczególnie tarczycy) regularnie pojawia się jako diagnoza u krewnych naszych pacjentów. Ale jak często diagnozowane są te rodzinne przypadki? Przykłady mogą obejmować 17-letnią córkę pacjenta z APS cierpiącą na ból głowy i gorączkę gruczołową, rodzeństwo ze stwardnieniem rozsianym lub matkę i ciotkę nowo zdiagnozowanego pacjenta z APS, które doznały udaru mózgu we wczesnych latach 40-tych.
Nie jest niewyobrażalne, że APS zmienił bieg historii, jak w przypadku opisanym przez mojego przyjaciela, Dr. Geralda Weissmanna, królowej Anglii Anny, która miała 17 nieudanych ciąż i zmarła bezdzietnie, tym samym kładąc kres panowaniu Stuartów i rozpoczynając panowanie Hanowerczyków – z Jerzym III, podatkami w koloniach amerykańskich, rewolucją i narodzinami USA.50
Potomstwo-Do tej pory większość badań sugeruje, że potomstwo matek aPL-dodatnich nie ma żadnych poważnych negatywnych skutków (innych niż, być może, później rozwijające się dziedziczne cechy APS w niektórych). Jednakże, niektóre niepokojące opisy przypadków problemów płodowych i noworodkowych wskazują na potrzebę dalszych badań. Trwające badania dr Anne Parke, Angeli Tincani, Marii Claire Boffa i innych dostarczą z czasem niektórych z tych brakujących danych.51,52
Klasyfikacja a diagnoza-
Drogi Doktorze, byłbym wdzięczny, gdyby mógł Pan udzielić porady w sprawie tej pacjentki. W trakcie przyjmowania doustnych tabletek antykoncepcyjnych rozwinęła się u niej zakrzepica. Miała jeden pozytywny test na aPL, ale nie miała powtórzonego testu 12 tygodni później.
Tak jak w przypadku tocznia, kryteria klasyfikacji czasami mieszają się z diagnozą. Wielu pacjentów nie przychodzi uzbrojonych w testy „w odstępie 12 tygodni” (to kryterium zostało wprowadzone, aby pokryć ryzyko, że współistniejąca infekcja mogła doprowadzić do przejściowego pozytywnego testu aPL-nie jest to główny czynnik w naszej ocenie tego pacjenta).
Istnieją również względy finansowe, takie jak w następującym badaniu z Bejrutu, Liban.
„Tylko 50.5% miało przetestowane zarówno aCL jak i LA. … Koszt każdego testu wynosił około 50 USD dla pacjenta. … Pozostaje sprawdzić, czy koszty testu mogą częściowo wyjaśnić bardzo mały odsetek pacjentów, którzy poddali się kolejnemu testowi potwierdzającemu.”
Przebieg czasu ujawnił również jedno pozytywne odkrycie: To bardzo nietypowe dla pacjentów z pierwotnym APS, aby rozwinąć toczeń w późniejszych latach.
Uznanie wielu pozakrzepowych manifestacji APS dodało do znaczenia oddzielenia diagnozy od klasyfikacji. Być może z czasem z pomocą przyjdą nam postępy laboratoryjne w zakresie pomiaru potencjalnych markerów ryzyka.44
Lęk przed lataniem – Ta anegdota kliniczna pojawia się regularnie w mojej klinice. Do tego stopnia, że uważam, iż wymaga ona dalszych badań. Wielu moich pacjentów z APS, szczególnie przed rozpoczęciem leczenia, cierpi z powodu przedłużającego się jet lag po długim locie, ze zmęczeniem, bólem głowy i dezorientacją, czasami trwającymi przez wiele dni.
Co ciekawe, po skutecznym rozpoczęciu leczenia heparyną lub warfaryną, zjawisko to znika. Czy te objawy odnoszą się do łagodnego mózgowego niedotlenienia drugiego do nieznacznie zmniejszonego ciśnienia w kabinie nie jest znane. Niemniej jednak niektórzy z moich pacjentów z APS uzupełniają leczenie aspiryną przed długim lotem zastrzykiem heparyny LMW. Chociaż efekt placebo może być znaczny, jestem pod wystarczającym wrażeniem doświadczenia klinicznego tych (obserwujących) pacjentów, aby uwierzyć, że zjawisko przedłużonego jet lagu u wielu naszych pacjentów jest bardzo realne.
Przyszłość-Podczas 14th International Congress on Antiphospholipid Antibodies, który odbył się w Rio de Janeiro w 2013 roku, poproszono mnie o moje przewidywania dotyczące przyszłości APS.23 Podsumowując, uważam, że:
- badanie aPL stanie się ogólnoświatowe i rutynowe;
- Zestawy do testowania aPL bez recepty staną się dostępne;
- Znaczący podzbiór osób cierpiących na migrenę będzie miał nową nadzieję;
- APS zostanie uznane jako główny związek między migreną a udarem mózgu;
- Zmniejszy się liczba ataków serca u młodych kobiet (szczególnie tych poniżej 45 roku życia);
- Zmniejszy się liczba udarów mózgu u osób poniżej 45 roku życia;
- Niektóre przypadki przyspieszonej choroby tętnic zostaną rozpoznane jako związane z (nieleczoną) aPL;
- Niektóre przypadki utraty pamięci są uleczalne;
- APS będzie nadal wywierać głęboki wpływ na naszą ocenę kliniczną i leczenie tocznia; i
- Wreszcie, aby powrócić do tematu otwarcia, częstość występowania martwych urodzeń zostanie zredukowana, dzięki, częściowo, bardziej proaktywnemu podejściu do testowania aPL w ciąży.
Aby powtórzyć zdanie wzięte z papieru z 1983 roku:1
Dla tych z nas zahartowanych w nihilizmie przez lata badań różnych autoprzeciwciał w SLE, jest rzadkie poczucie podniecenia przy implikacjach stowarzyszeń obecnie zgłaszanych.
Trzydzieści lat później, to kliniczne podniecenie pozostaje niezmniejszone.
 Graham R.V. Hughes, MD, FRCP, jest konsultantem reumatologiem i szefem Londyńskiego Centrum Tocznia. Szkolił się w Szpitalu Londyńskim i spędził dwa lata w Nowym Jorku, pracując nad wprowadzeniem testu wiążącego DNA, pod kierownictwem dr Charlesa Christiana. W 1971 r. otworzył specjalistyczną klinikę w Londynie, zajmującą się wyłącznie toczniem i chorobami pokrewnymi. Jest założycielem i redaktorem międzynarodowego czasopisma „Lupus”. W 1983 r. opisał zespół antyfosfolipidowy, a w 1991 r. otrzymał za tę pracę nagrodę ILAR (światowe badania naukowe). Inne wyróżnienia obejmują Doctor Honoris Causa na Uniwersytetach w Marsylii i Barcelonie oraz Master of the ACR.
Graham R.V. Hughes, MD, FRCP, jest konsultantem reumatologiem i szefem Londyńskiego Centrum Tocznia. Szkolił się w Szpitalu Londyńskim i spędził dwa lata w Nowym Jorku, pracując nad wprowadzeniem testu wiążącego DNA, pod kierownictwem dr Charlesa Christiana. W 1971 r. otworzył specjalistyczną klinikę w Londynie, zajmującą się wyłącznie toczniem i chorobami pokrewnymi. Jest założycielem i redaktorem międzynarodowego czasopisma „Lupus”. W 1983 r. opisał zespół antyfosfolipidowy, a w 1991 r. otrzymał za tę pracę nagrodę ILAR (światowe badania naukowe). Inne wyróżnienia obejmują Doctor Honoris Causa na Uniwersytetach w Marsylii i Barcelonie oraz Master of the ACR.
- Hughes GR. Zakrzepica, aborcja, choroba mózgu i antykoagulant tocznia. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipin w przeciwciałach: Detection by radioimmunoassay and association with thrombosis in SLE. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE: Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. The Prosser White oration 1983: Connective tissue disease and the skin. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Pulmonary hypertension in systemic lupus erythematosus. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Association with anticardiolipin antibodies. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Zespół antykardiolipinowy. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Zespół Hughes’a: The anticardiolipin syndrome. A historical view. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revisiting the molecular mechanism in antiphospholipid syndrome: Beyond vascular damage. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Brain-reactive lymphocytotoxic antibodies in the serum of patients with SLE. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Brain-reactivity of lymphocytotoxic anitibodies in systemic lupus erythematosus with and without cerebral involvement. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Relationship of lymphocyte antibody specificities to clinical disease. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Association with anticardiolipin antibodies. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. „Cerebral disease in the antiphospholipid syndrome” in Hughes Syndrome-Antiphospholipid Syndrome. Khamashta MA, red. Springer, London: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rheumatology (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine: Systemic review and meta-analysis of observational studies. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus antykoagulant i antykardiolipinowe przeciwciała w młodych dorosłych z mózgowym niedokrwieniem. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Antiphospholipid syndrome, migraine and stroke. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsja: An early symptom of systemic lupus erythematosus. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsy as part of systemic lupus erythematosus and systemic antiphospholipid syndrome (Hughes syndrome). Lupus. 2006;15(4):191-194.
- Hughes GR. „Diplomatic epilepsy” w Understanding Hughes Syndrome. Springer-Verlag, London: 2009.
- Hughes GR. Zespół Hughesa/APS. 30 lat później, czego się nauczyliśmy? Wystąpienie otwierające 14. Międzynarodowy Kongres na temat przeciwciał antyfosfolipidowych. Rio de Janeiro, październik 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Can neurologic manifestations of Hughes (antiphospholipid) syndrome be distinguished from multiple sclerosis? Analysis of 27 patients and review of the literature. Medycyna (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migrena, utrata pamięci i „stwardnienie rozsiane”. Neurologiczne cechy antyfosfolipidowego (Hughes’) zespołu. Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Zespół Hughesa i stwardnienie rozsiane. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea w zespole antyfosfolipidowym. Clinical, radiologic, and immunologic characteristics of 50 patients from our clinics and the recent literature. Medicine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Vienna). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Antiphospholipid antibodies, systemic lupus erythematosus, and non-traumatic metatarsal fractures. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr, et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: A case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Syndrom X i zespół Hughesa. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Coeliac artery stenosis and antiphospholipid (Hughes) syndrome/antiphospholipid antibodies. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. Possible pathogenetic role of anti-phospholipid antibodies. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Catastrophic antiphospholipid syndrome and pregnancy: An experience of 13 cases. Rheumatology (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Renal artery stenosis in antiphospholipid syndrome (Hughes) and hypertension. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: An enigma. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. The challenge of pregnancy for patients with SLE. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. The stillbirth scandal. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies (the so-called 'seronegative APS’). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid syndrome in 2014: Więcej manifestacji klinicznych, nowi gracze patogenetyczni i wyłaniające się biomarkery. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Seronegatywny zespół antyfosfolipidowy. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibition of the mTORC pathway in the antiphospholipid syndrome. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparyna, przeciwciała antyfosfolipidowe i mózg. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s lupus: Fosfolipidy i przebieg imperium. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Children born to SLE and APS mothers. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Practice patterns of antiphospholipid syndrome at a tertiary teaching hospital in Lebanon. Lupus. 2002;11(11):759–764.