INTRODUCTION
Premature ventricular contractions (PVC) originating in the right ventricular outflow tract (RVOT) usually appear in patients without structural heart disease. Mogą występować pod postacią izolowanych lub nieustających PVC, a także jako tachykardia (do 80% idiopatycznych częstoskurczów komorowych). Głównym mechanizmem przyczynowym jest aktywność wyzwalana, ale postuluje się również mechanizm re-entry lub nieprawidłowy mechanizm automatyczny.
Pacjenci zwykle zgłaszają się z objawami związanymi z wysiłkiem fizycznym, stresem lub stosowaniem leków pobudzających. Objawy mogą wpływać na jakość życia, a nieustający typ VE może prowadzić do tachykardiomiopatii.
Beta-blokery lub werapamil zwykle wykazują ograniczoną skuteczność w kontrolowaniu tego typu PVC. Ablacja prądem o częstotliwości radiowej może być skuteczna, ale jest utrudniona przez fakt, że ten typ PVC ma ograniczoną i nieprzewidywalną indukowalność. Konwencjonalne metody kierowane fluoroskopowo mogą mieć ograniczone zastosowanie, jeśli PVC są rzadkie, ponieważ mapowanie aktywacji jest złożone, a mapowanie stymulacji ma niską rozdzielczość przestrzenną.
Systemy mapowania bezkontaktowego (NCMS) okazały się przydatne w lokalizacji pobudzeń ektopowych i jako przewodnik w ich ablacji.1, 2 W niniejszej pracy opisujemy ablację PVC w RVOT przy użyciu Ensite Array NCMS (St. Jude Medical, St. Paul, Minnesota, Stany Zjednoczone). System ten wykorzystuje cewnik MAC (multielectrode array catheter) z balonem o pojemności 7,5 ml i 64 mikroelektrodami do lokalizacji częstoskurczu. MAC dostarcza ponad 3000 wirtualnych jednobiegunowych elektrogramów jednocześnie z pojedynczego pobudzenia i wyświetla je w trójwymiarowym obrazie z komory zainteresowania.
METODY Charakterystyka pacjentów
Czterech pacjentów bez strukturalnej choroby serca, ale z nieustannym objawowym PVC w RVOT poddano ablacji przy użyciu NCMS między styczniem 2006 a grudniem 2009 roku. Średni wiek pacjentów wynosił 43±6 lat, a 50% stanowili mężczyźni.
Wszyscy mieli niską jakość życia z powodu bardzo objawowych i częstych PVC (średnia, 30 763±4710 PVC/dzień). U wszystkich nie udało się zastosować co najmniej 2 leków antyarytmicznych, z których jednym był zawsze beta-bloker. U 2 pacjentów podjęto wcześniej próbę ablacji przy użyciu konwencjonalnego systemu, ale bez powodzenia.
U wszystkich pacjentów aktywność pozazkurczowa była niewielka w dniu zabiegu. Leki antyarytmiczne odstawiono co najmniej 5 półokresów przed zabiegiem i unikano sedacji.
Badanie elektrofizjologiczne
Cewnik ablacyjny o średnicy 4 mm (Livewire TC, St. Jude Medical) umieszczano w prawej komorze (RV). Jeśli po wlewie izoproterenolu i stymulacji komorowej nie udało się uzyskać wystarczającego PVC do wykonania mapowania aktywacji, wprowadzano MAC.
Cewnik MAC był przesuwany na prowadnicy 0,035″ za pomocą fluoroskopii, a balon umieszczano w RVOT w odległości 2-3 cm od zastawki płucnej. W tym momencie rozpoczęto antykoagulację heparyną. Następnie odtworzono anatomię RV, zwracając szczególną uwagę na RVOT i położenie zastawki płucnej (ryc. 1). Odległość
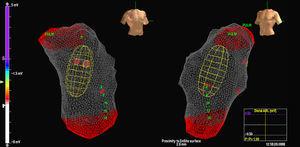
Rycina 1. Obraz cewnika wieloelektrodowego w drodze odpływu prawej komory.
Następnie analizowano 3 pobudzenia ekstraskurczowe dla każdej morfologii PVC prezentowanej przez pacjenta i uzyskiwano mapy izopotencjałów i izochron w trybie offline. Do elektrogramów dwubiegunowych stosowano filtry o częstotliwości od 30 do 500 Hz, a do wirtualnych elektrogramów jednobiegunowych filtr górnoprzepustowy o częstotliwości 2 Hz.
Mapa izopotencjału dynamicznie przedstawia aktywację przy użyciu obszarów maksymalnej amplitudy napięcia i pokazuje, jak przemieszcza się front fali. Najwcześniejszy punkt aktywacji jest definiowany jako punkt wykazujący najwcześniejszą aktywację w odniesieniu do początku zespołu QRS i wykazuje morfologię QS z szybkim ujemnym odchyleniem na jednobiegunowym elektrogramie. Mapa izopotencjału identyfikuje również punkt początkowy czoła fali przed jej rozprzestrzenieniem się na resztę miokardium. Mapa izochronowa jest konwencjonalną mapą czasu aktywacji powierzchni wsierdzia i wykorzystuje wirtualny sygnał unipolarny.
Celem ablacji był zarówno obszar najwcześniejszej aktywacji, jak i punkt początkowy frontu aktywacji. Częstotliwość radiowa była sporadycznie stosowana w tych miejscach, z kontrolą temperatury ograniczoną do 50W, temperaturą poniżej 55°C i czasem trwania 60s. Ablację uznawano za udaną, jeśli PVC znikał podczas aplikacji i nie był ponownie indukowany.
Wszystkie procedury wykonywał ten sam elektrofizjolog, który kierował inżynierem obsługującym NCMS.
WYNIKI
Trzech pacjentów miało pojedynczą morfologię PVC, podczas gdy jeden pacjent miał 2 morfologie. W 3 przypadkach lokalizacja była przegrodowa, a w 2 pozostałych znajdowała się w wolnej ścianie RVOT. We wszystkich przypadkach to właśnie mapa izopotencjału (ryc. 2) najdokładniej lokalizowała ognisko inicjujące; mapa izochron miała stosunkowo niewielką wartość (ryc. 3).
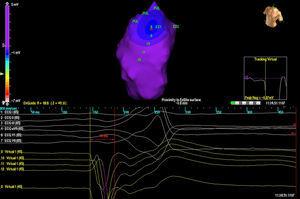
Ryc. 2. Mapa izopotencjału u pacjenta z 2 różnymi ekstrasystoliami komorowymi pochodzącymi z drogi odpływu prawej komory. Każde wyjście jest reprezentowane przez litery EX (1 i 2). Najwcześniejszy punkt aktywacji pokazano w EX1, z obrazem QS w wirtualnych unipolarach (poniżej).
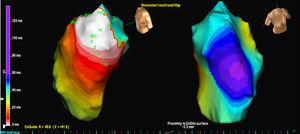
Rycina 3. Mapa izochron wyjścia EX1 dla tych samych ekstrasystolii komorowych analizowanych na rycinie 1 . Kolor biały wskazuje najwcześniejszą aktywację, a fioletowy – najpóźniejszą aktywację.
We wszystkich przypadkach potwierdziliśmy również, że PVC nie był spowodowany mechanicznie i że pokrywał się z morfologią klinicznego PVC. U jednego pacjenta balon znajdował się bardzo blisko powierzchni wsierdzia, gdzie doszło do PVC i musiał zostać przesunięty, aby umożliwić odpowiednią mobilizację elektrokatetera ablacyjnego.
Po zidentyfikowaniu miejsca pochodzenia PVC zastosowano średnio 3 aplikacje częstotliwości radiowej na ognisko w celu ablacji zarówno punktu najwcześniejszej aktywacji, jak i punktu początkowego frontu aktywacji. Średni czas aplikacji wynosił 113±15s dla każdego ogniska. Obserwowano wzrost aktywności ektopowej poprzedzający zakończenie aplikacji.
Średni czas fluoroskopii wynosił 31±11 (21-46) min, a całkowity czas zabiegu 136±38min, choć zmniejszał się on wzdłuż krzywej uczenia, od 190min przy pierwszej procedurze do 100min przy czwartej.
Osiągnęliśmy 100% odsetek powodzeń w ostrej fazie zabiegu, bez powikłań i bez ponownego pojawienia się PVC przy wlewie izoproterenolu lub powtarzaniu protokołu stymulacji. Po upływie średnio 30±16 miesięcy pacjenci pozostawali bezobjawowi bez leczenia farmakologicznego, a w monitorowaniu holterowskim podczas rocznej wizyty kontrolnej średnia liczba PVC wynosiła 159±113/dobę.
DYSKUSJA
Chociaż inni autorzy wykazali przydatność NCMS do ablacji PVC w RVOT,2,3 jej zastosowanie nie jest powszechne.4 W naszym doświadczeniu doskonałe wyniki uzyskiwano już od pierwszych przypadków. Odsetek powodzeń ablacji częstoskurczu komorowego w RVOT wynosi zwykle ponad 80%5; my jednak osiągnęliśmy wyższy odsetek powodzeń, mimo że byliśmy w stanie mapować jedynie izolowany PVC. Naszym ostrym punktem końcowym było ustąpienie PVC, a ograniczeniem była mała częstość występowania PVC podczas zabiegu. Spowodowało to konieczność potwierdzenia skuteczności ablacji w trakcie obserwacji poprzez zmniejszenie częstości PVC w monitorowaniu holterowskim.
Arytmia u naszych pacjentów miała ogniskowe pochodzenie, co jest zgodne z obserwacjami innych autorów.2, 6 Ablacja była ograniczona do punktu najwcześniejszej aktywacji, co mogło przyczynić się do wysokiego odsetka powodzeń.
System NCMS wymagał tylko jednego pobudzenia, aby dokładnie zlokalizować początek PVC. Chociaż woleliśmy potwierdzić lokalizację poprzez mapowanie innych, identycznych PVC, miejsce pochodzenia nie było modyfikowane. W naszym doświadczeniu udaną ablację uzyskano wyłącznie na podstawie mapy izopotencjałów.
Jednym z ograniczeń systemu jest to, że lokalizuje on najwcześniejszy punkt aktywacji we wsierdziu badanej komory, nawet jeśli punkt ten nie znajduje się we wsierdziu, ale w nasierdziu lub w innej, dołączonej komorze. W tych przypadkach wirtualna analiza jednobiegunowa pomaga wskazać, że początek nie znajduje się we wsierdziu RV, ponieważ w takim przypadku najwcześniejszy punkt wsierdziowy prezentowałby rS.
Co więcej, MAC może wytwarzać mechaniczne PVC i, będąc zlokalizowanym w RVOT, może być mylony z klinicznym PVC. W celu rozróżnienia analizowaliśmy zgodność elektrokardiograficzną z klinicznym PVC i potwierdziliśmy, że punkt pochodzenia PVC nie był w kontakcie z balonem.
PVC może również powstawać bardzo blisko miejsca, w którym znajduje się MAC, utrudniając tym samym dostęp do cewnika ablacyjnego. W takich przypadkach może być konieczna zmiana położenia balonu.
W naszej serii NCMS okazał się skutecznym i bezpiecznym sposobem usuwania izolowanego, trudnego do wywołania PVC w RVOT i pomógł zmniejszyć złożoność wykonywanych procedur.
KONFLIKT INTERESÓW
Nie zgłoszono.
Podziękowania
Chcielibyśmy podziękować Joaquínowi Panduro za krytyczną recenzję manuskryptu.
Przyjęto 21 stycznia 2011 r.
Przyjęto 1 maja 2011 r.