Rdzeń i elektrony walencyjne
Jak kontynuujemy przez układ okresowy w ten sposób, pisząc konfiguracje elektronowe coraz większych atomów, staje się uciążliwe, aby utrzymać kopiowanie konfiguracji wypełnionych wewnętrznych podpowłok. W praktyce chemicy upraszczają notację, używając nawiasowego symbolu gazu szlachetnego do reprezentowania konfiguracji gazu szlachetnego z poprzedniego rzędu, ponieważ wszystkie orbitale w gazie szlachetnym są wypełnione. Na przykład, reprezentuje 1s2 2s2 2p6 konfiguracji elektronowej neonu (Z = 10), więc konfiguracja elektronowa sodu, z Z = 11, który jest 1s2 2s2 2p6 3s1, jest zapisana jako 3s1
| Pełna konfiguracja elektronowa | Skrót gazu Nobla | ||
| Neon | Z = 10 | Ne: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Sód | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Elektrony na wypełnionych orbitalach wewnętrznych znajdują się bliżej jądra i są z nim ściślej związane, dlatego rzadko biorą udział w reakcjach chemicznych. Takie elektrony będziemy nazywać elektronami rdzeniowymi. Dla reprezentatywnych pierwiastków (kolumny 1, 2 i 13-18 układu okresowego), elektrony rdzeniowe to wszystkie elektrony o wartości n mniejszej niż maksymalna wartość n w konfiguracji elektronowej. Dla przykładu, w atomie sodu najwyższa wartość n wynosi 3. Zatem elektrony rdzeniowe to te, które znajdują się na orbitalach atomowych o n < 3, czyli na orbitalach 1s, 2s i 2p. Tak więc, sód ma 10 elektronów rdzeniowych. Powrócimy do tej definicji elektronów rdzeniowych później dla metali przejściowych.
To oznacza, że chemia atomu zależy głównie od elektronów w jego najbardziej zewnętrznej powłoce, tych o największej wartości n, które nazywamy elektronami walencyjnymi. Uproszczony zapis pozwala nam łatwiej zobaczyć konfigurację elektronów walencyjnych. Używając tej notacji do porównania konfiguracji elektronowych sodu i litu, mamy:
| Sód | 1s2 2s2 2p6 3s1 | 3s1 |
| Lit | 1s2 2s1. | 2s1 |
Jest łatwo widoczne, że zarówno sód i lit mają jeden elektron s w ich powłoki walencyjnej. Można zatem przewidzieć, że sód i lit mają bardzo podobne chemii, co jest rzeczywiście case.
Jak nadal budować osiem elementów okresu 3, 3s i 3p orbitale są wypełnione, jeden elektron na raz. Ten rząd kończy się gazem szlachetnym argonem, który ma konfigurację elektronową 3s2 3p6, co odpowiada wypełnionej powłoce walencyjnej.
Przykład 2.2.2
Narysuj diagram orbitalny i użyj go do określenia konfiguracji elektronowej fosforu, Z = 15. Jaka jest jego konfiguracja elektronów walencyjnych?
Dane: liczba atomowa
Pytanie o: diagram orbitalny i konfiguracja elektronów walencyjnych dla fosforu
Strategia:
- Znajdź najbliższy gaz szlachetny poprzedzający fosfor w układzie okresowym. Następnie odejmij jego liczbę elektronów od liczby elektronów w fosforze, aby uzyskać liczbę elektronów walencyjnych w fosforze.
- Odnosząc się do rysunku 2.1.1, narysuj diagram orbitalny, aby reprezentować te orbitale walencyjne. Zgodnie z regułą Hunda, umieścić elektrony walencyjne w dostępnych orbitali, zaczynając od orbitalu, który jest najniższy w energii. Napisz konfigurację elektronową z diagramu orbitalnego.
- Ignoruj wewnętrzne orbitale (te, które odpowiadają konfiguracji elektronowej najbliższego gazu szlachetnego) i napisz konfigurację elektronów walencyjnych dla fosforu.
Rozwiązanie:
A Ponieważ fosfor jest w trzecim rzędzie układu okresowego, wiemy, że ma zamkniętą powłokę z 10 elektronami. Zaczynamy od odjęcia 10 elektronów od 15 znajdujących się w fosforze.
B Dodatkowe pięć elektronów umieszczamy na kolejnych dostępnych orbitalach, które Rysunek 2.1.1 mówi nam, że są to orbitale 3s i 3p:
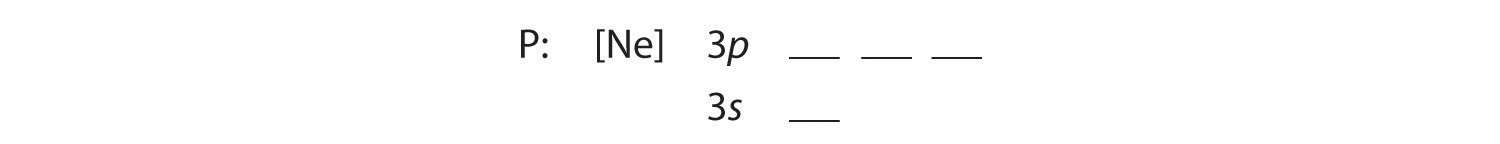
Ponieważ orbital 3s ma niższą energię niż orbitale 3p, wypełniamy go jako pierwszy:
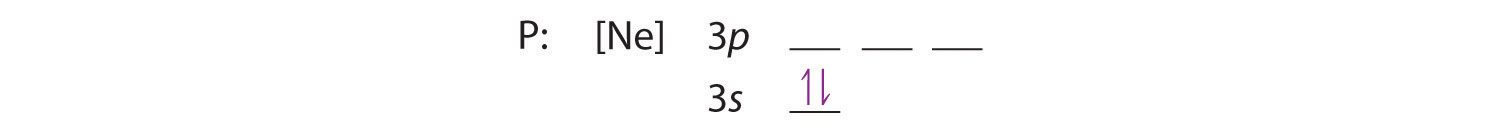
Reguła Hunda mówi nam, że pozostałe trzy elektrony zajmą zdegenerowane orbitale 3p oddzielnie, ale z wyrównanymi spinami:
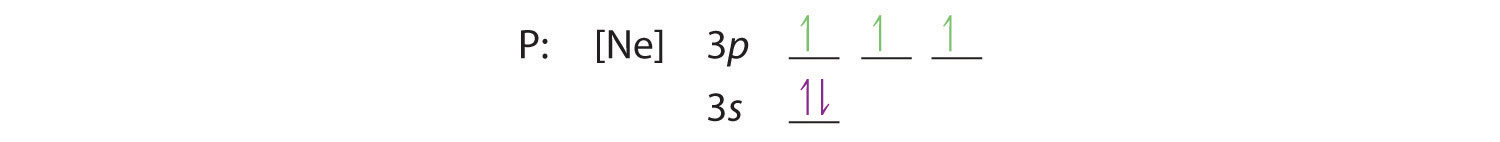
Konfiguracja elektronowa to 3s2 3p3.
C Otrzymujemy konfigurację elektronu walencyjnego ignorując wewnętrzne orbitale, co dla fosforu oznacza, że ignorujemy zamkniętą powłokę. Daje to konfigurację elektronu walencyjnego 3s2 3p3.
Ćwiczenie 2.2.2
Narysuj diagram orbitalny i wykorzystaj go do wyprowadzenia konfiguracji elektronowej chloru, Z = 17. Jaka jest jego konfiguracja elektronów walencyjnych?
Odpowiedź: 3s2 3p5
Konfiguracja elektronów walencyjnych: 3s23p5
Ogólna kolejność zapełniania orbitali przedstawiona jest na rysunku 2.2.1. Podpowłoki odpowiadające każdej wartości n są zapisane od lewej do prawej na kolejnych poziomych liniach, gdzie każdy rząd reprezentuje rząd w układzie okresowym. Kolejność zapełniania orbitali wskazują ukośne linie biegnące od prawej górnej do lewej dolnej. Odpowiednio, orbital 4s jest wypełniony przed orbitalem 3d ze względu na efekty ekranowania i penetracji. W związku z tym konfiguracja elektronowa potasu, który rozpoczyna czwarty okres, jest 4s1, a konfiguracja wapnia jest 4s2. Pięć orbitali 3d jest wypełnionych przez kolejnych 10 pierwiastków, metali przejściowych, a następnie trzy orbitale 4p. Zauważ, że ostatnim członkiem tego rzędu jest gaz szlachetny krypton (Z = 36), Kr: 4s2 3d10 4p6, który ma wypełnione orbitale 4s, 3d i 4p. Piąty rząd układu okresowego jest zasadniczo taki sam jak czwarty, z wyjątkiem tego, że orbitale 5s, 4d i 5p są wypełnione kolejno.
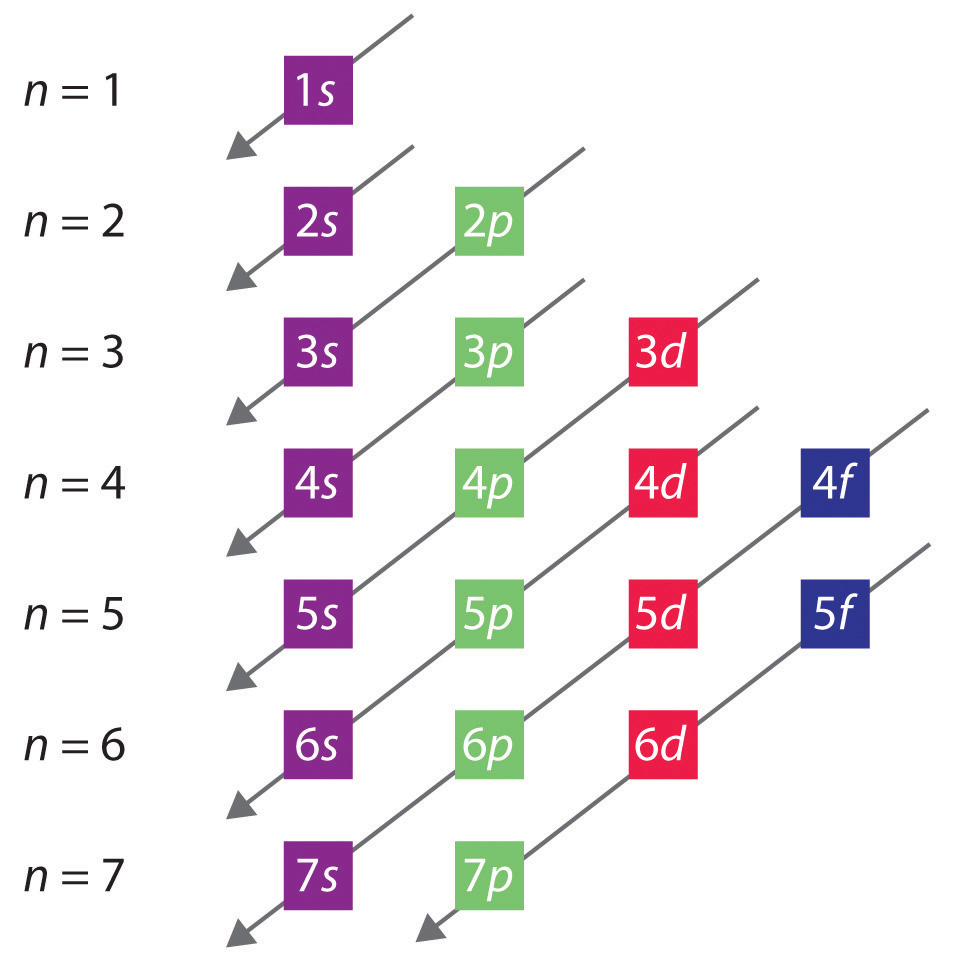
Rysunek 2.2.1 Przewidywanie kolejności wypełniania orbitali w atomach wieloelektronowych. Jeśli w kolejnych wierszach zapiszemy podpowłoki dla każdej wartości głównej liczby kwantowej, to obserwowaną kolejność ich wypełniania wskaże seria ukośnych linii biegnących od prawego górnego rogu do lewego dolnego.
Szósty rząd układu okresowego będzie różnił się od dwóch poprzednich, ponieważ orbitale 4f, które mogą pomieścić 14 elektronów, są wypełnione pomiędzy orbitalami 6s i 5d. Pierwiastki, które zawierają orbitale 4f w swojej powłoce walencyjnej to lantanowce. Kiedy orbitale 6p są w końcu wypełnione, mamy następny (i ostatni znany) gaz szlachetny, radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. W ostatnim rzędzie, orbitale 5f są wypełnione pomiędzy orbitalami 7s i 6d, co daje 14 pierwiastków aktynowców. Ponieważ duża liczba protonów czyni ich jądra niestabilnymi, wszystkie aktynowce są radioaktywne.
Przykład 2.2.3
Zapisz konfigurację elektronową rtęci (Z = 80), pokazując wszystkie wewnętrzne orbitale.
Podajemy: liczbę atomową
Pytanie o: kompletną konfigurację elektronową
Strategia:
Korzystając ze schematu orbitali na rysunku 2.2.1 oraz z układu okresowego jako przewodnika, wypełniaj orbitale aż do umieszczenia wszystkich 80 elektronów.
Rozwiązanie:
Umieszczając elektrony na orbitalach zgodnie z kolejnością pokazaną na rysunku 2.2.1 i korzystając z układu okresowego jako przewodnika, otrzymujemy
| 1s2 | wiersz 1 | 2 elektrony |
| 2s22p6 | wiersz 2 | 8 elektronów |
| 3s23p6 | wiersz 3 | 8 elektronów |
| 4s23d104p6 | wiersz 4 | 18 elektronów |
| 5s24d105p6 | wiersz 5 | 18 elektronów |
| wiersz 1-5 | 54 elektrony |
Po wypełnieniu pierwszych pięciu rzędów, mamy jeszcze 80 – 54 = 26 elektronów do obsadzenia. Zgodnie z rysunkiem 2.2.2, musimy wypełnić orbitale 6s (2 elektrony), 4f (14 elektronów) i 5d (10 elektronów). Wynikiem tego jest konfiguracja elektronowa rtęci:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
z wypełnioną podpowłoką 5d, konfiguracją powłoki walencyjnej 6s2 4f14 5d10 i całkowitą liczbą 80 elektronów. (Powinieneś zawsze sprawdzić, czy całkowita liczba elektronów jest równa liczbie atomowej.)
Ćwiczenie 2.2.3
Ale pierwiastek 114 nie jest wystarczająco stabilny, aby występować w przyrodzie, dwa jego izotopy zostały stworzone po raz pierwszy w reaktorze jądrowym w 1999 roku przez zespół rosyjskich i amerykańskich naukowców. Napisz pełną konfigurację elektronową dla pierwiastka 114.
Odpowiedź: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Konfiguracje elektronowe pierwiastków przedstawia rysunek 2.2.3, na którym wymieniono orbitale w kolejności ich zapełnienia. W kilku przypadkach konfiguracje elektronowe w stanie podstawowym różnią się od tych przewidywanych przez Rysunek 2.2.1. Niektóre z tych anomalii pojawiają się w miarę wypełniania orbitali 3d. Na przykład, obserwowana konfiguracja elektronowa stanu podstawowego chromu to 4s1 3d5 zamiast przewidywanej 4s2 3d4. Podobnie, obserwowana konfiguracja elektronowa miedzi jest 4s1 3d10 zamiast s2 3d9. Rzeczywista konfiguracja elektronowa może być zracjonalizowana w kategoriach dodatkowej stabilności związanej z półpełną (ns1, np3, nd5, nf7) lub wypełnioną (ns2, np6, nd10, nf14) podpowłoką. Biorąc pod uwagę niewielkie różnice pomiędzy wyższymi poziomami energetycznymi, ta dodatkowa stabilność jest wystarczająca do przesunięcia elektronu z jednego orbitalu na drugi. W cięższych pierwiastkach, inne bardziej złożone efekty mogą być również ważne, prowadząc do niektórych dodatkowych anomalii wskazanych na rysunku 2.2.3. Na przykład, cer ma konfigurację elektronową 6s2 4f1 5d1, która jest niemożliwa do zracjonalizowania w prosty sposób. W większości przypadków jednak te pozorne anomalie nie mają ważnych konsekwencji chemicznych.
Uwaga
Dodatkowa stabilność jest związana z półwypełnionymi lub wypełnionymi podpowłokami.
.