Un programme de recherche a été mené pour améliorer la technologie de traitement pour l’extraction de l’alumine à partir du non-bauxitique. Le succès de ce programme avait fourni la technologie nécessaire pour produire un approvisionnement adéquat d’alumine de haute qualité à partir de sources nationales, répondant ainsi aux besoins économiques et stratégiques nationaux relatifs à la production d’aluminium. Le procédé à l’acide chlorhydrique pour récupérer l’alumine à partir de minerais à faible teneur est l’un des procédés étudiés dans le programme de recherche.
Une phase de ce procédé utilise l’effet de la concentration en ions chlorure sur la solubilité de l’ion aluminium en solution. A 25° C, la solubilité de l’AlCl3 dans l’eau pure est d’environ 31 pct en poids, et diminue avec l’augmentation de la concentration en acide chlorhydrique (HCl), devenant 0,1 pct lorsque la concentration en HCl est portée à 37 pct. Ce comportement a fait l’objet de nombreuses recherches, procédés et brevets. Ainsi, il est possible de lixivier un minerai non bauxitique avec du HCl, de décanter et de filtrer la liqueur, et d’ajouter du HCl gazeux pour précipiter AlCl3-6H2O. La solution acide restante peut alors être utilisée pour lixivier d’autres minerais et le AlCl3-6H2O précipité peut être calciné pour obtenir Al2O3 . Une discussion et une évaluation approfondies de ce procédé sont présentées par Peters, Johnson et Kirby. Les données thermodynamiques, telles que les activités ioniques et les solubilités, nécessaires à l’analyse complète, l’interprétation et l’amélioration de ce procédé sont rares, et les données de solubilité existantes sont limitées à une gamme étroite de températures. Par conséquent, les objectifs de cette étude étaient (1) de déterminer la solubilité de AlCl3, dans une gamme de température de 25° à 85° C avec une concentration de HCl de 0.0 à 37.2 pct ; (2) de calculer les activités de AlCl3 et de H2O dans des solutions contenant divers électrolytes , et la constante d’équilibre pour la dissolution de AlCl3-6H2O ; et (3) de suggérer des domaines de recherche pour générer des données utiles.
- Appareil
- Procédure expérimentale
- Analyse
- Résultats
- Comparaison avec d’autres données
- Traitement thermodynamique
- Produit de solubilité et activités dans le système AlCl3-6H2O-H2O
- Estimation des activités dans le système AlCl3-6H2O-H2O
- Produit de solubilité et activités dans le système AlCl3-6H2O-HCl-H2O
- Estimation des activités dans le système AlCl3-6H2O-HCl-H2O
- Système AlCl3-FeCl3-KCl-NaCl-HCl-H2O
- Domaines recommandés pour la recherche
- Chlorure d’aluminium dans les solutions aqueuses d’acide chlorhydrique
Appareil
L’appareil utilisé pour les mesures de solubilités est représenté sur la figure 1. Un flacon de 100 ml, A, contient une solution d’électrolytes et un certain excès de sel. Un filtre en verre fritté, B, fusionné sur un tube Pyrex de 6 mm de diamètre est relié à un tube extérieur fixé à deux robinets d’arrêt en téflon, D et E. L’ensemble supérieur est fixé à A au niveau de C par un raccord à compression en nylon fileté avec un anneau en néoprène. Un tube en polyéthylène de 6 mm de diamètre, F-L, envoie un échantillon de la solution filtrée en B dans le deuxième ballon, K, lorsque A est mis sous pression par le robinet d’arrêt D et que E est ouvert. Le raccord en J est similaire à celui en C. Les flacons sont fixés sur une barre, G, qui est attachée à un mécanisme à bascule, avec H comme axe de bascule pour secouer les flacons, A et K, alternativement de haut en bas. Un thermostat couvert, 0, est contrôlé à ±0,2° C. Un contrôle plus étroit de la température est inutile puisque la solubilité est une fonction très faible de la température.
Procédure expérimentale
Les mesures des solubilités à 25°, 45°, 65° et 85° C ont été effectuées dans des conditions d’équilibre de phase avec des matériaux analytiques de qualité réactif. Des quantités appropriées de AlCl3-6H2O, d’une solution de HCl à 37 % et d’eau distillée ont été placées dans le flacon A pour former environ 90 ml de solution avec une petite quantité de cristaux de sel en excès (le « sel » désigne ci-après le chlorure d’aluminium hexahydraté). Les quantités de matières ont été estimées à partir des données de solubilité existantes sur le système ternaire AlCl3-6H2O-HCl-H2O. Après la formation de la solution dans le flacon A et l’assemblage de l’appareil, celui-ci a été immergé dans l’eau jusqu’au niveau N, et le thermostat a été réglé à la température désirée. Une agitation mécanique continue des flacons a été utilisée pendant chaque cycle de 2 à 3 jours. Périodiquement, une agitation manuelle vigoureuse était également utilisée pour assurer
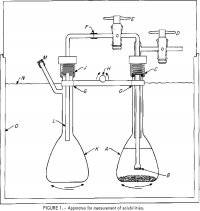
l’équilibre, en particulier si le sel pouvait former un sel solide complexe avec HCl. A la fin de la période d’équilibrage, on a laissé les flacons immobiles en position verticale pendant 1 heure pour assurer la décantation des particules solides. Les robinets d’arrêt D et E ont ensuite été ouverts pour transférer environ la moitié de la solution dans le flacon d’échantillonnage K. Le niveau de B en dessous du liquide dans A détermine généralement la quantité de solution transférée dans K. Le poids de la solution dans K a été déterminé en pesant le flacon avant le montage et après l’admission de la solution et le démontage. Une quantité connue d’eau distillée a été injectée dans le ballon par L pour diluer l’échantillon et dissoudre toute vapeur en phase gazeuse. La pression partielle de HCl dans l’eau pure dépasse 1 torr à 25° C à des molalités supérieures à 8 m (m après un chiffre dans une phrase indique une molalité) ; par conséquent, à des concentrations inférieures à 8 m, il est douteux qu’une quelconque perte de HCl puisse se produire pendant l’échantillonnage. Pour cette raison, certains des passages à 25° C, contenant moins de 4 m de HCl, ont été effectués avec un seul flacon bouché et, après équilibrage, une partie de la solution a été soigneusement décantée et filtrée pour l’échantillonnage.
Analyse
Les solutions ont été analysées après dilutions appropriées pour les concentrations totales en ions chlorure et en ions aluminium. La concentration totale en ions chlorure a été déterminée par titrage potentiométrique avec Ag+. La concentration en Al+++ a été déterminée en complexant d’abord avec un excès d’acide éthylènediamine-tétraacétique (EDTA), puis en titrant à rebours l’excès d’EDTA avec Cu++ à un pH de 3,8.
La teneur en AlCl3 a été calculée à partir de l’analyse de Al+++. La soustraction de l’ion chlorure dans la quantité calculée d’AlCl3 de la concentration totale en ions chlorure a permis de calculer la concentration en HCl dans les solutions saturées.
Cette méthode de calcul a été utilisée pour toutes les analyses sauf celles pour lesquelles la concentration en HCl était connue pour être nulle, c’est-à-dire lorsque l’AlCl3 était le seul électrolyte dans l’eau pure. Pour ces analyses, la concentration d’AlCl3 a été simplement calculée à partir de l’analyse des ions chlorure, qui était la plus précise des deux analyses, bien que les analyses d’Al+++ et de Cl- aient quand même été complétées pour ces échantillons.
La différence dans l’analyse de Cl- calculée à partir de l’analyse de Cl- total et de Cl- à partir de l’analyse d’Al+++ pour les expériences sans ajout de HCl était de ±0,2 % en poids de Cl-. Cela indique qu’en moyenne, l’analyse de Al++ était sujette à une erreur de +0,05 % en poids, puisque l’analyse du Cl était connue pour être considérablement plus précise que l’analyse de Al+++. Dans les solutions contenant du HCl, une erreur de ±0,05 pour cent dans la teneur en Al+++ se traduisait par une erreur de ±0,20 pct dans la teneur en HCl ; cela s’explique par le fait que, si la teneur totale en Cl était très précise, le Cl apporté par le HCl ajouté et, par conséquent, la molalité du HCl, était calculé par différence comme mentionné précédemment.
Résultats
Les résultats sont résumés dans le tableau 1 et illustrés dans la figure 2. La concentration maximale de HCl pour les données indiquées dans le tableau 1 pour 85° C est d’environ 30 % en poids. Les mesures ont été arrêtées à cette concentration en raison des pressions d’équilibre excessives dans le système à des concentrations plus élevées. Il faut également noter que moins de déterminations ont été effectuées à 65° et 85° C qu’à 25° et 45° C. Des répliques ont été effectuées aux deux températures inférieures pour donner une indication de la répétabilité satisfaisante des résultats. La figure 2 montre que la solubilité du sel d’aluminium diminue drastiquement avec l’augmentation de la concentration de HCl. Par conséquent, la lixiviation de minerais non bauxitiques avec une solution de HCl et la précipitation du sel pur pour l’extraction de l’aluminium par l’ajout de HCl est un procédé réalisable ; ce procédé a fait l’objet de plusieurs brevets. Les résultats montrent que la solubilité ne change pas beaucoup avec la température, et pour une augmentation de température de 60° C (25° à 85° C), la solubilité du sel pur seul dans l’eau n’augmente que de 2,2 pct par rapport à la solubilité à 25° C.
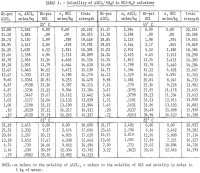
Comparaison avec d’autres données
La solubilité du sel pur dans l’eau à 25° C a été trouvée en accord exact avec les données de Palitzch et avec Ehret et Frere. Les résultats donnés par Malquori sont environ 10 pc plus élevés. La solubilité obtenue par Tanaka est d’environ 3,3 % supérieure à celle de la présente étude à 45° et à 65° C.
L’effet du HCl dans l’eau sur la solubilité du sel a été étudié par Seidel et Fisher à 0° C et par Malquori à 25° C. Les résultats des premiers chercheurs à 0° C concordent très étroitement avec les données du tableau 1, extrapolées à 0° C, tandis que ceux de ce dernier chercheur à 25° C se dispersent quelque peu et divergent grossièrement de 3 pet à de faibles concentrations de HCl ; cependant, la concordance dans la gamme de 5 à 30 % en poids de HCl est de 1 pct près.
Traitement thermodynamique
Produit de solubilité et activités dans le système AlCl3-6H2O-H2O
Le coefficient d’activité ionique Y12 de l’AlCl3 dans l’eau a été mesuré jusqu’à 1,8 m par Mason, et des valeurs recalculées sont données par Robinson et Stokes. Comme le coefficient d’activité de 1,8 m à la valeur de saturation de 3,3835 m devrait être multiplié par plus de cinq, la valeur de saturation est utilisée pour le calcul par la méthode décrite en détail dans un rapport précédent (1 m = 1 mole dans 1 kg de solvant). La méthode, avec sa nouvelle application appropriée, est brièvement résumée dans ce rapport. L’activité ionique moyenne de l’AlCl3, désignée par a12, est exprimée par la série de puissance suivante en termes de molalité m :

L’équation correspondante pour l’activité de l’eau aw, est obtenue par application de la relation de Gibbs-Duhem ; le résultat est
![]()
Notez que les exposants de m avec les mêmes coefficients de C, D, etc, sont 1 plus élevés dans l’équation 2 que dans l’équation 1, et le coefficient de m dans l’équation 2 provient de la théorie de Debye-Huckel telle que discutée par Gokcen.
La réaction pour la dissolution du sel est
AlCl3-6H2O (S) = Al+++ + 3Cl- + 6H2O (l),…………………………..(3)
où (s) signifie solide et (l) liquide.
La constante d’équilibre correspondante est
![]()
où le dénominateur, l’activité du solide, est pris égal à l’unité puisque sa composition reste inchangée lorsque d’autres électrolytes sont ajoutés en solution. Nous substituons a12 à 1n Kp directement à partir de l’équation 1 et à aw à partir de l’équation 2 après avoir multiplié l’équation 2 par 0,108093 pour que le coefficient de 1n aw soit égal à 6. Comme Kp est indépendant de la composition, il est évident que
![]()
Après les substitutions requises à partir des équations 1 et 2, puis la substitution de la valeur moyenne m = 3.3835 des deux premiers passages du tableau 1, on obtient une équation pour résoudre les six coefficients inconnus de l’équation 1, et les cinq autres équations sont obtenues en substituant chacune des cinq valeurs expérimentales du coefficient d’activité ionique moyen de AlCl3 , y12 du tableau 2, dans
![]()
puis en substituant chaque résultat dans l’équation 1. Six équations simultanées obtenues de cette manière sont ensuite résolues par ordinateur. Les résultats sont les suivants :
C = -57,5723,
D = +142,0288,
E = -202,5581,
F = +161,1919,
G = -67,7831,
et H = +11,6880.
La substitution de ces valeurs dans les équations 1, 2 et 4 donne les valeurs de Y12, aw et Kp. Les résultats sont répertoriés dans le tableau 3 sous la rubrique « Résultats du bureau : » Il convient de noter que l’activité de l’eau peut maintenant être calculée à partir de l’équation 2, et la pression de vapeur de l’eau sur la solution, P, à partir de
aw = P/P°,……………………………….(7)
où P° est la pression de vapeur de l’eau pure à la même température. Notons que la pression de vapeur de l’eau sur la solution saturée est un peu plus de la moitié de celle de l’eau pure puisque aw = 0,509. Les résultats précédents constituent le premier ensemble de données sur les activités basées sur la solubilité du sel.
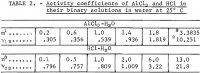
Note.-Dans ce tableau, m se réfère à la molalité de AlCl3, n se réfère à la molalité de HCl, et la molalité est des moles dans 1 kg d’eau.
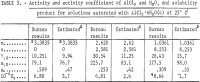
Note.-.Dans ce tableau, m se réfère à la molalité de AlCl3, n se réfère à la molalité de HCl, et la molalité est des moles dans 1 kg d’eau.
Estimation des activités dans le système AlCl3-6H2O-H2O
Deux méthodes d’estimation fiables existantes sont utilisées pour obtenir les activités dans le système AlCl3-6H2O-H2O au-delà des données expérimentales directes existantes à m = 1,8. La première méthode, décrite par Kusik et Meissner, donne une valeur estimée de γ12 = 9,94 à 3,3835 m. Cette valeur estimée est en accord étroit avec 10,251, la valeur obtenue dans la présente étude. La valeur estimée correspondante de l’activité de l’eau, aw, est de 0,47, encore une fois en accord étroit avec la valeur de 0,509 trouvée dans la présente étude. La constante d’équilibre Kp calculée à partir de ces valeurs n’est pas éloignée de 6,8 x 10 5, compte tenu du fait que la quatrième puissance de a12 et la sixième puissance de aw sont multipliées pour obtenir Kp.
La deuxième méthode d’estimation due à Bromley donne 10,42 pour γ12, valeur plus proche de celle obtenue par la méthode précédente. Le coefficient d’activité de l’eau a été obtenu par les présents auteurs, en intégrant l’équation de Gibbs-Duhem dans laquelle ont été utilisées les valeurs de a12 estimées par la méthode de Bromley. Le résultat est aw = 0,540. La moyenne des deux méthodes est de 0,505, ce qui est en très bon accord avec la valeur de 0,509 du Bureau. La méthode de Bromley, cependant, ne contient pas une méthode pratique pour la détermination de l’aw incluse dans la méthode de Kusik-Meissner.
L’accord des valeurs estimées avec les valeurs des données de solubilité n’est pas toujours aussi bon que celui montré ici pour chaque électrolyte à chaque composition. Par exemple, même pour AlCl3 à 1 m, les deux estimations de γ12 ne diffèrent que de 13 % l’une de l’autre.
Produit de solubilité et activités dans le système AlCl3-6H2O-HCl-H2O
L’effet de l’augmentation de la concentration de HCl sur la solubilité du sel est largement dû à l’augmentation de la concentration des ions chlorure. La constante d’équilibre dans ce cas avec les activités a1 et a2 des ions individuels est
![]()
où γ12 = γ1γ2 par définition de γ12 à partir des activités ioniques individuelles γ1 (pour Al+++) et γ2 (pour Cl-), et n est la molalité de HCl. La valeur de Kp est la même que celle de l’équation 4 mais le côté droit de l’équation 8 est différent de celui de l’équation 4. On peut noter que lorsque n augmente, m, la concentration de Al+++, doit diminuer, à condition que γ12 et aw ne diminuent pas beaucoup ; par conséquent, le sel précipite, ce qui est connu comme l’effet de salage.
Le calcul des activités dans la solution ternaire nécessite une équation similaire à l’équation 1 pour HCl. Comme les données pour HCl sont connues avec précision sur une large gamme de concentration, il est possible de prendre une équation avec autant de variables que souhaité. L’équation suivante donne une représentation précise des données du coefficient d’activité de HCl, γ32 où l’indice 3 correspond à H+ et 2 à Cl-:
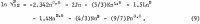
Les données choisies à cet effet de Haase, Naas et Thutnm figurent sur les troisième et quatrième lignes du tableau 2. Les valeurs des coefficients calculés à partir de ces données sont les suivantes :
J = -1,88416,
K = +2,24342,
L = -1,98545,
M = +1,00091,
N = -0,25934,
et P = +0,02634.
Les équations des activités de AlCl3 et de H2O contiennent ces coefficients ainsi que les coefficients des produits croisés (m h/2)(n k/2), où h et k sont des entiers, et ces équations sont les suivantes :
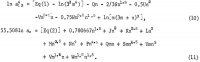
Les cinq coefficients supplémentaires de ces équations sont déterminés en ajoutant l’équation 10 et 6 1n aw de l’équation 11 pour obtenir 1n Kp et en utilisant les données de solubilité sélectionnées suivantes du tableau 1:
m : 2.620, 2,016, 1,333, 0,953 et 0,535.
n : 2,581, 4,460, 6,780, 8,397 et 10,063.
Les calculs résultants donnent les valeurs suivantes des coefficients des équations 10 et 11 :
Q = +23,27027,
S = -22.47064,
U = +4,29102,
V = -9,76081,
et W = +4,60246.
Les résultats pour γ12, a12, aw, et Kp calculés à partir des équations précédentes sont indiqués dans le tableau 3. Les valeurs de γ12 de l’équation 9 sont en accord avec celles de Harned et Gary à de très faibles concentrations de HCl et d’AlCl3.
La pression partielle de HCl(g), P32, sur une solution peut être calculée à partir de l’équation (4) suivante :
Kp (HCl) = 4.94 x 10 -7 = P32/a²32………………………….(12)
où Kp(HCl) est la constante d’équilibre à 25° C pour H+ + Cl- = HCl(g), et a32 est l’activité ionique moyenne de HCl en solution. A cet effet, il est nécessaire d’écrire une équation pour a32, similaire à l’équation 10, en utilisant les paramètres de l’équation 11, comme indiqué ailleurs en détail.
L’effet de la température sur la solubilité du sel est faible, comme le montre le tableau 1. L’effet sur les activités ioniques devrait donc être faible puisque tous les paramètres de l’équation 11 auraient pu être obtenus à partir des données de solubilité si l’erreur expérimentale était inférieure à ±0,01 % en poids pour l’analyse de l’aluminium. En général, pour une plage de température allant jusqu’à environ 80° C, chaque paramètre est une fonction linéaire de la température, et cette dépendance peut être déterminée si l’équation 11 était connue à une autre température supérieure d’au moins 50° C à 25° C.
Estimation des activités dans le système AlCl3-6H2O-HCl-H2O
Les valeurs des activités, du coefficient d’activité et du produit de solubilité estimées dans le présent rapport selon la méthode conçue par Kusik et Meissner, sont indiquées dans le tableau 3. Le coefficient d’activité γ12 pour AlCl3 est environ deux fois plus élevé que la valeur estimée pour les solutions sélectionnées contenant HCl. L’activité de l’eau, aw, par contre, concorde bien avec les valeurs estimées, sauf pour m = 2,620. Il est évident que les calculs auraient été considérablement plus fiables si la pression de vapeur de l’eau, aw, avait été mesurée car aw entre dans Kp comme aw, de sorte que de petites erreurs dans aw entraînent de grandes erreurs dans γ12 et Kp . A cet effet, il est recommandé de procéder à un nombre limité de mesures de la pression de vapeur pour tester l’exactitude des présents calculs et des méthodes d’estimation.
La dépendance en température des propriétés thermodynamiques énumérées dans le tableau 3 peut être estimée comme décrit par Kusik et Meissner. Cependant, l’estimation est susceptible de donner un degré plus élevé de dépendance à la température que celui indiqué par la faible dépendance à la température de la solubilité. Aucune tentative n’a pu être faite pour calculer l’effet de la température par la méthode du Bureau parce que (1) a12 à de faibles concentrations de AlCl3 n’est pas connu à diverses températures, (2) la solubilité de AlCl3 n’a pas pu être déterminée avec une précision approchant 0,01 pct dans Al+++, et (3) la gamme de concentration de HCl à 65° et 85° C est trop petite pour sélectionner un nombre suffisant de données de solubilité très différentes pour AlCl3 afin de déterminer avec précision les paramètres des équations 10 et 11.
Système AlCl3-FeCl3-KCl-NaCl-HCl-H2O
Des données préliminaires sur les solubilités d’AlCl3, de FeCl3, de KCl et de NaCl dans des solutions aqueuses contenant 24 à 31 % en poids de HCl à 25° C ont été obtenues pour évaluer la contamination d’AlCl3-6H2O extractible de minerais non bauxitiques. A cet effet, 2 litres d’une solution contenant des quantités connues de sels ont été préparés, 90 ml de cette solution ont été placés dans un flacon pour chaque essai et ensuite une quantité connue de HCl gazeux a été admise pour atteindre 24 à 31 % en poids de HCl dissous. Dans cette gamme de HCl en solution, des cristaux anisotropes incolores de AlCl3-6H2O, des cristaux anisotropes brillants de FeCl3-2KCl-H2O, et des cristaux transparents isotropes cubiques de KCl et NaCl ont été précipités et identifiés par examen microscopique. La procédure et les analyses pour les concentrations d’ions aluminium et d’ions chlorure étaient les mêmes que celles utilisées pour le système AlCl3-6H2O-HCl-H2O présenté plus tôt dans ce rapport. De plus, la concentration d’ions ferriques a été déterminée par un titrage standard de K2Cr2O7, la concentration d’ions sodium a été déterminée par des techniques d’absorption atomique, et la concentration d’ions potassium a été déterminée par soustraction de la concentration d’ions sodium d’une détermination des concentrations combinées d’ions potassium et d’ions sodium après séparation par échange d’ions. Les résultats sont énumérés au tableau 4 et représentés à la figure 3. Des résultats similaires obtenus par Miles sont également représentés sur la figure 3 pour montrer que la concordance est excellente. Des données publiées pour des systèmes connexes plus simples contenant moins de composants ont été compilées par Linke.
Dans les procédés de cristallisation par évaporation ou par barbotage de gaz HCl pour produire du chlorure d’aluminium hexahydraté pur, la contamination par d’autres chlorures métalliques devient un problème à mesure que les niveaux d’impuretés s’accumulent dans les solutions de lixiviation. La figure 3 montre les niveaux de concentration auxquels les impuretés telles que NaCl, KCl et FeCl2-2KCl-H2O cristalliseront également à partir de la solution sous forme de phases distinctes séparées, entraînant ainsi la contamination des cristaux d’AlCl3-6H2O. Par exemple, à moins de 2,4 % en poids de FeCl3 en présence de 1,6 % en poids de KCl à 25° C, la concentration de HCl doit être inférieure à 28 % en poids pour éviter la contamination de AlCl3-6H2O par le sel double, FeCl3-2KCl-H2O. La figure 3 est également utile pour redissoudre le précipité de recristallisation fractionnée afin de purifier le sel d’aluminium. En outre, certains des sels d’éléments de transition, tels que FeCl3, peuvent être minimisés par une électrolyse partielle pour plaquer une quantité suffisante de fer avant l’acidification avec HCl.
Un traitement thermodynamique du système avec l’erreur habituelle de ±0,05 % en poids dans la concentration en ions chlorure n’est pas réalisable, en particulier en l’absence de données de pression de vapeur pour H2O(g) et HCl(g). Cependant, des estimations approximatives des activités peuvent être faites par la méthode de Kusik-Meissner. On prévoit que ces estimations ne pourraient donner que des valeurs approximatives des activités pour les sels hydratés et complexes et pour l’eau.

Domaines recommandés pour la recherche
Les mesures des activités sont utiles pour interpréter la thermodynamique et la cinétique de la lixiviation, de la précipitation et de la purification des composants désirés de divers minerais. Il y a deux raisons pour lesquelles les activités peuvent être déterminées avec précision à partir des mesures de la pression de vapeur de l’eau : (1) La pression de vapeur peut être mesurée avec un haut degré de précision par des transducteurs de pression différentielle pour obtenir aw par l’équation 7 et ensuite pour calculer les valeurs des paramètres dans l’équation 11 de sorte que toutes les propriétés liées puissent être calculées comme discuté précédemment en détail (2) Le produit de solubilité et les activités peuvent tous deux être déterminés avec précision pour les sels multivalents qui contiennent un grand nombre de molécules d’eau dans leurs cristaux hydratés. La deuxième raison provient du fait que l’exposant de l’activité de l’eau dans l’équation 4 est égal aux moles d’eau dans le cristal hydraté.
Chlorure d’aluminium dans les solutions aqueuses d’acide chlorhydrique
Un autre type d’expérience intéressant pour le système ternaire discuté ici est la mesure de la pression partielle de HCl(g) sur diverses solutions contenant des quantités suffisamment importantes de HCl dissous. La procédure expérimentale à cet effet est décrite ailleurs. Les sels des groupes IIA, IIIA et des métaux de transition sont d’excellents candidats pour ces types d’investigations puisque les électrolytes ayant des valences supérieures à 1:1 forment généralement des sels hydratés.
La solubilité et l’activité du chlorure d’aluminium hexahydraté, AlCl3-6H2O, dans des solutions aqueuses ont été déterminées dans le cadre des recherches du Bureau des Mines, Département de l’Intérieur des États-Unis, visant à améliorer la technologie de traitement des minéraux pour récupérer l’alumine à partir de ressources domestiques de faible qualité. La solubilité de l’AlCl3 dans l’eau pure s’est avérée être de 31,09 et 31,77 % en poids à 25° et 85° C, respectivement, et a diminué de manière drastique à 10 et 0,1 % en poids lorsque les quantités respectives de 20,3 et 37 % en poids d’acide chlorhydrique (HCl) ont été ajoutées en solution. La constante d’équilibre pour la solubilité de l’hexahydrate, les activités et les coefficients d’activité de AlCl3 et H2O ont été calculés et comparés aux résultats des méthodes d’estimation disponibles. Les résultats se sont avérés utiles pour la lixiviation des minerais non bauxitiques en vue de l’extraction de l’alumine en modifiant les solubilités des sels composants lors de l’addition de HCl.
Les solubilités simultanées de AlCl3, FeCl3, KCl et NaCl dans des solutions de HCl-H2O ont également été déterminées et leurs effets sur la pureté de AlCl3-6H2O cristallisé à partir de solutions de sels mixtes sont brièvement discutés.