Une page de bioreaume microbien sur le genre Rhodospirillum rubrum
Classification
Taxons d’ordre supérieur
Kingdom : Bactéries
Phylum : Protéobactéries
Classe : Alphaproteobacteria
Ordre : Rhodospirillales
Famille : Rhodospirillaceae
Genus : Rhodospirillum
Espèce
Rhodospirillum rubrum
Description et importance
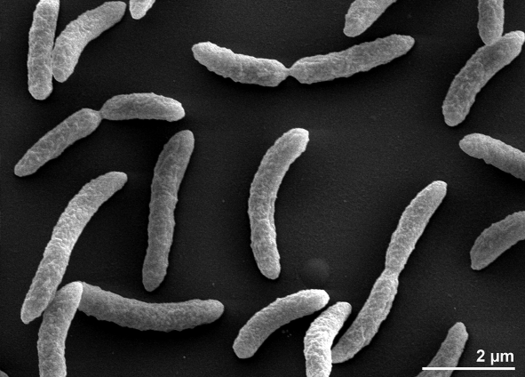
Rhodospirillum rubrum est une protéobactérie mésophile à Gram négatif. Sa température optimale de croissance est de 25 à 30 degrés Celsius. Elle possède des enveloppes externes multicouches, qui contiennent principalement des graisses insaturées, mais quelques graisses saturées dans sa paroi cellulaire. R. rubrum est une spirille, ce qui signifie qu’elle a une forme de spirale. Elle est polairement flagellée, et donc mobile. Sa longueur est de 3-10 um, avec une largeur de 0,8-1,0 um.
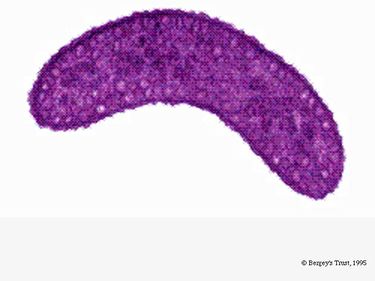
R. rubrum est un anaérobie facultatif. Selon la présence d’oxygène, il peut subir une fermentation alcoolique ou une respiration aérobie. Elle est également capable de photosynthèse et contient du caroténoïde et de la bateriochlorophylle dans ses particules chromatophores. Ces molécules aident à absorber la lumière et à la convertir en énergie et lui donnent également sa couleur rouge pourpre distincte dans des conditions anaérobies. R. rubrum est incolore dans des conditions aérobies.
Bien que la photosynthèse soit active dans des conditions aérobies, elle est généralement supprimée en présence d’O2. Le soufre est un sous-produit majeur de la photosynthèse, pas l’O2. R. rubrum peut croître de manière hétérotrophe ou autotrophe lorsqu’elle est photosynthétique. Contrairement à de nombreuses plantes, R. rubrum ne contient pas de chlorophylle a (spectre d’absorption 430-662 nm). Cependant, il contient de la chlorophylle b (spectres d’absorption 660-680 nm) et des bactériochlorophylles (800-925 nm). Cela lui permet d’utiliser davantage d’énergie provenant des spectres électromagnétiques. R. rubrum oxyde également le monoxyde de carbone (CO) avec de l’hydrogène gazeux comme produit final de la voie, et peut utiliser le sulfure à de faibles concentrations comme donneur d’électrons dans la réduction du dioxyde de carbone. De plus, c’est une bactérie fixatrice d’azote ; elle utilise la nitrogénase pour convertir l’azote atmosphérique gazeux en ammoniac (Munk et al, 2011).
Il existe plusieurs applications de R. rubrum dans le domaine de la biotechnologie. C’est un système modèle de conversion de la lumière en énergie chimique et pour ses voies de fixation de l’azote. Il fait également l’objet d’études sur la résistance aux radiations. Elle peut également être utilisée de plusieurs façons pour la consommation. Les protéobactéries peuvent être une source d’alimentation animale et d’engrais agricole. La production de vitamines constitue un autre rôle important dans la recherche. Elle fait également l’objet de recherches pour sa production de plastique biologique à partir de précurseurs de l’acide poly-hydroxybutyrique. R. rubrum pourrait également contribuer aux carburants biologiques à base d’hydrogène, principalement grâce à l’évolution de l’enzyme nitrogénase.
Structure du génome
Le séquençage du génome est terminé. Il est constitué d’un chromosome circulaire de 4 352 825 paires de bases, dont 65% sont des paires guanine-cystosine. Il y a aussi un plasmide de 53 732 paires de bases avec 60% de guanine-cytosine. Au total, il y a 3 850 gènes codant pour des protéines et 83 gènes ARN. Parmi ces gènes, 6,9 % sont liés à la transcription ; 4,6 % à la traduction, à la structure des ribosomes et à la biosynthèse ; 4,0 % à la réplication, à la recombinaison et à la réparation ; 7,9 % aux mécanismes de transduction du signal ; 5,9 % à la biogenèse de la paroi et de la membrane cellulaires ; 6,6 % à la production et à la conversion d’énergie ; 5,0 % au transport et au métabolisme des glucides ; 9.9% le transport et le métabolisme des acides aminés ; 4,7% le transport et le métabolisme des coenzymes ; 3,7% le transport et le métabolisme des lipides ; et 6,5% le transport et le métabolisme des ions inorganiques(Munk et al, 2011).
Ecologie
Du fait que Rhodospirillum rubrum peut se développer à la fois en aérobie et en anaérobie, il est capable d’habiter une grande variété de conditions. On trouve R. rubrum dans de nombreux environnements aquatiques naturels tels que les étangs, les lacs, les cours d’eau et les eaux stagnantes (Reslewic et. al, 2005). R. rubrum est également souvent trouvé dans la boue et les eaux usées (Brock et al, 2000). Des études ont montré que R. rubrum peut apporter de grands changements à sa composition chimique pour s’adapter à différents environnements (Cohen-Bazire et Kunisawa, 1963). R. rubrum préfère se développer dans des habitats dont le pH est de 6,8-7,2 (Bergey et Holt, 1994). Des études ont également montré que R. rubrum a une température de croissance optimale de 22-35 degrés Celcius (Weaver, 1971).
Structure cellulaire et métabolisme
R. rubrum est un organisme polyvalent qui peut obtenir de l’énergie par une variété de mécanismes. Les mécanismes de respiration et de photosynthèse existent ensemble et leur activité dépend de la présence de lumière et d’énergie. R. rubrum peut se développer dans des environnements chimio-tropicaux sombres avec la présence d’oxygène ou peut se développer dans un environnement photo tropical sans oxygène.
La photosynthèse chez R. rubrum commence par le don d’un hydrogène d’un substrat organique à un substrat oxydant. La bactériochlorophylle et les carténoïdes, les pigments photoréactifs présents dans la membrane cellulaire, sont liés aux chromatophores (Schachman, Pardee et Stanier, 1952). Les chromatophores sont des disques aplatis qui contiennent des phospholipides de choline, de la cardiolipine et des diglycérides de galactosyle (Benson, Wintermans et Wiser, 1959 ; Benson 1961). De plus, les chromatophores contiennent une chaîne complète de transport d’électrons qui comprend divers cytochromes, de la flavine et des nucléotides pyridine (Newton et Newton, 1957 ; Hulcher et Conti, 1960 ; Kamen, 1961). La membrane cellulaire contient également une machinerie pour la synthèse de l’ATP, y compris une ATP synthétase.
En présence d’oxygène, R. rubrum est capable de respirer de manière aérobie en utilisant une chaîne de transport d’électrons traditionnelle avec NAD+/NADH comme principal transporteur d’électrons (Keister et Minton, 1969). Parmi les protéines de transport d’électrons se trouve le cytochrome C428 (Chance et Smith, 1955). La respiration aérobie, cependant, est inhibée par la photosynthèse (Oelze et Weaver, 1971).
R. rubrum est également capable de respiration anaérobie. Ses accepteurs d’électrons terminaux non oxygénés peuvent inclure le sulfoxyde de diméthyle et l’oxyde de triméthylamine. La présence de ces accepteurs d’électrons permet à des substrats tels que le succinate, le malate et l’acétate de soutenir la croissance de R. rubrum. Ces accepteurs, cependant, ne sont qu’environ 33 à 41 % aussi efficaces que l’oxygène en termes de conservation de l’énergie (Schultz et Weaver, 1982).
De plus, R. rubrum a la capacité unique d’oxyder le monoxyde de carbone en utilisant la monoxyde de carbone déshydrogénase. Cette voie d’oxydation se termine par la réduction et l’hydrogène et la production d’hydrogène gazeux.
Sans accepteur terminal d’électrons, R. rubrum complète la fermentation acide mixte. Les principaux produits de la fermentation du pyruvate sont l’acétate, le formate, le dioxyde de carbone et l’hydrogène. En présence de l’ion bicarbonate, le fructose peut être fermenté. Les produits finaux de cette voie sont les mêmes que pour le pyruvate mais avec l’ajout de succinate et de propionate (Schultz et Weaver 1982).
En plus d’avoir la capacité de fixer le dioxyde de carbone (Schon et Biedermann, 1972), une propriété anabolique identifiante de R. rubrum est sa capacité à fixer l’azote. Dans des conditions d’obscurité avec la présence de fructose, R. rubrum utilise la nitrogénase pour fixer l’azote gazeux en ammonium. Il contient à la fois des nitrogénases Fe-Mo et Fe seul.
Pathologie
R. rubrum n’a pas été trouvé pour infecter les humains ou les animaux.
Recherche actuelle
Résistance aux radiations
Rhodospirillum rubrum a récemment fourni un aperçu de la résistance aux radiations. Felice Mastroleo et al, dans Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods (2010), ont caractérisé la tolérance aux rayonnements de R. rubrum.
En soumettant la bactérie à des doses sublétales de rayons gamma Cobalt-60, un type de rayonnement ionisant, des gènes marqueurs de R. rubrum spécifiques aux rayonnements ionisants ont été caractérisés dans l’organisme. L’expression de ces gènes augmentait au fur et à mesure que le « temps de récupération » s’écoulait après un traitement donné aux rayons gamma. L’analyse de l’expression des gènes par R. rubrum après un rayonnement gamma crée un potentiel pour d’autres recherches microbiologiques qui pourraient conduire à des avancées dans la résistance appliquée aux rayonnements dans le futur.
Plastiques biodégradables
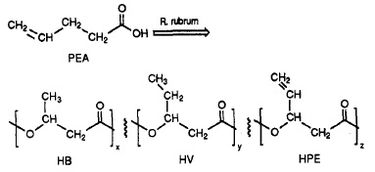
R. rubrum se révèle produire une classe de plastiques biodégradables, les poly bêta-hydroxyalcanoates (PHA). Les applications de cette recherche peuvent résoudre de nombreux problèmes causés par les plastiques synthétiques non dégradables qui ont eu un impact négatif sur l’environnement. Une expérience de recherche réalisée par Herbert. W. Ulmer et al a décrit la production de PHAs contenant des unités 3HV par Rhodospriillum rubrum (1993). Ulmer a utilisé l’acide 4-penténoïque (PEA) comme milieu de croissance pour R. rubrum. Lorsque la bactérie a été placée dans des » conditions de production de PHA « , des PHA ont été synthétisés contenant 3 sous-unités répétitives (note : R = groupe substituant) : HB (R = méthyle), HV (R = éthyle), HPE (R = vinyle) (voir figure 1).
La synthèse de plastiques fonctionnels et biodégradables par des bactéries a le potentiel de réduire la pollution globale et les dépenses en carburant des usines de plastique. R. rubrum peut être utilisé comme un outil microbiologique pour produire des biopolymères respectueux de l’environnement.
Énergie renouvelable
L’inquiétude croissante concernant la pollution de l’environnement due à la combustion des combustibles fossiles a conduit à une augmentation des recherches sur Rhodospirillum rubrum. L’utilisation de R. rubrum comme source d’hydrogène à utiliser dans les carburants à hydrogène renouvelables répond à plusieurs problèmes créés par la consommation de combustibles fossiles. L’hydrogène s’oxyde en eau en tant que produit de combustion, contrairement aux combustibles fossiles qui créent des polluants tels que le CO, le CO2, le SOx et le NOx. R. rubrum peut produire de l’hydrogène en utilisant la « réaction de déplacement eau-gaz » suivante (Najafpour et al, 2004) :
CO + H2O → H2 + CO2
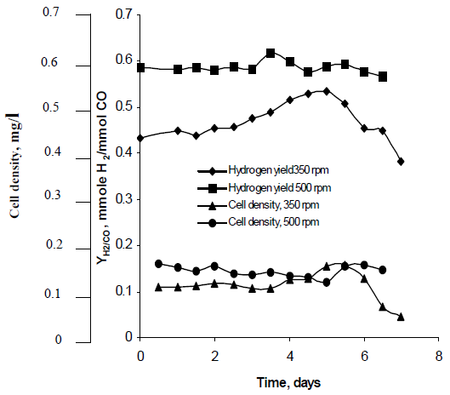
La méthode de recherche de Najafpour a observé comment l’agitation, créée par des ensembles de roues de turbine réglées à des taux de 350 rpm ainsi que 500 rpm, affectait les taux de production d’hydrogène de R. rubrum. Ses recherches ont montré que le carburant hydrogène a le potentiel de freiner le réchauffement climatique et de fournir une solution technologique écologique à la production et à la consommation de carburant. Son étude a révélé que « le taux d’agitation plus élevé a donné un rendement plus élevé d’hydrogène ainsi que la densité cellulaire » de R. rubrum (Voir Figure 2).
Dans une autre étude microbiologique, réalisée par Matthew Ross Melnicki, il a été constaté que R. rubrum fournit le potentiel pour l’énergie renouvelable, comme le carburant hydrogène, via la synthèse de l’hydrogène. Ses voies biologiques peuvent produire de l’hydrogène à des taux élevés lorsqu’elles sont cultivées conjointement avec Chlamydomonas reinhardtii, une espèce d’algue avec laquelle R. rubrum peut se développer harmonieusement. Melnicki a proposé une approche non conventionnelle de la co-culture pour la synthèse de l’hydrogène qui a produit des niveaux accrus de synthèse de l’hydrogène qui peuvent ne pas être atteints si la co-culture est découplée. C. reinhardtii a été favorisée à des intensités lumineuses plus élevées, tandis que R. ruburm a été plus productive sous des intensités lumineuses plus faibles, mettant en évidence les avantages de leur coculture.
En utilisant une technique fed-batch pour cultiver R. rubrum, il a été constaté que les cultures inoculées produisaient de l’hydrogène pendant sa phase de croissance exponentielle, et la synthèse de l’hydrogène a continué à prospérer en continu pendant 70 heures. Lorsque la croissance a cessé, Melnicki a ajouté du succinate, qui agit comme un donneur d’électrons dans la voie métabolique, et le dégagement d’hydrogène a repris même si la bactérie ne se développait plus. Cependant, il est important de noter qu’avec l’ajout continu de succinate, les taux d’évolution de l’hydrogène ont été réduits. Une fois que des milieux de croissance supplémentaires ont été ajoutés, les taux de production d’hydrogène ont augmenté une fois de plus.
Melnicki a également déclaré, « alors que la croissance n’est pas nécessaire pour la production d’hydrogène, ce travail établit la nécessité de la croissance cellulaire afin de maintenir les taux maximaux, suggérant l’adéquation industrielle d’une stratégie de culture semi-continue » (Melnicki, 2009).
Cool Factor
La séquence du génome de Rhodospirillum rubrum est seulement la deuxième du genre Rhodospirillum à avoir été publiée, après R. centenum (Munk et al, 2011).

Un aspect intéressant de Rhodospirillum rubrum est sa capacité à changer de couleur dans différentes conditions. C’est un phototrophe anoxygénique, mais il ne produit pas d’oxygène extracellulaire. Au lieu de cela, elle produit du soufre élémentaire pendant la récolte de la lumière. Cela est dû au fait que R. rubrum ne possède pas le complexe 2 de récolte de la lumière (Munk et al, 2011). La bactérie utilise la bactériochlorophylle, ce qui lui permet d’absorber des longueurs d’onde de lumière que les plantes n’utilisent pas. La bactériochlorophylle absorbe les longueurs d’onde de 800 à 925 nm.
Dans des conditions aérobies, l’activité photosynthétique de R. rubrum est génétiquement supprimée, et la bactérie devient incolore. Dans des conditions anaérobies, cependant, la photosynthèse est activée et la bactérie prend une couleur rouge pourpre distincte (voir Image 5). Cela est dû à l’activité des chromatophores, qui se trouvent dans la membrane (Munk et al, 2011). Les chromatophores contiennent les pigments de bactériochlorophylle de la bactérie, et subissent des changements d’absorption pendant l’activation de la photosynthèse.
Benson, A. « Le métabolisme des lipides du chloroplaste. » Dans Symposium no. VI. 5e congrès international de biochimie. 1961. Oxford : Pergamon Press. (Sous presse.)
Benson, A., Wintermans, J. et Wiser, R. « Chloroplast lipids as carbohydrate reservoirs. » Physiologie végétale. 1959. Volume 34. p. 815.
Bergey, D. et Holt, J. Bergey’s manual of determinative bacteriology. Neuvième édition. Baltimore. Lippincott Williams et Wilkins. 1994. p. 359.
Brock, T.D., M.T. Madigan, J.M. Martinko, et J Parker. Biologie des micro-organismes. 9e édition. Upper Saddle River : Prentice Hall, 2000. p. 459.
Chance, B. et Smith, L. « Pigments respiratoires de Rhodospirillum rubrum ». Nature. Volume 174. p. 803-806.
Cohen-Bazire, G. et Kunisawa, R. « The Fine Structure of Rhodospirillum Rubrum . » Journal de la biologie cellulaire. 1963. Volume 16. p. 401-419.
Hulcher, M. et Conti, S. « Cytochronies dans les particules contenant de la chlorophylle de Chromatium et Chlorobium thiosuphatophilum. » Communications de recherche en biochimie et biophysique. 1960. Volume 3. p. 497.
Kamen, M. « Les protéines hématiques des tissus photosynthétiques ». Dans Symposium no. VI. 5e congrès international de biochimie. 1961. Oxford : pergamon Press. (Dans la presse.)
Keister, D. et Minton, N. « Energy-linked reactions in photosynthetic bacteria. 3. Études complémentaires sur la réduction du nicotinamide-adénine dinucléotide liée à l’énergie par les chromatophores de Rhodospirillum rubrum. » Biochimie. 1969. Volume 8. p. 167-173.
Mastroleo, F., Monsieurs, P., et Leys, N. « Insight into the radiotolerance of the life support bacterium Rhodospirillum rubrum S1H by means of phenotypic and transcriptomic methods ». Assemblée scientifique du COSPAR. 2010. p. 4.
Melnicki, M. R. « Modes de production d’hydrogène dans la bactérie photosynthétique, Rhodosphirillum rubrum ». Université de Californie, Berkeley. 2009.
Munk, C., Copeland, A., Lucas, C., Lapidus, A., et al. « Complete genome sequence of Rhodospirillum rubrum type strain (S1T) ». Normes en sciences génomiques. 2011. Volume 4. pp. 293-302.
Najafpour, G., Ismail, K., Younesi, H., Mohamed, A. R., et Kamaruddin, A. H. « Hydrogène comme carburant propre via la fermentation continue par des bactéries photosynthétiques anaérobies, Rhodospirillum rubrum ». African Journal of Biotechnology. 2004. Volume 3. pp. 503-507.
Newton, J. et Newton, G. « Composition des particules subcellulaires photoactives de Chromatium ». Les archives de la biochimie et de la biophysique. 1957. Volume 71. p. 250.
Oelze, J. et Weaver, P. « L’ajustement des cellules cultivées photosynthétiquement de Rhodospirillum rubrum aux conditions de lumière aérobie. » Les archives de la microbiologie. 1982. Volume 79. p. 108-121.
Reslewic, S., Shigou, Z., Place, M., Zhang, Y., Briska A., Goldstein, S., Churas, C., Runnheim, R., Forrest, D., Lim, A., Lapidus, A., Han, C., Roberts, G., et Schwartz, D. « Whole-Genome Shotgun Optical Mapping of Rhodospirillum rubrum . » Microbiologie appliquée et environnementale. 2005. Volume 71. p. 5511-5522.
Schachman, H., Pardee, A., et Stanier, R. « Études sur l’organisation macromoléculaire des cellules microbiennes. » Les archives de la biochimie et de la biophysique. 1952. Volume 38. p. 245-260.
Schön, G. et Biedermann, M. « Synthèse d’acides volatils par fermentation du pyruvate et du fructose dans des cultures anaérobies en milieu sombre de Rhodospirillum rubrum. » Archiv fur Mikrobiologie.1972. Volume 85. p. 77-90.
Schultz, J. et Weaver, P. « Fermentation and anaerobic respiration by Rhodospirillum rubrum and Rhodopseudomonas capsulate. » Le Journal de Bactériologie. 1982. Volume 149. p. 181-190.
Ulmer, H., Gross, R., Posada, M., Weisbach, P., Fuller, R. C., et Lenz, R. « Bacterial production of poly(.beta.-hydroxyalkanoates) containing unsaturated repeating units by Rhodospirillum rubrum ». Macromolecules. 1994. Volume 27. p. 1675-1679.
Weaver, P. « Temperature-Sensitive Mutations of the Photosynthetic Apparatus of Rhodospirillum rubrum ». Proceedings of the National Academy of Sciences of the United States of America. 1971. Volume 68. p. 136-138.
Éditée par les étudiants du Dr Iris Keren : Allison Almeida, Matthew Cozzolino, Trung Nguyen, et Jessica Wong.
NEUF2011