J Cancer 2020 ; 11(6):1341-1350. doi:10.7150/jca.40817.
Document de recherche
Amy C. Moreno1, Yan Heather Lin2, Isabelle Bedrosian3, Yu Shen2, Gildy V. Babiera3, Simona F. Shaitelman1 ![]()
1. Département de radio-oncologie, The University of Texas MD Anderson Cancer Center, Houston, TX.
2. Département de biostatistique, The University of Texas MD Anderson Cancer Center, Houston, TX.
3. Département d’oncologie chirurgicale, The University of Texas MD Anderson Cancer Center, Houston, TX.
Moreno AC, Lin YH, Bedrosian I, Shen Y, Babiera GV, Shaitelman SF. Résultats après traitement du cancer du sein métaplasique par rapport à d’autres sous-types. J Cancer 2020 ; 11(6):1341-1350. doi:10.7150/jca.40817. Disponible à partir de https://www.jcancer.org/v11p1341.htm
Objectif : Le cancer du sein (CB) métaplasique est un sous-type histologique peu commun mais agressif de CB. Nous avons cherché à identifier les facteurs associés à son diagnostic et à comparer la prise en charge et les résultats du CB métaplasique avec ceux des autres CB et du carcinome canalaire invasif triple négatif en particulier étant donné la fréquence de son phénotype triple négatif.
Patientes et méthodes : Nous avons identifié les femmes diagnostiquées avec un BC invasif en 2010-2014 dans la base de données nationale sur le cancer, et avons utilisé une analyse univariée pour comparer les caractéristiques de base des patients et des tumeurs par sous-type de BC. La survie globale (OS) a été estimée avec la méthode de Kaplan-Meier, et des modèles de risques proportionnels de Cox multivariés ont été utilisés pour identifier les prédicteurs indépendants de l’OS.
Résultats : Sur 247 355 cas, 2 084 (0,8 %) étaient des CB métaplasiques, 55 998 (23 %) des CB triple négatifs et 77 % d’autres CB. Par rapport aux CB non métaplasiques, les femmes atteintes de CB métaplasiques étaient plus susceptibles d’être plus âgées au moment du diagnostic (âge médian, 62 vs 59 ans), de présenter ≥1 comorbidité (22 % vs 18 %) et de bénéficier de Medicare (41 % vs 33 % ; P<0,001). Les cancers métaplasiques avaient tendance à être de type basal (77 %) et, par rapport aux cancers triple négatif ou autres, les cancers métaplasiques étaient associés à un statut T clinique plus élevé (cT3-4, 18 % contre 11 %, 8 %), à l’absence d’atteinte ganglionnaire clinique (cN0, 86 %, 77 %, 80 %), à l’absence d’invasion lymphovasculaire (72 %, 65 %, 62 %) et à des tumeurs de haut grade (71 %, 77 %, 35 %) (P<0,001). La plupart des CB métaplasiques ont été traités par mastectomie (58 %), dissection du ganglion lymphatique sentinelle (65 %), irradiation de la paroi thoracique ou du sein (74 %) et chimiothérapie (75 %) comme traitement adjuvant (60 %). Après un suivi médian de 44,5 mois, les taux de survie globale étaient plus faibles pour le cancer métaplasique que pour le cancer triple négatif ou les autres cancers, quel que soit le stade clinique, à 5 ans (stade I, 85%, 87%, 91% ; II, 73%, 77%, 87% ; III, 43%, 53%, 75%) et à 3 ans (stade IV, 15%, 22%, 64% ; P<0,001). Dans l’analyse multivariée, l’augmentation de l’âge, le stade clinique avancé, l’invasion lymphovasculaire, le curage des ganglions axillaires (par opposition aux ganglions sentinelles) et l’absence de radiothérapie ou de chimiothérapie étaient associés à de plus mauvais résultats dans le cas du cancer métaplasique. L’étendue de la chirurgie a affecté la survie pour le BC triple négatif et les autres BC mais pas pour le BC métaplasique.
Conclusion : Les résultats pour le BC métaplasique continuent d’être plus mauvais que ceux des autres sous-types de BC malgré les traitements modernes. L’optimisation des options de traitement systémique, qui était un prédicteur significatif de la survie, devrait être une priorité dans la gestion du BC métaplasique.
Mots clés : cancer du sein métaplasique, cancer du sein triple négatif, résultats du cancer du sein, radiothérapie, chimiothérapie.
Introduction
Bien que le cancer du sein soit le diagnostic de cancer le plus fréquent affectant les femmes, avec plus de 268 000 cas documentés chaque année, le cancer du sein métaplasique (CB) constitue moins de 1 à 2 % de tous les cas de cancer du sein. Sur le plan clinique, le cancer du sein métaplasique se manifeste par une masse mammaire à croissance rapide, à échogénicité complexe (c’est-à-dire avec des composants solides et kystiques) à l’échographie et une masse de haute densité à la mammographie. Histologiquement, le CB métaplasique est composé d’une population hétérogène de tumeurs qui peuvent être classées par la présence de types de cellules non glandulaires ou mésenchymateuses ou par une catégorisation supplémentaire en sous-types en fonction de la présence de diverses caractéristiques telles que des cellules géantes ostéoclastiques ou des cellules fusiformes.
Au moment de la présentation, le taux d’implication clinique des ganglions lymphatiques dans le CB métaplasique est généralement faible. Cependant, le CB métaplasique est plus souvent diagnostiqué à des stades cliniques avancés en raison de tumeurs primaires plus grandes par rapport aux autres CB et est associé à des taux plus élevés de chimiorésistance, de métastases à distance et à une survie globale (OS) plus faible. Le cancer métaplasique présente une prévalence particulièrement élevée de récepteurs triple-négatifs ou d’absence d’amplification des récepteurs des œstrogènes, des récepteurs de la progestérone et du récepteur 2 du facteur de croissance épidermique humain (HER2). En l’absence de protéines ciblées, le CB métaplasique reste difficile à traiter. Les données prospectives sont limitées pour choisir le meilleur traitement pour le CB métaplasique étant donné la rareté du diagnostic. Au lieu de cela, une grande partie de la norme actuelle de soins pour le CB métaplasique a été extrapolée à partir des résultats de petites séries ou de rapports de cas provenant d’une seule institution. Nous avons donc utilisé la base de données nationale sur le cancer (NCDB), qui recense environ 70 % de tous les cas de cancer diagnostiqués aux États-Unis, pour évaluer les caractéristiques, la prise en charge et les résultats en fonction du traitement et des caractéristiques tumorales des patients atteints de cancer métaplasique du sein, par rapport à ceux atteints de cancer triple négatif et à tous les autres sous-types de cancer du sein. Nous avons également utilisé une analyse multivariée pour identifier les prédicteurs indépendants de la survie des femmes atteintes d’un CB métaplasique.
Source de données et sélection des cohortes
Projet conjoint établi en 1989 par la Commission sur le cancer de l’American College of Surgeons et l’American Cancer Society, la NCDB a recueilli des données oncologiques auprès d’environ 1 500 établissements accrédités aux États-Unis, totalisant plus de 34 millions d’enregistrements. Les informations disponibles sur les patients sont dépersonnalisées et donc exemptées de la surveillance de la protection humaine par le comité de révision institutionnel.
Les critères de sélection utilisés pour cette étude sont décrits dans la figure 1. Les femmes âgées de 18 ans et plus qui ont reçu un diagnostic de cancer du sein invasif entre 2010 et 2014 ont été incluses. Les patientes dont le statut des récepteurs hormonaux (œstrogènes et progestérone) (HR) était inconnu ont été exclues. Les autres raisons d’exclusion étaient les informations manquantes concernant la chirurgie, la chimiothérapie ou la stadification clinique selon l’American Joint Committee On Cancer (AJCC) 6e ou 7e édition. Les patients ont ensuite été répartis en trois groupes : 1) les cancers métaplasiques (avec les codes histologiques 8575 ou 8573), 2) les cancers triple-négatifs (TNBC, qui ne comprennent que les histologies non métaplasiques) et 3) tous les autres types de cancers. Le terme » BC non métaplasique » a été utilisé pour désigner le BC triple négatif et les autres BC combinés.
Diagramme de CONSORT. BC, cancer du sein.
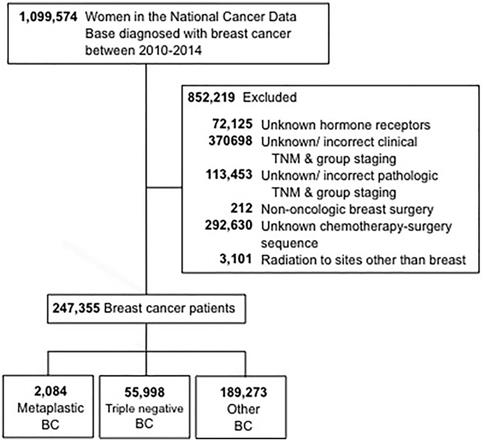 (Cliquez sur l’image pour l’agrandir.)
(Cliquez sur l’image pour l’agrandir.)
Variables
Les informations obtenues et analysées à partir de la NCDB comprenaient l’âge du patient au moment du diagnostic, l’année du diagnostic, la race, l’indice de comorbidité de Charlson/Deyo, le statut d’assurance médicale, le revenu médian du ménage et le type d’établissement traitant (dichotomisé en universitaire/recherche versus non universitaire). Les caractéristiques clinicopathologiques comprenaient la désignation AJCC clinique T et N (nodale), le groupe de stade clinique global AJCC, le statut HR, le statut des récepteurs HER2, le grade de la tumeur et l’invasion lymphovasculaire (LVSI). Les sous-types moléculaires ont été définis comme étant HR(+)/HER2(-), HER2(+), triple négatif (récepteur d’œstrogène(-), récepteur de progestérone (-), HER2(-)), ou inconnu. Les patientes présentant un CB métaplasique avec un statut de récepteur triple négatif ont été étiquetées CB tn-métaplasique pour les distinguer du CBTN non métaplasique. La prise en charge primaire comprenait la chirurgie (conservation du sein, mastectomie ou aucune), la radiothérapie avec ou sans inclusion d’une irradiation ganglionnaire régionale, la chimiothérapie (néoadjuvante, adjuvante ou aucune) et l’hormonothérapie. La gestion chirurgicale de l’aisselle a été définie comme étant soit une dissection des ganglions axillaires (ALND), avec 10 ganglions lymphatiques ou plus retirés, soit une dissection du ganglion lymphatique sentinelle (SLND), lorsque <10 ganglions lymphatiques ont été retirés.
Analyse statistique
Une analyse univariée a été utilisée pour évaluer les associations potentielles entre les caractéristiques démographiques, tumorales et cliniques et un diagnostic de CB métaplasique, en utilisant des tests de chi-carré pour les variables catégorielles et le test t/analyse de variance ou leurs équivalents des approches non paramétriques (Wilcoxon rank-sum ou Kruskal-Wallis) pour les variables continues. La SG a été définie comme la période comprise entre le moment du diagnostic et le moment du décès. La durée de la SG pour les patients survivants a été censurée à droite au moment du dernier contact. La distribution de la SG a été estimée par la méthode de Kaplan-Meier. Le test log-rank a été utilisé pour tester la différence de survie entre les groupes. Des analyses de régression des données de survie basées sur le modèle des risques proportionnels de Cox ont été effectuées sur la SG. Un modèle multivarié des risques proportionnels de Cox a été obtenu en incluant d’abord un ensemble initial de variables prédictives candidates avec une valeur P < 0,05 dans l’analyse univariée. Des analyses de survie ont été effectuées séparément pour chaque type de cancer.
L’emplacement et le type d’établissement n’ont pas été inclus dans le processus de sélection du modèle de cancer métaplasique car aucun de ces facteurs n’était statistiquement significatif pour ce groupe dans l’analyse univariée et les données n’étaient pas entièrement disponibles pour les patients de moins de 40 ans. Afin de déterminer si les détails de la thérapie systémique et de la radiothérapie affectent les résultats chez les patients atteints d’un cancer métaplasique, nous avons effectué des analyses de sous-ensembles sur cette cohorte pour évaluer l’influence potentielle de la séquence de chimiothérapie et de l’étendue des cibles de radiothérapie sur la survie globale. Tous les tests étaient bilatéraux, et la signification statistique était définie comme une valeur P <0,05. SAS version 9.4 (SAS Institute, Cary, NC) et S-Plus version 8.2 (TIBCO Software Inc, Palo Alto, CA) ont été utilisés pour effectuer les calculs de toutes les analyses.
Caractéristiques de la cohorte et des tumeurs
Nous avons identifié 247 355 femmes ayant reçu un diagnostic de cancer du sein invasif entre 2010 et 2014, dont 0,8 % (n=2 084) avaient un CB métaplasique, 23 % (n=55 998) un TNBC et 77 % (n=189 273) un autre CB. Les caractéristiques sociodémographiques, cliniques et pathologiques des tumeurs des patients et les caractéristiques du traitement par type de CB sont présentées dans le tableau 1. L’âge médian était de 63 ans (fourchette de 22 à 90 ans) pour les femmes atteintes d’un cancer métaplasique et de 59 ans (fourchette de 18 à 90 ans) pour les cancers du sein et les autres cancers. Les femmes atteintes d’un cancer métaplasique présentaient plus souvent un score de comorbidité ≥1 (22 % contre 18 % pour les cancers du sein et 16 % pour les autres cancers) et bénéficiaient d’une assurance publique (50 % contre 42 % pour les cancers du sein et 41 % pour les autres cancers) (toutes les valeurs P<0,001). Le diagnostic de CB métaplasique ou de CBTN était plus souvent associé à la race noire que les autres CB (18% contre 21% contre 11%, P<0,001).
Des différences significatives dans le stade clinique de la maladie et les caractéristiques de la tumeur ont été observées par type de cancer. Le BC métaplasique était souvent diagnostiqué à des stades plus avancés, avec seulement 31% des patients atteints de BC métaplasique ayant une maladie de stade clinique I contre 46% des TNBC et 54% des autres BC (P<0,001). Ce schéma semble être en corrélation avec des taux plus élevés de tumeurs de plus grande taille dans le groupe de CB métaplasique (cT3-4, 18% contre 11% contre 8%, respectivement), mais la présence d’une atteinte ganglionnaire clinique était la plus faible pour le CB métaplasique (cN1-3, 14% contre 23% contre 20%, respectivement) (tous les P<0,001). Contrairement au statut ganglionnaire clinique, les taux d’atteinte ganglionnaire pathologique étaient légèrement inférieurs pour le CB métaplasique et le CBTN mais doublaient pour les autres CB (pN1-3, 18% vs 26% vs 40%, respectivement, P<0,001). En ce qui concerne le statut des récepteurs, 77 % du groupe de CB métaplasique présentait un CB tn-métaplasique, soit 3,4 fois plus que le groupe de CB non métaplasique (23 %), dont le sous-type moléculaire HR(+)/HER2(-) était le plus courant (59 %) (P<0,001). En outre, seulement 5 % des cancers métaplasiques étaient HER2(+), contre 16 % des cancers non métaplasiques. Le BC métaplasique et le TNBC présentaient tous deux une proportion presque deux fois plus élevée de tumeurs de grade 3 par rapport aux autres BC (71%, 77% et 35%, respectivement, P<0,001), et le BC métaplasique présentait des taux plus faibles de LVSI par rapport au TNBC et aux autres BC (13%, 20% et 24%, respectivement, P<0,001).
Caractéristiques des patients et des traitements.
| Caractéristiques | BC métaplasique, Nbre (%) | BC triplement négatif, Nbre (%) | Autres BC, Nbre. (%) | Valeur P | |
|---|---|---|---|---|---|
| Age moyen, années (fourchette) | 62 (22-90) | 59 (18-90) | 59 (18-90) | <0.001 | |
| Race | |||||
| Blanc | 1623 (77,9) | 41791 (74,6) | 158406 (83.7) | <0,001 | |
| Noir | 368 (17,7) | 11771 (21) | 20722 (10,9) | ||
| Autre | 80 (3.8) | 2041 (3,6) | 8507 (4,5) | ||
| Inconnu | 13 (0,6) | 395 (0,7) | 1638 (0.9) | ||
| Score de comorbidité | |||||
| 0 | 1635 (78.5) | 45882 (81.9) | 158177 (83.6) | <0.001 | |
| 1 | 349 (16.7) | 8107 (14.5) | 25524 (13.5) | ||
| >=2 | 100 (4.8) | 2009 (3.6) | 5572 (2.9) | ||
| Revenu médian | |||||
| <30 000$ | 251 (12) | 7110 (12.7) | 19154 (10.) | <0.001 | |
| $30,000-$34,999 | 332 (15.9) | 9081 (16.2) | 28472 (15) | ||
| $35,000-$45,999 | 580 (27.8) | 15084 (26.9) | 48845 (25.8) | ||
| $46,000+ | 858 (41.2) | 23050 (41.2) | 86637 (45.8) | ||
| Inconnu | 63 (3) | 1673 (3) | 6165 (3.3) | ||
| Assurance médicale | |||||
| Privé | 975 (46.8) | 30263 (54) | 105839 (55.9) | <0.001 | |
| Medicaid | 154 (7,4) | 4716 (8,4) | 13267 (7) | ||
| Medicare | 862 (41.4) | 18355 (32,8) | 61535 (32,5) | ||
| Autre | 19 (0,9) | 665 (1,2) | 2212 (1.2) | ||
| Non assuré | 43 (2.1) | 1422 (2.5) | 4163 (2.2) | ||
| Inconnu | 31 (1.5) | 577 (1) | 2257 (1.2) | ||
| Type de comté | |||||
| Métropolitain | 1720 (82.5) | 46252 (82,6) | 157058 (83) | 0,152 | |
| Urbain | 271 (13) | 7456 (13,3) | 24367 (12.9) | ||
| Rural | 43 (2,1) | 951 (1,7) | 3219 (1.7) | ||
| Inconnu | 50 (2.4) | 1339 (2.4) | 4629 (2.4) | ||
| Type d’établissement | |||||
| Académique | 668 (32.1) | 16117 (28,8) | 52120 (27,5) | <0,001 | |
| Non académique | 1318 (63,2) | 35472 (63,3) | 126101 (66.6) | ||
| Inconnu | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Lieu d’implantation | |||||
| Midwest | 614 (29.5) | 14132 (25.2) | 46644 (24.6) | <0.001 | |
| Nord-Est | 410 (19,7) | 10411 (18,6) | 37787 (20) | ||
| Sud | 716 (34,4) | 20595 (36.8) | 66519 (35.1) | ||
| Ouest | 246 (11.8) | 6451 (11.5) | 27271 (14.4) | ||
| Inconnu | 98 (4.7) | 4409 (7.9) | 11052 (5.8) | ||
| Stade clinique de la maladie | |||||
| I | 639 (30.7) | 25843 (46,1) | 102257 (54) | <0,001 | |
| II | 1215 (58,3) | 23912 (42,7) | 70846 (37.4) | ||
| III | 201 (9,6) | 5579 (10) | 14283 (7,5) | ||
| IV | 29 (1,4) | 664 (1.2) | 1887 (1) | ||
| Statut T clinique | |||||
| cT0 | 5 (0.2) | 131 (0,2) | 341 (0,2) | <0,001 | |
| cT1 | 674 (32,3) | 28452 (50,8) | 113113 (59.8) | ||
| cT2 | 1026 (49,2) | 21530 (38,4) | 61145 (32,3) | ||
| cT3 | 252 (12.1) | 3702 (6,6) | 10061 (5,3) | ||
| cT4 | 127 (6,1) | 2183 (3,9) | 4613 (2.4) | ||
| Statut N clinique | |||||
| cN0 | 1787 (85.7) | 43357 (77.4) | 150890 (79.7) | <0,001 | |
| cN1 | 224 (10,7) | 9659 (17,2) | 30427 (16,1) | ||
| cN2 | 51 (2.4) | 1804 (3,2) | 5414 (2,9) | ||
| cN3 | 22 (1,1) | 1178 (2,1) | 2542 (1.3) | ||
| Stade pathologique | |||||
| 0 | 45 (2.2) | 4314 (7.7) | 5361 (2.8) | <0.001 | |
| 1 | 582 (27.9) | 24787 (44.3) | 81680 (43.2) | ||
| 2 | 1223 (58.7) | 20790 (37.1) | 72445 (38.3) | ||
| 3 | 210 (10.1) | 5675( 10.1) | 28323 (15) | ||
| 4 | 24 (1.2) | 432 (0.8) | 1464 (0.8) | ||
| Statut T pathologique | |||||
| pTis | 7 (0.3) | 432 (0,8) | 1862 (1) | <0,001 | |
| pT0 | 42 (2) | 4250 (7.6) | 3972 (2,1) | ||
| pT1 | 634 (30,4) | 29055 (51,9) | 106130 (56.1) | ||
| pT2 | 1017 (48,8) | 18530 (33,1) | 63484 (33,5) | ||
| pT3 | 290 (13.9) | 2540 (4,5) | 10588 (5,6) | ||
| pT4 | 93 (4,5) | 1097 (2) | 2892 (1.5) | ||
| pTX | 1 (0) | 94 (0.2) | 345 (0.2) | ||
| Statut N pathologique | |||||
| pN0 | 1705 (81.9) | 41587 (74,3) | 113787 (60,2) | <0,001 | |
| pN1 | 284 (13.6) | 9725 (17,4) | 51483 (27,2) | ||
| pN2 | 66 (3,2) | 3031 (5.4) | 16111 (8,5) | ||
| pN3 | 27 (1,3) | 1607 (2,9) | 7685 (4.1) | ||
| Groupement des récepteurs | |||||
| HR(+)/HER2(-) | 334 (16) | 0 (0) | 143687 (75.9) | <0.001 | |
| Triple négatif | 1604 (77) | 55998 (100) | 0 (0) | ||
| HER2(+) | 97 (4.7) | 0 (0) | 38726 (20.5) | ||
| Inconnu | 49 (2.4) | 0 (0) | 6860 (3.6) | ||
| Tumor grade | |||||
| 1 | 41 (2) | 988 (1.8) | 32015 (16.9) | <0.001 | |
| 2 | 237 (11.4) | 9050 (16.2) | 80590 (42.6) | ||
| 3 | 1485 (71.3) | 42930 (76.7) | 65482 (34.6) | ||
| 4 | 37 (1.8) | 286 (0.5) | 438 (0.2) | ||
| Inconnu | 284 (13,6) | 3030 (5.4) | 11186 (5,9) | ||
| LVSI | |||||
| Non présent | 1505 (72.2) | 36400 (65) | 118082 (62.4) | <0.001 | |
| Présent | 263 (12.6) | 11091 (19.8) | 45681 (24.1) | ||
| Inconnu | 316 (15.2) | 8507 (15.1) | 25510 (13.4) | ||
| Type de chirurgie | |||||
| BCS | 876 (42) | 29142 (52) | 92022 (48.6) | <0.001 | |
| Mastectomie | 1200 (57,6) | 26561 (47,4) | 95910 (50.7) | ||
| Pas de chirurgie | 8 (0,4) | 295 (0.5) | 1341 (0,7) | ||
| Chirurgie axillaire | |||||
| Pas de chirurgie | 47 (2.3) | 1034 (1,8) | 4433 (2,3) | <.001 | |
| SLND | 1353 (64,9) | 34880 (62.3) | 109718 (58) | ||
| ALND | 666 (32) | 19229 (34.3) | 73181 (38,7) | ||
| Inconnu | 18 (0,9) | 855 (1.5) | 1941 (1) | ||
| Radiothérapie | |||||
| Oui | 1087 (52.2) | 33938 (60,6) | 109268 (57,7) | <.001 | |
| Non | 989 (47,5) | 21860 (39) | 79375 (41.9) | ||
| Inconnu | 8 (0,4) | 200 (0,4) | 630 (0.3) | ||
| Cibles de rayonnement | |||||
| Mammifère/CW uniquement | 803 (73.9) | 24704 (72.8) | 72410 (66.3) | <0.001 | |
| Sein/CW + ganglions régionaux | 284 (26,1) | 9234 (27,2) | 36858 (33.7) | ||
| Chimiothérapie | |||||
| Oui | 1571 (75.4) | 44321 (79,1) | 133965 (70,8) | <0,001 | |
| Non | 499 (23.9) | 11195 (20) | 53062 (28) | ||
| Inconnu | 14 (0,7) | 482 (0,9) | 2246 (1.2) | ||
| Séquence chimiothérapie-chirurgie | |||||
| Adjuvant | 1241 (59,5) | 31519 (56.3) | 116645 (61,6) | <0,001 | |
| Néoadjuvant | 324 (15.5) | 12581 (22,5) | 16717 (8,8) | ||
| Aucun | 519 (24.9) | 11898 (21.2) | 55911 (29.5) | ||
| Hormonothérapie | |||||
| Oui | 220 (10.6) | 1178 (2,1) | 103906 (54,9) | <0,001 | |
| Non | 1798 (86,3) | 53274 (95.1) | 76820 (40,6) | ||
| Inconnu | 66 (3,2) | 1546 (2,8) | 8547 (4.5) | ||
| Année de diagnostic | |||||
| 2010 | 309 (14.8) | 9605 (17.2) | 36712 (19.4) | <0.001 | |
| 2011 | 393 (18.9) | 11163 (19.9) | 38815 (20.5) | ||
| 2012 | 458 (22) | 11205 (20) | 39364 (20.8) | ||
| 2013 | 463 (22.2) | 11992 (21.4) | 37764 (20) | ||
| 2014 | 461 (22.1) | 12033 (21.5) | 36618 (19,3) |
Abréviations : BC, cancer du sein ; ALND, curage des ganglions axillaires ; BCS, chirurgie conservatrice du sein ; CW, paroi thoracique ; HER2, récepteur du facteur de croissance épidermique humain ; HR, récepteur hormonal ; LVSI, invasion lymphovasculaire ; SLND, curage du ganglion sentinelle.
Traitement par type de cancer du sein
La plupart des patients (99%) ont subi une chirurgie oncologique du sein, y compris une évaluation chirurgicale de l’aisselle (97%). La mastectomie a été plus fréquemment utilisée dans le groupe BC métaplasique (58% vs 47% TNBC vs 51% autres BC, P<0,001), tout comme la SLND (65% vs 62% TNBC vs 58% autres BC ; P<0,001). L’irradiation ganglionnaire régionale a été plus souvent utilisée dans le cadre du traitement des autres CB que des CB métaplasiques et des CBTN (26%, 27% et 34% ; P<0,001), respectivement.
En ce qui concerne le traitement systémique, la chimiothérapie néoadjuvante a été utilisée presque deux fois plus souvent pour les CB métaplasiques et les CBTN que pour les autres CB (16%, 23%, 9% ; P<0,001), et environ un quart de toutes les femmes n’ont reçu aucune chimiothérapie. L’hormonothérapie a été utilisée le moins souvent pour le TNBC (2%) mais faisait partie du paradigme de traitement pour 11% des cas de BC métaplasique et 55% des autres BC.
Analyse de survie
La durée médiane de suivi était de 44,5 mois. Les patients atteints de CB métaplasique avaient une SG non ajustée significativement plus mauvaise, quel que soit le stade clinique (figure 2). Les estimations de la SG à 5 ans pour les patients atteints de BC métaplasique, de TNBC et d’autres BC au stade I de la maladie étaient de 85%, 87% et 91% ; celles pour le stade II étaient de 73%, 77% et 87% ; et celles pour le stade III étaient de 43%, 53% et 75% (P<0,001). Les taux de survie à 3 ans des patients atteints de maladie métastatique étaient 2 à 4 fois plus élevés pour les groupes TNBC et autres CB, soit 30 % et 64 %, contre 15 % pour le CB métaplasique (P<0,001). La survie par sous-type moléculaire a également été analysée (Fig. 3). Parmi les patients atteints d’un cancer métaplasique, aucune différence de survie n’est apparue en fonction du sous-type moléculaire (HR(+)/HER2(-), HER2(+) ou tn-métaplasique) (P=0,778). En revanche, dans le cas du cancer du sein non métaplasique, le sous-type triple négatif était associé à une moins bonne survie que les sous-types HER+ et HR(+)/HER2(-) (P<0,001). La race ne semblait pas non plus être associée à la survie chez les patientes atteintes d’un CB métaplasique (taux de SG à 5 ans de 73 % pour les blancs contre 74 % pour les noirs, P=0,876), alors que la race était associée à la SG dans les groupes TNBC (P<0,001) et autres CB (P<0,001 ; Fig. 4).
Courbes de survie globale des types de cancer du sein par stade clinique, en examinant les cancers du sein métaplasique, triple négatif et autres. Abréviation : MBC, cancer du sein métaplasique.
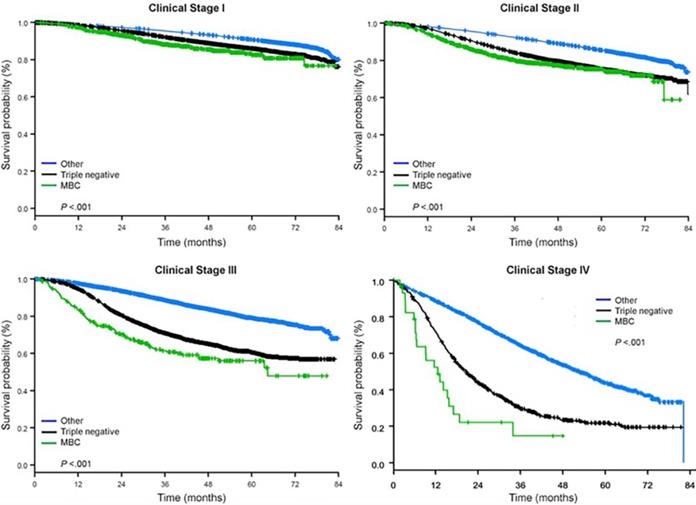 (Cliquez sur l’image pour l’agrandir.)
(Cliquez sur l’image pour l’agrandir.)
Courbes de survie globale des patientes atteintes d’un cancer du sein métaplasique et non métaplasique stratifiées par le statut des récepteurs. Abréviations : HER2, récepteur 2 du facteur de croissance épidermique humain ; HR, récepteur hormonal ; MBC, cancer du sein métaplasique.
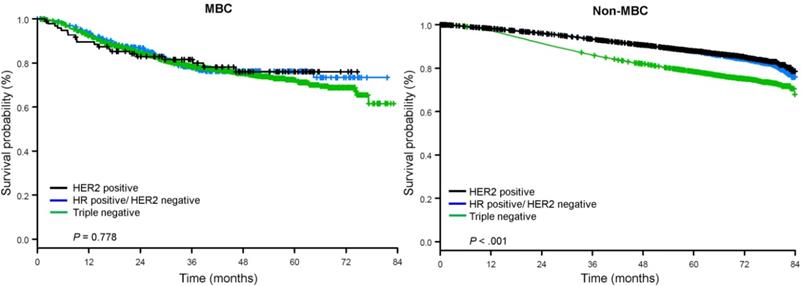 (Cliquez sur l’image pour l’agrandir.)
(Cliquez sur l’image pour l’agrandir.)
Courbes de survie globale des patientes atteintes d’un cancer du sein métaplasique, triple négatif et autre, stratifiées par race. Abréviations : CB, cancer du sein.
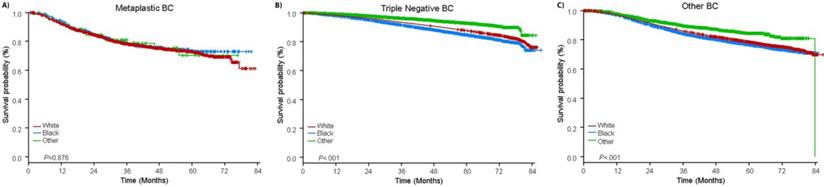 (Cliquez sur l’image pour l’agrandir.)
(Cliquez sur l’image pour l’agrandir.)
Analyse multivariable des facteurs associés à la survie globale des patients atteints de CB métaplasique.
| Facteurs associés à la survie globale dans le BC métaplasique | |||
|---|---|---|---|
| Variable (référence) | Ratio de dangerosité (intervalle de confiance à 95%) | Valeur P | |
| Age | Par an d’augmentation | 1.024 (1,015-1,033) | <0,0001 |
| Invasion lymphovasculaire (aucune) | Présent | 1,307 (1,017-1,679) | 0.0364 |
| Statut N clinique (cN0) | cN+ | 1,758 (1,328-2,326) | <0.0001 |
| Statut T clinique (cT1) | cT0 | 2,226 (0,301-16.447) | <0,0001 |
| cT2 | 1,454 (1,102-1.918) | ||
| cT3 | 3,029 (2,183-4,204) | ||
| cT4 | 3.145 (2.124-4.657) | ||
| Statut M clinique (cM0) | cM1 | 3.330 (2.020-5,488) | <0,0001 |
| Chirurgie axillaire (SLND) | ALND | 1.333 (1,065-1,670) | 0,0247 |
| Pas de chirurgie | 1,538 (0.884-2,675) | ||
| Radiation (Non) | Oui | 0,709 (0.572-0,878) | 0,0016 |
| Chémothérapie (Non) | Oui | 0,579 (0,446-0,752) | <0,0001 |
Abréviations : ALND, curage des ganglions axillaires ; BC, cancer du sein ; SLND, curage du ganglion sentinelle.
Sur une analyse multivariée, l’augmentation de l’âge, une classification T clinique plus élevée, la présence d’une maladie ganglionnaire clinique ou d’une LVSI, et le traitement par ALND sont tous corrélés à des résultats plus mauvais pour les patients atteints de BC métaplasique, de TNBC et d’autres BC (tableau supplémentaire 1). L’ajout de la chimiothérapie et de la radiothérapie a amélioré de façon indépendante la SG, quel que soit le type de cancer du sein. D’autres caractéristiques des patientes et des tumeurs associées à la survie dans les cas de CBTN et d’autres CB, y compris la race, les comorbidités et le grade de la tumeur, n’étaient pas associées aux résultats de survie pour le CB métaplasique lors de l’analyse multivariée.
Etant donné les résultats relativement médiocres parmi les patientes atteintes de CB métaplasique, des analyses de sous-groupes ont été effectuées sur le groupe de CB métaplasique pour évaluer si des modalités de traitement étaient associées à de meilleurs résultats. Après ajustement en fonction du statut ganglionnaire (cN0 vs. N+), le traitement par une chirurgie axillaire plus agressive (ALND vs. SLND) a été associé à de moins bons résultats, un phénomène qui a également été observé parmi le TNBC et les autres CB (tableau 2). Parmi les patients ayant reçu une radiothérapie, le traitement par irradiation ganglionnaire régionale par rapport à l’irradiation du sein ou de la paroi thoracique uniquement n’a pas influencé de manière significative les résultats chez les patients atteints de CB métaplasique (P=0,077 et 0,200 pour les cliniques N0 et N+, respectivement). La chimiothérapie néoadjuvante a été associée à des résultats plus mauvais que la chimiothérapie adjuvante chez les patients présentant un cancer métaplasique cliniquement négatif (HR 1,9, IC 95 % 1,3-2,6, P<0.001), mais pas chez celles présentant un BC métaplasique cliniquement positif au niveau des ganglions (P=0,43).
Discussion
Le cancer du sein métaplasique est une forme rare mais particulièrement agressive de cancer du sein, surtout lorsqu’on le compare à d’autres sous-types de tumeurs mammaires. Cette entité pathologique a été relativement sous-représentée dans la littérature. Une recherche approfondie de Rayson et al. dans les publications de 1966 à 1997 n’a donné que 27 cas au total. Les grandes bases de données nationales comme la NCDB sont avantageuses pour étudier les cancers rares comme le CB métaplasique. Cependant, l’incidence du diagnostic de CB métaplasique aux Etats-Unis selon ces bases de données est encore faible, avec moins de 500 cas par an. Dans notre étude, nous avons constaté que le cancer métaplasique était le plus souvent diagnostiqué comme une tumeur de grande taille avec des caractéristiques de risque défavorables telles que le grade de la tumeur peu différenciée et le statut de récepteur triple négatif. Les patients atteints de CB métaplasique avaient une survie significativement plus faible, quel que soit le stade de la présentation, par rapport aux CB triple négatif et aux autres CB. La chimiothérapie et la radiothérapie ont été des facteurs prédictifs indépendants d’une meilleure survie, mais la séquence de chimiothérapie a semblé affecter les résultats, en particulier pour les patients atteints de CB métaplasique sans atteinte ganglionnaire clinique, tout en reconnaissant que certains de ces patients avaient une atteinte ganglionnaire pathologique. Cependant, nos résultats peuvent refléter une hétérogénéité potentielle dans les mécanismes biologiques sous-jacents conduisant à des réponses aux traitements dans ce groupe particulier de patients BC et soulignent la nécessité d’une meilleure stratification du risque et des options de traitement systémique pour améliorer les résultats.
Bien que la plupart des BC métaplasiques aient un phénotype triple négatif, le comportement du BC métaplasique semble être unique par rapport aux autres TNBC. Le CBTN a tendance à avoir un pronostic plus défavorable que les autres types de CB, et l’idée que le CB métaplasique est plus agressif que le CBTN a été corroborée par de multiples petites études rétrospectives. Ces études ont montré des schémas similaires de diagnostic à des stades avancés pour le CB métaplasique par rapport au CBTN, en raison de taux plus élevés de maladie cT3-4 plutôt que d’atteinte ganglionnaire, et dans une revue de 46 cas de CB métaplasique réalisée par un seul établissement, les patients atteints de CB métaplasique avaient un risque significativement plus élevé de récidive locale de la maladie (30 % contre 15 % ; P=0,004). Ces caractéristiques ont finalement été corrélées à des taux de survie sans maladie à 5 ans (30 % contre 90 % ; P<0,001) et à des taux de survie globale (65 % contre 87 % ; P=0,002) inférieurs chez les patientes atteintes d’un CB métaplasique par rapport à celles atteintes d’un CBTN. Une étude de surveillance, d’épidémiologie et de résultats finaux portant sur 1 1112 patients atteints d’un cancer métaplasique du sein a également montré que les taux de survie spécifique à 3 ans étaient plus faibles pour les cancers métaplasiques du sein que pour les cancers TNBC (78 % contre 84 %). En examinant le CB métaplasique tn, Li et al. ont trouvé une survie sans maladie (HR 1,48, 95% CI 1,19-1,84, P<0,01) et une OS (HR 1,42 ; P<.01) plus faibles pour le CB métaplasique tn que pour le TNBC. Notre étude, qui a inclus l’un des plus grands groupes de patients atteints de cancer métaplasique du sein à ce jour (n=2 084), renforce ces résultats et souligne que le statut des récepteurs n’est pas un prédicteur indépendant de la survie pour le cancer métaplasique du sein (P=0.Un élément thérapeutique essentiel associé à l’amélioration des résultats pour tous les patients atteints de cancer métaplasique dans notre étude était l’utilisation de la chimiothérapie (HR 0,58, 95% CI 0,45-0,75, P<0,001). Notre rapport est le premier, à notre connaissance, à présenter les résultats du cancer métaplasique du sein en fonction de la séquence de chimiothérapie. Il est frappant de constater que, pour les patients atteints d’un cancer métaplasique cN0 en particulier, la chimiothérapie néoadjuvante était associée à une moins bonne survie que la chimiothérapie adjuvante (HR 1,88, IC 95 % 1,34-2,64, P<0,001), alors que le séquençage de la chimiothérapie n’avait aucun effet sur le cancer métaplasique cliniquement positif. Cela peut s’expliquer par le fait que nos patients atteints de cancer métaplasique avaient un statut T clinique plus élevé, ce qui, dans d’autres rapports, a été associé à des taux plus faibles de réponse complète pathologique et à des résultats de survie plus mauvais. De plus, les méthodes de stadification clinique (c’est-à-dire l’examen physique seul, l’incorporation de l’échographie) peuvent introduire une hétérogénéité dans une population clinique N0 en manquant la véritable charge de la maladie au niveau des ganglions, ce qui en soi peut être associé à des résultats inférieurs. Dans l’ensemble, la réponse du CB métaplasique à la chimiothérapie néoadjuvante a été rapportée comme étant aussi faible que 18%, ce qui est beaucoup plus faible que les taux de réponse connus pour le TNBC aux régimes de chimiothérapie à base d’anthracycline et de taxane.
Sur la base de la survie plus faible et du développement relativement rapide de la propagation métastatique à distance par rapport à d’autres sous-types de cancer du sein notés dans notre étude et dans d’autres rapports, le besoin de meilleures options de traitement systémique est clairement évident pour le CB métaplasique. Le profilage transcriptionnel a montré que ce sous-type de cancer présente une signature tumorigène avec des caractéristiques de type cellules souches, des aberrations fréquentes dans la voie PI3K/AKT/mTOR et une surexpression du facteur de croissance endothélial vasculaire (VEGF). Ces caractéristiques sont similaires à celles que l’on trouve dans les TNBC mésenchymateux. Des efforts prometteurs sont en cours pour identifier des schémas thérapeutiques systémiques alternatifs pour ces patients, notamment un récent essai de phase I qui a montré une amélioration des taux de réponse objective à la doxorubicine liposomale, au bevacizumab (anticorps monoclonal contre le VEGF-A) et à l’évérolimus (inhibiteur de mTOR) chez les patients atteints de TNBC métaplasique avec une aberration de la voie PI3K.
En ce qui concerne les traitements locaux, la mastectomie a été plus fréquemment utilisée dans notre étude pour le CB métaplasique mais n’a pas été associée à une amélioration de la survie par rapport à la chirurgie conservatrice du sein. De même, aucun avantage en termes de survie n’a été constaté pour un traitement intégrant une ALND par rapport à une SLND. La radiothérapie, cependant, a été un facteur prédictif significatif de la survie, les patientes atteintes d’un cancer métaplasique du sein traitées par radiothérapie adjuvante ayant 30 % de chances en moins de mourir que celles qui n’ont pas reçu de radiothérapie. Les limites pertinentes de notre analyse de la radiothérapie comprennent des détails inconnus concernant la planification du traitement, la modalité sélectionnée, l’assurance qualité ou l’utilisation de techniques telles que l’inspiration profonde en apnée. Bien que la rechute locorégionale ne puisse pas être examinée dans la NCDB, une série institutionnelle de 113 patients atteints d’un CB métaplasique (dont 54% ont reçu une radiothérapie) a montré que la radiation était le seul facteur corrélé avec une récidive locorégionale réduite (risque relatif sans radiation 3.1 ; 95% CI 1.13-9.88, P=0.027).
Nos résultats doivent être interprétés avec prudence étant donné les limitations majeures de ne pas connaître les régimes de chimiothérapie utilisés, la durée des traitements, ou la réponse à la chimiothérapie néoadjuvante, car ces informations ne sont pas disponibles dans la NCDB. Nous reconnaissons également les limites des facteurs de risque clinico-pathologiques saisis dans la NCDB, sans lesquels il ne serait peut-être pas possible de caractériser pleinement les différences cliniques à l’origine de certaines des différences de résultats que nous avons constatées, telles que des résultats de survie plus mauvais avec la TNLA, même en contrôlant le statut ganglionnaire. Bien que la taille de notre échantillon de patients atteints d’un cancer métaplasique du col de l’utérus soit faible par rapport aux études sur le cancer non métaplasique du col de l’utérus, il s’agit paradoxalement de la plus grande étude existante à ce jour sur cette question, étant donné le nombre limité de patients atteints d’un cancer métaplasique du col de l’utérus rapporté dans les séries institutionnelles. Des recherches supplémentaires sont nécessaires pour comprendre la prédilection biologique pour la propagation métastatique dans le CB métaplasique et valider nos résultats dans des ensembles de données distincts de patients atteints de CB métaplasique.
Notre norme de soins actuelle n’est clairement pas adaptée à cette population de cancer unique, et l’obtention de données randomisées sur le CB métaplasique à l’avenir nécessitera des efforts de coopération en raison du petit nombre de patients. La NCDB présente un atout notable, à savoir la possibilité d’étudier les schémas de traitement et les résultats associés à un diagnostic rare. Avec 2 084 personnes atteintes d’un cancer métaplasique du sein dans cette cohorte, il s’agit de l’une des plus grandes enquêtes sur le cancer métaplasique du sein rapportées à l’époque moderne. La survie de ces patients est faible par rapport à celle des patients atteints d’autres types de cancer du sein, et bien que ce fait incite probablement à l’incorporation d’une thérapie agressive, notre étude suggère qu’un traitement local-régional plus étendu (par exemple, la RAD ou l’irradiation des ganglions régionaux) devrait être soigneusement envisagé au cas par cas. Dans l’ensemble, l’utilisation d’un traitement systémique est cruciale pour la gestion du BC métaplasique, quel que soit le fardeau nodal, et le développement de thérapies ciblées efficaces basées sur l’analyse du profil génomique de la tumeur est prometteur pour l’avenir.
Matériel supplémentaire
![]()
Tableau supplémentaire.
Reconnaissances
Sincères remerciements à Christine Wogan pour l’assistance éditoriale.
Funding
Supported in part by Cancer Center Support (Biostatistics Core) Grant CA016672 from the National Cancer Institute, National Institutes of Health, to The University of Texas MD Anderson Cancer Center.
Competing Interests
Les auteurs ont déclaré qu’aucun intérêt concurrent n’existe.
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68(1):7-30
2. Yerushalmi R, Hayes MM, Gelmon KA. Carcinome du sein – types rares : revue de la littérature. Ann Oncol. 2009;20(11):1763-1770
3. Günhan-Bilgen I, Memiş A, Ustün EE, Zekioglu O, Ozdemir N. Metaplastic carcinoma of the breast : clinical, mammographic, and sonographic findings with histopathologic correlation. AJR Am J Roentgenol. 2002;178(6):1421-1425
4. Jung S-Y, Kim HY, Nam B-H. et al. Worse prognosis of metaplastic breast cancer patients than other patients with triple-negative breast cancer. Breast Cancer Res Treat. 2010;120(3):627-637
5. Wargotz ES, Norris HJ. Carcinomes métaplasiques du sein : V. Carcinome métaplasique avec cellules géantes ostéoclastiques. Hum Pathol. 1990;21(11):1142-1150
6. Wargotz ES, Norris HJ. Carcinomes métaplasiques du sein. I. Carcinome producteur de matrice. Hum Pathol. 1989;20(7):628-635
7. Wargotz ES, Deos PH, Norris HJ. Metaplastic carcinomas of the breast. II. Spindle cell carcinoma. Hum Pathol. 1989;20(8):732-740
8. Lee H, Jung S-Y, Ro JY. et al. Metaplastic breast cancer : clinicopathological features and its prognosis. J Clin Pathol. 2012;65(5):441-446
9. He X, Ji J, Dong R. et al. Pronostic dans différents sous-types de cancer du sein métaplasique : une analyse basée sur la population. Breast Cancer Res Treat. Octobre. 2018
10. Base de données nationale sur le cancer.
11. Chagpar AB, Scoggins CR, Martin RCG. et al. Facteurs déterminant l’adéquation de la dissection des ganglions axillaires chez les patientes atteintes de cancer du sein. Breast J. 2007;13(3):233-237
12. Bembenek A, Schlag PM. Dissection des ganglions lymphatiques dans le cancer du sein. Langenbeck’s Arch Surg. 2000;385(4):236-245
13. Woolson RF. Méthodes statistiques pour l’analyse des données biomédicales. New York, USA : John Wiley & Sons. 1987
14. Kaplan EL, Meier P. Estimation non paramétrique à partir d’observations incomplètes ESTIMATION NON PARAMÉTRIQUE À PARTIR D’OBSERVATIONS INCOMPLÈTES*. Source J Am Stat Assoc. 1958;53(282):457-481
15. Mantel N. Evaluation of survival data and two new rank order statistics arising in its consideration. Cancer Chemother Rep. 1966;50(3):163-170
16. D.R. C. Modèles de régression et tables de survie. Tables de vie Cox. 1972;2:187-220
17. Rayson D, Adjei AA, Suman VJ, Wold LE, Ingle JN. Cancer du sein métaplasique : pronostic et réponse à la thérapie systémique. Ann Oncol Off J Eur Soc Med Oncol. 1999;10(4):413-419
18. Bilimoria KY, Stewart AK, Winchester DP, Ko CY. La base de données nationale sur le cancer : une initiative puissante pour améliorer les soins du cancer aux États-Unis. Ann Surg Oncol. 2008;15(3):683-690
19. Ong CT, Campbell BM, Thomas SM. et al. Metaplastic Breast Cancer Treatment and Outcomes in 2500 Patients : A Retrospective Analysis of a National Oncology Database. Ann Surg Oncol. 2018;25(8):2249-2260
20. Dietze EC, Sistrunk C, Miranda-Carboni G, O’Regan R, Seewaldt VL. Le cancer du sein triple négatif chez les femmes afro-américaines : disparités versus biologie. Nat Rev Cancer. 2015;15(4):248-254
21. Rakha EA, El-Sayed ME, Green AR, Lee AHS, Robertson JF, Ellis IO. Marqueurs pronostiques dans le cancer du sein triple négatif. Cancer. 2007;109(1):25-32
22. ROJAS K, STUCKEY A. Épidémiologie et facteurs de risque du cancer du sein. Clin Obstet Gynecol. 2016;59(4):651-672
23. Liao H-Y, Zhang W-W, Sun J-Y, Li F-Y, He Z-Y, Wu S-G. Les caractéristiques clinicopathologiques et les résultats de survie des différents sous-types histologiques dans le cancer du sein triple négatif. J Cancer. 2018;9(2):296-303
24. El Zein D, Hughes M, Kumar S. et al. Le carcinome métaplasique du sein est plus agressif que le cancer du sein triple négatif : A Study From a Single Institution and Review of Literature. Clin Breast Cancer. 2017;17(5):382-391
25. Liedtke C, Mazouni C, Hess KR. et al. Réponse au traitement néoadjuvant et survie à long terme chez les patients atteints de cancer du sein triple négatif. J Clin Oncol. 2008;26(8):1275-1281
26. Cortazar P, Zhang L, Untch M. et al. Pathological complete response and long-term clinical benefit in breast cancer : the CTNeoBC pooled analysis. Lancet. 2014;384(9938):164-172
27. Fisher B, Brown A, Mamounas E. et al. Effet de la chimiothérapie préopératoire sur la maladie loco-régionale chez les femmes atteintes d’un cancer du sein opérable : résultats du projet national de chirurgie adjuvante du sein et de l’intestin B-18. J Clin Oncol. 1997;15(7):2483-2493
28. Chen IC, Lin CH, Huang CS. et al. Manque d’efficacité de la chimiothérapie systémique pour le traitement du carcinome métaplasique du sein dans l’ère moderne. Breast Cancer Res Treat. 2011;130(1):345-351
29. Hennessy BT, Gonzalez-Angulo A-M, Stemke-Hale K. et al. Characterization of a naturally occurring breast cancer subset enriched in epithelial-to-mesenchymal transition and stem cell characteristics. Cancer Res. 2009;69(10):4116-4124
30. Prat A, Parker JS, Karginova O. et al. Phenotypic and molecular characterization of the claudin-low intrinsic subtype of breast cancer. Breast Cancer Res. 2010;12(5):R68
31. Yu K-D, Zhu R, Zhan M. et al. Identification de sous-groupes pertinents pour le pronostic chez les patients atteints de cancer du sein triple négatif chimiorésistant. Clin Cancer Res. 2013;19(10):2723-2733
32. Basho RK, Yam C, Gilcrease M. et al. Efficacité comparative d’un régime de thérapie systémique basé sur mTOR dans le cancer du sein triple négatif avancé, métaplasique et non métaplasique. Oncologue. 2018;23(11):1300-1309
33. Basho RK, Gilcrease M, Murthy RK. et al. Targeting the PI3K/AKT/mTOR Pathway for the Treatment of Mesenchymal Triple-Negative Breast Cancer. JAMA Oncol. 2017;3(4):509
34. Bergom C, Currey A, Desai N, Tai A, Strauss JB. Deep Inspiration Breath Hold : Techniques et avantages pour l’épargne cardiaque pendant l’irradiation du cancer du sein. Front Oncol. 2018;8:87
35. Latty D, Stuart KE, Wang W, Ahern V. Examen des techniques d’apnée en inspiration profonde pour le traitement du cancer du sein. J Med Radiat Sci. 2015;62(1):74-81
36. Leyrer CM, Berriochoa CA, Agrawal S. et al. Facteurs prédictifs sur les résultats dans le cancer du sein métaplasique. Breast Cancer Res Treat. 2017;165(3):499-504
37. Takala S, Heikkilä P, Nevanlinna H, Blomqvist C, Mattson J. Carcinome métaplasique du sein : Pronostic et réponse au traitement systémique en cas de maladie métastatique. Breast J. 2019;25(3):418-424
38. Harper NW, Hodges KB, Stewart RL. et al. Traitement adjuvant du cancer du sein métaplasique triple négatif avec une chimiothérapie hebdomadaire au paclitaxel et au platine : Retrospective Case Review From a Single Institution. Clin Breast Cancer. Mai. 2019
Contact de l’auteur
.