Propriétés de l’eau
L’une des particularités de notre planète est la présence d’eau liquide. L’eau est fondamentale pour toute vie ; sans elle, chaque être vivant mourrait.
L’eau couvre environ 70% de la surface de la Terre et elle constitue 65-75% de notre corps (82% de notre sang est de l’eau). Même si l’eau peut sembler ennuyeuse – pas de couleur, de goût ou d’odeur – elle possède des propriétés étonnantes qui la rendent nécessaire au maintien de la vie.
(Notre besoin d’eau et les animaux océaniques qui vivent dans l’eau, sont ce qui rend les marées noires si dommageables.)
La composition chimique de l’eau est H2O – deux atomes d’hydrogène et un atome d’oxygène. Les propriétés de l’eau sont particulières en raison de la façon dont ses atomes se lient entre eux pour former une molécule d’eau, et de la façon dont les molécules interagissent entre elles.
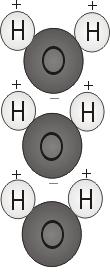
Polarité de l’eau
Lorsque les deux atomes d’hydrogène se lient à l’oxygène, ils se fixent au sommet de la molécule un peu comme des oreilles de Mickey Mouse. Cette structure moléculaire donne à la molécule d’eau une polarité, ou une charge électrique asymétrique qui attire d’autres atomes.
L’extrémité de la molécule avec les deux atomes d’hydrogène est chargée positivement. L’autre extrémité, avec l’oxygène, est chargée négativement. Tout comme dans un aimant, où les pôles nord sont attirés par les pôles sud (« les opposés s’attirent »), l’extrémité positive de la molécule d’eau va se connecter à l’extrémité négative d’autres molécules.
Que cela signifie-t-il pour nous ? La polarité de l’eau lui permet de dissoudre très facilement d’autres substances polaires. Lorsqu’une substance polaire est mise dans l’eau, les extrémités positives de ses molécules sont attirées par les extrémités négatives des molécules d’eau, et vice versa. Ces attractions font que les molécules de la nouvelle substance se mélangent uniformément aux molécules d’eau.
L’eau dissout plus de substances que tout autre liquide – même l’acide le plus fort ! Pour cette raison, elle est souvent appelée le « solvant universel ». Le pouvoir dissolvant de l’eau est très important pour la vie sur Terre. Partout où l’eau va, elle transporte des produits chimiques dissous, des minéraux et des nutriments qui sont utilisés pour soutenir les êtres vivants.
En raison de leur polarité, les molécules d’eau sont fortement attirées les unes vers les autres, ce qui donne à l’eau une tension de surface élevée. Les molécules à la surface de l’eau « collent ensemble » pour former une sorte de « peau » sur l’eau, suffisamment solide pour supporter des objets très légers. Les insectes qui marchent sur l’eau profitent de cette tension superficielle.
La tension superficielle fait que l’eau s’agglutine en gouttes plutôt que de s’étaler en une fine couche.
Elle permet également à l’eau de se déplacer à travers les racines et les tiges des plantes, les thermomètres et les plus petits vaisseaux sanguins de votre corps. Lorsqu’une molécule monte, elle « entraîne » les autres avec elle.
Trois états de la matière
L’eau est l’un des quatre éléments, et la seule substance naturelle qui peut exister dans les trois états de la matière – solide, liquide et gazeux – aux températures que l’on trouve normalement sur Terre.
Plusieurs autres substances doivent être surchauffées ou -refroidies pour changer d’état.
L’état gazeux de l’eau est présent continuellement dans notre atmosphère sous forme de vapeur d’eau. L’état liquide se trouve partout dans les rivières, les lacs et les océans.
L’état solide de l’eau, la glace, est unique. La plupart des liquides se contractent lorsqu’ils sont refroidis, car les molécules se déplacent plus lentement et ont moins d’énergie pour résister à l’attraction des autres. Lorsqu’ils gèlent pour devenir des solides, ils forment des cristaux très serrés qui sont beaucoup plus denses que le liquide ne l’était à l’origine.
L’eau n’agit pas de cette façon. Lorsqu’elle gèle, elle se dilate : les molécules s’alignent pour former une structure cristalline très « ouverte » qui est moins dense que l’eau liquide.
C’est pourquoi la glace flotte. Et c’est une bonne chose qu’elle le fasse ! Si l’eau se comportait comme la plupart des autres liquides, les lacs et les rivières gèleraient solidement et toute la vie qui s’y trouve mourrait.
Trois autres propriétés de l’eau
L’eau a une chaleur spécifique élevée. C’est-à-dire que, contrairement à l’air, l’eau peut absorber beaucoup de chaleur sans changer de température. C’est pourquoi la natation est si rafraîchissante par une journée chaude.
L’eau perd également sa chaleur plus lentement que l’air. Il en résulte qu’en été, l’eau des lacs et des océans est généralement la plus froide en début de saison et la plus chaude en fin de saison (après de nombreux jours d’absorption de l’énergie du soleil).
Le point d’ébullition de l’eau (212° F ou 100°C au niveau de la mer) est affecté par l’altitude. En général, plus l’altitude est élevée, plus le point d’ébullition de l’eau est bas. Par exemple, à Denver, CO (5 280 ft.), l’eau bout à 202,4° F. Sur le Mont Everest au Népal (29 012 ft.), l’eau bout à 156° F.
Projets scientifiques sur l’eau:
- Le cycle de l’eau
- Roue à eau
- Eau super refroidie
- Réservoir d’eau
.