Formation posologique : capsule
Médicament revu par Drugs.com. Dernière mise à jour le 1er octobre 2020.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Conseils
- Interactions
- Plus
Pour réduire le développement de bactéries résistantes aux médicaments.bactéries résistantes aux médicaments et maintenir l’efficacité de la nitrofurantoïne (macrocristaux) et des autres médicaments antibactériens, la nitrofurantoïne (macrocristaux) ne doit être utilisée que pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu’elles sont causées par des bactéries.
- DESCRIPTION:
- PHARMACOLOGIE CLINIQUE:
- MICROBIOLOGIE
- Mécanisme d’action
- Interactions avec d’autres antibiotiques
- Développement de la résistance
- INDICATIONS ET USAGE:
- CONTRAINDICATIONS:
- MISES EN GARDE:
- Réactions pulmonaires:
- Hépatotoxicité:
- Neuropathie:
- Anémie hémolytique:
- Diarrhée associée à Clostridium difficile:
- PRECAUTIONS:
- Information pour les patients:
- Généralités:
- Interactions médicamenteuses:
- Interactions médicament/test de laboratoire:
- Carcinogenèse, mutagenèse, altération de la fertilité :
- Grossesse:
- Grossesse de catégorie B.
- L’accouchement:
- Mères allaitantes:
- Utilisation pédiatrique:
- Utilisation gériatrique:
- REACTIONS INDÉSIRABLES:
- Respiratoires:
- Hépatique:
- Neurologique:
- Dermatologiques:
- Allergique:
- Gastro-intestinal:
- Hématologique:
- Divers:
- Effets indésirables de laboratoire :
- Surdosage
- DOSAGE ET ADMINISTRATION:
- Adultes:
- Enfants:
- COMMENT FOURNIR :
- Panneau d’affichage principal – 50 mg
- Panneau d’affichage principal – 100 mg
- Frequently asked questions
- Plus d’informations sur la nitrofurantoïne
- Ressources pour les consommateurs
- Ressources pour les professionnels
- Guides de traitement associés
DESCRIPTION:
La nitrofurantoïne, USP (macrocristaux) est un produit chimique synthétique de taille cristalline contrôlée. C’est un composé stable, jaune et cristallin. La nitrofurantoïne, USP (macrocristaux) est un agent antibactérien pour les infections spécifiques des voies urinaires. Il est disponible en gélules de 25 mg, 50 mg et 100 mg pour une administration orale.
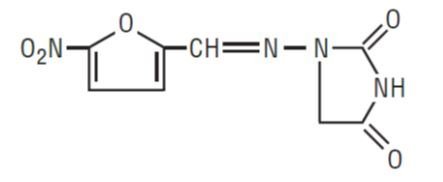
1-AMINO]-2, 4-IMIDAZOLIDINEDIONE
Ingrédients inactifs : Chaque capsule contient D&C jaune # 10, FD&C bleu # 1, FD&C bleu # 2, FD&C rouge # 40, gélatine, oxyde de fer noir, lactose anhydre, stéarate de magnésium, amidon de maïs prégélatinisé, lauryl sulfate de sodium, talc et dioxyde de titane. Les gélules de 50 mg et 100 mg contiennent également du jaune FD&C n° 6.
PHARMACOLOGIE CLINIQUE:
La nitrofurantoïne (macrocristaux) est une forme cristalline plus grande de nitrofurantoïne. L’absorption de la nitrofurantoïne (macrocristaux) est plus lente et son excrétion un peu moindre par rapport à la nitrofurantoïne. Les concentrations sanguines à la dose thérapeutique sont généralement faibles. Elle est très soluble dans l’urine, à laquelle elle peut conférer une couleur brune.
Après un schéma posologique de 100 mg quatre fois par jour pendant 7 jours, les récupérations urinaires moyennes du médicament (0 à 24 heures) au jour 1 et au jour 7 étaient de 37.9 % et 35,0 %.
Contrairement à de nombreux médicaments, la présence d’aliments ou d’agents retardant la vidange gastrique peut augmenter la biodisponibilité de la nitrofurantoïne (macrocristaux), vraisemblablement en permettant une meilleure dissolution dans les sucs gastriques.
MICROBIOLOGIE
La nitrofurantoïne est un agent antimicrobien nitrofurane ayant une activité contre certaines bactéries à Gram positif et à Gram négatif.
Mécanisme d’action
Le mécanisme de l’action antimicrobienne de la nitrofurantoïne est inhabituel parmi les antibactériens. La nitrofurantoïne est réduite par les flavoprotéines bactériennes en intermédiaires réactifs qui inactivent ou altèrent les protéines ribosomales bactériennes et d’autres acromolécules. Ces inactivations ont pour conséquence d’inhiber les processus biochimiques vitaux que sont la synthèse des protéines, le métabolisme énergétique aérobie, la synthèse de l’ADN, la synthèse de l’ARN et la synthèse de la paroi cellulaire. La nitrofurantoïne est bactéricide dans l’urine aux doses thérapeutiques. La nature large de ce mode d’action peut expliquer l’absence de résistance bactérienne acquise à la nitrofurantoïne, car les mutations multiples et simultanées nécessaires des macromolécules cibles seraient probablement létales pour les bactéries.
Interactions avec d’autres antibiotiques
Un antagonisme a été démontré in vitro entre la nitrofurantoïne et les antimicrobiens de type quinolone. La signification clinique de ce résultat est inconnue.
Développement de la résistance
Le développement de la résistance à la nitrofurantoïne n’a pas été un problème significatif depuis son introduction en 1953. La résistance croisée avec les antibiotiques et les sulfamides n’a pas été observée, et la résistance transférable est, tout au plus, un phénomène très rare.
La nitrofurantoïne s’est révélée active contre la plupart des souches des bactéries suivantes, à la fois in vitro et dans les infections cliniques (voir Indications et utilisation) :
Micro-organismes Gram positif aérobies et facultatifs :
Staphylococcus aureus
Entérocoques (par ex. Enterococcus faecalis)
Micro-organismes à Gram négatif aérobies et facultatifs :
Escherichia coli
NOTE : Bien que la nitrofurantoïne ait une excellente activité contre Enterococcus faecalis, la majorité des isolats d’Enterococcus faecium ne sont pas sensibles à la nitrofurantoïne.
Au moins 90 % des micro-organismes suivants présentent une concentration minimale inhibitrice (CMI) in vitro inférieure ou égale au seuil de sensibilité de la nitrofurantoïne. Cependant, l’efficacité de la nitrofurantoïne dans le traitement des infections cliniques dues à ces micro-organismes n’a pas été établie dans des essais adéquats et bien contrôlés.
Micro-organismes à Gram positif aérobies et facultatifs :
Staphylocoques à coagulase négative (y compris Staphylococcus
epidermidis et Staphylococcus saprophyticus)
Streptococcus agalactiae
Streptocoques du groupe D
Streptocoques du groupe Viridans
Micro-organismes aérobies et facultatifs à Gram-négatifs :
Citrobacter amalonaticus
Citrobacter diversus
Citrobacter freundii
Klebsiella oxytoca
Klebsiella ozaenae
NOTE : Certaines souches des espèces Enterobacter et Klebsiella sont résistantes à la nitrofurantoïne.
Essais de sensibilité :
Pour des informations spécifiques concernant les critères d’interprétation des tests de sensibilité et les méthodes d’essai associées ainsi que les normes de contrôle de qualité reconnues par la FDA pour ce médicament, veuillez consulter : https://www.fda.gov/STIC.
INDICATIONS ET USAGE:
Les capsules de nitrofurantoïne (macrocristaux) sont spécifiquement indiquées pour le traitement des infections urinaires lorsqu’elles sont dues à des souches sensibles d’Escherichia coli, d’entérocoques, de Staphylococcus aureus et de certaines souches sensibles d’espèces de Klebsiella et d’Enterobacter.
La nitrofurantoïne n’est pas indiquée pour le traitement de la pyélonéphrite ou des abcès périnéphriques.
Pour réduire le développement de bactéries résistantes aux médicaments et maintenir l’efficacité des capsules de nitrofurantoïne (macrocristaux) et des autres médicaments antibactériens, les capsules de nitrofurantoïne (macrocristaux) ne doivent être utilisées que pour traiter ou prévenir les infections dont il est prouvé ou fortement suspecté qu’elles sont causées par des bactéries sensibles. Lorsque des informations sur la culture et la sensibilité sont disponibles, elles doivent être prises en compte dans le choix ou la modification du traitement antibactérien. En l’absence de telles données, l’épidémiologie locale et les profils de sensibilité peuvent contribuer à la sélection empirique du traitement.
Les nitrofurantoïnes n’ont pas la distribution tissulaire plus large des autres agents thérapeutiques approuvés pour les infections urinaires. Par conséquent, de nombreux patients traités avec des capsules de nitrofurantoïne (macrocristaux) sont prédisposés à la persistance ou à la réapparition de la bactériurie. Des échantillons d’urine pour la culture et l’antibiogramme doivent être obtenus avant et après la fin du traitement. En cas de persistance ou de réapparition de la bactériurie après le traitement par les capsules de nitrofurantoïne (macrocristaux), il faut choisir d’autres agents thérapeutiques ayant une distribution tissulaire plus large. En envisageant l’utilisation de capsules de nitrofurantoïne (macrocristaux), les taux d’éradication plus faibles doivent être mis en balance avec le potentiel accru de toxicité systémique et de développement d’une résistance antimicrobienne lorsque des agents à distribution tissulaire plus large sont utilisés.
CONTRAINDICATIONS:
L’anurie, l’oligurie ou une altération significative de la fonction rénale (clairance de la créatinine inférieure à 60 ml par minute ou élévation cliniquement significative de la créatinine sérique) sont des contre-indications. Le traitement de ce type de patient comporte un risque accru de toxicité en raison de l’altération de l’excrétion du médicament. En raison de la possibilité d’anémie hémolytique due à l’immaturité des systèmes enzymatiques érythrocytaires (instabilité du glutathion), le médicament est contre-indiqué chez les patientes enceintes à terme (38 à 42 semaines de gestation), pendant le travail et l’accouchement ou lorsque le début du travail est imminent. Pour la même raison, le médicament est contre-indiqué chez les nouveau-nés de moins d’un mois.
Les capsules de nitrofurantoïne (macrocristaux) sont contre-indiquées chez les patients ayant des antécédents d’ictère cholestatique/dysfonctionnement hépatique associé à la nitrofurantoïne.
Les capsules de nitrofurantoïne (macrocristaux) sont également contre-indiquées chez les patients présentant une hypersensibilité connue à la nitrofurantoïne.
MISES EN GARDE:
Réactions pulmonaires:
Des réactions pulmonaires aiguës, subaiguës ou chroniques ont été observées chez des patients traités par la NITROFURANTOÏNE. SI CES RÉACTIONS SE PRODUISENT, IL FAUT CESSER L’ADMINISTRATION DE LA NITROFURANTOÏNE (MACROCRISTAUX) ET PRENDRE LES MESURES APPROPRIÉES. DES RAPPORTS ONT CITÉ LES RÉACTIONS PULMONAIRES COMME UNE CAUSE CONTRIBUTIVE DE DÉCÈS.
LES RÉACTIONS PULMONAIRES CHRONIQUES (PNEUMONIE INTERSTITIELLE DIFFUSE OU FIBROSE PULMONAIRE, OU LES DEUX) PEUVENT SE DÉVELOPPER INSIDIEUSEMENT. CES RÉACTIONS SURVIENNENT RAREMENT ET GÉNÉRALEMENT CHEZ LES PATIENTS RECEVANT UN TRAITEMENT PENDANT SIX MOIS OU PLUS. UNE SURVEILLANCE ÉTROITE DE L’ÉTAT PULMONAIRE DES PATIENTS RECEVANT UN TRAITEMENT À LONG TERME EST JUSTIFIÉE ET NÉCESSITE QUE LES BÉNÉFICES DU TRAITEMENT SOIENT MIS EN BALANCE AVEC LES RISQUES POTENTIELS (VOIR RÉACTIONS RESPIRATOIRES).
Hépatotoxicité:
Des réactions hépatiques, incluant hépatite, ictère cholestatique, hépatite chronique active et nécrose hépatique, se produisent rarement. Des cas de décès ont été rapportés. L’apparition d’une hépatite chronique active peut être insidieuse, et les patients doivent être surveillés périodiquement pour déceler des changements dans les tests biochimiques qui pourraient indiquer une lésion hépatique. En cas d’hépatite, le médicament doit être retiré immédiatement et des mesures appropriées doivent être prises.
Neuropathie:
Des cas de neuropathie périphérique, pouvant devenir sévère ou irréversible, ont été rapportés. Des cas de décès ont été rapportés. Des conditions telles qu’une insuffisance rénale (clairance de la créatinine inférieure à 60 ml par minute ou élévation cliniquement significative de la créatinine sérique), une anémie, un diabète sucré, un déséquilibre électrolytique, une carence en vitamine B et une maladie débilitante peuvent favoriser l’apparition d’une neuropathie périphérique. Les patients recevant un traitement à long terme doivent être surveillés périodiquement pour détecter des changements dans la fonction rénale.
Une névrite optique a été rapportée rarement dans l’expérience de post-commercialisation avec les formulations de nitrofurantoïne.
Anémie hémolytique:
Des cas d’anémie hémolytique de type primaquine-sensibilité ont été induits par la nitrofurantoïne. L’hémolyse semble être liée à un déficit en glucose-6-phosphate déshydrogénase dans les globules rouges des patients concernés. Ce déficit est retrouvé chez 10 % des Noirs et un faible pourcentage des groupes ethniques d’origine méditerranéenne et proche-orientale. L’hémolyse est une indication pour l’arrêt de la nitrofurantoïne (macrocristaux) ; l’hémolyse cesse lorsque le médicament est retiré.
Diarrhée associée à Clostridium difficile:
La diarrhée associée à Clostridium difficile (DACD) a été rapportée avec l’utilisation de presque tous les agents antibactériens, y compris la nitrofurantoïne, et peut varier en gravité de la diarrhée légère à la colite fatale. Le traitement par des agents antibactériens modifie la flore normale du côlon, ce qui entraîne une prolifération de C. difficile.
C. difficile produit des toxines A et B qui contribuent au développement de la DACD. Les souches de C. difficile produisant des hypertoxines entraînent une morbidité et une mortalité accrues, car ces infections peuvent être réfractaires à la thérapie antimicrobienne et peuvent nécessiter une colectomie. La DACD doit être envisagée chez tous les patients qui présentent une diarrhée après avoir pris des antibiotiques. Une anamnèse minutieuse est nécessaire, car la DACD a été signalée comme pouvant survenir plus de deux mois après l’administration d’agents antibactériens. Si la DACD est suspectée ou confirmée, il peut être nécessaire d’interrompre la prise d’antibiotiques non dirigés contre C. difficile. Une gestion appropriée des liquides et des électrolytes, une supplémentation en protéines, un traitement antibiotique du C. difficile et une évaluation chirurgicale doivent être instaurés selon les indications cliniques.
PRECAUTIONS:
Information pour les patients:
Il faut conseiller aux patients de prendre la nitrofurantoïne (macrocristaux) avec de la nourriture afin d’augmenter encore la tolérance et d’améliorer l’absorption du médicament. On doit demander aux patients de suivre le traitement complet ; toutefois, on doit leur conseiller de communiquer avec leur médecin si des symptômes inhabituels surviennent pendant le traitement.
De nombreux patients qui ne peuvent tolérer la nitrofurantoïne microcristalline peuvent prendre la nitrofurantoïne (macrocristaux) sans nausée.
Il convient de conseiller aux patients de ne pas utiliser de préparations antiacides contenant du trisilicate de magnésium lorsqu’ils prennent de la nitrofurantoïne (macrocristaux).
Il convient de conseiller aux patients que les médicaments antibactériens, y compris la nitrofurantoïne (macrocristaux), ne doivent être utilisés que pour traiter les infections bactériennes. Ils ne traitent pas les infections virales (par exemple, le rhume). Lorsque la nitrofurantoïne (macrocristaux) est prescrite pour traiter une infection bactérienne, il faut dire aux patients que, même s’il est courant de se sentir mieux au début du traitement, le médicament doit être pris exactement comme indiqué. Sauter des doses ou ne pas terminer le traitement complet peut (1) diminuer l’efficacité du traitement immédiat et (2) augmenter la probabilité que les bactéries développent une résistance et ne soient pas traitables par la nitrofurantoïne (macrocristaux) ou d’autres médicaments antibactériens à l’avenir.
La diarrhée est un problème courant causé par les antibiotiques qui se termine généralement lorsque l’antibiotique est arrêté. Parfois, après avoir commencé un traitement par antibiotiques, les patients peuvent avoir des selles liquides et sanglantes (avec ou sans crampes d’estomac et fièvre), même deux mois ou plus après avoir pris la dernière dose de l’antibiotique. Si cela se produit, les patients doivent contacter leur médecin dès que possible.
Généralités:
Prescrire la nitrofurantoïne (macrocristaux) en l’absence d’une infection bactérienne avérée ou fortement suspectée ou d’une indication prophylactique est peu susceptible d’apporter un bénéfice au patient et augmente le risque de développement de bactéries résistantes au médicament.
Interactions médicamenteuses:
Les antiacides contenant du trisilicate de magnésium, lorsqu’ils sont administrés de façon concomitante avec la nitrofurantoïne, réduisent à la fois la vitesse et l’étendue de l’absorption. Le mécanisme de cette interaction est probablement l’adsorption de la nitrofurantoïne sur la surface du trisilicate de magnésium.
Les médicaments uricosuriques, tels que le probénécide et la sulfinpyrazone, peuvent inhiber la sécrétion tubulaire rénale de la nitrofurantoïne. L’augmentation des taux sériques de nitrofurantoïne qui en résulte peut augmenter la toxicité, et la diminution des taux urinaires pourrait diminuer son efficacité en tant qu’antibactérien des voies urinaires.
Interactions médicament/test de laboratoire:
En raison de la présence de nitrofurantoïne, une réaction faussement positive pour le glucose dans l’urine peut se produire. Ceci a été observé avec les solutions de Benedict et de Fehling mais pas avec le test enzymatique du glucose.
Carcinogenèse, mutagenèse, altération de la fertilité :
La nitrofurantoïne n’était pas cancérigène lorsqu’elle était administrée à des rats Holtzman femelles pendant 44,5 semaines ou à des rats Sprague-Dawley femelles pendant 75 semaines. Deux essais biologiques chroniques sur des rongeurs utilisant des rats Sprague-Dawley mâles et femelles et deux essais biologiques chroniques sur des souris suisses et des souris BDF1 n’ont révélé aucun signe de cancérogénicité.
La nitrofurantoïne a présenté des signes d’activité cancérogène chez les souris B6C3F1 femelles, comme le montre l’augmentation de l’incidence des adénomes tubulaires, des tumeurs mixtes bénignes et des tumeurs des cellules de la granulosa de l’ovaire. Chez les rats mâles F344/N, on a observé une augmentation de l’incidence des néoplasmes tubulaires rénaux peu communs, des ostéosarcomes osseux et des néoplasmes du tissu sous-cutané. Dans une étude impliquant l’administration sous-cutanée de 75 mg/kg de nitrofurantoïne à des souris femelles gravides, des adénomes papillaires pulmonaires de signification inconnue ont été observés dans la génération F1.
Il a été démontré que la nitrofurantoïne induit des mutations ponctuelles dans certaines souches de Salmonella typhimurium et des mutations directes dans les cellules de lymphome de souris L5178Y. La nitrofurantoïne a induit un nombre accru d’échanges de chromatides soeurs et d’aberrations chromosomiques dans les cellules ovariennes de hamster chinois mais pas dans les cellules humaines en culture. Les résultats du test de létalité récessive liée au sexe chez la drosophile ont été négatifs après administration de nitrofurantoïne par voie alimentaire ou par injection. La nitrofurantoïne n’a pas induit de mutation héréditaire dans les modèles de rongeurs examinés.
La signification des résultats de la cancérogénicité et de la mutagénicité par rapport à l’utilisation thérapeutique de la nitrofurantoïne chez l’homme est inconnue.
L’administration de fortes doses de nitrofurantoïne à des rats provoque un arrêt temporaire de la spermatogénèse ; ceci est réversible à l’arrêt du médicament. Des doses de 10 mg/kg/jour ou plus chez des hommes en bonne santé peuvent, dans certains cas imprévisibles, produire un arrêt spermatogène léger à modéré avec une diminution du nombre de spermatozoïdes.
Grossesse:
Effets tératogènes:
Grossesse de catégorie B.
Plusieurs études de reproduction ont été réalisées chez le lapin et le rat à des doses allant jusqu’à six fois la dose humaine et n’ont révélé aucune preuve d’altération de la fertilité ou d’atteinte au fœtus due à la nitrofurantoïne. Dans une seule étude publiée, menée chez des souris à des doses 68 fois supérieures à la dose humaine (sur la base de mg/kg administrés à la mère), un retard de croissance et une faible incidence de malformations mineures et communes ont été observés. Cependant, à 25 fois la dose humaine, aucune malformation fœtale n’a été observée ; la pertinence de ces résultats pour l’homme est incertaine. Il n’existe cependant pas d’études adéquates et bien contrôlées chez la femme enceinte. Les études de reproduction chez l’animal n’étant pas toujours prédictives de la réponse chez l’homme, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
Effets non tératogènes :
La nitrofurantoïne a montré, dans une étude publiée de cancérogénicité transplacentaire, qu’elle induisait des adénomes papillaires pulmonaires chez les souris de la génération F1 à des doses 19 fois supérieures à la dose humaine sur une base mg/kg. La relation entre cette découverte et la cancérogenèse humaine potentielle est actuellement inconnue. En raison de l’incertitude concernant les implications humaines de ces données animales, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
L’accouchement:
Voir CONTRE-INDICATIONS.
Mères allaitantes:
La nitrofurantoïne a été détectée dans le lait maternel humain à l’état de traces. En raison du risque d’effets indésirables graves de la nitrofurantoïne chez les nourrissons de moins d’un mois qui sont allaités, il faut décider d’interrompre l’allaitement ou d’arrêter le médicament, en tenant compte de l’importance du médicament pour la mère (voir CONTRE-INDICATIONS).
Utilisation pédiatrique:
La nitrofurantoïne (macrocristaux) est contre-indiquée chez les nourrissons âgés de moins d’un mois (voir CONTRE-INDICATIONS).
Utilisation gériatrique:
Les études cliniques de la nitrofurantoïne (macrocristaux) n’ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondent différemment des sujets plus jeunes. D’autres expériences cliniques rapportées n’ont pas identifié de différences de réponses entre les personnes âgées et les patients plus jeunes. Les rapports spontanés suggèrent une proportion plus élevée de réactions pulmonaires, y compris des décès, chez les patients âgés ; ces différences semblent être liées à la proportion plus élevée de patients âgés recevant un traitement à long terme par la nitrofurantoïne. Comme chez les patients plus jeunes, les réactions pulmonaires chroniques sont généralement observées chez les patients recevant le traitement pendant six mois ou plus (voir MISES EN GARDE). Des rapports spontanés suggèrent également une proportion accrue de réactions hépatiques sévères, y compris des décès, chez les patients âgés (voir MISES EN GARDE).
En général, la fréquence plus élevée d’une diminution de la fonction hépatique, rénale ou cardiaque, et d’une maladie concomitante ou d’un autre traitement médicamenteux doit être prise en considération lors de la prescription de la nitrofurantoïne (macrocristaux). On sait que ce médicament est excrété en grande partie par le rein, et le risque de réactions toxiques à ce médicament peut être plus élevé chez les patients dont la fonction rénale est altérée. L’anurie, l’oligurie ou une altération importante de la fonction rénale (clairance de la créatinine inférieure à 60 mL par minute ou élévation cliniquement significative de la créatinine sérique) sont des contre-indications (voir CONTRE-INDICATIONS). Comme les patients âgés sont plus susceptibles de présenter une diminution de la fonction rénale, il faut faire preuve de prudence dans le choix de la dose et il peut être utile de surveiller la fonction rénale.
REACTIONS INDÉSIRABLES:
Respiratoires:
Des réactions d’HYPERSENSIBILITÉ PULMONAIRE CHRONIQUE, SUBACTIVE OU AIGUE PEUVENT SURVENIR.
Des réactions d’HYPERSENSIBILITÉ PULMONAIRE CHRONIQUE surviennent généralement chez les patients qui ont reçu un traitement continu pendant six mois ou plus. MALAISE, DYSPNÉE À L’EFFORT, TOUX ET ALTÉRATION DE LA FONCTION PULMONAIRE SONT DES MANIFESTATIONS COURANTES QUI PEUVENT SURVENIR DE FAÇON INSIDIEUSE. LES CONSTATATIONS RADIOLOGIQUES ET HISTOLOGIQUES D’UNE PNEUMONIE INTERSTITIELLE DIFFUSE OU D’UNE FIBROSE, OU DES DEUX, SONT ÉGALEMENT DES MANIFESTATIONS COURANTES DE LA RÉACTION PULMONAIRE CHRONIQUE. LA FIÈVRE EST RAREMENT PROÉMINENTE.
LA SÉVÉRITÉ DES RÉACTIONS PULMONAIRES CHRONIQUES ET LEUR DEGRÉ DE RÉSOLUTION SEMBLENT ÊTRE LIÉS À LA DURÉE DU TRAITEMENT APRÈS L’APPARITION DES PREMIERS SIGNES CLINIQUES. LA FONCTION PULMONAIRE PEUT ÊTRE ALTÉRÉE DE FAÇON PERMANENTE, MÊME APRÈS L’ARRÊT DU TRAITEMENT. LE RISQUE EST D’AUTANT PLUS ÉLEVÉ QUE LES RÉACTIONS PULMONAIRES CHRONIQUES NE SONT PAS RECONNUES RAPIDEMENT.
Dans les réactions pulmonaires subaiguës, la fièvre et l’éosinophilie sont moins fréquentes que dans la forme aiguë. A l’arrêt du traitement, la récupération peut nécessiter plusieurs mois. Si les symptômes ne sont pas reconnus comme étant liés au médicament et que le traitement par nitrofurantoïne n’est pas arrêté, les symptômes peuvent s’aggraver.
Les réactions pulmonaires aiguës se manifestent généralement par une fièvre, des frissons, une toux, une douleur thoracique, une dyspnée, une infiltration pulmonaire avec consolidation ou un épanchement pleural à la radiographie, et une éosinophilie. Les réactions aiguës surviennent habituellement au cours de la première semaine de traitement et sont réversibles à l’arrêt du traitement. La résolution est souvent spectaculaire (voir MISES EN GARDE).
Changements de l’ECG (par ex, modifications non spécifiques de l’onde ST/T, bloc de branche) ont été rapportées en association avec des réactions pulmonaires.
Cyanose a été rapportée rarement.
Hépatique:
Des réactions hépatiques, y compris une hépatite, un ictère cholestatique, une hépatite chronique active et une nécrose hépatique, se produisent rarement (voir rubrique MISES EN GARDE).
Neurologique:
Une neuropathie périphérique, qui peut devenir sévère ou irréversible, est survenue. Des cas de décès ont été rapportés. Des conditions telles qu’une insuffisance rénale (clairance de la créatinine inférieure à 60 ml par minute ou élévation cliniquement significative de la créatinine sérique), une anémie, un diabète sucré, un déséquilibre électrolytique, une carence en vitamine B et des maladies débilitantes peuvent augmenter la possibilité de neuropathie périphérique (voir MISES EN GARDE).
Des cas d’asthénie, de vertiges, de nystagmus, d’étourdissements, de céphalées et de somnolence ont également été signalés lors de l’utilisation de la nitrofurantoïne.
Des cas d’hypertension intracrânienne bénigne (pseudo-tumeur cérébrale), de confusion, de dépression, de névrite optique et de réactions psychotiques ont été signalés dans de rares cas. Des fontanelles bombées, comme signe d’une hypertension intracrânienne bénigne chez les nourrissons, ont été rapportées rarement.
Dermatologiques:
Des dermatites exfoliatives et des érythèmes polymorphes (y compris le syndrome de Stevens-Johnson) ont été rapportés rarement. Une alopécie transitoire a également été rapportée.
Allergique:
Un syndrome de type lupus associé à des réactions pulmonaires à la nitrofurantoïne a été rapporté. De même, des cas d’angioedème, d’éruptions maculopapuleuses, érythémateuses ou eczémateuses, de prurit, d’urticaire, d’anaphylaxie, d’arthralgie, de myalgie, de fièvre médicamenteuse, de frissons et de vascularite (parfois associée à des réactions pulmonaires) ont été rapportés. Les réactions d’hypersensibilité représentent les effets indésirables signalés spontanément les plus fréquents dans l’expérience mondiale de post-commercialisation des formulations de nitrofurantoïne.
Gastro-intestinal:
Les nausées, les vomissements et l’anorexie sont les plus fréquents. Les douleurs abdominales et la diarrhée sont des réactions gastro-intestinales moins fréquentes. Ces réactions liées à la dose peuvent être minimisées par une réduction de la dose. Des cas de sialadénite et de pancréatite ont été signalés. Des cas sporadiques de colite pseudo-membraneuse ont été signalés lors de l’utilisation de la nitrofurantoïne. L’apparition des symptômes de colite pseudo-membraneuse peut survenir pendant ou après un traitement antimicrobien (voir MISES EN GARDE).
Hématologique:
Un cyanose secondaire à une méthémoglobinémie a été rarement rapporté.
Divers:
Comme avec d’autres agents antimicrobiens, les surinfections causées par des organismes résistants, par ex, Pseudomonas species ou Candida species, peuvent se produire.
Effets indésirables de laboratoire :
Les effets indésirables de laboratoire suivants ont été rapportés lors de l’utilisation de la nitrofurantoïne : augmentation de l’AST (SGOT), augmentation de l’ALT (SGPT), diminution de l’hémoglobine, augmentation du phosphore sérique, éosinophilie, anémie par déficit en glucose-6-phosphate déshydrogénase (voir MISES EN GARDE), agranulocytose, leucopénie, granulocytopénie, anémie hémolytique, thrombocytopénie, anémie mégaloblastique. Dans la plupart des cas, ces anomalies hématologiques se sont résolues après l’arrêt du traitement. Une anémie aplasique a été rarement rapportée.
Surdosage
Des incidents occasionnels de surdosage aigu de nitrofurantoïne (macrocristaux) n’ont pas entraîné de symptômes spécifiques autres que des vomissements. L’induction de vomissements est recommandée. Il n’y a pas d’antidote spécifique, mais un apport liquidien élevé doit être maintenu pour favoriser l’excrétion urinaire du médicament. Il est dialysable.
DOSAGE ET ADMINISTRATION:
Les capsules de nitrofurantoïne (macrocristaux) doivent être administrées avec de la nourriture pour améliorer l’absorption du médicament et, chez certains patients, la tolérance.
Adultes:
50 mg à 100 mg quatre fois par jour — le niveau posologique le plus faible est recommandé pour les infections urinaires non compliquées.
Enfants:
5 à 7 mg/kg de poids corporel par 24 heures, administrés en quatre doses fractionnées (contre-indiqué en dessous d’un mois).
Le traitement doit être poursuivi pendant une semaine ou pendant au moins 3 jours après l’obtention de la stérilité de l’urine. Une infection continue indique la nécessité d’une réévaluation.
Pour un traitement suppressif à long terme chez les adultes, une réduction de la posologie à 50-100 mg au coucher peut être adéquate. Pour un traitement suppressif à long terme chez les patients pédiatriques, des doses aussi faibles que 1 mg/kg par 24 heures, administrées en une seule dose ou en deux doses fractionnées, peuvent être adéquates. VOIR LA SECTION MISES EN GARDE CONCERNANT LES RISQUES ASSOCIÉS À UNE THÉRAPIE À LONG TERME.
COMMENT FOURNIR :
Les capsules de nitrofurantoïne USP (macrocristaux) sont disponibles comme suit :
Corps blanc opaque de 50 mg et bouchon jaune opaque imprimé à l’encre noire avec « WATSON » sur le bouchon et « 5780 » sur le corps.
NDC 0115-2023-10 flacons de 100
100 mg opaque, capsule jaune imprimée à l’encre noire avec « WATSON » sur la capsule et « 5781 » sur le corps.
NDC 0115-2024-10 flacons de 100
Réserver entre 20° et 25°C (68° et 77°F) .
Fabriqué par:
Watson Pharma Private Limited
Verna, Salcette Goa 403722 INDIA
Distribué par :
Amneal Pharmaceuticals LLC
Bridgewater, NJ 08807
Pour signaler des EFFETS INDÉSIRABLES SUSPECTÉS, contactez Amneal Pharmaceuticals au 1-877-835-5472 ou la FDA au 1-800-FDA-1088 ou www.fda.gov/medwatch.
Rev. 11-2019-00
Panneau d’affichage principal – 50 mg

Panneau d’affichage principal – 100 mg

| NITROFURANTOÏNE nitrofurantoïne gélule |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
| NITROFURANTOIN nitrofurantoïne gélule |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
Étiqueteur – Amneal Pharmaceuticals of New York LLC (123797875)
Frequently asked questions
- Quels antibiotiques sont utilisés pour traiter l’infection urinaire ?
- Qu’est-ce que la nitrofurantoïne à « double libération » ?
Plus d’informations sur la nitrofurantoïne
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Informations sur la posologie
- Conseils aux patients
- Médicament. Images
- Interactions médicamenteuses
- Comparer les alternatives
- Groupe de soutien
- Prix & Coupons
- En Español
- 1538 Critiques
- Classe de médicaments : anti-infectieux urinairesinfectieux urinaires
Ressources pour les consommateurs
- Information pour les patients
- Nitrofurantoïne (Lecture avancée)
Ressources pour les professionnels
- Information pour les prescripteurs
- . Information
- Nitrofurantoïne (Conseils professionnels aux patients)
- Nitrofurantoïne gélules (FDA)
- Nitrofurantoïne suspension orale (FDA)
Autres marques Macrobid, Macrodantin, Furadantin
Guides de traitement associés
- Infection des voies urinaires
- Prévention de l’infection de la vessie
- Infection de la vessie
Avis médical
.