Dénomination générique : chlorhydrate de lidocaïne
Formation posologique : solution orale
Rx only
Asthésique topique pour les muqueuses de la bouche et du pharynx.
Des cas de convulsions, d’arrêt cardio-pulmonaire et de décès chez des patients âgés de moins de 3 ans ont été rapportés après commercialisation lors de l’utilisation de la Lidocaïne Visqueuse 2% lorsqu’elle n’a pas été administrée en respectant strictement les recommandations de dosage et d’administration. En cas de poussée dentaire, la lidocaïne visqueuse à 2% ne doit généralement pas être utilisée. Pour les autres affections, l’utilisation du produit chez les patients âgés de moins de 3 ans doit être limitée aux situations où des alternatives plus sûres ne sont pas disponibles ou ont été essayées mais ont échoué.
Pour diminuer le risque d’effets indésirables graves lors de l’utilisation de Lidocaïne Viscous 2%, demander aux soignants de respecter strictement la dose et la fréquence d’administration prescrites et de conserver le flacon d’ordonnance en toute sécurité, hors de portée des enfants.
- DESCRIPTION
- Solution orale topique de lidocaïne – Pharmacologie clinique
- Mécanisme d’action
- Hémodynamique
- Pharmacocinétique et métabolisme
- Indications et utilisation de la lidocaïne solution orale topique
- Contre-indications
- Avertissements
- Mise en danger de la vie et événements fatals chez les nourrissons et les jeunes enfants
- Méthémoglobinémie
- Précautions
- Information pour les patients
- Généralités
- Interactions médicamenteuses
- Carcinogenèse, mutagenèse, altération de la fertilité
- Grossesse
- Mères allaitantes
- Utilisation pédiatrique
- Réactions indésirables
- Système nerveux central
- Surdosage
- Gestion des urgences liées aux anesthésiques locaux
- DOSAGE ET ADMINISTRATION
- Adulte
- Pédiatrie
- COMMENT FOURNI
- Panneau de présentation de l’emballage/étiquette
- Panneau de présentation de l’emballage/étiquette
DESCRIPTION
Lidocaïne Viscous 2% (solution orale topique de chlorhydrate de lidocaïne USP) contient un agent anesthésique local et est administré par voie topique. Lidocaïne Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) contient du chlorhydrate de lidocaïne, qui est chimiquement désigné comme acétamide, 2-(diéthylamino)-N-(2,6-diméthylphényl)-,monochlorhydrate, et a la formule structurelle suivante :
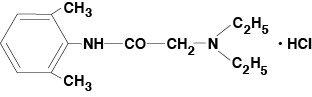
La formule moléculaire de la lidocaïne est C14H22N2O. Le poids moléculaire est de 234,34.
Composition de la solution :
Chaque mL contient 20 mg (2 %) de chlorhydrate de lidocaïne USP et les ingrédients inactifs suivants : carboxyméthylcellulose sodique, arôme, méthylparabène, propylparabène, eau purifiée et saccharine sodique.
Solution orale topique de lidocaïne – Pharmacologie clinique
Mécanisme d’action
La lidocaïne stabilise la membrane neuronale en inhibant les flux ioniques nécessaires à l’initiation et à la conduction des impulsions, effectuant ainsi une action anesthésique locale.
Hémodynamique
Des taux sanguins excessifs peuvent entraîner des modifications du débit cardiaque, de la résistance périphérique totale et de la pression artérielle moyenne. Ces modifications peuvent être attribuables à un effet dépresseur direct de l’agent anesthésique local sur divers composants du système cardiovasculaire. L’effet net est normalement une hypotension modeste lorsque les doses recommandées ne sont pas dépassées.
Pharmacocinétique et métabolisme
La lidocaïne est absorbée après administration topique sur les muqueuses, son taux et son étendue d’absorption dépendant de la concentration et de la dose totale administrée, du site spécifique d’application et de la durée d’exposition. En général, le taux d’absorption des agents anesthésiques locaux après une application topique est plus rapide après une administration intratrachéale. La lidocaïne est également bien absorbée à partir du tractus gastro-intestinal, mais peu de médicament intact apparaît dans la circulation en raison de sa biotransformation dans le foie. La liaison de la lidocaïne au plasma dépend de la concentration du médicament, et la fraction liée diminue avec l’augmentation de la concentration. À des concentrations de 1 à 4 mcg de base libre par mL, 60 à 80 pour cent de la lidocaïne se lie aux protéines. La liaison dépend également de la concentration plasmatique de l’alpha-1-glycoprotéine acide.
La lidocaïne traverse les barrières hémato-encéphalique et placentaire, vraisemblablement par diffusion passive.
La lidocaïne est rapidement métabolisée par le foie, et les métabolites et le médicament inchangé sont excrétés par les reins. La biotransformation comprend la N-déalkylation oxydative, l’hydroxylation du cycle, le clivage de la liaison amide et la conjugaison. La N-désalkylation, une voie majeure de biotransformation, donne les métabolites monoéthylglycinexylidide et glycinexylidide. Les actions pharmacologiques/toxicologiques de ces métabolites sont similaires, mais moins puissantes, que celles de la lidocaïne. Environ 90 % de la lidocaïne administrée est excrétée sous forme de divers métabolites, et moins de 10 % est excrétée sous forme inchangée. Le principal métabolite dans l’urine est un conjugué de la 4-hydroxy-2, 6-diméthylaniline.
La demi-vie d’élimination de la lidocaïne après une injection intraveineuse en bolus est généralement de 1,5 à 2 heures. En raison de la vitesse rapide à laquelle la lidocaïne est métabolisée, toute affection qui affecte la fonction hépatique peut modifier la cinétique de la lidocaïne. La demi-vie peut être multipliée par deux ou plus chez les patients présentant un dysfonctionnement hépatique. Le dysfonctionnement rénal n’affecte pas la cinétique de la lidocaïne mais peut augmenter l’accumulation des métabolites.
Des facteurs tels que l’acidose et l’utilisation de stimulants et de dépresseurs du SNC affectent les niveaux de lidocaïne dans le SNC nécessaires pour produire des effets systémiques manifestes. Les manifestations indésirables objectives deviennent de plus en plus apparentes avec l’augmentation des taux plasmatiques veineux au-dessus de 6 mcg de base libre par mL. Chez le singe rhésus, il a été démontré que des taux sanguins artériels de 18 à 21 mcg/mL sont le seuil de l’activité convulsive.
Indications et utilisation de la lidocaïne solution orale topique
La lidocaïne est indiquée pour la production d’une anesthésie topique des muqueuses irritées ou enflammées de la bouche et du pharynx. Elle est également utile pour réduire les bâillements lors de la prise de clichés radiographiques et d’empreintes dentaires.
Contre-indications
La lidocaïne est contre-indiquée chez les patients ayant des antécédents connus d’hypersensibilité aux anesthésiques locaux de type amide, ou aux autres composants de la solution.
Avertissements
Une dose excessive, ou des intervalles courts entre les doses, peuvent entraîner des niveaux plasmatiques élevés et des effets indésirables graves. LES PATIENTS DOIVENT ÊTRE INFORMÉS QU’ILS DOIVENT RESPECTER STRICTEMENT LA POSOLOGIE RECOMMANDÉE ET LES DIRECTIVES D’ADMINISTRATION TELLES QU’ELLES SONT ÉNONCÉES DANS CETTE NOTICE. LA PRISE EN CHARGE DES EFFETS INDÉSIRABLES GRAVES PEUT EXIGER L’UTILISATION D’ÉQUIPEMENT RESUSCITATIF, D’OXYGÈNE ET D’AUTRES MÉDICAMENTS RESUSCITATIFS.
La lidocaïne doit être utilisée avec une extrême prudence si la muqueuse de la zone d’application a été traumatisée, car dans de telles conditions, il existe un risque d’absorption systémique rapide.
Mise en danger de la vie et événements fatals chez les nourrissons et les jeunes enfants
Des cas de convulsions, d’arrêt cardio-pulmonaire et de décès chez des patients âgés de moins de 3 ans ont été rapportés après commercialisation lors de l’utilisation de Lidocaïne Visqueuse 2% lorsqu’elle n’a pas été administrée en respectant strictement les recommandations de dosage et d’administration. En cas de poussée dentaire, la lidocaïne visqueuse à 2% ne doit généralement pas être utilisée. Pour les autres affections, l’utilisation du produit chez les patients âgés de moins de 3 ans doit être limitée aux situations où des alternatives plus sûres ne sont pas disponibles ou ont été essayées mais ont échoué.
Méthémoglobinémie
Des cas de méthémoglobinémie ont été rapportés en association avec l’utilisation d’anesthésiques locaux. Bien que tous les patients soient à risque de méthémoglobinémie, les patients présentant un déficit en glucose-6-phosphate déshydrogénase, une méthémoglobinémie congénitale ou idiopathique, un compromis cardiaque ou pulmonaire, les nourrissons de moins de 6 mois et une exposition simultanée à des agents oxydants ou à leurs métabolites sont plus susceptibles de développer des manifestations cliniques de cette affection. Si des anesthésiques locaux doivent être utilisés chez ces patients, une surveillance étroite des symptômes et des signes de méthémoglobinémie est recommandée.
Les signes de méthémoglobinémie peuvent survenir immédiatement ou être retardés de quelques heures après l’exposition et se caractérisent par une coloration cyanotique de la peau et/ou une coloration anormale du sang. Les taux de méthémoglobine peuvent continuer à augmenter ; par conséquent, un traitement immédiat est nécessaire pour éviter des effets indésirables plus graves sur le système nerveux central et le système cardiovasculaire, notamment des convulsions, un coma, des arythmies et la mort. Arrêter l’administration de Lidocaine Viscous 2% et de tout autre agent oxydant. Selon la gravité des signes et des symptômes, les patients peuvent répondre aux soins de soutien, c’est-à-dire à l’oxygénothérapie et à l’hydratation. Une présentation clinique plus sévère peut nécessiter un traitement par bleu de méthylène, une transfusion d’échange ou de l’oxygène hyperbare.
Précautions
Information pour les patients
Les parents et les soignants doivent être mis en garde contre les points suivants :
– Pour les patients de moins de 3 ans, une attention particulière doit être accordée à la mesure précise de la dose prescrite et à ne pas administrer le produit plus souvent que prescrit. – Pour garantir la précision, nous vous recommandons d’utiliser un dispositif de mesure pour mesurer soigneusement le volume correct. – Le produit ne doit être utilisé que pour l’indication prescrite. – Pour réduire le risque d’ingestion accidentelle, le récipient du produit doit être hermétiquement fermé et le produit doit être conservé hors de portée de tous les enfants immédiatement après chaque utilisation. – Si le patient présente des signes de toxicité systémique (par exemple, léthargie, respiration superficielle, crises d’épilepsie), il convient de consulter immédiatement un médecin d’urgence et de ne pas administrer d’autres produits. – Le produit non utilisé doit être jeté de manière à éviter toute exposition possible aux enfants et aux animaux domestiques.
Tous les patients doivent savoir que lorsque des anesthésiques topiques sont utilisés dans la bouche ou la gorge, la production de l’anesthésie topique peut entraver la déglutition et ainsi augmenter le danger d’aspiration. Pour cette raison, il ne faut pas ingérer d’aliments pendant les 60 minutes qui suivent l’utilisation de préparations anesthésiques locales dans la bouche ou la gorge. Ceci est particulièrement important chez les enfants en raison de leur fréquence d’alimentation.
L’engourdissement de la langue ou de la muqueuse buccale peut augmenter le danger de traumatisme par morsure. Pour cette raison, la nourriture et/ou le chewing-gum ne doivent pas être utilisés lorsque la région de la bouche ou de la gorge est anesthésiée.
Informez les patients que l’utilisation d’anesthésiques locaux peut provoquer une méthémoglobinémie, un état grave qui doit être traité rapidement. Conseillez aux patients ou aux soignants de consulter immédiatement un médecin si eux-mêmes ou une personne dont ils s’occupent présentent les signes ou les symptômes suivants : peau pâle, grise ou bleue (cyanose), maux de tête, accélération du rythme cardiaque, essoufflement, étourdissement ou fatigue.
Généralités
La sécurité et l’efficacité de la lidocaïne dépendent d’une dose appropriée, d’une technique correcte, de précautions adéquates et de la préparation aux urgences (voir MISES EN GARDE et EFFETS INDÉSIRABLES). La dose la plus faible permettant d’obtenir une anesthésie efficace doit être utilisée pour éviter des taux plasmatiques élevés et des effets indésirables graves. L’administration de doses répétées de lidocaïne peut entraîner une augmentation significative des concentrations sanguines à chaque dose répétée en raison de l’accumulation lente du médicament et/ou de ses métabolites. La tolérance varie en fonction de l’état du patient. Les patients affaiblis, les personnes âgées, les patients souffrant de maladies aiguës et les enfants doivent recevoir des doses réduites en fonction de leur âge, de leur poids et de leur condition physique. La lidocaïne doit également être utilisée avec prudence chez les patients présentant un choc sévère ou un bloc cardiaque.
La lidocaïne doit être utilisée avec prudence chez les personnes présentant des sensibilités médicamenteuses connues. Les patients allergiques aux dérivés de l’acide paraaminobenzoïque (procaïne, tétracaïne, benzocaïne, etc.) n’ont pas présenté de sensibilité croisée à la lidocaïne.
Interactions médicamenteuses
Les patients auxquels on administre des anesthésiques locaux ont un risque accru de développer une méthémoglobinémie lorsqu’ils sont exposés simultanément aux médicaments suivants, qui pourraient inclure d’autres anesthésiques locaux :
Exemples de médicaments associés à la méthémoglobinémie :
|
Classe |
Exemples |
|
Nitrates/Nitrites |
nitroglycérine, nitroprussiate, oxyde nitrique, oxyde nitreux |
|
Anesthésiques locaux |
benzocaïne, lidocaïne, bupivacaïne, mépivacaïne, tétracaïne, prilocaïne, procaïne, articaïne, ropivacaïne |
|
Agents antinéoplasiques |
cyclophosphamide, flutamide, rasburicase, ifosfamide, hydroxyurée |
|
Antibiotiques |
dapsone, sulfamides, nitrofurantoïne, acide para-aminosalicylique |
|
Antimalariques |
chloroquine, primaquine |
|
Anticonvulsivants |
phénytoïne, valproate de sodium, phénobarbital |
|
Autres médicaments |
acétaminophène, métoclopramide, sulfasalazine, quinine |
Carcinogenèse, mutagenèse, altération de la fertilité
Des études de la lidocaïne chez l’animal pour évaluer le potentiel cancérigène et mutagène ou l’effet sur la fertilité n’ont pas été réalisées.
Grossesse
Effets tératogènes
Grossesse Catégorie B : Des études de reproduction ont été réalisées chez le rat à des doses allant jusqu’à 6,6 fois la dose humaine et n’ont révélé aucune preuve d’effet nocif pour le ftus causé par la lidocaïne. Cependant, il n’existe pas d’études adéquates et bien contrôlées chez les femmes enceintes. Les études de reproduction chez l’animal n’étant pas toujours prédictives de la réponse humaine, ce médicament ne doit être utilisé pendant la grossesse que si cela est clairement nécessaire.
Mères allaitantes
On ne sait pas si ce médicament est excrété dans le lait maternel. Comme de nombreux médicaments sont excrétés dans le lait maternel, il faut faire preuve de prudence lorsque la lidocaïne est administrée à des femmes qui allaitent.
Utilisation pédiatrique
La posologie chez les enfants doit être réduite, en fonction de l’âge, du poids corporel et des conditions physiques. Voir POSOLOGIE ET ADMINISTRATION.
Réactions indésirables
Les expériences indésirables suivant l’administration de lidocaïne sont de nature similaire à celles observées avec d’autres agents anesthésiques locaux de type amide. Ces effets indésirables sont, en général, liés à la dose et peuvent résulter de taux plasmatiques élevés causés par une dose excessive ou une absorption rapide, ou peuvent résulter d’une hypersensibilité, d’une idiosyncrasie ou d’une tolérance diminuée de la part du patient. Les effets indésirables graves sont généralement de nature systémique. Les types suivants sont ceux qui sont le plus fréquemment rapportés :
Système nerveux central
Les manifestations du SNC sont excitatrices et/ou dépressives et peuvent être caractérisées par des étourdissements, de la nervosité, de l’appréhension, de l’euphorie, de la confusion, des vertiges, de la somnolence, des acouphènes, une vision floue ou double, des vomissements, des sensations de chaleur, de froid ou d’engourdissement, des secousses, des tremblements, des convulsions, une perte de conscience, une dépression et un arrêt respiratoire. Les manifestations excitatrices peuvent être très brèves ou ne pas se produire du tout, auquel cas la première manifestation de la toxicité peut être une somnolence qui se transforme en perte de conscience et en arrêt respiratoire.
La somnolence après l’administration de lidocaïne est généralement un signe précoce d’un taux sanguin élevé du médicament et peut survenir en conséquence d’une absorption rapide.
Système cardiovasculaire
Les manifestations cardiovasculaires sont généralement dépressives et se caractérisent par une bradycardie, une hypotension et un collapsus cardiovasculaire, pouvant conduire à un arrêt cardiaque.
Allergies
Les réactions allergiques se caractérisent par des lésions cutanées, une urticaire, un oedème ou des réactions anaphylactoïdes. Les réactions allergiques peuvent survenir à la suite d’une sensibilité soit à l’agent anesthésique local, soit au méthylparabène et/ou au propylparabène utilisés dans cette formulation. Les réactions allergiques résultant d’une sensibilité à la lidocaïne sont extrêmement rares et, si elles se produisent, elles doivent être traitées par des moyens conventionnels. La détection de la sensibilité par des tests cutanés a une valeur douteuse.
Surdosage
Les urgences aiguës dues aux anesthésiques locaux sont généralement liées aux taux plasmatiques élevés rencontrés lors de l’utilisation thérapeutique des anesthésiques locaux. (Voir RÉACTIONS INDÉSIRABLES, MISES EN GARDE et PRÉCAUTIONS)
Gestion des urgences liées aux anesthésiques locaux
La première considération est la prévention, le meilleur moyen d’y parvenir étant de surveiller attentivement et constamment les signes vitaux cardiovasculaires et respiratoires et l’état de conscience du patient après chaque administration d’anesthésique local.
La première étape de la gestion des convulsions consiste à accorder une attention immédiate au maintien d’une voie aérienne perméable et à la ventilation assistée ou contrôlée avec de l’oxygène. Dans les situations où du personnel formé est facilement disponible, la ventilation doit être maintenue et l’oxygène doit être délivré par un système d’administration capable de permettre une pression positive immédiate des voies aériennes par masque. Immédiatement après la mise en place de ces mesures ventilatoires, il faut évaluer l’adéquation de la circulation, en gardant à l’esprit que les médicaments utilisés pour traiter les convulsions dépriment parfois la circulation lorsqu’ils sont administrés par voie intraveineuse. Si les convulsions persistent malgré une assistance respiratoire adéquate, et si l’état de la circulation le permet, de petites doses d’un barbiturique à action ultra-courte (comme le thiopental ou le thiamylal) ou d’une benzodiazépine (comme le diazépam) peuvent être administrées par voie intraveineuse. Le clinicien doit connaître ces anticonvulsivants avant d’utiliser les anesthésiques locaux. Le traitement de soutien de la dépression circulatoire peut nécessiter l’administration de liquides intraveineux et, le cas échéant, d’un vasopresseur comme indiqué par la situation clinique (par exemple, éphédrine).
Si elles ne sont pas traitées immédiatement, les convulsions comme la dépression cardiovasculaire peuvent entraîner une hypoxie, une acidose, une bradycardie, des arythmies et un arrêt cardiaque. Si un arrêt cardiaque devait se produire, des mesures de réanimation cardio-pulmonaire standard devraient être instituées.
La dialyse a une valeur négligeable dans le traitement du surdosage aigu de lidocaïne.
La DL50 orale de la lidocaïne chez les rats femelles non nourris est de 459 (346 à 773) mg/kg (sous forme de sel) et de 214 (159 à 324) mg/kg (sous forme de sel) chez les rats femelles à jeun.
DOSAGE ET ADMINISTRATION
Adulte
La dose unique maximale recommandée de lidocaïne pour les adultes en bonne santé doit être telle que la dose de lidocaïne ne dépasse pas 4.5 mg/kg ou 2 mg/lb de poids corporel et ne dépasse en aucun cas un total de 300 mg.
Pour le traitement symptomatique des muqueuses irritées ou enflammées de la bouche et du pharynx, la dose habituelle pour un adulte est de 15 mL non diluée. Pour une utilisation dans la bouche, la solution doit être agitée dans la bouche et recrachée. Pour l’utilisation dans le pharynx, la solution non diluée doit être gargarisée et peut être avalée. Cette dose ne doit pas être administrée à moins de trois heures d’intervalle, et il ne faut pas administrer plus de huit doses par période de 24 heures. La posologie doit être ajustée en fonction de l’âge, du poids et de la condition physique du patient (voir PRÉCAUTIONS).
Pédiatrie
Il faut veiller à ce que la posologie soit correcte chez tous les patients pédiatriques car il y a eu des cas de surdosage dus à une posologie inappropriée.
Il est difficile de recommander une dose maximale de tout médicament pour les enfants car celle-ci varie en fonction de l’âge et du poids. Pour les enfants de plus de 3 ans qui ont une masse maigre normale et un développement corporel normal, la dose maximale est déterminée par le poids ou l’âge de l’enfant. Par exemple : chez un enfant de 5 ans pesant 50 livres, la dose de lidocaïne ne doit pas dépasser 75 à 100 mg (3,7 à 5 ml de lidocaïne).
Pour les nourrissons et chez les enfants de moins de 3 ans, la solution doit être mesurée avec précision et ne pas appliquer plus de 1,2 ml sur la zone immédiate avec un applicateur à bouts de coton. Attendre au moins 3 heures avant d’administrer la dose suivante ; un maximum de quatre doses peut être administré sur une période de 12 heures. La lidocaïne ne doit être utilisée que si l’affection sous-jacente nécessite un traitement avec un volume de produit inférieur ou égal à 1,2 mL.
COMMENT FOURNI
Lidocaïne visqueuse 2 % (solution topique orale de chlorhydrate de lidocaïne USP)
La solution topique orale à 2 % est fournie sous forme de solution visqueuse claire et incolore.
NDC 0054-0548-44 : Bouteille à presser de 20 mL
NDC 0054-3500-49 : Bouteille à presser de 100 mL
Réservez entre 20° et 25°C (68° et 77°F).
Dispenser dans un contenant à l’épreuve des enfants tel que défini dans l’USP/NF.
Bien agiter avant l’utilisation.
Distr. par : West-Ward
Pharmaceuticals Corp.
Eatontown, NJ 07724
Révisé en octobre 2018
Panneau de présentation de l’emballage/étiquette
NDC 0054-3500-49 Lidocaïne Viscous (solution topique orale de chlorhydrate de lidocaïne USP) 100mL

Panneau de présentation de l’emballage/étiquette
NDC 0054-0548-.44 Lidocaïne Visqueuse (solution topique orale de chlorhydrate de lidocaïne USP) 15mL

| LIDOCAINE VISCOUS solution de chlorhydrate de lidocaïne. |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINE VISCOUS chlorhydrate de lidocaïne solution |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Étiqueteur – West-Ward Pharmaceuticals Corp. (080189610)
| Etablissement | |||
| Nom | Adresse | ID/FEI | Opérations |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Avis médical
.